莫西沙星干预治疗对耐多药肺结核患者血清miRNA-99b、125b、155水平的影响
2018-02-05郭存炳郑淑兰
郭存炳,李 辉,郑淑兰
0 引言
结核病是结核杆菌感染引起的慢性传染病,由于医学的不断发展,结核病的控制情况明显改善,但逐渐出现了耐多药结核病(MDR-TB)[1]。MDR-TB指的是结核分枝杆菌至少对利福平、异烟肼2种及以上抗结核化疗药物产生耐药的结核病。MDR-TB出现原因尚未明确,主要与化疗方案不合理、化疗管理不善以及患者依从性差等有关[2]。莫西沙星具有明确的抗结核作用,药代动力学研究发现,莫西沙星在呼吸系统分布较高,如支气管黏膜、肺泡上皮细胞以及巨噬细胞内均可测得较高的药物浓度,因此有助于对抗MDR-TB[3]。目前,对于莫西沙星治疗MDR-TB的机制学研究报道较少。微小RNA(miRNA)属于非编码RNA,可以特异性结合mRNA3′UTR非翻译区的某些位点,在转录后水平抑制蛋白的表达[4],因此,miRNA可以广泛参与细胞分化、凋亡、激素分泌等生理过程[5],也可以调控肿瘤、感染、糖尿病和动脉粥样硬化等病理过程[6]。某些特定的miRNA可以调控机体对于结核杆菌的免疫反应,参与结核感染损伤过程[7]。因此,本研究从结核相关miRNA(miR-99b、miR-125b和miR-155)角度出发,探讨莫西沙星治疗MDR-TB的分子机制。
1 资料与方法
1.1 一般资料 选取2014年4月至2016年9月于河南省许昌市结核病防治所住院治疗的MDR-TB患者共150例。随机等分为莫西沙星组(75例)和对照组(75例)。纳入标准:①年龄18~80岁;②符合《肺结核诊断和治疗指南》[8]MDR-TB诊断;③入组前3个月未使用过喹诺酮类抗生素;④签署知情同意书。排除标准:①长期使用免疫抑制剂,或合并自身免疫性疾病的患者;②研究期间合并其他细菌或真菌感染;③存在喹诺酮类药物禁忌证;④严重心肝肾功能不全患者;⑤妊娠或哺乳期患者;⑥恶性肿瘤患者。本研究所有试验内容经本院伦理委员会审批通过。
对照组患者化疗方案为6 ZKmLfxCsPto/18 ZLfxCsPto,莫西沙星组化疗方案为6 ZKmMfxCsPto/18 ZMfxCsPto。其中Z为比嗪酰胺;Km为丁胺卡那;Lfx为左氧氟沙星;Mfx为莫西沙星;Cs为环丝氨酸;Pto为丙硫异烟胺(6为6个月,18为18个月)。
1.2 化疗疗效判定标准 疗效判断标准包括细菌学和影像学两部分,其中前者定义有效为痰菌转阴或痰带菌量减低,无效为痰带菌量无变化或增多。影像学评价采用X线方法,有效为病灶明显吸收或有吸收,无效为病灶不变或恶化。
1.3 血清miRNA检测 所有患者于入组前(T0)、治疗后3个月(T1)和9个月(T2)3个时间点空腹抽取静脉血约15 mL,于4 ℃ 3 000 r/min条件下离心20 min,提取上清液,置于-80 ℃冻存待检。通过苯酚法提取总RNA,cDNA合成通过逆转录-聚合酶链反应(RT-PCR),cDNA测定通过7600型序列检测系统(ABI公司产品)。以U6作为内参,miR-16建立标准曲线,参照相关文献描述绝对表达量计算方法[9],计算血清miRNA的绝对含量。

2 结果
2.1 一般资料结果 两组MDR-TB患者的年龄、性别、体重指数(BMI)、吸烟史等一般临床资料比较差异无统计学意义(P>0.05)。观察终点治疗后9个月的累计显效方面,莫西沙星组明显优于对照组(42.7% vs.26.7%,P<0.05)。见表1。
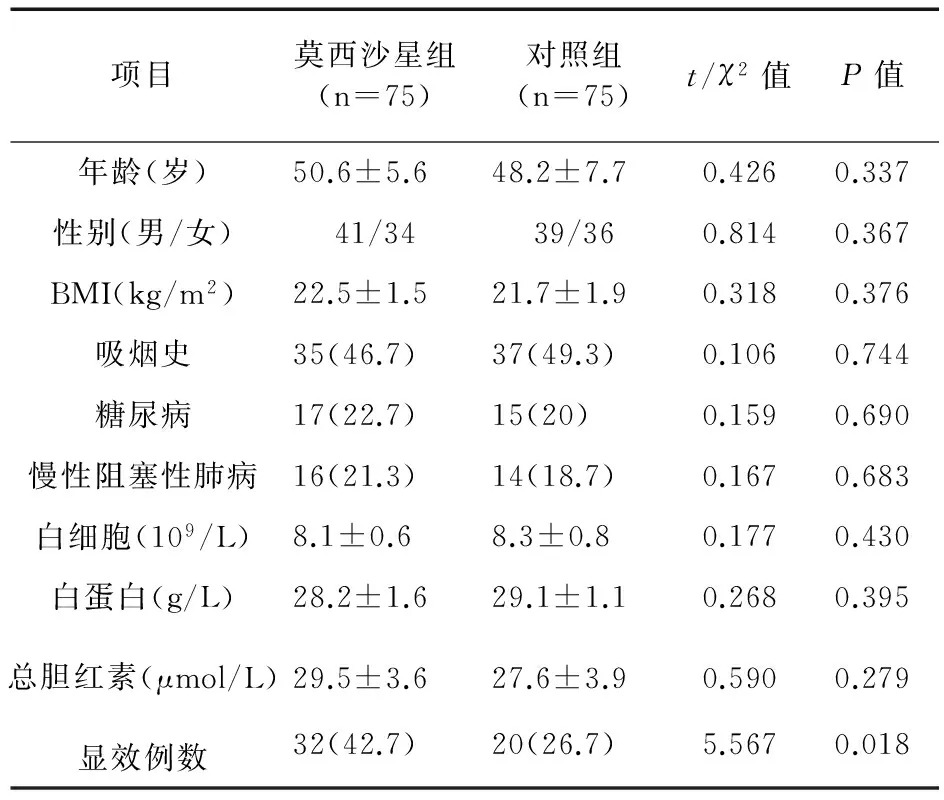
表1 两组患者一般资料比较(例,%)
2.2 结核相关miRNA(miR-99b、miR-125b和miR-155)水平波动情况 T0时两组患者3种结核相关miRNAs比较差异均无统计学意义(P>0.05)。T1时,两组患者3种结核相关miRNAs均呈下降趋势,但差异无统计学意义(P>0.05);组间比较可见莫西沙星组miR-99b明显低于对照组(P<0.05)。T2时,两组患者3种结核相关miRNAs较T0和T1时均明显下降(P<0.05);组间比较可见莫西沙星组miR-99b、miR-125b和miR-155明显低于对照组(P<0.05)。见表2。
2.3 不同疗效患者3种结核相关miRNAs水平比较 根据患者用药9个月的疗效情况,将两组患者组内分为有效亚组和无效亚组,其中对照组有效亚组20例,无效亚组55例;莫西沙星组有效亚组32例,无效亚组43例。T0时,两组患者有效亚组和无效亚组之间miR-21、miR-29和miR-142-3p水平比较差异均无统计学意义(P>0.05)。T1时,莫西沙星组可见有效亚组患者miR-99b水平明显下降(P<0.05),有效亚组miR-99b、125b均明显低于无效亚组(P<0.05);组间比较可见莫西沙星有效亚组miR-99b水平明显低于对照组有效亚组(P<0.05)。T2时,莫西沙星组可见有效亚组患者miR-99b、miR-125b和miR-155水平较T0和T1时明显下降(P<0.05),组间比较可见莫西沙星有效亚组miR-99b和miR-155水平均明显低于对照组有效亚组(P<0.05)。见表3。
2.4 相关性分析 通过Pearson和Spearman相关性分析比较莫西沙星与结核相关miRNAs水平变化(△1=治疗后3月-治疗前,△2=治疗后9月-治疗后3月,△3=治疗后9月-治疗前)之间的相关性。可见莫西沙星干预治疗与miR-99b△3(r=-0.633,P<0.05)、miR-125b△3(r=-0.526,P<0.05)、miR-155△3(r=-0.576,P<0.05)呈负相关。
3 讨论
在MDR-TB患者化疗方案中添加莫西沙星可以明显增强抗结核效果,但对于其中的机制研究了解甚少。miRNA可以结合特定的基因位点影响下游翻译,影响蛋白表达,参与结核感染后人体一系列免疫反应。本研究选择了3个结核相关miRNA(miR-99b、miR-125b、miR-155)进行分析,探讨在MDR-TB人群中,通过莫西沙星干预治疗对上述3种miRNA浓度改变情况,结果发现,莫西沙星干预治疗后,可以明显降低循环中上述3种miRNAs的浓度。
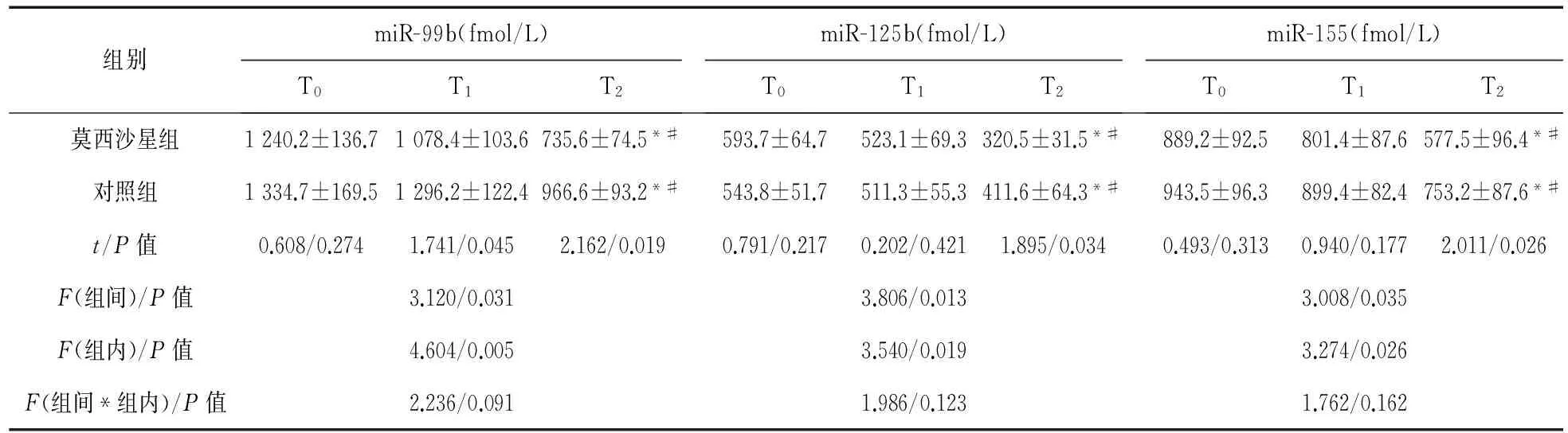
表2 治疗后血清结核相关miRNA波动情况
注:*与T0时比较,P<0.05;#与T1时比较,P<0.05
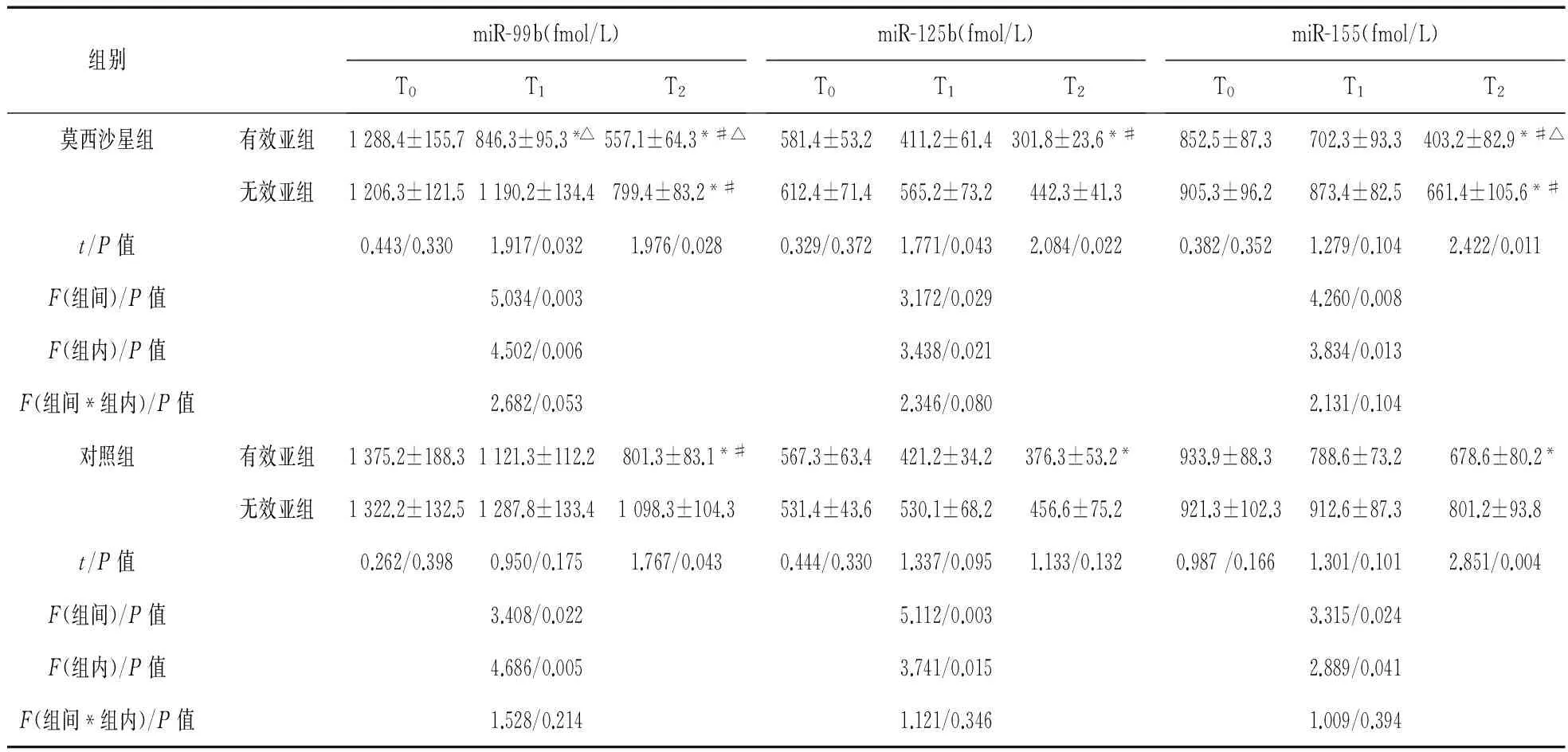
表3 不同疗效患者三种miRNAs水平比较
注:*与T0时比较,P<0.05;#与T1时比较,P<0.05;△与对照组有效亚组同一时间点比较(组间),P<0.05
结核分枝杆菌定植于巨噬细胞中,抑制宿主合成保护性细胞因子,进而减少结核分枝杆菌自身抗原被免疫系统识别,降低宿主的免疫反应性[10]。在这种抑制宿主免疫反应的过程中,miRNAs发挥重要作用,有研究发现,miR-99b在结核杆菌H37Rv感染的树突状细胞和巨噬细胞中表达明显增加,通过基因沉默miR-99b后,可见树突状细胞中结核分枝生长明显减少,同时白介素6和肿瘤坏死因子α等促炎因子水平明显升高,提示miR-99b参与结核杆菌感染后的免疫抑制和炎症反应[11]。关于miR-99b与结核的研究多为动物实验研究,本研究则选择了MDR-TB患者为研究人群,发现添加莫西沙星的化疗方案可以明显降低外周血miR-99b水平。研究发现,miR-125b可能参与了调节结核性脑膜炎的发生、发展过程,有可能作为潜在的诊断结核性脑膜炎的生物学标志[12]。关于miR-125b在MDR-TB患者中的研究报道较少,本研究观察到含有莫西沙星的化疗方案可以更加明显地降低MDR-TB患者血清miR-125b浓度。对于miR-125b与结核感染之间的机制问题,有报道,肺结核患儿外周血巨噬细胞中miR-125b水平升高,上调THP-1巨噬细胞miR-125b水平,可以促进巨噬细胞凋亡并抑制细胞活力[13]。
miR-155是本研究选择观察的另一个结核相关miRNA。人外周血单个核细胞miR-155的差异表达及miR-155/细胞信号抑制因子1比值对潜伏性肺结核及活动性肺结核的鉴别诊断具有重要的参考价值[14]。也有研究针对尘肺合并肺结核患者进行研究,发现尘肺并发肺结核患者血清miR-155水平相比单纯尘肺组患者明显升高,提示miR-155在尘肺并发肺结核病时可能发挥着一定的作用[15]。本研究针对MDR-TB患者,发现莫西沙星可以通过降低miR-155浓度增加化疗疗效。miR-155与结核的机制学方面,目前认为与叉头转录因子3(FOXO3)表达情况有关,研究发现,miR-155可以特异性结合FOXO3的3′端非编码区,抑制FOXO3翻译,降低FOXO3表达[16]。而FOXO3是巨噬细胞的保护性因子,在结核感染条件下,可以有效抑制巨噬细胞的凋亡[17]。
综上所述,本研究发现miR-99b、miR-125b和miR-155 3种结核相关miRNA可能参与莫西沙星的抗结核作用,提高MDR-TB患者化疗疗效。
[1] Kuaban C,Noeske J,Rieder HL,et al.High effectiveness of a 12-month regimen for MDR-TB patients in Cameroon[J].Int J Tuberc Lung Dis,2015,19(5):517-524.
[2] 尹凤鸣,周友乾,任彬,等.血清降钙素原与sTREM-1水平对多重耐药肺结核患者临床预后的相关性研究[J].临床肺科杂志,2015,20(10):1770-1773.
[3] 牛家峰,尚永明,吕纪玲,等.耐多药肺结核患者莫西沙星与卷曲霉素联用对炎性因子及免疫功能的影响[J].中华医院感染学杂志,2016,26(14):3138-3140.
[4] Yu X,Li Z.MicroRNAs regulate vascular smooth muscle cell functions in atherosclerosis (review)[J].Int J Mol Med,2014,34(4):923-933.
[5] Tian T,Wang J,Zhou X.A review:microRNA detection methods[J].Org Biomol Chem,2015,13(8):2226-2238.
[6] Flowers E,Won GY,Fukuoka Y.MicroRNAs associated with exercise and diet:a systematic review[J].Physiol Genomics,2015,47(1):1-11.
[7] Zhang H,Sun Z,Wei W,et al.Identification of serum microRNA biomarkers for tuberculosis using RNA-seq[J].PLoS One,2014,9(2):e88909.
[8] 张培元.肺结核诊断和治疗指南[J].中华结核和呼吸杂志,2001,24(2):70-74.
[9] 陈曦,杨承健,韩志君,等.microRNA-499在急性心肌梗死患者外周血中含量变化的研究[J].南京医科大学学报(自然科学版),2015,22(1):46-50.
[10]Zheng L,Leung E,Lee N,et al.Differential microRNA expression in human macrophages with mycobacterium tuberculosis infection of Beijing/W and non-Beijing/W strain types[J].PLoS One,2015,10(6):e0126018.
[11]Singh Y,Kaul V,Mehra A,et al.Mycobacterium tuberculosis controls microRNA-99b (miR-99b) expression in infected murine dendritic cells to modulate host immunity[J].J Biol Chem,2013,288(7):5056-5061.
[12]柴璐璐,田宋新,袁俐,等.miR-125b、miR-29a和miR-155-5p作为诊断结核性脑膜炎生物标志的研究[J].天津医药,2015,43(6):674-677.
[13]于光远,詹学,张祯祯,等.巨噬细胞过表达miR-125b促进其凋亡[J].细胞与分子免疫学杂志,2016,32(7):958-962,967.
[14]杨绍俊,李发科,邓少丽,等.TLR2、miR-155及SOCS1基因检测在肺结核诊断中的意义[J].免疫学杂志,2016,22(11):972-976.
[15]刘义涛,曾强,李树新,等.尘肺并发肺结核患者血清miRNAs表达[J].中华劳动卫生职业病杂志,2016,34(7):525-527.
[16]Huang J,Jiao J,Xu W,et al.MiR-155 is upregulated in patients with active tuberculosis and inhibits apoptosis of monocytes by targeting FOXO3[J].Mol Med Rep,2015,12(5):7102-7108.
[17]Haoues M,Refai A,Mallavialle A,et al.Forkhead box O3 (FOXO3) transcription factor mediates apoptosis in BCG-infected macrophages[J].Cell Microbiol,2014,16(9):1378-1390.
