丹酚酸B对EPCs释放VEGF、SDF-1、IL-8和MMP9细胞因子及EPCs黏附能力的影响
2018-02-05刘璐菘王春田王丽敏张丽艳
刘璐菘,王春田,王丽敏,刘 君,刘 鸿,白 剑,张丽艳*
0 引言
血管内皮祖细胞(Endothelial progenitor cells,EPCs)是一类具有增殖和分化能力的干细胞,作为血管内皮细胞的前体,其可以通过增殖和分化为血管内皮细胞,对受损的内皮组织进行修复[1]。常见的临床心血管疾病如动脉粥样硬化和冠心病,都是以血管内皮细胞损伤为主要特征。研究显示,当血管内皮受损后,胶原组织暴露,存在于末梢血液循环中的EPCs可以通过动员、增殖和归巢的方式黏附于胶原表面,并在其表面增殖、分化为血管内皮细胞[2-3]。但是,EPCs体内增殖缓慢,很难满足临床治疗需要,国内外对EPCs的研究尚处于起步阶段,因此,如何寻找到有效的方案帮助EPCs归巢并增强EPCs活性具有临床治疗意义。
丹参又名长鼠尾草,中医认为丹参味苦,微寒,入心、肝经,具有活血化瘀、通经止痛、凉血消痈、养血安神、消心除烦等功效[4-5]。而丹酚酸B作为丹参水溶性成分的主要提取物,具有多种药理学活性,包括抗凝、抑制血小板聚集、抗氧化、抗炎、抗动脉粥样硬化、保护血脑屏障和改善内皮细胞功能的作用。本研究在此基础上,通过观察丹酚酸B对离体的EPCs的黏附和旁分泌功能的影响,分析丹酚酸B修复血管内皮细胞的可能机制。
1 材料和方法
1.1 材料
1.1.1 EPCs来源 经辽宁中医药大学附属医院伦理委员会批准,征得健康自愿者本人同意,取健康自愿者血液20 mL。
1.1.2 实验试剂及仪器 丹酚酸B购于中国食品药品检定研究院;胎牛血清购于美国Hyclone公司;M199培养基和PBS购于美国GE公司;血管内皮生长因子(Vascular endothelial growth factor,VEGF)、碱性成纤维细胞生长因子(Basic fibroblast growth factor,bFGF)和胰酶购于美国Sigma-Aldrich公司;CCK8试剂盒购于碧云天生物技术研究所;VEGF、基质细胞衍生因子-1(Stromal cell-derived factor-1,SDF-1)、白细胞介素8(Interleukin-8,IL-8)和基质金属蛋白酶9(Matrix metalloprotein9,MMP9)酶联免疫吸附(Enzyme-linked immunosorbent assay,ELISA)检测试剂盒购于美国Ebioscience公司;Percoll分离液购于美国GE公司;CD34-PE、VEGRF-2-APC和CD45-FITC购于美国BD公司;倒置相差显微镜购于日本Olympus公司;离心机购于湘仪公司;FACSCalibur流式细胞仪购于美国BD公司;550酶标仪购于美国Bio-Rad公司;细胞流动腔实验装置系统购于美国flexcell公司;CO2培养箱购于美国Thermo公司。
1.2 实验方法
1.2.1 EPCs原代培养及鉴定 在无菌条件下,将20 mL健康人的末梢血中加入等体积的Percoll分离液,放入50 mL离心管中,1 500 r/min离心20 min,吸取液面交界处的有核细胞,使用PBS稀释后1 500 r/min离心5 min。弃上清液,将离心后的细胞在含10%胎牛血清、10 ng/mL VEGF和3 ng/mL bFGF的M199培养基中培养24 h后,去除未贴壁的细胞,贴壁细胞继续培养7 d。将细胞消化后,1 500 r/min离心5 min后弃去上清液,用PBS清洗2次,重悬细胞制备单细胞悬液并调整浓度为1×106个/ mL,取200 μL细胞悬液,分别加入CD34-PE、VEGRF-2-APC和CD45-FITC流式抗体各5 μL,避光室温孵育20 min后,流式细胞仪检测CD34、VEGRF-2和CD45的表达情况。
1.2.2 丹酚酸B促进EPCs的增殖 将培养7 d的血管内皮祖细胞用胰酶消化后,按照4×103个/孔的细胞量转到96孔板中。加入含10%胎牛血清、10 ng/mL VEGF和3 ng/mL bFGF的M199培养基培养8 h,待细胞完全贴壁后,将细胞分为2组,对照组用10%胎牛血清、10 ng/mL VEGF和3 ng/mL bFGF的M199培养基,实验组在对照组基础培养基中加入不同浓度的丹酚酸B:20 μg/mL丹酚酸B组、40 μg/mL丹酚酸B组和60 μg/mL丹酚酸B组。将对照组和实验组的细胞放入培养箱中培养4 d,每组均设置5个平行孔,隔天换液,每隔24 h进行1次CCK8试剂盒检测,绘制细胞的生长曲线。
1.2.3 流动腔实验 将光交联胶原10 mg与丹酚酸B 40 μg、60 μg和80 μg充分混合后,加入2 mL蒸馏水充分溶解,覆盖在玻片上,同时取光交联胶原100 mg溶解2 mL蒸馏水作为对照组,将丹酚酸B和对照组混合后的盖玻片置于紫外灯下交联4 h。将分离培养7 d后的EPCs经胰酶消化后,用PBS洗去漂浮的死细胞,制成细胞密度为1×105/mL的细胞悬液。将含有EPCs的混悬液以0.01 mL/min流过涂层有胶原的玻片。通过倒置显微镜检测EPCs流过相同距离的时间以及最终黏附在载玻片上的内皮祖细胞数量。
1.2.4 丹酚酸B促进EPCs旁分泌VEGF、SDF-1、IL-8和MMP9 取EPCs贴壁后和实验进行48 h后的培养基各200 μL,通过酶联免疫吸附法检测培养基中VEGF、SDF-1、IL-8和MMP9的浓度,方法参照试剂盒说明书进行。

2 结果
2.1 EPCs鉴定结果 使用倒置相差显微镜观察EPCs呈梭形和多边形,在细胞表面附着少量的悬浮细胞,细胞呈集落融合生长(图1)。经过流式抗体CD34-PE、VEGRF-2-APC和CD45染色后,CD34、VEGRF-2和CD45 3种抗原标记物均为阳性的比例为89.11%±6.09%(图2)。
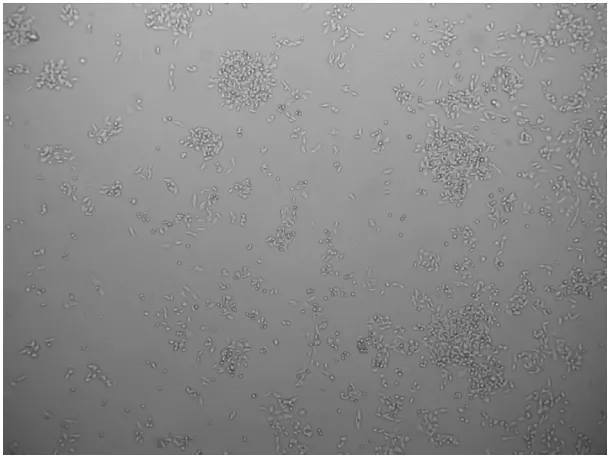
图1 倒置相差显微镜观察EPCs形态(40×)
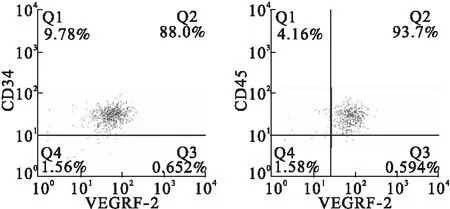
图2 培养7 d后EPCs表面抗原CD34、VEGRF-2和CD45鉴定结果
2.2 丹酚酸B促进EPCs的增殖实验结果 每隔24 h采集细胞并进行光密度值检测,第2、3、4天时,各浓度丹酚酸B组的光密度值与对照组比较,差异均有统计学意义(P<0.05),且细胞增殖与丹酚酸B的浓度相关。见表1。
2.3 流动腔实验 取下载玻片,将其置于相差显微镜下,在×40目镜下观察细胞并计数,结果显示,不同浓度丹酚酸B组每个低倍镜视野的细胞计数与对照组比较,差异有统计学意义(P<0.05)。见图3、表2。
2.4 丹酚酸B促进血管EPCs旁分泌VEGF、SDF-1、IL-8和MMP9结果 不同浓度丹酚酸B培养4 d后,通过ELISA方法检测培养基中VEGF、SDF-1、IL-8、MMP9的浓度。各浓度丹酚酸B组的VEGF、SDF-1、IL-8、MMP9浓度与对照组比较,差异均有统计学意义(P<0.05)。见表3。

表1 不同浓度丹酚酸B培养后 EPCs增殖情况
注:与对照组比较,*P<0.05

图3 流动腔实验细胞黏附结果(×40)

组别细胞计数对照组98±1320μg/mL丹酚酸B组235±24*40μg/mL丹酚酸B组393±28*60μg/mL丹酚酸B组551±35*
注:与对照组比较,*P<0.05
3 讨论
EPCs是一种具备分化潜能的前体细胞,在一定条件下可以分化为血管内皮细胞。最早发现EPCs的是日本学者Asahara,此后的研究证明,EPCs在心肌缺血的情况下可以被迅速动员,从骨髓进入到外周末梢血中,归巢至缺血损伤的心肌组织,并可以分化为成熟的血管内皮细胞,参与缺血组织的修复[6]。现已证实,EPCs在多种心血管疾病中均有变化,包括冠心病、急性心肌梗死和缺血性脑卒中等[7-9]。以上疾病的共同点是机体出现短暂的缺氧状态,由于低氧可以造成血管内皮受损并导致内皮细胞下的胶原暴露,如未得到及时有效的修复,血液循环中的炎症细胞和血小板可以吸附于胶原组织表面,造成受损部位狭窄,甚至是栓塞等不良后果[10]。EPCs的修复则可以有效避免狭窄的形成,同时,EPCs还可以通过旁分泌作用释放各种细胞因子,包括VEGF、bFGF、粒细胞-巨噬细胞集落刺激因子(Granulocyte macrophage colony stimulating Factor,GM-CSF)、SDF-1、IL-8和MMP9等,这些细胞因子对促进EPCs的骨髓动员有着重要作用[11-13]。由于EPCs具有重要的生物学功能,临床上已经开展了相关实验,通过体外扩增EPCs方式回输入人体,但这种方法也面临一些风险,首先是回输的EPCs不具有成血管的功能,其次是EPCs容易被体内巨噬细胞识别,最终转化为泡沫细胞,反而使血管损伤加重[14-15]。因此,如何有效提高EPCs黏附,诱导产生有生物学功能的EPCs成为临床治疗的重要方向。
丹酚酸B是传统中药丹参活性最强的水溶性成分之一,是由三分子3,4-二羟基苯基乳酸和一分子咖啡酸缩合而成的低聚体型化合物[16]。研究显示,丹酚酸B可以有效减少心肌梗死灶的范围、改善心肌缺血和缺血-再灌注后的氧化应激损伤,修复受损的血管内皮细胞,防止血栓形成和改善受损组织的微循环等[17-18]。研究显示,丹酚酸B可以促进骨髓间充质干细胞表达VEGF,并诱导骨髓间充质干细胞分化为心肌细胞[19]。同时,丹酚酸B还可以促进血管内皮细胞迁徙,促进单核细胞分泌VEGF和bFGF细胞活性因子,并帮助血管形成[20]。
目前认为血管内皮的修复有2种方式:受损组织周围的血管内皮细胞分裂并迁徙至受损部位或者是由末梢血液中具有分化功能的EPCs分化而来[21]。丹酚酸B对受损血管的修复作用不明,因此,本研究从成人末梢血中分离培养了EPCs,经过20、40、60 μg/mL的丹酚酸B培养4 d后,检测EPCs增殖的情况,结果发现,各浓度组丹酚酸B的EPCs增殖数量与对照组比较差异均有统计学意义。流动腔实验结果显示,不同浓度丹酚酸B交联后的胶原表面吸附细胞数量明显不同,且明显高于对照组,并呈现出一定的浓度依赖性,表明丹酚酸B可以促进EPCs的增殖和黏附。EPCs具有旁分泌功能,这些细胞因子不仅可以动员EPCs从骨髓中进入外周血,还可以促进EPCs增殖、分化、趋化和归巢[22]。VEGF是目前已知的诱导EPCs向成熟的血管内皮细胞分化的最重要的细胞因子,可以促进EPCs的骨髓动员,促进EPCs成熟,在EPCs增殖、分化、趋化和归巢中起重要作用。SDF-1对EPCs的趋化作用是其他细胞因子的10倍以上,血液中SDF-1浓度升高有利于EPCs归巢,诱发EPCs与受损内皮黏附和血小板聚集,并抑制EPCs凋亡,在诊断和治疗心肌缺血性疾病中具有重要的临床意义;IL-8可以通过激活CXCR2受体,磷酸化Ras和MAPK信号通路中的下游蛋白而介导EPCs的迁徙和增殖;MMP9最初报道来源于肿瘤的侵袭性研究,研究发现,MMP9可以增强肿瘤的侵袭性,可能与其降解胶原能力有关,MMP9还可以使EPCs在骨髓内募集并向外周血迁徙[23-25]。因此,本研究选取上述4种细胞因子,分析丹酚酸B在离体条件下对EPCs旁分泌功能是否有影响。结果显示,不同浓度丹酚酸B在与EPCs共培养4 d后,可以明显增加VEGF、SDF-1、IL-8和MMP9在培养基中的浓度,由于在离体培养过程中排除了其他细胞的干扰,因此上述细胞因子的分泌只能是来源于EPCs的旁分泌功能。

表3 不同浓度丹酚酸B对EPCs培养基中VEGF、SDF-1、IL-8和MMP9浓度的影响(pg/mL)
注:与对照组比较,*P<0.05
综上所述,丹酚酸B作为丹参中主要的活性成分,在体外可以促进EPCs增殖和增强EPCs的黏附功能,同时可以刺激EPCs通过旁分泌作用释放VEGF、SDF-1、IL-8和MMP9等细胞活性因子,对于治疗以血管内皮损伤为特征的疾病有着潜在的治疗价值。
[1] 刘竹影,陈颖,刘倩,等.血管内皮祖细胞改善骨质疏松大鼠骨髓间充质干细胞的增殖及凋亡[J].中国组织工程研究,2016,20(14):1999-2006.
[2] 张文学,江荣才,张建宁.骨髓间充质干细胞诱导血管内皮祖细胞治疗大鼠创伤性脑损伤[J].中华创伤杂志,2015,31(11):1014-1019.
[3] 孙景敏,张庆桥,黄乾鑫,等.原发性布加综合征患者外周血内皮祖细胞的检测及意义[J].中华肝胆外科杂志,2015,21(7):466-469.
[4] 孔羽,魏宇昆,黄艳波.HPLC-DAD比较鼠尾草属6种植物根中丹参酮类成分含量[J].中药材,2016,39(1):131-133.
[5] 李霞,杨阳,黄豆豆,等.甘西鼠尾草药材和提取物中迷迭香酸、丹酚酸B的含量测定[J].中国医院药学杂志,2014,34(19):1634-1638.
[6] 张晶晶,张欢,黄佳雯,等.内皮祖细胞及在血管损伤中的应用[J].中国急救复苏与灾害医学杂志,2016,11(7):739-742.
[7] 白洁,孟军,蔡泽民,等.高脂蛋白(a)的冠心病患者内皮祖细胞功能受损[J].中国动脉硬化杂志,2015,23(4):384-388.
[8] 李海清,赵强,朱丹,等.17β-雌二醇预处理的骨髓源性内皮祖细胞治疗急性心肌梗死的实验研究[J].中华心血管病杂志,2011,39(5):420-423.
[9] 权哲,宋薇,韦博,等.纤维蛋白胶介导大鼠内皮祖细胞移植干预大鼠急性脑缺血的实验研究[J].中国实验诊断学,2017,21(1):145-148.
[10]Ho KK,Abrams-Ogg AC,Wood RD,et al.Assessment of platelet function in healthy sedated cats using three whole blood platelet function tests[J].J Vet Diagn Invest,2015,27(3):352-360.
[11]荆静,王翠兰,高洪博.脑缺血再灌注大鼠外周血EPCs与VEGF、bFGF、eNOS水平变化及相关性[J].中国现代医学杂志,2011,21(7):759-765.
[12]荆静,王翠兰,高洪博.脑缺血再灌注大鼠外周血EPCs与VEGF、bFGF、eNOS水平变化及相关性[J].中国现代医学杂志,2011,21(7):759-765.
[13]Sun YM,Liu XF,LI GB,et al.Study on the correlation of nourishing kidney and regulating Chong therapy mobilizing bone marrow EPCs and VEGF and bFGF[J].China J Traditional Chin Med Pharmacy,2014,29(4):1203-1207.
[14]陈曦,张先兵,李勋,等.内皮祖细胞修复血管损伤的研究[J].中国现代普通外科进展,2015,18(11):908-911.
[15]崔斌,黄岚,武晓静,等.内皮祖细胞移植对血管内膜修复的影响[J].中国病理生理杂志,2007,23(4):625-628.
[16]刘梅,夏鑫华,张志敏,等.丹参素、原儿茶醛、咖啡酸和丹酚酸B体外抗氧化活性比较研究[J].中药材,2009,32(2):265-267.
[17]Peng Q,Gong T,Zuo J,et al.Enhanced oral bioavailability of salvianolic acid B by phospholipid complex loaded nanoparticles[J].Pharmazie Die,2008,63(9):661-666.
[18]Gao DY,Han LM,Zhang LH,et al.Bioavailability of salvianolic acid B and effect on blood viscosities after oral administration of salvianolic acids in beagle dogs[J].Arch Pharm Res,2009,32(5):773-779.
[19]陈嘉,邹移海,张进,等.丹酚酸B对骨髓间充质干细胞增殖和血管内皮生长因子表达的影响[J].中华生物医学工程杂志,2008,14(1):31-34.
[20]李庆雯,南亚昀,谭俊珍,等.骨髓间充质干细胞与丹酚酸B预处理内皮祖细胞共移植对急性心肌梗死大鼠心功能及分化基因表达的影响[J].中国组织工程研究与临床康复,2009,13(23):4417-4420.
[21]吉宗珊,刘思颖,权威,等.内皮祖细胞分离培养及应用技术新进展[J].现代生物医学进展,2016,16(8):1567-1572.
[22]刘茂胜,罗少军,张文广.治疗性血管发生的研究进展[J].医学综述,2005,11(12):1125-1127.
[23]Szmitko PE,Fedak PW,Weisel RD,et al.Endothelial progenitor cells:new hope for a broken heart[J].Circulation,2003,107(24):3093-3100.
[24]Li SC,Acevedo J,Wang L,et al.Mechanisms for progenitor cell-mediated repair for ischemic heart injury[J].Curr Stem Cell Res Ther,2012,7(1):2-14.
[25]Dalakas E,Newsome P,Hart M,et al.The cytokines,MMP-9 and SDF-1,play a central role in regulating the mobilisation of CD34+stem cells in human liver injury.[J].J Gastroenterol Hepatol,2004,15(10):1120-1124.
