槲皮黄酮对原代皮层神经元细胞氧糖剥夺损伤的保护作用
2018-02-05何标,廉果
何 标,廉 果
0 引言
槲皮黄酮(Quercetin,Qu)属于黄酮类化合物,主要提取于裸子植物、蕨类植物及被子植物这三大类植物的根茎部位[1]。近年来研究报道,槲皮黄酮在临床上的应用较为广泛,因其抗氧化和抗炎症反应的效果颇为显著,还可用于神经系统疾病、癌症、糖尿病引起的多种并发症及肥胖症等[2-4]。在上述疾病中,槲皮黄酮在肿瘤治疗中的研究最为深入。槲皮黄酮能够抑制多种致癌剂及促癌剂的生物活性,而且在乳腺癌、肺癌、结肠癌及前列腺癌的治疗中效果较好[5]。已有较多文献报道槲皮黄酮具有抗细胞凋亡作用,对内皮细胞具有保护作用[6-7]。内皮细胞损伤在心脑血管疾病的发生发展过程中起着重要的作用,可进一步导致高血压、动脉粥样硬化、冠心病及阿尔茨海默病等疾病的发生[8]。
急性缺血性卒中是因为脑动脉闭塞引起的脑组织梗死,伴随着神经元细胞凋亡的发生。研究发现,转化生长因子β-激活激酶1(TAK1)可介导下游多种生物学效应,包括炎症、细胞凋亡、氧化应激损伤及细胞侵袭等,其上游的衔接蛋白肿瘤坏死因子相关受体因子6(Traf6)在TAK1的活化调节中起着重要的作用[9]。实验室前期研究发现,槲皮黄酮可通过抑制Traf6/IKKβ/NF-κB信号通路活性降低炎症反应,从而对急性缺血性卒中大鼠具有较好的保护作用[10]。为了进一步研究槲皮黄酮的保护机制,本文在体外以氧糖剥夺方法构建原代皮层神经元细胞的局部缺血/再灌注损伤,以进一步探讨槲皮黄酮对神经元细胞的保护作用。
1 材料及方法
1.1 材料 动物(SPF级ICR胎鼠,由上海斯莱克实验动物有限责任公司提供);原代皮层神经元细胞(本实验室分离、培养);槲皮黄酮(Sigma,CAS No.117-39-5,≥99%);SDS-PAGE凝胶配制试剂盒(巴菲尔生物技术有限公司,批号:131221);CCK8试剂盒(深圳保安康生物科技有限公司);BCA蛋白浓度测定试剂盒(上海谷歌生物有限公司,批号:P0010S-01);Traf6质粒及阴性对照序列由武汉巴菲尔生物有限公司设计和合成;脂质体转染试剂LipofectamineTM2000(美国Invitrogen公司);Neurobasal培养液;DMEM高糖培养基;神经生长因子B27(50×);200 mmol/L L-谷氨酰胺(100×);胎牛血清(Gibco公司);D-HANKS缓冲液;D-PBS缓冲液(Hyclone);β-actin、TRAF6、p-TAK1、TAK1、Bax及Bcl-2一抗均购自美国Cell Signaling Technology;二抗羊抗兔IgG购自武汉谷歌生物有限公司。
1.2 仪器及器械 常规手术器械一套(高压灭菌);DNM-9602G型酶标仪(北京普朗新技术有限公司);单人超净台(苏州华新空调净化有限公司);细胞培养箱(上海医用分析仪器厂);凝胶电泳仪(北京六一仪器厂);双色红外激光成像系统(BIO-RAD,美国)。
1.3 原代皮层神经元细胞分离、培养 断颈处死13.5 d怀孕的ICR小鼠,在超净工作台上取出胚胎,在冰上操作,取出脑部组织,分离出大脑皮层。将皮层组织转移至冷的解剖液中,剪成小块,再漂洗3次,加入室温的胰蛋白酶进行消化,每间隔2 min轻轻振摇1次,加入含10% FBS的高糖培养基终止消化;用吸管反复轻轻吹打至组织块消失,制备得到细胞悬液;4 ℃、1 000 r/min离心10 min后,弃去上清保存沉淀。细胞沉淀用神经元细胞培养基重悬、计数,取适量浓度细胞接种至PLL包被过的6孔板中,每孔终体积2 mL,置于37 ℃、5% CO2的恒温培养箱中培养,每2 d换液1次。
1.4 缺血/再灌注细胞模型(I/R)的构建[11]采用氧糖剥夺实验进行构建,细胞培养的神经元细胞培养基被无血清、无葡萄糖的洛克缓冲液(154 mmol/L NaCl,5.6 mmol/L KCl,2.3 mmol/L CaCl2,1 mmol/L MgCl2,3.6 mmol/L NaHCO3,5 mmol/L HEPES,5 mg/mL庆大霉素,pH 7.2)代替,然后置于缺氧的培养箱(5% CO2,90%N2)中培养60 min,然后再转移至正常环境条件的培养箱中培养。
1.5 细胞相对存活率检测 将对数生长期的皮层神经元细胞进行消化、重悬、计数后,取适量细胞接种于96孔板中,每孔终体积为200 μL,每组设置6个复孔。待细胞贴壁生长至80%左右时,将细胞按“1.4”项操作处理60 min,弃去旧培养基,加入含不同浓度槲皮黄酮(10、20、40 μg/mL)的高糖培养基,置于正常环境中继续孵育24 h。弃去旧培养基,每孔加入10 μL CCK8试剂,重新放置培养箱中培养1 h后,置于酶标仪中于450 nm波长处检测吸光度(OD)值,并计算细胞相对存活率。
1.6 细胞转染 将神经元细胞消化传代,取对数生长期的细胞接种于6孔板,采用含10%胎牛血清无抗生素的培养基培养24 h,当细胞贴壁生长至60%左右时开始转染,转染前4~6 h将要转染的培养基换成无血清无抗生素的培养基。转染步骤严格按照LipofectamineTM2000试剂盒说明书进行,转染48 h后倒置显微镜下观察转染效率,以期进行后续实验。
1.7 免疫印迹检测蛋白表达 将对数生长期的皮层神经元细胞进行消化、重悬、计数后,取适量细胞接种于6孔板中,每孔终体积为2 mL,每组设置3个复孔。待细胞贴壁生长至80%左右时,将细胞按“1.4”项操作处理60 min,弃去旧培养基,加入含不同浓度槲皮黄酮的高糖培养基,置于正常环境中继续孵育24 h。收集细胞裂解液,采用BCA试剂盒检测蛋白浓度,每孔上样30 μg蛋白质进行凝胶电泳,电泳完成后将蛋白转移至NC膜,然后一抗孵育过夜,洗膜3次后二抗孵育1 h,利用Odyssey近红外扫描仪对β-actin、TRAF6、p-TAK1和TAK1表达水平进行检测。

2 结果
2.1 槲皮黄酮对神经元细胞增殖的影响 采用CCK8试剂对原代皮层神经元细胞的增殖情况进行检测,结果如图1a所示,I/R组神经元细胞经过氧糖剥夺处理后,细胞的相对存活率较正常对照组显著降低,差异有统计学意义(P<0.05)。而经过低、中、高剂量槲皮黄酮处理后,神经元细胞的相对存活率显著高于I/R细胞组,差异有统计学意义(P<0.05),且随着药物浓度的增加,相对存活率升高越明显,表现出浓度依赖性。同时,采用中剂量槲皮黄酮处理0、12、24、48、72 h,发现药物作用时间越长,细胞相对存活率越高,结果见图1b。
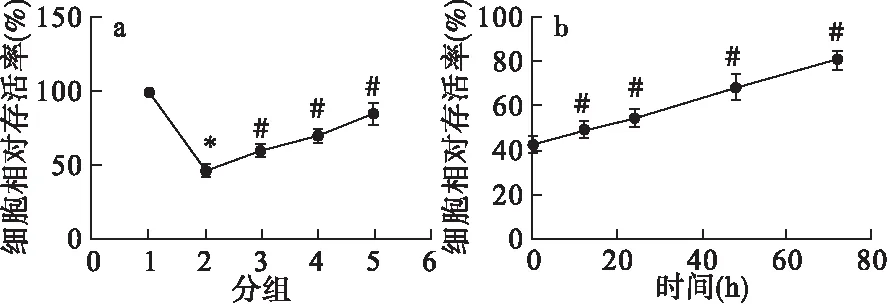
图1 槲皮黄酮对神经元细胞增殖的影响(n=6)
2.2 槲皮黄酮对凋亡蛋白表达的影响 采用Western blot检测原代皮层神经元细胞中凋亡蛋白表达情况,结果如图2所示,I/R组神经元细胞经过氧糖剥夺处理后,促凋亡蛋白Bax显著高于正常对照组,而抗凋亡蛋白Bcl-2明显降低,差异有统计学意义(P<0.05)。经低、中、高剂量槲皮黄酮处理后,Bax表达水平显著低于I/R细胞组,而Bcl-2显著升高,差异均有统计学意义(P<0.05),并且表现出浓度依赖性。
2.3 槲皮黄酮对Traf6/TAK1信号通路蛋白表达的影响 采用Western blot检测神经元细胞中Traf6/TAK1信号通路蛋白表达水平,结果如图3所示,I/R组神经元细胞经过氧糖剥夺处理后,Ttaf6及p-TAK1表达水平显著高于正常对照组,差异有统计学意义(P<0.05)。低、中、高剂量槲皮黄酮处理后,Ttaf6及p-TAK1表达水平显著低于I/R细胞组,差异均有统计学意义(P<0.05),并且随着药物浓度的增加,Ttaf6及p-TAK1表达水平降低越明显,表现出浓度依赖性。
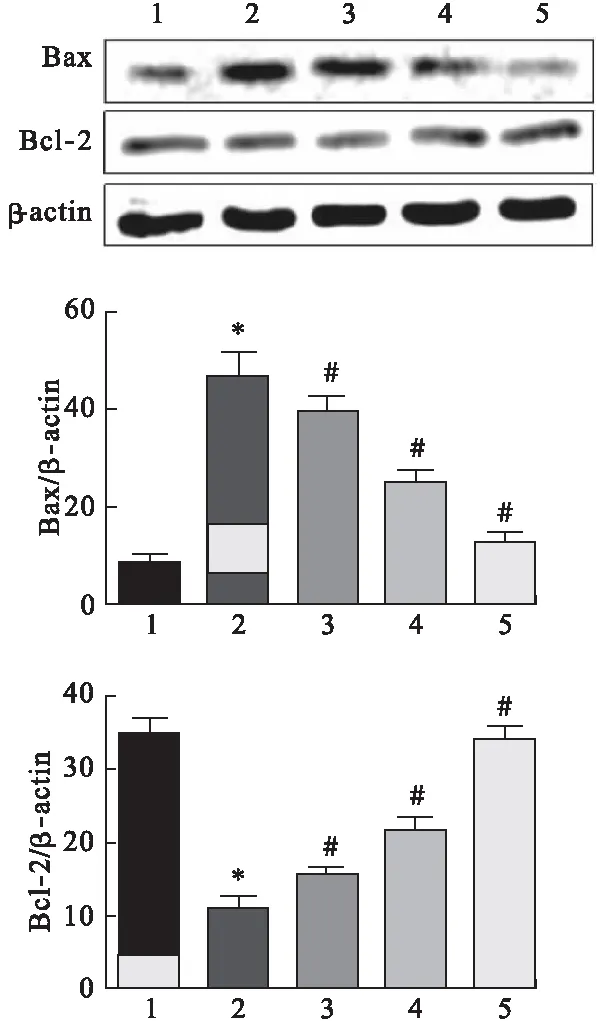
图2 槲皮黄酮对凋亡蛋白表达水平的影响(n=3)
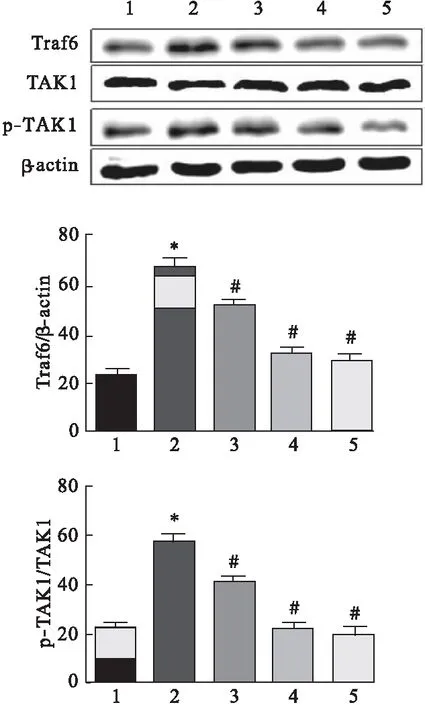
图3 槲皮黄酮对Traf6/TAK1信号通路蛋白表达水平的影响(n=3)
2.4 Traf6过表达对原代神经元细胞凋亡的影响 将Traf6质粒及阴性对照质粒瞬时转染神经元细胞48 h后,对凋亡蛋白的检测结果如图4所示。结果表明Traf6蛋白在细胞过表达可诱导促凋亡蛋白Bax表达、抑制抗凋亡蛋白Bcl-2表达,说明Traf6在细胞中的过表达可激活凋亡通路,引起细胞凋亡的发生。
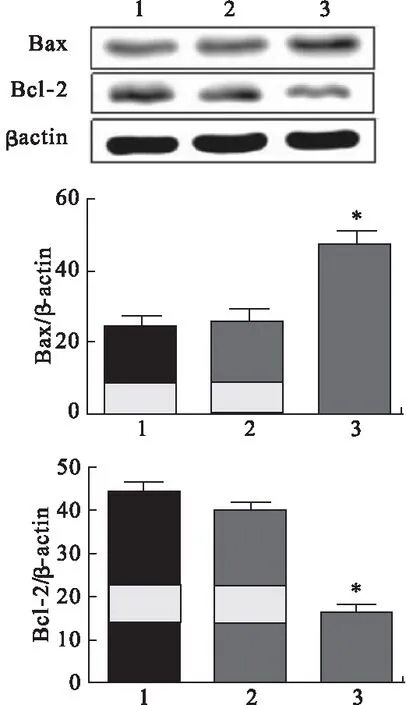
图4 Traf6过表达对凋亡蛋白表达的影响(n=3)
2.5 槲皮黄酮通路Traf6降低神经元细胞的凋亡 将Traf6质粒和阴性质粒转染神经元细胞48 h后,用20 μg/mL槲皮黄酮处理转染细胞24 h后,采用Western blot检测细胞中Traf6、TAK1、p-TAK1、Bax及Bcl-2蛋白表达水平,结果如图5所示。结果表明,转染了Traf6质粒的细胞中,Traf6蛋白表达水平显著高于正常对照组,并且p-TAK1、Bax表达水平均显著高于正常对照组,Bcl-2则低于正常对照组,差异均有统计学意义(P<0.05)。经20 μg/mL槲皮黄酮处理24 h后,Traf6、p-TAK1、Bax表达水平显著低于Traf6过表达组,Bcl-2则显著升高,差异均有统计学意义(P<0.05)。说明槲皮黄酮可以通过抑制Traf6的表达,进而抑制细胞凋亡通路的活化,减少细胞凋亡的发生。
3 讨论
缺血性卒中在脑血管疾病中的致死率、致残率位居第2位,尽管在卒中发作开始就接受了良好的治疗,但也有将近40%的患者死亡或者留下后遗症[10]。缺血性卒中的发作是由多种病理生理学过程和复杂的分子机制引起的,其中神经元细胞凋亡的发生始终存在于缺血性卒中发作的全过程。前期的动物实验发现,槲皮黄酮对急性缺血性卒中大鼠起保护作用,并且可以通过抑制Traf6/IKKβ/NF-κB炎症信号通路的活化来达到治疗效果[11]。Traf6是胞浆中的一种衔接蛋白,可以传导胞膜上多种受体介导的信号刺激,进而使细胞产生相应的生物学效应。Gong等[12]研究表明,Traf6在大鼠中的过表达,可以增加急性缺血性卒中大鼠脑组织的死亡面积,加剧皮层神经元细胞的凋亡率。由此说明,Traf6介导的下游信号通路,包括炎症、细胞凋亡及氧化应激相关的通路均与缺血/再灌注损伤相关。
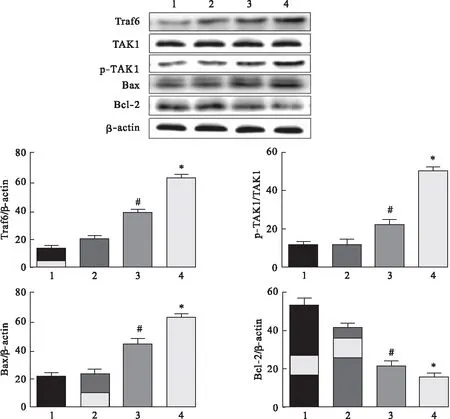
图5 槲皮黄酮通过Traf6降低神经元细胞凋亡(n=3)
为了进一步探究槲皮黄酮对缺血卒中的保护作用机制,本研究采用糖氧剥夺诱导神经元细胞缺血/再灌注模型,发现糖氧剥夺诱导组细胞凋亡蛋白表达水平与正常对照组差异有统计学意义,说明缺血/再灌注细胞模型构建成功。低、中、高剂量槲皮黄酮处理模型组细胞后,结果发现,槲皮黄酮可以明显降低细胞中促凋亡蛋白Bax表达,促进抗凋亡蛋白Bcl-2表达,抑制Traf6/TAK1信号通路的活化,并且均表现出浓度依赖性。为了进一步探究槲皮黄酮是否通过Traf6来调控细胞凋亡发生,本研究构建了过表达Traf6的细胞,采用槲皮黄酮处理后Traf6、p-TAK1、Bax的表达水平明显降低,Bcl-2的表达明显升高。表明槲皮黄酮是通过抑制Traf6的表达来调控神经元细胞的凋亡情况。
综上所述,槲皮黄酮对皮层神经元细胞凋亡发生表现出抑制作用,其可能作用机制与抑制Traf6/TAK1信号通路有关。
[1] 马云峰,尚富德.黄酮类化合物在药用植物中的分布[J].生物学杂志,2003,20(1):35-39.
[2] Comalada M,Camuesco D,Sierra S,et al.In vivo quercitrin anti-inflammatory effect involves release of quercetin,which inhibits inflammation through down-regulation of the NF-kappaB pathway[J].Eur J Immunol,2005,35(2):584-592.
[3] Dok-Go H,Lee KH,Kim HJ,et al.Neuroprotective effects of antioxidative flavonoids,quercetin,(+)-dihydroquercetin and quercetin 3-methyl ether,isolated from Opuntia ficus-indica var.saboten[J].Brain Res,2003,965(1-2):130-136.
[4] Lu J,Papp LV,Fang J,et al.Inhibition of mammalian thioredoxin reductase by some flavonoids:implications for myricetin and quercetin anticancer activity[J].Cancer Res,2006,66(8):4410-4418.
[5] Dallavalle S,Ferrari A,Biasotti B,et al.Novel 7-oxyiminomethyl derivatives of camptothecin with potent in vitro and in vivo antitumor activity[J].J Med Chem,2001,44(20):3264-3274.
[6] Wang YK,Huang ZQ.Protective effects of icariin on human umbilical vein endothelial cell injury induced by H2O2 in vitro[J].Pharmacol Res,2005,52(2):174-182.
[7] Wang YK,Hong YJ,Wei M,et al.Curculigoside attenuates human umbilical vein endothelial cell injury induced by H2O2[J].J Ethnopharmacol,2010,132(1):233-239.
[8] Foster MW,Hess DT,Stamler JS.Protein S-nitrosylation in health and disease:a current perspective[J].Trends Mol Med,2009,15(9):391-404.
[9] Landström M.The TAK1-TRAF6 signalling pathway[J].Int J Biochem Cell Biol,2010,42(5):585-589.
[10]Gong J,Li ZZ,Guo S,et al.Neuron-specific tumor necrosis factor receptor-associated factor 3 Is a central regulator of neuronal death in acute ischemic stroke[J].Hypertension,2015,66(3):604-616.
[11]Deaton C,Froelicher ES,Wu LH,et al.The global burden of cardiovascular disease[J].J Cardiovasc Nurs,2011,26(4 Suppl):S5-S14.
[12]何标,廉果.槲皮黄酮对急性缺血性卒中大鼠的保护作用及机制[J].广东药学院学报,2017,33(3):371-374.
