急性运动对血清游离mtDNA以及先天免疫信号通路的影响
2018-02-03李省天漆正堂丁树哲
李省天,漆正堂,丁树哲
急性运动对血清游离mtDNA以及先天免疫信号通路的影响
李省天,漆正堂,丁树哲
华东师范大学 青少年健康评价与干预教育部重点实验室,上海 200241
目的:探讨不同强度急性运动对小鼠外周血液循环中游离mtDNA含量和骨骼肌免疫信号通路的影响。方法:32只7周龄雄性小鼠随机分为4组:安静组(SED,n=8),低强度运动组(R10,n=8),中强度运动组(R15,n=8),高强度运动组(R20,n=8)。分别按照10 m/min、15 m/min、20 m/min的速度进行一次40 min的跑台运动,运动后即刻采集血液和腓肠肌,应用PCR技术检测小鼠血清mtDNA含量及骨骼肌免疫信号分子基因表达。结果:1)高强度运动使小鼠血清游离mtDNA含量显著增加(<0.05),但中、低强度运动组小鼠血清游离mtDNA与安静组无显著性差异;2)中低强度运动可使线粒体相关免疫信号分子(AIM2、NLRP3、TLR9、STING、MAVS)表达增加,其中,低强度运动组AIM2和STING的表达存在显著性差异,而中等强度运动组均存在显著性差异(<0.05),但高强度运动组免疫信号分子表达均下降,TLR9的表达存在显著性差异。结论:1)急性高强度运动可使血清游离mtDNA显著提高,并抑制先天性免疫反应,但血清游离mtDNA的来源是否来自骨骼肌尚需进一步实验证明;2)中、低强度急性运动对血清游离mtDNA含量无显著性影响,但可提高机体的先天性免疫能力,原因可能是细胞内游离mtDNA含量的增加。
急性运动;线粒体DNA;先天性免疫;AIM2; NLRP3;TLR9;STING;MAVS
先天性免疫是人类在漫长进化过程中获得的一种遗传特性,宿主通过模式识别受体(PatternRecognition Receptors,PRRs)识别病原体相关分子(PAMPs Pathogen-associated Molecular Patterns)和损伤相关分子(Damage-associated Molecular Patterns, DAMPs)引起免疫反应。病原相关分子(PAMPs)主要有DNA(CpG-DNA)、双链RNA、单链RNA、脂蛋白、表面糖蛋白和生物膜成分等[38]。损伤相关分子(DAMPs)是在组织或细胞受到损伤或其他情况时,释放出的一类被Toll样受体和NOD样受体[Nucleotide Oligomerization Domain(NOD)-like Receptor, NLR]识别进而诱导免疫应答发生的物质。随着线粒体相关病毒感受器(Mitochondrial-associated Viral Sensor, MAVS)的发现,线粒体与先天免疫的关系开始引起重视。随后发现的NLRP3、TLR9、STING、AIM2等免疫分子也与线粒体功能密切相关[11,20,29,33,36]。运动具有抗炎作用,其抗炎机制包括降低内脏脂肪含量、增加骨骼肌中抗炎因子的产生和释放,或者减少中性粒细胞与白细胞中TLRs(Toll-like Receptors)的表达[16]。线粒体DNA(Mitochondrial DNA,mtDNA)是组织或细胞受损时释放入血的一种DAMP,参与先天免疫过程。有研究发现,专业男性运动员血液中mtDNA含量低于正常男性,说明规律运动可降低血液中mtDNA,对于抗炎症反应有积极作用[22]。此外,有证据表明,mtDNA作为DAMPs被免疫细胞识别引起免疫反应,因此线粒体也被称为机体先天性免疫的触发器[4]。
为了进一步探求不同运动强度急性运动对骨骼肌先天免疫信号通路的影响,本研究设计了不同强度的急性运动方案,探讨运动后即刻血清游离mtDNA的变化,并提出骨骼肌释放的mtDNA可以激活细胞内免疫蛋白信号分子的假设。
1 材料与方法
1.1 实验动物及分组
C57BL/6雄性小鼠32只,7周龄,体重19~22 g,由上海斯莱克实验动物有限公司提供。国家标准啮齿类动物常规饲料和垫料均由上海生工生物技术有限公司提供,实验小鼠自由饮水饮食,每周更换垫料2~3次,饲养环境温度20℃~23℃,相对湿度50%~70%,保持通风。小鼠随机分为4组:安静组(SED)、低强度运动组(R10)、中强度运动组(R15)、高强度运动组(R20),每组均8只小鼠。
1.2 运动方案

1.3 实验动物处死与取材
安静组(SED)安静饲养,与运动组对照同步处死,运动组运动后即刻处死。立刻采取眼球取血的方式提取小鼠血液,随后断颈处死,并迅速取出完整的下肢腓肠肌,用锡纸包裹迅速置于液氮速冻,之后转到-80℃超低温冰箱保存,待测。
1.4 血清总DNA提取与mtDNA测定
取血清,基因组抽提试剂盒抽提循环DNA(碧云天D0063),依据说明书进行操作。线粒体DNA的含量用PCR进行检测,6 μL反应体系:1X SYBR Green Master Mix,200 nmol/L引物,2μL血清DNA样品。引物序列如下:ND F 5‘TCCGAGCATCTTATCCACGC3’,R5‘GTATGGTGGTAC TCCCGCTG3’;CYTb F5‘GGCTACGTCCTTCCATGAGG 3’,R5‘AGGTGAACGATTGCTAGGGC3’;COX F5‘AACA TGAAACCCCCAGCCAT3’,R5‘CTCCTCCAGCGGGATCA AAG3’。循环参数:95°C 10 min,进行40个循环(95°C 15s和58°C 1 min ),采集数据[17]。
1.5 Real-Time PCR
取完整腓肠肌,对腓肠肌中线粒体相关免疫蛋白进行mRNA表达的检测,RNA抽取参照Trizol(Invitrogen)试剂盒说明书进行。取RNA样品5 μL,以oligo Dt为随机引物反转录,进行cDNA合成。10 μL反应体系中含有:5×RT Buffer 2 μL,RT Enzyme Mix 0.5 μL,Primer Mix 0.5 μL,RNA 5 μL,Nuclease-free Water 2 μL。反应条件:37 ℃,15 min;然后95℃,5 min;-20 ℃冰箱保存。
cDNA样品按以下反应体系进行:SYBR green PCR Master Mix(TOYOBO)10 μL,上下游引物各0.8 μL,DEPC水6.4 μL,cDNA模板2 μL,总反应体积20 μL。引物序列如下:TLR9 F 5’CTGGTGTGGAACATCATTC3’;R 5’CTT TCCATTGCTGTCCCTTC3’;NLRP3 F5’AGGCTCAATTCT ATCCTCTGTG3’, R5’CTTTCCAGTTCCTTAGCCCC3’;ST INGF5’TCTGCAAGAGAAGGGCTTTG3’, R5’AAGTACGG CAAAGCTGTGTG3’;MAVS F5’GCAACTGCTTTATCTCA TTTCC3’,R 5’AACCCTAACCTTCCTGCGAG3’;AIM2 F 5’GAATTCTAATTCTCAGCCATGC3’,R5’ACAGAAGGCTTCGAGTGCTG3’。反应条件,Step1:预变性(95℃,45 s);Step2:40个循环(95℃,15 s;57℃,60 s;80℃,45 s);Step3:建立PCR产物溶解曲线,变性(95℃,15 s),退火(56℃,60 s),从56 ℃缓慢加热到95℃,15 s;每1℃收集荧光一次。熔解曲线只显示一个主波峰,说明其扩增特异性高,符合Real-Time PCR的技术要求。反应结束后PCR仪输出各反应孔的CT值,GADPH基因为内参,根据公式2-ΔCT计算待测样品目的基因相对表达进行分析。
1.6 数据统计

2 实验结果
2.1 血清循环mtDNA
本研究通过监测ND、CYTb、COX这3种mtDNA片段在小鼠血清中含量来反应游离mtDNA在外周血液循环中的存在情况。结果显示,3种mtDNA片段在SED组、R10组和R15组中的含量水平无差异,而R20组中3种mtDNA片段含量显著增加(<0.05,图1)。
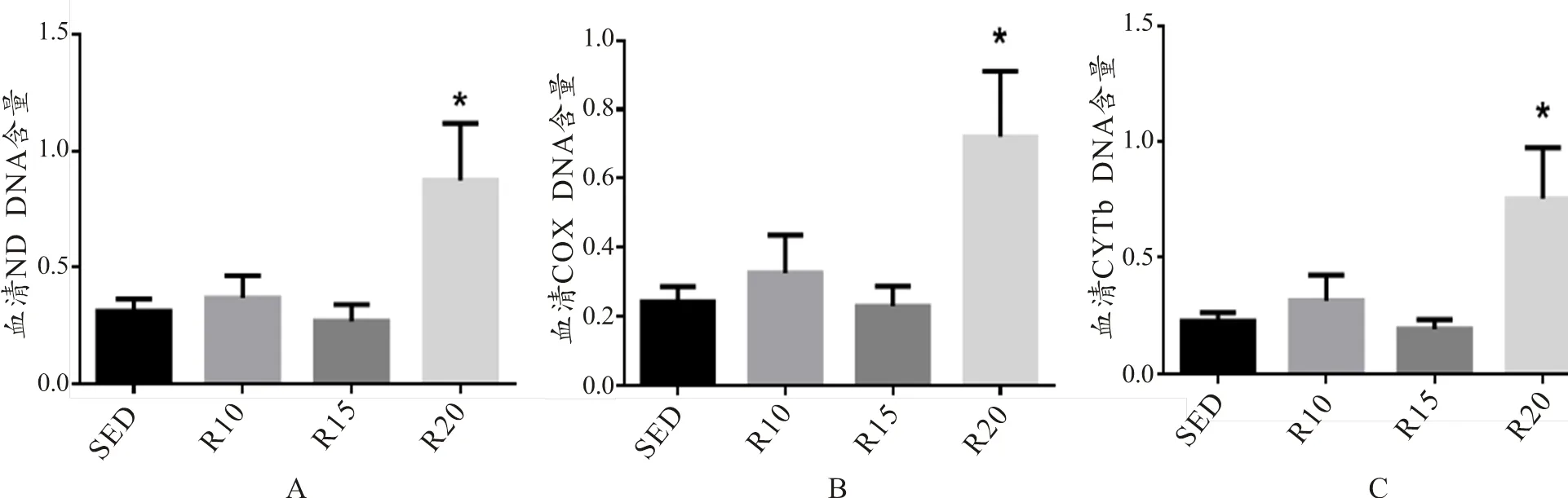
图1 小鼠血清ND1,CYTb,COX的DNA相对含量示意图(n=8)
Figure1. Changes of ND1 DNA, CYTb DNA, COX DNA Relative Content in Serum of C57BL
注:*表示与SED组比<0.05。下同。
2.2 骨骼肌免疫蛋白mRNA表达
与SED组比,R10组中免疫蛋白mRNA表达水平均有所提高,其中,STING mRNA表达显著上调(<0.01);R15组TLR9、AIM2、MAVS以及NLRP3 mRNA表达显著提高(<0.05);R20组中免疫蛋白含量表达均有所下降,其中,TLR9 mRNA表达显著降低(<0.05)。提示,中、低强度运动可明显促进骨骼肌中免疫信号分子的表达水平,而高强度运动组则对其产生了负面影响。

图2 小鼠骨骼肌免疫信号分子mRNA相对含量示意图(n=6)
Figure2. Changes of mRNA of Immune Signaling Molecule in C57BL
3 分析与讨论
骨骼肌作为一个内分泌器官参与了体内很多生理反应,其中包括先天性免疫反应。运动对先天性免疫的影响程度取决于运动的方式和强度[15]。急性运动会导致骨骼肌内环境紊乱,引发肌纤维修复、重塑和再生长,致使肌纤维类型成分改变、卫星细胞活化和成肌细胞分化,以此来适应运动训练。在这一过程中骨骼肌与免疫系统之间的交流也越来越明显,有研究证明,肌纤维收缩可改变该部位炎症环境,聚集白细胞来适应骨骼肌修复、重塑和再生长的过程[5]。Chatterjee等[7]以果蝇的间接飞行肌肉(Indirect Flight Muscles,IFM)为模型,发现残翅果蝇无法产生有效的体液免疫应答,并在以斑马鱼为脊椎动物模型代表的实验中证实了骨骼肌可以增强先天性免疫的观点。
线粒体是对细胞环境异常敏感的细胞器,细菌、病毒、氧化应激等刺激因素均可使线粒体受损,可导致mtDNA释放到细胞质基质甚至会进入到外周血液循环中诱发免疫炎症反应。外周循环DNA可以作为许多疾病确诊及发展过程中的诊断指标[3],有研究在癌症患者的血液中发现了突变的mtDNA[9,12,23,24]。Zhang等[35]发现,无菌创伤造成的类似败血病的全身系统性炎症是细胞受损后导致线粒体DAMPs释放进入外周血液循环引发先天性免疫造成的。孢疹病毒会引起mtDNA应激增强抗病毒信号和Ⅰ型干扰素分泌,证明mtDNA是抗病毒反应中的触发器[31]。Chang等[6]对绝经后妇女的研究发现,规律运动可以增加白细胞内mtDNA的拷贝数,并有研究发现,排球运动员血液游离mtDNA含量要低于正常人[22]。
本研究通过不同强度急性运动实验,发现R20组(高强度运动组)血液中mtDNA含量明显升高,其他3组无显著性变化,提示,急性高强度运动可引起线粒体失调。目前,关于mtDNA进入外周血液循环的机制还不清楚,可能的机制有3种:1)线粒体损伤导致线粒体膜通透性改变,致使mtDNA从线粒体通透性转换孔(Mitochondrial Permeability Transition Pore,mPTP)进入细胞质基质;2)运动引起肌细胞分泌外泌体,mtDNA包裹在外泌体中被释放到细胞外[26];3)溶酶体中核酸酶活性降低无法完全降解自噬体内的mtDNA,或细胞凋亡致使mtDNA进入外周循环[32]。急性大强度运动可造成肌细胞损伤[2],R20组(高强度运动组)血清游离mtDNA含量的明显提高可能由于骨骼肌细胞损伤/凋亡引起的。
先天性免疫细胞识别PAMP的PRR有4类:TLR(Toll-like Receptor)、RLR(RIG-I Like Receptor)、NLR(NOD-like Receptor)和DNA受体AIM2(Absent in Melanoma 2)。TLR9是先天性免疫和适应性免疫的纽带,它的天然配体是病毒和细菌基因组中的非甲基化胞嘧啶-磷酸-鸟嘌呤二核苷酸序列(CPG-DNA)[13],在脊椎动物的基因组中CpGDNA片段非常少见,且大多数处于甲基化状态,而线粒体中的DNA恰巧含有大量未甲基化的CpGDNA片段,当mtDNA进入细胞质或释放到细胞外时可被TLR9识别诱导细胞进行免疫应答,所以,mtDNA与TLR9可能与自身免疫性疾病和肿瘤的发生密切相关。在NLR家族中,NLRP3是一种能够识别多种外来病原体和内在危险信号的PRR[8],mtDNA释放到细胞基质中可激活NLRP3炎症小体[21,29],若减少线粒体中mtDNA的数量则可以降低NLRP3的活化,这进一步证明了mtDNA在激活NLRP3炎症小体过程中有直接作用[29]。MAVS即线粒体抗病毒信号蛋白(Mitochondrial Antiviral Signaling),是2005年由4个独立的研究小组通过不同的方法鉴定的RLR(Retinic Acid-induced Gene I-like Recptor,RLR)下游的接头蛋白,分别命名为MAVS、VISA(Virus-induced Signaling Adapter)、IPS-1(Interferon-β Promoter Stimulator 1)和Cardif(CARD Adapter Inducing IFN-β)[14,20,34]。MAVS基因敲除小鼠的实验表明,MAVS是RIG-I(Retinin Acid-Induced Gene I)和MDA5(Melanoma Differentiation-Associated Gene-5)共同的唯一接头蛋白[30],MAVS的发现揭示了线粒体在RLR信号传导中的重要地位。2008年,两个独立的研究小组报道了RLR信号通路中MAVS下游的接头蛋白,分别命名为MITA(Mediator of IRF3 Activation)和STING(Stimulator of Interferon Gene)[10,37]。免疫共沉淀实验表明,STING的N端与MAVS的C端相互作用,使STING通过MAVS与RLR相互作用,实现RLR所介导的信号传导。West等[30]研究表明,在诱导基因或者疱疹病毒感染情况下会导致线粒体转录因子A(TFAM)的缺损,降低mtDNA稳定性造成线粒体拟核的丢失,进入到细胞质中的mtDNA会通过cGAS-cGAMP-STING信号通路来激活先天性免疫反应。AIM2(Absent in Melanoma 2,AIM2)是一种主要定位在细胞质的蛋白质,体外实验显示,AIM2可与DNA直接结合,并与DNA状态有关:1)只结合双链DNA,不结合单链DNA;2)与DNA长度呈正相关,双链DNA越长,AIM2的活性越高,诱发的免疫反应越强烈;3)DNA无特异性,病毒、细菌、哺乳动物甚至人工合成的双链DNA均可通过AIM2诱导先天性免疫[1]。线粒体DNA作为体内的DAMPs,在细胞受损线粒体应激等情况下会泄露到细胞质中,与AIM2结合引发先天性免疫。
急性大强度运动可以引起一系列包括炎症反应和氧化应激在内的不良反应,但其发生机制尚未明确。目前关于骨骼肌与先天性免疫的研究鲜有报道,研究主要集中在先天性免疫与癌症和心脏疾病等方向。有研究结果表明,中等强度运动可使T淋巴细胞产生积极性免疫应答,提高机体免疫功能,而力竭运动和过度训练则抑制免疫细胞产生免疫应答。肥胖病人机体常处在慢性炎症状态,不同强度运动在提高胰岛素敏感性的同时可显著降低机体炎症水平,表明运动影响炎症相关信号通路[25]。对大鼠进行急性不同强度的训练发现,急性大强度运动引起的线粒体应激会通过线粒体自噬激活NLRP3炎症小体触发心肌的炎症反应[18]。McCarthy等[19]对美式橄榄球运动员高血压发病机制的研究发现,肌肉损伤引起的DAMPs(HMGB1和mtDNA)进入外周循环激活免疫细胞内TLR9信号通路诱发先天性免疫反应。以上研究提示,大强度运动引起炎症反应与线粒体密切相关。
本研究结果显示,R15组(中等强度运动)显著提高了NLRP3、AIM2、STING、MAVS、TLR9等线粒体相关免疫蛋白的表达,促使机体产生积极免疫应答,与前人研究结果一致;R10组(低强度运动)显示免疫蛋白的表达均有所提高,但只有AIM2和STING具有显著性差异,提示,急性低强度运动对先天性免疫系统可发挥积极影响;R20组(高强度运动)显示免疫蛋白的表达均下降,其中TLR9具有显著性差异,提示,急性高强度运动抑制了线粒体相关免疫蛋白的表达,对先天性免疫系统产生了消极影响。研究结果似乎并未证明假设的成立,R20组血清游离mtDNA存在显著性提高而免疫蛋白的表达却呈下降的现象,表明R20组骨骼肌内可能出现明显的细胞凋亡现象致使血清游离mtDNA含量提高,抑制骨骼肌内先天性免疫功能。R10组与R15组血清游离mtDNA含量与安静组并未产生显著性差异,但线粒体相关免疫蛋白的表达均成提高的趋势,其中R15组存在显著性差异,表明低强度运动和中等强度运动可能通过增加细胞质内游离mtDNA发挥增强先天性免疫的功能。综上,本研究证明,急性高强度运动可使血清游离mtDNA显著提高,并抑制先天性免疫反应,但血清游离mtDNA的来源是否来自骨骼肌尚需进一步实验证明;中、低强度急性运动对血清游离mtDNA含量无显著性影响,但可提高机体的先天性免疫能力,原因可能是细胞内游离mtDNA含量的增加。
4 结论
不同强度的急性运动对先天性免疫通路产生不同影响,中、低强度运动对先天性通路的激活可产生正向影响,原因可能是胞内游离mtDNA含量增加。
高强度运动对先天性通路激活产生负向影响,原因可能是细胞受损或凋亡增加,而血清游离mtDNA含量的显著增加是由此引起的。
[1] 郭晓强, 李文婕, 辛启亮. AIM2:一种先天免疫系统中的细胞质双链DNA感应蛋白[J]. 生命的化学, 2009(05):683-686.
[2] 王力先. 高强度运动训练对专业运动员免疫功能的影响及葫芦素E潜在免疫调节作用研究[D]. 广州:暨南大学, 2015.
[3] ANKER P, MULCAHY H, STROUN M. Circulating nucleic acids in plasma and serum as a noninvasive investigation for cancer: time for large-scale clinical studies?[J]. Int J Cancer, 2003,103(2):149-152.
[4] ARNOULT D, SOARES F, TATTOLI I,. Mitochondria in innate immunity[J]. EMBO Rep, 2011,12(9):901-910.
[5] BEITER T, HOENE M, PRENZLER F,. Exercise, skeletal muscle and inflammation: ARE-binding proteins as key regulators in inflammatory and adaptive networks[J]. Exerc Immunol Rev, 2015,21:42-57.
[6] CHANG Y K, KIM D E, CHO S H,. Association between leukocyte mitochondrial DNA copy number and regular exercise in postmenopausal women[J]. Korean J Fam Med, 2016,37(6):334-339.
[7] CHATTERJEE A, ROY D, PATNAIK E,. Muscles provide protection during microbial infection by activating innate immune response pathways in drosophila and zebrafish[J]. Dis Model Mech, 2016,9(6):697-705.
[8] GURUNG P, LUKENS J R, KANNEGANTI T D. Mitochondria: diversity in the regulation of the NLRP3 inflammasome[J]. Trends Mol Med, 2015,21(3):193-201.
[9] HIBI K, NAKAYAMA H, YAMAZAKI T,. Detection of mitochondrial DNA alterations in primary tumors and corresponding serum of colorectal cancer patients[J]. Int J Cancer, 2001,94(3):429-431.
[10] ISHIKAWA H, BARBER G N. STING is an endoplasmic reticulum adaptor that facilitates innate immune signalling[J]. Nature, 2008,455(7213):674-678.
[11] JABIR M S, HOPKINSs L, RITCHIE N D. Mitochondrial damage contributes to Pseudomonas aeruginosa activation of the inflammasome and is downregulated by autophagy[J]. Autophagy, 2015,11(1):166-182.
[12] JERONIMO C, NOMOTO S, CABALLERO O L,. Mitochondrial mutations in early stage prostate cancer and bodily fluids[J]. Oncogene, 2001,20(37):5195-5198.
[13] KASASHIMA K, SUMITANI M, ENDO H. Human mitochondrial transcription factor A is required for the segregation of mitochondrial DNA in cultured cells[J]. Exp Cell Res, 2011,317(2):210-220.
[14] KAWAI T, TAKAHASHI K, SATO S,. IPS-1, an adaptor triggering RIG-I- and Mda5-mediated type I interferon induction[J]. Nat Immunol, 2005,6(10):981-988.
[15] KRUGER K, MOOREN F C, PILAT C. The immunomodulatory effects of physical activity[J]. Curr Pharm Des, 2016,22(24):3730-3748.
[16] LANCASTER G I, KHAN Q, DRYSDALE P,. The physiological regulation of toll-like receptor expression and function in humans[J]. J Physiol, 2005,563(Pt 3):945-955.
[17] LI L, HANN H W, WAN S,. Cell-free circulating mitochondrial DNA content and risk of hepatocellular carcinoma in patients with chronic HBV infection[J]. Sci Rep, 2016,6:23992.
[18] LI H, MIAO W, MA J,. Acute exercise-Induced mitochondrial stress triggers an inflammatory response in the myocardium via NLRP3 inflammasome activation with mitophagy[J]. Oxid Med Cell Longev, 2016,2016:1987149.
[19] MCCARTHY C G, WEBB R C. The toll of the gridiron: damage-associated molecular patterns and hypertension in American football[J]. FASEB J, 2016,30(1):34-40.
[20] MEYLAN E, CURRAN J, HOFMANN K,. Cardif is an adaptor protein in the RIG-I antiviral pathway and is targeted by hepatitis C virus[J]. Nature, 2005,437(7062):1167-1172.
[21] NAKAHIRA K, HASPEL J A, RATHINAM V A,Autophagy proteins regulate innate immune responses by inhibiting the release of mitochondrial DNA mediated by the NALP3 inflammasome[J]. Nat Immunol, 2011,12(3):222-230.
[22] NASI M, CRISTANI A, PINTI M,. Decreased Circulating mtDNA Levels in Professional Male Volleyball Players[J]. Int J Sports Physiol Perform, 2016,11(1):116-121.
[23] NOMOTO S, YAMASHITA K, KOSHIKAWA K,. Mitochondrial D-loop mutations as clonal markers in multicentric hepatocellular carcinoma and plasma[J]. Clin Cancer Res, 2002,8(2):481-487.
[24] OKOCHI O, HIBI K, UEMURA T,. Detection of mitochondrial DNA alterations in the serum of hepatocellular carcinoma patients[J]. Clin Cancer Res, 2002,8(9):2875-2878.
[25] RINGSEIS R, EDER K, MOOREN F C,. Metabolic signals and innate immune activation in obesity and exercise[J]. Exerc Immunol Rev, 2015,21:58-68.
[26] SAFDAR A, SALEEM A, TARNOPOLSKY M A. The potential of endurance exercise-derived exosomes to treat metabolic diseases[J]. Nat Rev Endocrinol, 2016,12(9):504-517.
[27] SCHEFER V, TALAN M I. Oxygen consumption in adult and AGED C57BL/6J mice during acute treadmill exercise of different intensity[J]. Exp Gerontol, 1996,31(3):387-392.
[28] SETH R B, SUN L, EA C K,. Identification and characterization of MAVS, a mitochondrial antiviral signaling protein that activates NF-kappaB and IRF 3[J]. Cell, 2005,122(5):669-682.
[29] SHIMADA K, CROTHER T R, KALIN J,. Oxidized mitochondrial DNA activates the NLRP3 inflammasome during apoptosis[J]. Immunity, 2012,36(3):401-414.
[30] SUN Q, SUN L, LIU H H,. The specific and essential role of MAVS in antiviral innate immune responses[J]. Immunity, 2006,24(5):633-642.
[31] WEST A P, KHOURY-HANOLD W, STARON M,Mitochondrial DNA stress primes the antiviral innate immune response[J]. Nature, 2015,520(7548):553-557.
[32] WEST A P, SHADEL G S. Mitochondrial DNA in innate immune responses and inflammatory pathology[J]. Nat Rev Immunol, 2017,17(6):363-375.
[33] WHITE M J, MCARTHUR K, METCALF D,. Apoptotic caspases suppress mtDNA-induced STING-mediated type I IFN production[J]. Cell, 2014,159(7):1549-1562.
[34] XU L G, WANG Y Y, HAN K J,. VISA is an adapter protein required for virus-triggered IFN-beta signaling[J]. Mol Cell, 2005,19(6):727-740.
[35] ZHANG Q, RAOOF M, CHEN Y,. Circulating mitochondrial DAMPs cause inflammatory responses to injury[J]. Nature, 2010,464(7285):104-107.
[36] ZHANG Q, ITAGAKI K, HAUSER C J. Mitochondrial DNA is released by shock and activates neutrophils via p38 map kinase[J]. Shock, 2010,34(1):55-59.
[37] ZHONG B, YANG Y, LI S,. The adaptor protein MITA links virus-sensing receptors to IRF3 transcription factor activation[J]. Immunity, 2008,29(4):538-550.
[38] ZHU J, MOHAN C. Toll-like receptor signaling pathways--therapeutic opportunities[J]. Mediat Inflamm, 2010,2010:781235.
Effects of Acute Exercise on Circulating mtDNA and Innate Immune Signaling Pathways
LI Xing-tian, QI Zheng-tang, DING Shu-zhe
East China University, Shanghai 200241China.
Objective: To discuss the effects of acute exercise with different intensity on circulating mitochondrial DNA (mtDNA) and immune signaling molecules in skeletal muscle of rats. Methods: The mice were randomly divided into rest group (SED, n=8), low intensity group (R10, n=8), medium intensity group (R15, n=8), high intensity group (R20, n=8). The speed of treadmill running is 10m/min for R10, 15m/min for R15, 20 m/min for R20, Each run 40 minutes. Quantitative real time PCR was used to detect the content of mtDNA and skeletal muscle MAVS, NLRP3, TLR9, STING as well as AIM2 mRNA genes expression in each group. Results: 1 )The content of mtDNA in R20 groups improved significantly (P<0.05) ; 2 )The immune molecules’ expression improved in R15 and R10 groups ,but in R15 group improved more obviously (P<0.05) ; however ,the immune molecules’ expression in R20 all declined. Conclusion: The data suggest that acute heavy exercise can make the serum circulating mtDNA increased significantly and inhibit immune response, while the source of the serum free mtDNA from skeletal muscle still needs further experimental proof. The moderate and low intensity acute exercise has no significant effect on serum free mtDNA content, but it can improve the innate immunity ability of the body, which may be the increase of free mtDNA content in the cell.
G804.2
A
1002-9826(2018)01-0123-06
10.16470/j.csst.201801017
2017-03-10;
2017-12-21
国家自然科学基金资助项目(316712141)。
李省天,女,在读硕士研究生,主要研究方向为运动适应与线粒体信号调控,E-mail:1838006723@qq.com。
