Survivin、COX⁃2和P⁃gp在结直肠癌中的表达及临床意义*
2018-02-01刘振兴梁金龙杨雪峰遵义医学院附属医院胃肠外科贵州遵义563003
刘振兴,梁金龙,杨雪峰,谢 铭(遵义医学院附属医院胃肠外科,贵州遵义563003)
结直肠癌(CRC)又称大肠癌,是消化系统常见的恶性肿瘤之一,其发病率居我国消化系统恶性肿瘤的第1位[1]。近年来,随着人口老龄化、饮食习惯及生活方式的改变,CRC的发病率呈逐年上升趋势[2]。其早期症状隐匿、临床发现多属于中晚期、5年生存率低、预后较差,严重威胁着人类的健康[3]。因此,开展CRC的防治研究具有重要意义。CRC的发生与发展是一个极为复杂的过程,为了探讨凋亡抑制蛋白(Survivin)、环氧合酶⁃2(COX⁃2)和 P⁃糖蛋白(P⁃gp)在 CRC 发病过程中的作用,本研究采用免疫组化方法检测Survivin、COX⁃2和P⁃gp在CRC中的表达,并分析其相关性及与临床病理特征的关系,从而为探索CRC新的诊断及防治方法提供实验依据。
1 资料与方法
1.1 一般资料 选取2014年1—12月本院60例临床病理资料完整的CRC患者手术标本,取癌组织和其中20例患者的相应正常黏膜组织(距肿瘤大于10 cm)作为研究对象。60例患者中,男31例,女29例;年龄37~80岁,平均(60.2±12.5)岁;所有患者术前均未进行过放化疗等相关治疗,并排除CRC家族史和CRC术后复发者。60例患者均为腺癌,其中肿瘤直径小于5 cm 34例,≥5 cm 26例;中高分化14例,低分化46例;肿瘤浸润未及浆膜层19例,浸润超过浆膜层41例;有淋巴结转移38例,无淋巴结转移22例;CRC TNM分期:Ⅰ~Ⅱ期27例,Ⅲ~Ⅳ期33例。所有标本均经甲醛溶液固定,常规石蜡包埋,4 μm厚连续切片。
1.2 方法
1.2.1 试剂与方法 Survivin兔抗人多克隆抗体、COX⁃2兔抗人多克隆抗体、P⁃gp兔抗人单克隆抗体、即用型抗鼠/兔通用免疫组化试剂盒均购自上海基因科技有限公司。采用免疫组化方法(GTVision法)检测,实验操作步骤严格按照试剂盒说明书进行,以磷酸盐缓冲液(PBS)代替一抗作为阴性对照。
1.2.2 结果判断标准 根据阳性细胞数及阳性信号出现的位置综合判断。Survivin、COX⁃2阳性染色定位于细胞浆和胞膜的棕黄色颗粒,P⁃gp阳性染色定位于细胞膜的棕黄色颗粒。细胞着色强度评分:无色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分;阳性细胞百分数(以 a表示)评分:0为 0分,0<a≤25% 为 1分,25%<a≤50% 为 2 分,50%<a≤75% 为 3 分,75%<a≤100%为4分;以阳性细胞数计分和着色强弱计分之乘积评定,>3分者为阳性,≤3分者为阴性。
1.3 统计学处理 采用SPSS17.0软件进行分析。计数资料以率或构成比表示,采用χ2检验;二者的相关性采用 Spearman相关性分析。P<0.05为差异有统计学意义。
2 结 果
2.1 Survivin、COX⁃2和 P⁃gp在 CRC 及正常结直肠黏膜组织的表达情况 Survivin、COX⁃2在CRC内主要表达于细胞质和细胞膜,P⁃gp主要表达于细胞膜。阳性表达结果为棕黄色颗粒(图1~3)。60例CRC组织中Sur⁃vivin蛋白表达阳性43例,表达率为71.7%(43/60);20例正常大肠黏膜组织内Survivin蛋白阳性表达率为15.0%(3/20),二者比较,差异有统计学意义(χ2=18.287,P<0.01);60例 CRC 组织中 COX⁃2蛋白表达阳性40例,表达率为66.7%(40/60);20例正常结直肠黏膜组织内COX⁃2蛋白阳性表达率为20.0%(4/20),二者比较,差异有统计学意义(χ2=13.119,P<0.01);60 例CRC组织中P⁃gp蛋白表达阳性15例,表达率为25.0%(15/60);20例正常结直肠黏膜组织内P⁃gp蛋白阳性表达率为10.0%(2/20),二者比较,差异无统计学意义(χ2=2.017,P>0.05)。见表 1。
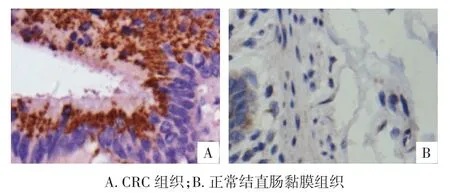
图1 Survivin在CRC及正常结直肠黏膜组织内表达(400×)

图2 COX⁃2在CRC及正常结直肠黏膜组织内表达(400×)

图3 P⁃gp在CRC及正常结直肠黏膜组织内表达(400×)

表1 CRC、正常结直肠黏膜组织中Survivin、COX⁃2和 P⁃gp 的表达[n(%)]
2.2 Survivin和COX⁃2的表达与CRC临床病理特征的关系 Survivin和COX⁃2二者均与浸润深度、淋巴结转移、肿瘤分期相关(P<0.05),而与CRC患者性别、年龄、肿瘤大小及分化程度无相关性(P>0.05)。见表2。
2.3 Survivin和COX⁃2在CRC中表达的相关性分析 43例Survivin蛋白阳性表达的CRC患者中COX⁃2蛋白的阳性表达为34例,17例Survivin蛋白阴性表达的CRC患者中COX⁃2蛋白的阳性表达6例,Spearman相关性分析显示二者呈正相关(r=0.418,P<0.01)。见表3。
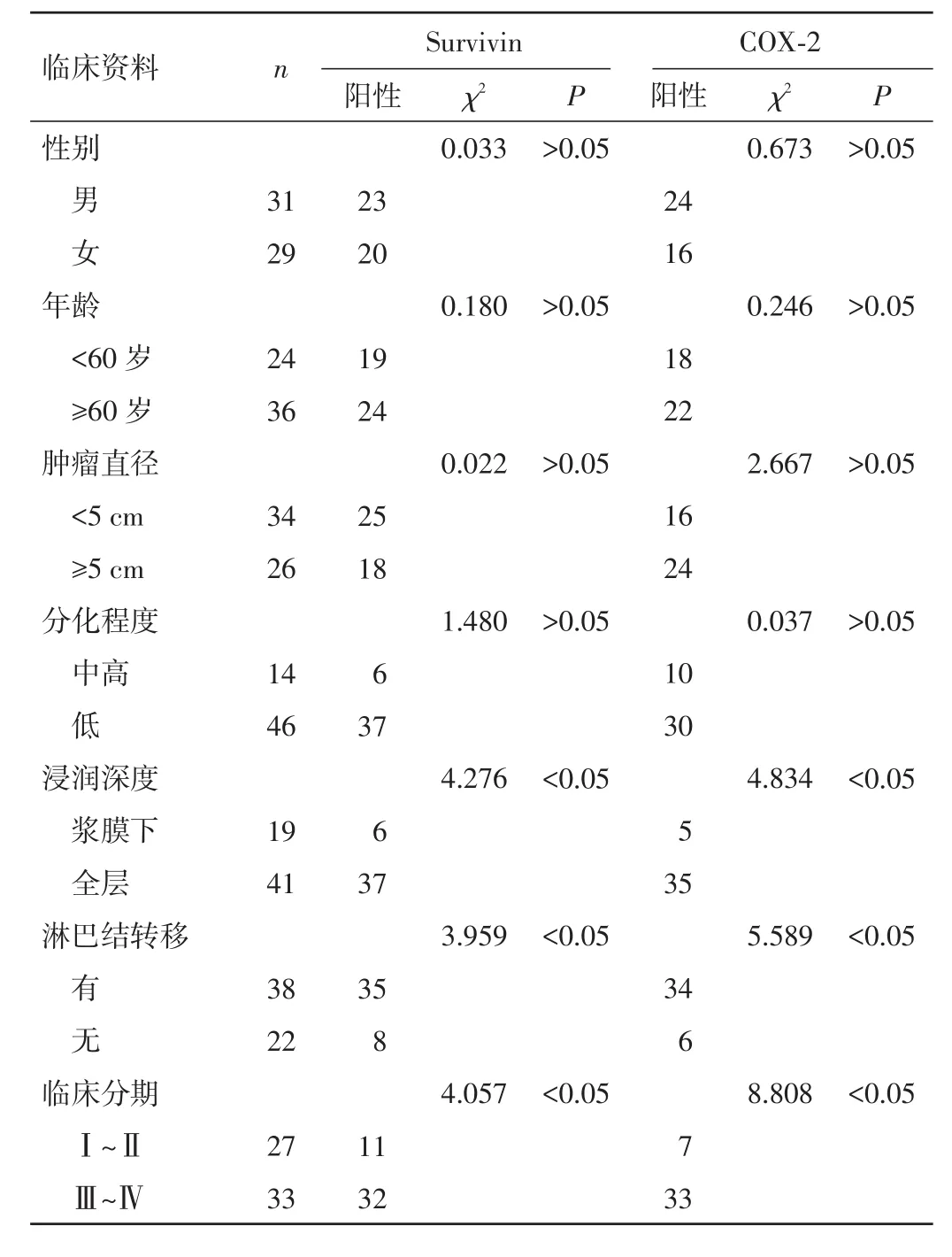
表2 Survivin和COX⁃2异常表达与CRC临床病理特征的关系(n)

表3 CRC患者Survivin和COX⁃2表达的关系[n(%)]
2 讨 论
CRC是我国最常见的消化系统恶性肿瘤之一,严重威胁着人类健康,其发生是一个多因素、多步骤共同参与的复杂过程,而肿瘤患者的预后与其侵袭、转移及对化疗药物的敏感性密切相关[4]。
Survivin是凋亡抑制蛋白家族(IAPs)的一员,也是目前发现的最强的凋亡抑制因子[5],含142个氨基酸,相对分子质量为16.5×103。Survivin具有肿瘤特异性表达的特点,其通过抑制Caspase⁃3和Caspase⁃7的活性,从而抑制肿瘤细胞凋亡[6],促进细胞增殖,并通过对细胞G2/M期的调节,参与细胞周期调控、有丝分裂的过程,导致肿瘤细胞跳过细胞控制点而继续增殖[7]。同时其具有促进肿瘤血管生成作用,参与肿瘤细胞的侵袭、转移等生物学行为[8]。研究报道,Survivin在正常结直肠黏膜中呈无表达或低表达,在CRC组织中呈高表达,且与肿瘤的淋巴结转移和临床分期相关[9⁃10]。本研究结果显示,CRC组织中Survivin蛋白表达阳性表达率为71.7%(43/60),明显高于正常黏膜组织内表达阳性表达率15.0%(3/20),二者比较,差异有统计学意义(χ2=18.287,P<0.01),其高表达与肿瘤浸润深度、淋巴结转移、临床分期密切相关(P<0.05)。提示Survivin可能为CRC特异性表达的一种分子生物学改变,因此可作为CRC早期诊断和评判预后的指标。
COX是催化花生四烯酸转化为前列腺素(PG)的关键酶,COX⁃2是其中一个亚型,在正常组织中无表达,其多种实体肿瘤的增殖、侵袭和转移,并与其预后密切相关[11]。研究表明,COX⁃2也过表达于CRC中,与肿瘤临床分期、浸润深度及淋巴结转移密切相关,并与基质金属蛋白酶⁃2(MMP⁃2)呈协同效应,共同促进CRC的发生与发展[12]。COX⁃2高表达能够促进PGs的合成,从而抑制肿瘤细胞的凋亡[13]。赵亚玲等[14]研究结果表明,塞来昔布能够显著下调COX⁃2蛋白表达水平,从而抑制人红白血病HEL细胞增殖、迁移。COX⁃2可能通过促进细胞增殖和抑制细胞凋亡、诱导肿瘤血管形成、逃避生物体内细胞免疫监视作用等机制发挥抗凋亡作用[15]。本研究结果表明,COX⁃2蛋白在CRC组织中表达阳性表达率为66.7%(40/60),显著高于正常黏膜组织内表达阳性率20.0%(4/20),二者比较,差异有统计学意义(χ2=13.119,P<0.01),与 Survivin 蛋白表达相同,COX⁃2高表达也与肿瘤浸润深度、淋巴结转移、临床分期密切相关(P<0.05)。通过进一步分析,COX⁃2与Survivin在CRC组织中的阳性表达呈正相关(P<0.05),提示二者共同促进了CRC的发生与发展。
P⁃gp是由多药耐药基因1(MDR1)编码的跨膜糖蛋白,是一种腺苷三磷酸(ATP)依赖性外输泵[16]。P⁃gp和ATP结合后,利用ATP供能,将化疗药物泵至细胞外,因此肿瘤细胞内的药物蓄积下降,低于杀伤肿瘤细胞的水平,从而导致细胞产生耐药,这种药物外排机制称为经典的多药耐药(MDR)机制[17]。赵岗等[18]采用Western blotting检测CRC耐奥沙利铂细胞HCT116/L、耐阿霉素细胞LoVo/adr及对应亲本细胞中P⁃gp蛋白表达情况,结果显示在耐药细胞HCT116/L、LoVo/adr中P⁃gp高表达,而在亲本细胞中未检测到其表达。在本研究中,CRC组织内P⁃gp蛋白的表达阳性率25.0%(15/60)与正常黏膜组织内表达阳性10.0%(2/20)比较,差异无统计学意义(χ2=2.017,P>0.05)。结合患者病史资料进行分析,由于患者术前均未进行过放化疗等治疗,并未产生化疗药物耐药性,这或许是本实验中CRC组织内P⁃gp低表达或无表达的主要原因。
综上所述,本研究通过免疫组化方法,检测了CRC组织与正常黏膜内 Survivin、COX⁃2和 P⁃gp的表达,结果显示在CRC组织内Survivin和COX⁃2明显高表达,而P⁃gp低表达或无表达。Survivin和COX⁃2的异常表达与CRC的侵袭,转移密切相关,进一步分析表明二者的表达呈协同效应,提示二者共同促进CRC的发生与发展。通过研究其与CRC临床特征的关系,可为CRC的诊治及判断预后提供新的理论依据。
[1]ZHENG R,ZENG H,ZHANG S,et al.National estimates of cancer prevalence in China,2011[J].Cancer Lett,2016,370(1):33⁃38.
[2]徐玉彬,张培建,王超臣.结直肠癌的病因及发病机制的研究进展[J].中华临床医师杂志,2015,9(15):2912⁃2915.
[3]DAVID KA,UNGER FT,UHLIG P,et al.Surgical procedures and postsurgical tissue processing significantly affect expression of genes and EGFR⁃pathway proteins in colorectal cancer tissue[J].Oncotarget,2014,5(22):11017⁃11028.
[4]孙荣,姚健,杨志.结直肠癌患者的临床特征及预后影响因素[J].中国肿瘤临床与康复,2015,22(12):1420⁃1422.
[5]CHENG XL,LI MK.Effect of topiramate on apoptosis⁃related protein expression of hippocampus in model rats with Alzheimers disease[J].Eur Rev Med Pharmacol Sci,2014,18(6):761⁃768.
[6]NIU Y,LI JS,LUO XR.Enhancement of expression of survivin promoter⁃driven CD/TK double suicide genes by the nuclear matrix attachment region intransgenicgastriccancercells[J].Gene,2014,534(2):177⁃182.
[7]BOYKIN C,ZHANG G,CHEN YH,et al.Cucurbitacin Ⅱa:a novel class of anti⁃cancer drug inducing non⁃reversible actin aggregation and inhibiting survivin Independent of JAK2/STAT3 phosphorylation[J].Br J Cancer,2011,104(5):781⁃789.
[8]张鑫,郝玉琴.靶向survivin shRNA在肿瘤治疗中的研究进展[J].中国麻风皮肤病杂志,2016,32(1):58⁃60.
[9]王林娜,侯素平,刘洪博,等.结直肠癌中REG4与survivin的表达及临床意义[J].实用医学杂志,2015,31(20):3347⁃3350.
[10]薛军,武雪亮,高晓斌,等.结直肠腺癌组织survivin和Ki⁃67的表达及其与预后的关系[J].基础医学与临床,2015,35(11):1526⁃1530.
[11]ABDELAAL ASMAA A,AFIFY RA,ZAHER AE,et al.Study of prognostic significance of marrow angiogenesis assessment in patients with de novo acute leukemia[J].Hematology,2015,20(9):504⁃510.
[12]卢国丰,陈军,刘菊林,等.COX⁃2和MMP⁃2在结直肠癌中的表达及其意义[J].胃肠病学,2014,19(10):596⁃598.
[13]王志强,黄述斌,李松梅,等.环氧合酶⁃2及表皮生长因子在结直肠肿瘤中的表达及意义[J].安徽医学,2015,36(11):1361⁃1363.
[14]赵亚玲,刘贵敏,梁文同,等.COX⁃2抑制剂对人红白血病HEL细胞增殖,凋亡及迁移的影响[J].南京医科大学学报(自然科学版),2016,36(4):435⁃439.
[15]MISRA S,SHARMA K.COX⁃2 signaling and cancer:new players in old arena[J].Curr Drug Targets,2014,15(3):347⁃359.
[16]冯慧玲,熊玉卿.与P⁃糖蛋白及MDR1基因关联的药物转运研究现状[J].中国临床药理学杂志,2014,30(11):1062⁃1064.
[17]张剑虹,张飞,张晓丽,等 .CerbB⁃2、MDR1/P⁃gp 蛋白在乙状结肠黏液腺癌中的表达及意义[J].河北医药,2015,37(10):1454⁃1457.
[18]赵岗,郑泰浩,黄秀,等.结直肠癌中microRNA⁃451部分逆转MDR1/P⁃gp途径介导的多药耐药[J].第三军医大学学报,2016,38(2):155⁃160.
