上转换发光技术侧流免疫夹心法检测麻风患者和家庭接触者PGL-I抗体水平
2018-01-31张信辉杨梨丽赵廷芳杨昌明翁小满AnoukvanHooijPaulCorstjensAnnemiekeGeluk赖雅芳李进岚
张信辉 杨梨丽 杨 琴 赵廷芳 杨昌明 戴 乾 元 康 翁小满 温 艳 Anouk. van Hooij Paul Corstjens Annemieke Geluk 赖雅芳 付 云 李进岚
麻风分枝杆菌(Mycobacterium Leprae, ML)是麻风的病原体,麻风是严重影响人类身心健康的疾病。目前早诊断与早治疗依然是控制麻风的基石,涂片查菌阳性率低和缺乏特异性延迟了麻风早期诊断及治疗。但因多菌型(MB)麻风患者细胞免疫力缺陷,体液免疫力与正常人接近,而少菌型(PB)与MB相反,造成免疫检测困难[1];另 ML 抗原大多与结核分枝杆菌(Mtb)、 非结核分枝杆菌(NTM)有交叉反应,也限制了免疫诊断的发展。目前诊断的麻风病人,通常发现较晚,即使采用了有效的联合化疗(MDT),依然有相当多的治愈病人因麻风病所致神经损伤而造成畸残[2]。早期发现并及时治疗麻风病,是切断传播途径、减少麻风致残的先决条件。从麻风患者的家属(家内接触者)中监测到临床极易忽略的早期感染者及潜在的麻风患者十分困难。麻风患者PGL-I血清水平与细菌指数(BI)相关[11],通过对PGL-I抗体检测结果的分析,密切监测PGL-I抗体水平的变化,评估发病风险。本研究旨在判断该实验对疾病发病的预测价值,并提供一种新的诊断麻风感染的有效诊断方法。
1 材料和方法
1.1 UCP-LFA反应管及检测试剂由本项目合作单位(荷兰莱顿大学医学中心传染病研究所)Annemieke GelukA教授自主研发[9,10]。项目期间在麻风流行地区采集下列研究对象肝素抗凝全血标本进行UCP-LFA检测分析:①未服药的新确诊麻风患者(排除复发患者)60例;②患者家属(与麻风患者共同生活半年以上)87名;③正常人(与麻风患者无共同生活史)56名。
1.2 采集肝素抗凝全血,3 h内分装在反应管内(每管全血1 mL以上),即刻放入37℃水浴箱孵育20~24 h,孵育结束后转存-20℃以下冰箱待检。
1.3 ①测试前,将反应管内的样本室温解冻,4500 g离心10 min。②吸取上清液(4 uL)至96孔稀释板中(每孔预加200 uL buffer),避免吸到细胞层,按标本编号顺序排列。③将显色剂(UCP)水浴超声振荡器处理后每孔加2 uL;④将PGL-1检测试纸条(批号:170405)放入稀释板各样本孔中,直至试纸条干燥。⑤用LUMC(Leiden University Medical Center)结果判读仪逐个读取检测结果(相对荧光单位 RFUs),并计算T/FC比值以判断阴阳性。
2 结果
本次研究样本共203份,其中患者60份,家内接触者87份,正常对照组56份,检测失败2份,有效结果共201份。
2.1 临界值确定 根据labrox结果判读仪(LUMC)读取的检测值和计算的ROC曲线来确定临界值。测试线和流量控制线的波峰面积比(R),Windows下GraphPad Prism version 7.00软件(GraphPad Software,拉霍亚加利福尼亚,美国)计算Youden指数确定最佳试验界限(图1)。经计算将临界值确定为0.29。
计算ROC曲线(receiver operating characteristic curve)以评估PGL-I的诊断潜力,区分麻风病人、家内接触者和健康人。PGL-I能区分LL/BL 、BT/TT患者和EC、HHC(图2),显示出对BL/LL患者有极好的显著性,对BT/TT患者有良好的显著性(表1)。
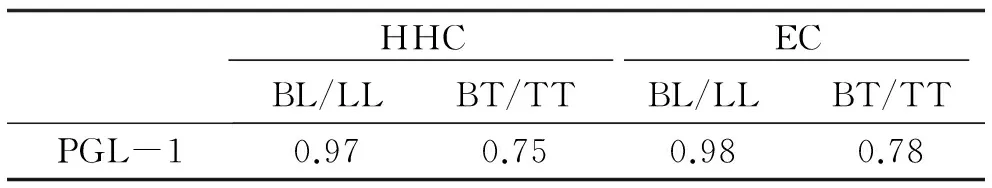
表1 曲线下面积的显著性(AUC)
2.2 PGL-I IgM阳性率
2.2.1 按患者、家内接触者和正常对照分组,计算PGL-I IgM阳性率,其阳性率分别为81.4%、5.7%和1.8%。患者组PGL-I IgM阳性率明显高于其余两组,家内接触者组PGL-I IgM阳性率又明显高于正常对照组。三组之间差异有统计学意义(χ2=126.47,P<0.005),见图3。
2.2.2 按少菌型(PB)和多菌型(MB)分组计算PGL-I IgM阳性率,其阳性率分别为44.5%和89.4%。MB患者PGL-I IgM阳性率明显高于PB患者。两组间差异有统计学意义(χ2=11.181,P<0.005),见图4。1例未定型麻风(I)未纳入分析。
2.2.3 按BI值阴阳性对患者分组, BI+、BI-患者其PGL-I IgM阳性率分别为83%、0%。BI+ 组PGL-I IgM阳性率明显高于BI- 组。两组之间差异有统计学意义(χ2=17.560,P<0.005),见图5。
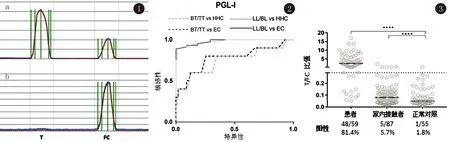
图1 检测线(T)一个正信号(a)和一个负信号(b);流量控制(FC)峰值为内部对照图2 ROC曲线以评估PGL-I的诊断潜力,区分麻风病人、家内接触者和健康人图3 麻风患者、家内接触者和正常对照分组PGL-I IgM阳性率
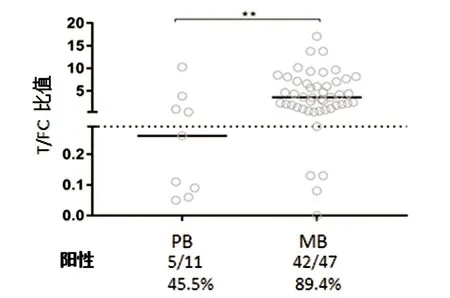
图4 不同型别PGL-I IgM阳性率
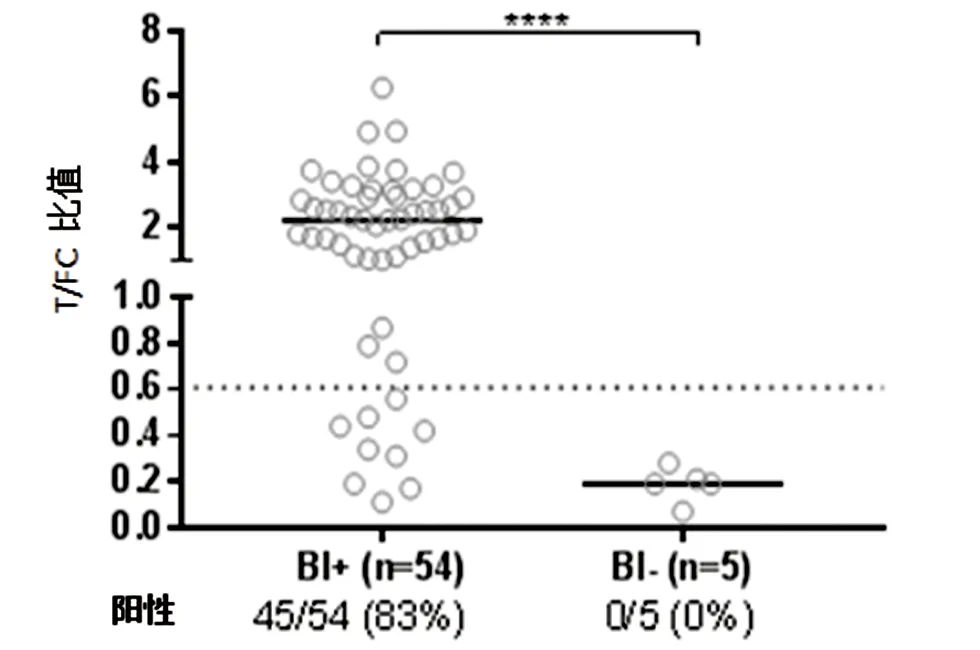
图5 BI值阳性与阴性者的PGL-I IgM阳性率
3 讨论
研究结果显示,患者、家内接触者、正常对照组PGL-I IgM阳性率分别是81.4%、5.7%和1.8%。患者组PGL-I IgM阳性率明显高于其余两组,家内接触者组PGL-I IgM阳性率又明显高于正常对照组。三个组别之间的差异有统计学意义(χ2=126.47,P<0.005)。多菌型(MB)PGL-I IgM阳性率(89.4%)明显高于少菌型(PB)(45.5%)。三个组之间差异有统计学意义(χ2=11.181,P<0.005)。虽然少菌型(BT/TT)患者中检测IgM类抗体阳性率不高,不能用于人群筛选,但可用于:为治疗目的区分MB和PB[4,12];早期预测复发或发病[4,5];在高危人群(如家内接触者)中发现发病危险者。按BI值阴阳性对患者分组, BI+、BI-患者其PGL-I IgM阳性率分别为83%、0%。BI+组PGL-I阳性率明显高于BI-组,两个组之间差异有统计学意义(χ2=17.560,P<0.005),其他学者的研究结果亦表明血抗麻风分枝杆菌IgM类抗体的水平与BI呈线性相关[11],故在麻风患者家内接触者中检出PGL-I IgM抗体水平高的个体,对该个体的发病风险评估具有重要意义。
家内接触者PGL-I IgM检测阳性(T/FC比值>0.29)5例(5/87),其中,3例为父/母子,2例为夫妻,接触的患者4例为多菌型(BL/LL)、1例为未定型麻风;另有5例家内接触者PGL-I IgM检测值偏高(T/FC比值=0.25~0.29),其中,3例为父/母子,1例为夫妻,1例为兄弟,且接触患者均为多菌型。家内接触者几乎与麻风患者共同生活,有极易被感染的环境条件,一些早期发现麻风有家族聚集现象的学者,证实遗传因素在麻风病学中起到重要作用,由于在这些易感家族中有相同的易感因素和相同的生活环境,故他们患麻风的危险性较无亲属患麻风的人群高[8]。也有研究表明,多菌型接触者中PGL-I抗体阳性者发病危险性比阴性高8倍以上[3,4,6,7]。故本次筛查发现的5例PGL-I IgM阳性及5例PGL-I IgM检测值偏高的接触者,可视为麻风发病危险者,均应密切随访[4],尤其以6例父/母子关系的接触者为随访重点。
55例正常对照组中,1例PGL-I检测阳性。自述出生于我省麻风流行地区(生活史5年),家内无明确诊断的麻风患者,应密切随访。
[1] 吴勤学,王洪生.麻风免疫诊断进展[J].中国麻风皮肤病杂志,2014,30(7):405-408.
[2] 吴勤学,王洪生.麻风病的血清学[J].中国麻风皮肤病杂志,2005,21(4):294-296.
[3] Geluk A, Duthie MS, Spencer J. Postgenomic Mycobacterium leprae antigens for cellular and serological diagnosis of M. leprae exposure,infection and leprosy disease[J]. Lepr Rev,2011,82(4):402-421.
[4] Barreto JG, Guimarães Lde S, LeaoMR, et al. Anti-PGL-1 seroepidemiology in leprosy cases :household contacts and school children from a hyperendemic municipality of the Brazilian[J]. Lepr Rev,2011,82(4):358-370.
[5] 翁小满,吴勤学,邓云山.麻风亚临床感染研究[J].中国麻风杂志,1987,3(4):197-201.
[6] 翁小满,邓云山,吴勤学.麻风免疫流行学研究[J].中华流行病学杂志,1990,11(1):16-19.
[7] Parkash O. Serological detection of leprosy employing Mycobacterium. leprae derived serine-rich 45kDa,ESAT-6,CFP-10 and PGL-1: acompilation of data from studies in Indian populations[J]. Lepr Rev,2011,82(4):383-388.
[8] 张永华,陈维国,郑承斌.家庭内麻风病发病调查分析及预防的必要性[J].现代预防医学,2001,28(2):216.
[9] van Hooij A, Tjon Kon Fat EM, Richardus R, et al. Quantitative lateral flow strip assays as User-Friendly tools to detect biomarker profiles for leprosy[J]. Sci Rep,2016,6:34260.
[10] van Hooij A, Tjon Kon Fat EM, van den Eeden SJF, et al. Field-friendly serological tests for determination of M. leprae-specific antibodies[J]. Sci Rep,2017,7(1): 8868.
[11] 吴勤学,李新宇,叶干运.对麻风天然和人工抗原的评价[J].中国麻风杂志,1989,5(3):132-137.
[12] Spencer JS, Brennan PJ. The role of Mycobacterium. leprae phenolic glycol-lipid-1(PGL-1)in serodiagnosis and in the pathogenesis of leprosy[J]. Lepr Rev,2011,82(4):344-357.
