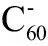碳纳米材料的水环境行为及对水生生物毒理学研究进展
2018-01-29李佳昕张娴张爱清常雪灵
李佳昕,张娴,张爱清,常雪灵
1. 中南民族大学,武汉 430071 2. 中国科学院环境与健康重点实验室,中国科学院城市环境研究所,厦门 361021 3. 中国科学院纳米生物效应与安全性实验室,中国科学院高能物理研究所,北京 100049
碳纳米材料是由碳元素组成,至少有一个维度在纳米尺度的新型纳米材料,主要包括富勒烯(fullerene)、碳纳米管(carbon nanotubes)和石墨烯(graphene)。近10年来,碳纳米材料的诸多优势使其用于导电材料、光学器件、量子计算机领域,并在生物污染修复、分子开关、组织工程学、制药、医学等方面得到了广泛的应用[1-5]。随着碳纳米材料使用增多,不可避免地从环境中扩散到水体、土壤和大气等介质并在其中沉积下来[6-8],所以在生态系统中,每一个环节都有可能有碳纳米材料的暴露并积累,而水环境与水生生物和人类关系最为密切,所以其影响备受关注。图1总结了碳纳米颗粒在环境中可能的分布行为和传播途径[9]。
大量研究表明,碳纳米颗粒能穿过细胞壁、细胞膜从而进入生命体的任何细胞,引发生物体肺部肿瘤和细胞炎症等反应,对生物体产生毒性效应,而且它们很可能沿着食物链传递并累积[10-11]。另外,碳纳米材料脂溶性强,水中溶解度低,是现今最难生物降解的人工合成材料之一。虽然目前在水体中测到的碳纳米材料浓度非常低[12],它们对自然环境和生物健康的危害没有完全暴露出来,但是随着碳纳米材料的大量生产和使用,其进入水环境中的机会越来越多。因此,对碳纳米材料的水环境行为与水生生物的毒性效应研究已然迫在眉睫[13-14]。本文总结了关于碳纳米材料在水环境中的行为、对水生生物毒性效应及其毒性机理等方面的研究进展,为研究碳纳米材料对环境的影响提供客观依据,并对今后的研究方向作出展望。
1 碳纳米材料的分类、特性及应用(Classification, characteristics and application of carbon nanomaterials)
碳纳米材料根据其结构特征可将其主要分为富勒烯、碳纳米管和石墨烯。其分类、制备方法、特征和用途见下表1。
富勒烯是由多个碳原子构成的空心球状体(表1a),其单体含60个碳原子,因此富勒烯也称C60。人类在1985年首次发现了富勒烯,其是由60个碳原子连接而成的32面空心球体,直径0.71 nm,其包含了12个五圆环和20个六圆环,因外形酷似足球,所以也被称为足球烯[15]。
碳纳米管(CNTs)单体是由石墨片卷曲形成的圆柱型管状体,根据不同的石墨片层数,可以分为单壁碳纳米管,简称SWCNTs(图2b)和多壁碳纳米管,简称MWCNTs(图2c)。理想碳纳米管是由碳原子形成的石墨烯片层卷曲而成的无缝、中空的管体,且构成CNTs的片层之间存在一定的夹角,由于其独特的结构,CNTs具有很多其他纳米材料不具备的特殊性能——高弹性、高强度、低密度、良好的红外吸收性及强疏水性等优点。根据SWCNTs的卷曲向量不同,又可以表现出金属性或半导体性这2种不同特性[17]。利用CNTs的特殊性质,我们可以制作出大量性能优异的复合材料,如CNTs增强的陶瓷复合材料和CNTs增强的塑料。另外据理论推算,CNTs的可逆储/放氢量在5 wt%左右,是迄今为止最好的储氢材料[18]。

图1 纳米材料生态环境行为示意图[9]注:图中黑圆点代表碳纳米材料,数字代表其各种环境过程;①大气与地表间的交换②大气输送③土壤中迁移扩散和渗透④土壤中转化 ⑤陆生生物吸收富集⑥地下水中迁移和转化⑦地表径流⑧水体与土壤间交换⑨水中分散与悬浮 ⑩水中团聚与沉淀水体中转化水生生物吸收富集人体暴露。Fig. 1 Ecological behavior of nanomaterials[9]Note: black dot represents carbon nanomaterials; ① exchange between atmosphere and earth surface, ② atmospheric transport, ③migration, distribution and permeation in soil, ④ transformation in soil, ⑤ absorption and accumulation by terrestrial organisms, ⑥ migration and transformation in ground water, ⑦ surface runoff, ⑧ exchange between waters and soil, ⑨ distribution and suspension in water, ⑩ agglomeration and precipitation in water, transformation in water, absorption and accumulation by aquatic organisms, human exposure.
石墨烯又称单层石墨(图2d),是一种蜂窝状二维平面结构,其轨道杂化模式为sp3杂化,同时具有金属和半导体的一些特性。石墨烯具有独特的机械、热力学、电学特性,与此同时,它还具有独特而优异的理化性能[19]。与碳纳米管一样,石墨烯在柔性透明导电材料、场发射、场效应晶体管器件、超级电容器、太阳能电池、储氢储能材料、传感器、复合材料、生物医学应用等众多方向具有巨大的潜在应用前景[20]。
2 碳纳米材料在水环境中的行为(Behavior of carbon nanomaterials in aquatic environment)
2.1 碳纳米材料在水环境中的稳定性及影响因素
在水环境中,碳纳米材料溶解度低,属于疏水性,会发生悬浮、聚沉和再悬浮等行为[21]。碳纳米材料的分散和聚集除了与自身性质密切相关,也与水体环境,如pH、水溶液的离子强度、表面活性剂和溶解性有机质等因素有关。其在水环境中的分散和聚集性能极大地影响其迁移归趋等环境行为[22]。
2.1.1 C60的水环境行为
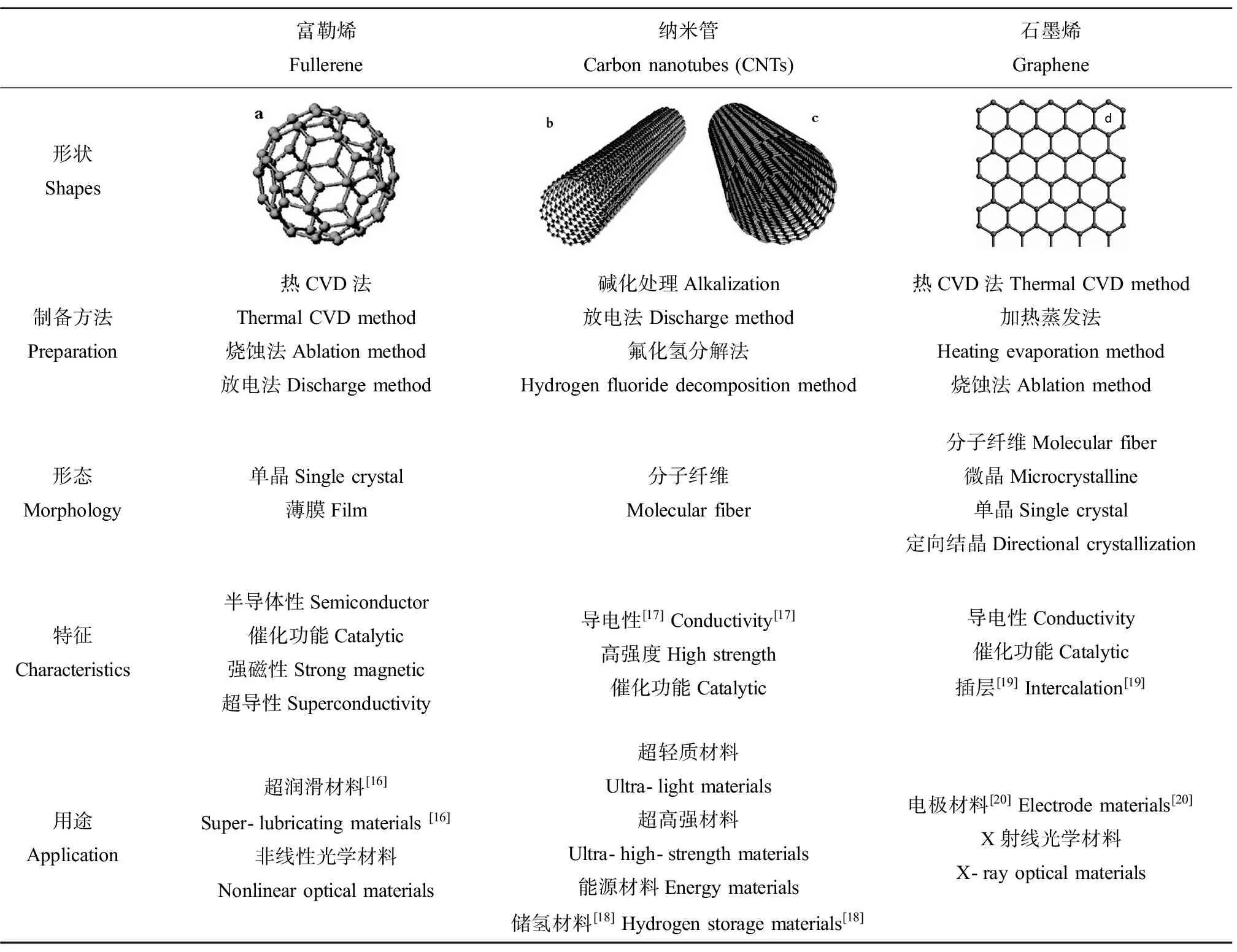
表1 单质碳纳米材料(a.富勒烯b. 单壁碳纳米管 c. 多壁碳纳米管 d.石墨烯)Table 1 Carbon nanomaterials (a. Fullerenes b. SWCNT c. MWCNTs d. Graphene )
C60在水中的溶解度很小,基本不溶或微溶于其他极性溶剂,但C60在水中会以胶态聚集体的形式稳定存在[23-26]。有研究表明,随着pH上升,C60纳米材料的粒径先快速减小然后趋于稳定,表面zeta电位增大,随电解质浓度的增加,C60纳米材料粒径呈现增大的趋势且zeta电位减小。在水溶液中,表面活性剂会形成泡状溶液或者胶束溶液,这会大大增加C60的溶解度[27]。如C60可以在表面活性剂曲拉通X-100形成的胶束溶液中稳定分散[28]。长时间搅拌水中C60所形成的胶态C60悬浮液与利用有机溶剂法生成的胶态C60悬浮液的稳定性和聚集状态存在很大差异[28]。腐殖酸可以提高C60在水中的稳定性[29],胶态C60的分散和聚集性能与有机大分子的性质息息相关,由于电荷稳定以及原子排列空间位阻作用,富里酸、腐殖酸、蛋白质和丹宁酸具有减弱C60材料聚集和沉降的倾向;而由于架桥作用,多聚糖一般会促进C60沉降和聚集[28]。
2.1.2 CNTs的水环境行为
因为沿CNTs长轴方向范德华力很强,CNTs同样也具有很强的疏水性[30-31]。在特定环境条件下,CNTs会在水溶液中以悬浮状态稳定存在。如添加阳离子表面活性剂、阴离子表面活性剂以及非离子表面活性剂等都可以使CNTs在溶液中稳定悬浮[32]。其原因是表面活性剂可以增大其表面积使得CNTs在水溶液中更容易分散。另一方面,加入表面活性剂不仅使水溶液形成适宜的热动力学表面,而且由于CNTs间的静电斥力和空间位阻等相互作用,阻碍CNTs发生聚集[31]。水体环境中的溶解性有机质与CNTs结合后,也会提高溶液中CNTs的稳定性。Hyung等[30]研究发现,天然有机大分子与表面活性剂相比,可以更好地使MWCNTs单体稳定悬浮,当溶解性天然有机大分子与十二烷基硫酸钠溶液质量浓度比为1:100时所能悬浮的MWCNTs单体比例约为3:1。同时,Hyung等[30]还发现,腐殖酸可以提高MWCNTs在去离子水中的溶解平衡浓度。此外,还有研究发现多聚糖、蛋白质、丹宁酸和其他高聚物会通过非共价修饰作用,增大CNTs在水溶液中的溶解性[33-34]。
2.1.3 石墨烯的水环境行为
石墨烯在水中的溶解度极低,因范德华力作用,其在水溶液中易形成团聚体,甚至堆积形成石墨[35]。氧化石墨烯(GO)表面具有亲水性含氧官能团,因此其较容易在水溶液中均匀分散。同时,由于静电稳定机制,GO在水中容易形成稳定的胶体溶液。石墨烯表面的zeta电位受溶液pH影响,进而颗粒间的相互作用也会受到影响,因此而改变了石墨烯的悬浮状态。Lanphere等[36-37]研究表明, 5 碳纳米材料在多孔介质中的转运特征是碳纳米材料在地下含水层中迁移归趋以及环境生态风险的重要组成部分[38-39]。由于扩散、截留以及沉积作用,碳纳米材料会因为附着在多孔介质表面或者被包裹其中而被去除。改变物理化学条件(如pH值、离子强度、流速等)后,碳纳米材料可能重新悬浮并进入水体中。C60和CNTs均为疏水性碳纳米材料,可以通过人为修饰以及环境作用发生衍生化,增加其亲水性,相应地就会使附着效率降低,迁移性能增加。Lecoanet等[38]发现,水溶性的羟基富勒烯以及SWCNTs在多孔介质中迁移能力比胶态C60强,相比之下,前两者的穿透速率更快、穿透率更高。多孔介质中碳纳米材料的转运也会受水流流速的影响,虽然羟基富勒烯、SWCNTs和胶态C60的表面化学和材料大小存在很大差异,但在较高的水流流速下,三者的穿透曲线极其相似。Cheng等[40]研究了水溶性胶态C60在土柱中的迁移。研究发现,当流速设计为典型地下水流速0.38 m·d-1时,胶态C60的穿透率仅为60%,此时,其迁移性能较弱,易于沉降。另外,有研究证实多孔介质中胶态C60的运移以及沉降性能也会受电解质组成和浓度、有机大分子以及胶态C60不同制备方法等各方面的影响[28]。 Lanphere等[36]研究了溶液理化条件对GO在饱和石英砂柱中迁移的影响,发现GO在水环境中的迁移行为受pH影响并不明显,而离子强度才是影响GO在多孔介质中迁移的决定因素。当离子强度较高时,GO的团聚作用以及其与石英砂表面的相互作用增强,在饱和多孔介质中GO的迁移能力降低。Feriancikova等[41]对GO在饱和砂柱中研究也得到了相似的结果。Chowdhury等[42]在研究硅砂与GO的相互作用过程中,发现在不同盐溶液中保留在硅砂中的GO的释放程度不同,但无论是什么溶液,GO在硅砂中的沉积都会随离子强度的增加而增大。 目前关于石墨烯的制备纯化过程还不完善,其降解转化相关的研究基本还未开展,本文仅综述了对富勒烯、碳纳米管的转化与降解的研究。 2.3.1 碳纳米材料的转化 碳纳米材料在苛刻的条件下会发生氧化还原反应,生成带有不同官能团的衍生物,但自然环境中条件温和,难以发生以上转化。此处仅综述有可能发生在水环境中及水生生物体中的氧化还原反应。 同许多缺电子烯烃一样,C60易与自由基发生反应。Kokubo等[43]发现,在Fe2+存在条件下,可通过H2O2加热合成水溶性多羟基富勒醇,这种Fenton反应被认为是水体中真菌水解C60反应的一种化学模式。C60可在氧化剂作用下生成含氧官能团衍生物。P450酶系是自然界中很多生物的重要解毒酶系,Hamano等[44]则模拟P450酶促反应体系,对C60进行氧化得到1,2-环氧C60的产物,因而该反应被认为是C60在自然界中被生物转化的模式之一。C60氢化反应途径也很多,如硼、锆氢化反应,氢自由基诱导加氢、转移加氢、电化学还原、固相加氢、二亚胺作用下的化学还原以及溶解金属还原、Birch还原和光诱导电子转移等[45-53],但大部分反应条件都比较严苛,目前仅有少量关于C60在温和条件下进行氢化反应的报导,如C60与脂肪胺中的锂会发生氢化反应生成C60H36[54]。 CNTs在水环境中可以发生化学氧化反应。一般废水中的氧化剂(如臭氧等)都可以通过产生活性氧来改变CNTs的表面性状。Datsyuk等[55]发现, MWCNTs经硝酸处理后,CNTs变短并在末端和管壁形成缺陷,并在缺陷处引入大量羟基、羰基、羧基和脂基等含氧官能团。这种高度转变后能为水环境中微生物及酶促转化提供可进攻位点。Allen等[56]研究发现SWCNTs在H2O2和血晶素或FeCl3存在条件下也会发生显著降解。Osmond-McLeod等[57]也发现了MWCNTs在模拟生理溶液中培养3周后其外形发生了显著变化,CNTs的长度明显变短,并通过计算分析表明培养过程中损失了30%碳管总质量。Russier等[58]模拟细胞吞噬碳纳米材料进入体内后在吞噬体溶液中的降解转化,结果表明强酸氧化产生具有结构缺陷的SWCNTs,其碳管粒径变小,碳骨骼结构消失,易发生高度降解。 2.3.2 碳纳米材料的生物降解 碳纳米材料的生物降解是进入碳循环的重要途径,水体中生物种类繁多,在环境净化过程中发挥着重要作用。虽然有关方面的研究还很少,但碳纳米材料与环境中腐殖酸类、多环芳烃类、木质素类物质部分结构相似,而这些已被证实能在水环境中发生生物降解[59],因此碳纳米材料很有可能被生物降解。 C60化学结构稳定,很难发生生物降解。而C60的衍生物则可以发生生物降解,如Schreiner等[60]发现白腐真菌对富勒醇C60(OH)19-27具有生物降解作用,在培养32周后,培养液中褐色的C60(OH)19-27颜色变浅,产物分析结果显示:富勒醇笼状结构被破坏,产生二氧化碳、乙酸等降解产物,同时部分碳被用于合成微生物自身物质。 目前,对于CNTs的生物降解性的研究所使用的碳管限于SWCNTs、羧基化单壁碳管(c-SWCNTs)和MWCNTs。同时也仅发现植物酶中的辣根过氧化物酶(HRP)[55]和动物酶中的人类中性白细胞髓过氧化物酶(MPO)[61]对CNTs具有降解作用。相关研究表明:HRP对SWCNTs的降解能力取决于CNTs与酶活性部位的接近程度,如Allen等[62]发现,在H2O2存在条件下,HRP对SWCNTs无降解能力,但在相同条件下HRP对c-SWCNTs却具有降解能力,是因为强烈的疏水性阻碍了SWCNTs与HRP的活性部位结合从而不能被有效降解。Zhao等[63]发现,HRP对MWCNTs的降解与SWCNTs基本相似,其对MWCNTs没有降解效果,而对O-MWCNTs及氮掺杂的碳管(N-MWCNTs)表现出良好的降解性能。同样是因为氧化或者氮掺杂过程使CNTs管壁和末端出现缺陷位点,使HRP的亲水性位点易于与之结合,因此引起了酶促降解反应的发生。Russier等[58]发现,O-MWCNTs在HRP或吞噬溶酶体模拟液的作用下会发生降解,且HRP对其的降解性能优于吞噬溶酶体模拟液。Vlasova等[61]发现中性白细胞髓过氧化物酶(MPO)能在体外降解c-SWCNT。有研究比较HRP、MPO、LPO(乳过氧化物酶) 和血红素对c-SWCNT降解能力时发现,酶促反应中产生的次卤酸盐在CNTs的降解过程中起着重要作用[64]。Kagan等[65]对MPO降解c-SWCNTs进行了进一步研究。他们发现除了次卤酸盐的强氧化作用,在酶促反应中,MPO产生的活性自由基对CNTs的降解也起着重要作用。2012年Shvedova等[66]研究也证明了MPO在CNTs降解方面起着很重要的作用,而且MPO不但在体外试验中能有效降解CNTs,在体内复杂环境中也能对CNTs起到很好的清除作用。 有研究比较C60的毒性时,发现nC60只经搅拌处理后,在淡水和海水中的最高浓度为35和22.5 mg·kg-1,难以制备到足够高的浓度而得到LC50,21 d暴露实验表明2.5和5 mg·kg-1nC60能够使大型蚤子代数量减少且蜕皮时间延迟,nC60的暴露不影响细胞色素P450酶的mRNA转录和蛋白表达,却可以降低黑头软口鲦体脂质转运蛋白PMP70的表达水平[67]。 碳纳米材料与其他纳米材料相比,毒性较小。不同水生生物对碳纳米材料产生的毒性所反映的效应也不同,因此在研究碳纳米材料对水生生物的毒性效应时,既要考虑碳纳米材料自身的结构特点和与之相对应的物理化学性质,也要考虑受试物种自身的各项生理特征。目前大部分的研究主要是通过对模式生物,如单细胞藻类、蚤类、鱼类等的实验室暴露来检测和论证碳纳米材料对水生生物的毒性效应。 3.1.1 C60的毒性效应 有研究表明,C60的浓度为90 mg·L-1时,对月牙藻生长抑制率大约为30%,C60对斜生栅藻的最低效应浓度(LOEC, lowest observable effect concentration)为5.0 mg·L-1。在nC60对大型蚤的暴露实验中,发现nC60对大型蚤的生理行为有很大影响,可加快大型蚤的跳跃速率,加快其心跳及附器运动[68],出现了脱壳延迟、子代数量减少等现象[69]。也有研究发现,THF-nC60的溶液浓度只要达到5 mg·L-1就能使实验的大型蚤达到最大死亡率,而水溶的nC60溶液浓度则要到100 mg·L-1才有明显死亡率[70]。Tao等[71]利用BLISS分析法确定C60引起新生水蚤的LD50和最低观测毒性效应浓度(LOEC)分别为0.44 mg·L-1和0.2 mg·L-1。同时,C60累计实验和脂质实验中,发现在亚致死剂量浓度下,C60可以累积和转移且具有生物活性。Yang等[23]发现C60(低剂量、21 d)引起大型蚤消化道细胞功能紊乱和细胞溶解或凋亡等慢性损伤。C60浓度高低和粒径大小会影响其毒性效应,如Tao等[70]实验结果表明,母代和子代蚤各经48 h暴露,其死亡率均随着C60浓度升高而增加。Oberdorster[72]发现在生物暴露48 h后,C60可以诱发大口黑鲈幼鱼鱼脑内部产生脂质过氧化反应。Usenko等[73]对比发现,纳米材料C60、C70对斑马鱼胚胎具有相近毒理性质,当纳米材料C60、C70的浓度达到200 μg·L-1时,会使部分斑马鱼胚胎发育畸形,且存活率明显下降;朱小山等[74]的研究表明,长期低剂量C60(0.0~1.0 mg·L-1)暴露30 d能导致鲫鱼的脑、肝、鳃等器官组织中还原型谷胱甘肽含量显著降低,并能显著激活肝组织中过氧化氢酶和超氧化物歧化酶的活性,以及鳃中Na+/K+-ATP酶的活性。纳米C60颗粒悬浮液的制备方法不同,其对生物的生态毒性也不一样,其中经过甲苯作为表面活性剂处理的纳米C60颗粒悬浮液对斑马鱼胚胎的毒性最强。 3.1.2 CNTs的毒性效应 对于CNTs对水生生物的影响,朱小山等[75]研究表明,SWCNTs、MWCNTs对斜生栅藻的毒性效应并不存在显著性差异。Wei等[76]研究发现羧基化的MWCNTs能够抑制杜氏藻的生长,并且会影响其PSII光化学反应过程以及细胞内谷胱甘肽氧化还原状态。另外,有研究发现对暴露于功能化MWCNTs溶液中的杜氏藻的研究表明MWCNTs与藻细胞或细胞代谢产物之间存在相互作用,促进了CNTs的聚集,从而产生了毒性作用[77]。Roberts等[78]研究发现溶血性磷脂酰包覆的水溶性单壁碳纳米管(LPC-SWCNTs)可被大型蚤通过摄食行为摄入体内,低浓度的LPC-SWCNTs不会引起大型蚤死亡,而10和20 mg·L-1的LPC-SWCNTs可分别导致20%和100%的大型蚤死亡率。研究SWCNTs和MWCNTs的发育毒性实验通常利用斑马鱼的胚胎来完成,相关实验显示:当SWCNTs的暴露浓度达到或超过240 mg·kg-1时会使孵化延迟[79],刘信勇等[80-81]发现,MWCNTs进入斑马鱼体内后,会对斑马鱼脑组织产生一定的影响,导致其乙酰胆碱酯酶活性降低。而且斑马鱼在MWCNTs中暴露具有时间效应和剂量效应,当暴露的时间越长,暴露浓度越大,受到的影响越明显。尤宏等[82]的研究显示CNTs对胚胎孵化率没有显著抑制,但是能够延长斑马鱼胚胎孵化时间,而且与暴露浓度存在浓度剂量效应关系,唐志杨等[83]发现当SWCNTs浓度低于10 mg·L-1时,其对斑马鱼各组织中GSH含量及SOD活性无明显影响,但能导致斑马鱼的肝、鳃、脑组织中Na+-K+-ATP酶活性显著增加,MDA含量明显下降。 3.1.3 石墨烯的毒性效应 对于石墨烯,GO对藻类细胞进行暴露后能够抑制藻细胞的生长,并能导致活性氧的生成,及干扰抗氧化酶的产生和藻细胞的代谢等[84]。Guo等[85]将水生生物大型蚤经水体暴露于石墨烯,发现石墨烯主要在大型蚤肠道内累积,并能转移到子代,但没有发现毒性效应。Chen等[86]研究发现,GO通过羟基相互作用附着在斑马鱼胚胎绒毛膜上,使胚胎细胞缺氧并阻碍细胞膜的通透性,从而导致孵化延迟。进一步研究发现,通过内吞作用进入胚胎细胞的石墨稀,会导致线粒体受损;GO还会通过心脏、眼睛等器官进入斑马鱼的循环系统,使活性氧含量增加,氧化应激性增强,进一步造成DNA损伤和细胞调亡。 3.1.4 与其他物质共存时的毒性效应 纳米材料在制备过程中,或者因为高比表面积容易携带有毒物质,不仅影响污染物的环境存在状态和迁移转化,也会作为污染物的载体,增大污染物的生物利用性和毒性效应等,从而导致生物体中毒,引起严重的生态后果,具有潜在的生态风险[87]。Wang等[88]发现不经过酸化处理的MWCNT由于其表面缺少功能集团对重金属基本不吸收,但是增大了对疏水性有机污染物(PAH)的吸附量[89]。nC60对甲基对硫磷、阿特拉津、五氯苯酚和菲(Phe)的吸附试验结果显示,nC60聚集体和玻璃瓶壁上同时具有这4种物质,其中Phe主要集中在nC60聚集体上,而其他的3种物质多分布在溶液中,这可能与菲较大的疏水性有关致使nC60对Phe的吸附容量最大[90]。刘信勇等[80]发现,不足以引起斑马鱼毒性浓度的MWCNTs会明显增强Pb、Zn的致死效应,这可能与MWCNTs具备较强的吸附能力有关。Kim等[91]发现lysophosphatidylcholine(LPC)修饰的MWCNTs增强了大型蚤对Cu2+的吸收以及毒性。Baun等[90]在nC60存在条件下,Phe对月牙藻(Pseudokirchneriellasubcapitata)的EC50由720 μg·L-1降低至430 μg·L-1,这可能由于nC60-Phe聚集体吸附在细胞膜表面,进而对生物体产生毒性。 有研究发现,黑头软口鲦在1 mg·L-1的THF/nC60溶液中100%死亡,而同浓度的aqu/nC60却没有影响,上述细胞毒性主要来自THF的光解副产物γ-丁丙酯和蚁酸[91-93]。CNTs的毒性可能主要来自自身所含的杂质,包括金属催化剂、不定形碳等,如Shvedova实验室的研究[94]显示,未纯化的金属残留量高的CNTs引起的氧化应激水平明显高于纯化的金属残留少的CNTs[95],其他研究也发现相似的结果[95-96],如果CNTs表面吸附了多环芳烃等有毒物质,这些有毒物质都可能导致生物中毒[97-98]。 当前对纳米材料的毒性研究仍然存在争议,如对CNTs毒性的一些研究结果表明其没有明显的毒性[99],而有一些研究却出现相反的情况[100]。对石墨烯的研究也出现类似的矛盾报道[101-102]。Kagan等[102]研究表明:SWCNTs的微晶结构可以通过酶促反应得到降解,次氯酸盐和人类嗜中性粒细胞髓过氧化物酶的几个活性自由基中间体,在嗜中性粒细胞和巨噬细胞中均可降解SWCNTs。被降解的碳纳米管是惰性的,并且进入小鼠肺细胞后并没有引起任何炎症反应。因此,当这种SWCNTs将药物输送到目的组织或细胞后,会很快地发生生物降解,降低了生物体的实际暴露剂量和时间。利用萘终止PEG修饰的GO对斑马鱼鱼卵进行毒理实验,结果表明:斑马鱼可以在GO对它们的发育尚未产生明显负面影响之前将其排出体外,可见GO经过修饰后可以降低其生物体内的暴露停留时间[104]。这是因为纳米材料的毒性由很多因素共同影响,如纳米材料的纯度、尺寸、表面电荷、表面修饰、亲疏水性、暴露时间、暴露剂量和反应介质等[105]。 目前普遍认为的碳纳米材料毒性机制主要包括氧化胁迫、引起炎症反应、干扰生物信号的传递、破坏细胞完整性、基因毒性等[106-107]。 3.2.1 氧化应激毒性机理 该机制是目前被广泛认可的纳米材料产生毒性效应的主要机理之一[108]。生物体内有氧化系统和抗氧化系统的存在,保持了生物体内活性氧自由基(ROS)产生和消除的平衡。生物体通过体内的抗氧化酶,如谷胱甘肽过氧化物酶、超氧化物歧化酶来消除多余的ROS,而ROS的产生一旦超出生物的清除能力,则会导致氧化应激的发生。由于碳纳米材料具有较强的表面活性,因此它们可以解除生物体内电子供体或者再吸收能量时产生ROS。ROS主要包括H2O2及HO2、·OH,其大量累积且不能被及时去除就会对生物体产生氧化应激,造成生物毒性效应。在正常的条件下,线粒体内的ROS含量较低,且很容易被一些抗氧化剂中和。碳纳米材料可诱导产生大量ROS,破坏线粒体的抗氧化防御体系,ROS平衡也被打破,大量的氧化型谷胱甘肽积累导致细胞内的氧化应激增大,进而丧失细胞功能,直到细胞死亡,使正常的生理机能受到影响。其他的毒性机制,如蛋白质变性、DNA损伤等也可能由ROS造成的氧化损伤引起。 3.2.2 纳米材料引起炎症反应 炎症反应是免疫系统识别并清除入侵外来物质的过程,包括免疫细胞的活化和向病变部位的聚集。纳米材料经内吞作用进入免疫细胞,可以通过刺激免疫细胞产生趋化因子(IL-8,MCP-1) 和促炎症因子(IL-1,TNF-α,IFN-γ),诱导并加速炎症反应。纳米颗粒对炎症反应的影响还涉及到对Th1/Th2 免疫反应类型的调节。Th细胞引发的炎症信号可以进一步活化B、T淋巴细胞和巨噬细胞产生炎性反应。一些研究[109]认为,通常较小的颗粒(<500 nm)引起Th2 型免疫反应,而较大的颗粒(>1 μm)引起 Th1 型免疫反应[110]。 3.2.3 干扰生物信号的传递 碳纳米颗粒也可与生物体的蛋白质相互作用,干扰基因信息以及生物信号的传递[111-112]。研究发现,当α-胰凝乳蛋白酶吸附在SWCNTs上后,α-胰凝乳蛋白酶二级结构中的肽链会展开吸附在CNTs表面,致使α-胰凝乳蛋白酶的失活[113]。另有研究发现,牛血清白蛋白(BSA) 和蛋白溶解酵素(LYS)吸附结合在CNTs表面后,蛋白质的疏水基团会暴露于溶液中,从而使蛋白质发生变性。 3.2.4 破坏细胞完整性 碳纳米材料可以通过细胞的内吞作用、膜渗透作用、或通过载体蛋白和离子通道等运输到细胞内部[114],然后产生毒性[115-116]。例如,有研究认为,CNTs对细菌的毒性是通过直接损伤细胞膜并导致其代谢能力下降和核酸外泄引起的[117]。大型蚤在低剂量的C60水溶液中暴露21 d后,消化道细胞结构明显被破坏[118]。另外有研究指出,由于石墨烯的物理特性,即石墨烯片层边缘锋利,在与藻细胞接触的过程中,会像刀锋一样切割藻细胞细胞壁,使其细胞壁破裂[119]。这与Hu等[120]发现的石墨烯会对细菌细胞膜造成机械损伤的结论相符。在GO处理下,有研究观察到小球藻藻细胞质壁分离的现象[84]。 3.2.5 基因毒性 一些纳米材料能使DNA双链断裂,破坏DNA的完整性,从而产生毒理效应[121]。分子动态模拟研究表明,液体中C60极易与DNA中的核苷稳定结合并使DNA变形而可能丧失功能[122]。 3.2.6 混合毒性 细胞的氧化应激反应可使细胞内的氧化还原平衡遭到破坏,其结果是使一些组蛋白发生乙酰化作用,导致这些组蛋白与DNA的结合松开,提供转录混合物到达致炎基因启动子区的途径。氧化应激引起转录调控因子NF-kB 转移到细胞核中,并到达关键致炎基因的启动子区,调控基因的转录。受NF-kB 调控的致炎基因包括TNFɑ,IL-8,IL-2,IL-6,GM-CSF,ICAM-1和E-选择iNOS等,因此 NF-kB 的活化可被认为存在高致炎作用。而且,氧化应激或者直接的与颗粒的相互作用都能刺激细胞溶质 Ca2+浓度的上升,这也会引起NF-kB 的活化。钙离子信号也可能控制能导致正反馈机制的活性氧的产生。上述过程的联合作用,将使基因的转录达到顶点,导致发炎和抗氧化剂生产的上升。 现有的研究结果显示不同的纳米颗粒在生态毒理和毒性上不尽相同,即使同一类纳米材料,由于使用对象不同,其致毒机制也可能大有不同,同时致毒机理可能并不是只由某一种机理控制,有可能其通过多种机制最后产生综合毒性效应。碳纳米材料的毒性究竟具体源自哪些方面仍有待于进一步研究。 综上所述,科学探索已对碳纳米材料对水环境的潜在生物毒性做了一些工作,对其致毒机制也有了一些认识,这些工作对碳纳米材料生产和使用等的评价和管理具有较大的参考价值。尽管人们已经开始研究碳纳米材料的自身毒性以及其对环境的潜在危害,但相关研究工作仍处于探索阶段,人们对它自身的毒性强度及持续时间等仍不清楚,同时碳纳米材料可能产生很多潜在的环境和健康风险,这些方面也仍然没有得到全面的了解,对于碳纳米材料是否真的有毒以及其致毒机制也没有完全达成共识。目前尚存在以下几个主要问题,需进一步深入研究,以准确阐述碳纳米材料可能导致的环境和健康风险。 (1)对碳纳米材料的毒性研究需建立系统而完善的标准; (2)碳纳米材料在不同水质和水文条件下的物理化学状态及其毒性; (3)应关注碳纳米材料对生物长期低剂量暴露所导致的生物毒性效应; (4)碳纳米材料与其他环境因素或异质的联合毒性效应; (5)要准确阐述纳米材料可能的环境和健康风险,还需要考虑在环境条件下真实的状态对生物毒性的效应。 在未来的生产生活中,碳纳米材料的使用及排放都将大量增加。在其被广泛使用前,我们必须通过严格的科学研究搞清它们对环境以及人类健康可能造成的负面影响特别是它们所产生的毒性效应。碳纳米材料的结构多样性及环境因素的复杂性是研究碳纳米材料毒理学效应的一个重大挑战。 [1] 杨林, 许恒毅, 杨孟, 等. 人工纳米材料对水生生物毒性的研究进展[J]. 中国水产科学,2013, 7(4): 902-909 Yang L, Xu H Y, Yang M, et al. Research progress on toxicity of manufactured nanomaterials to aquatic organisms [J]. Journal of Fishery Sciences of China, 2013, 7(4): 902-909 (in Chinese) [2] 陶核, 兰志仙, 吴南翔. 纳米材料对水生生物毒性效应及其机制的研究进展[J]. 环境与职业医学, 2014, 31(8):634-638 Tao H, Lan Z X, Wu N X. Advances on toxicity and toxic mechanisms of nanomaterials to aquatic organisms [J]. Journal of Environmental and Occupational Medicine, 2014, 31(8): 634-638 (in Chinese) [3] 常雪灵, 祖艳, 赵宇亮. 纳米毒理学与安全性中的纳米尺寸与纳米结构效应[J]. 科学通报, 2011, 56(2): 108-118 Chang X L, Zu Y, Zhao Y L. Size and structure effects in the nanotoxic response of nanomaterials [J]. Chinese Science Bulletin, 2011, 56(2): 108-118 (in Chinese) [4] Cong Y, Pang C, Dai L, et al. Importance of characterizing nanoparticles before conducting toxicity tests [J]. Integrated Environmental Assessment and Management, 2011,7(3): 502-503 [5] Borm P J A, Robbins D, Haubold S, et al. The potential risks of nanomaterials: A review carried out for ECETOC [J]. Particle and Fibre Toxicology, 2006, 3: 11-45 [6] Schmid K, Riediker M. Use of nanoparticles in Swiss industry: A targeted survey [J]. Environmental Science and Technology, 2008, 42(7): 2253-2260 [7] Köhler A R, Som C, Helland A, et al. Studying the potential release of carbon nanotubes throughout the application life cycle [J]. Journal of Cleaner Production, 2008, 16(8): 927-937 [8] Nowack B, Bucheli T D. Occurrence, behavior and effects of nanoparticles in the environment [J]. EnvironmentalPollution, 2007, 150(1): 5-22 [9] 王海涛, 孟沛. 纳米材料的生态环境暴露与生态环境效应研究及其控制体制[J]. 化工新型材料, 2014, 42(11): 227-231 Wang H T, Meng P. Research on ecological environmental exposure and effect of nanomaterials and their control system [J]. New Chemical Materials, 2014, 42(11): 227-231 (in Chinese) [10] Wu Y, Hudson J A S, Lu Q, et al. Coating single-walled carbon nanotubes with phospholipids [J]. The Journal of Physical Chemistry B, 2006, 110(6): 2475-2478 [11] Lam C W, James J T, McCluskey R, et al. Pulmonary toxicity of single-wall carbon nanotubes in mice 7 and 90 days after intratracheal instillation [J]. ToxicologicalSciences, 2004, 77(1): 126-134 [12] Maynard A D, Baron P A, Foley M, et al. Exposure to carbon nanotube material: Aerosol release during the handling of unrefined single-walled carbon nanotube material [J]. Journal of Toxicology and Environmental Health, Part A, 2004, 67(1): 87-107 [13] 闾晓萍, 黄绚, 杨坤. 碳纳米材料的生物毒性效应研究及展望[J]. 环境污染与防治, 2011, 33(5): 87-94 Lv X P, Huang X, Yang K. Advance and perspectives of the bio-toxicity of carbon nanomaterial [J]. Environmental Pollution and Control, 2011, 33(5): 87-94 (in Chinese) [14] Mueller N C, Nowack B. Exposure modeling of engineered nanoparticles in the environment [J]. Environmental Science and Technology, 2008, 42(12): 4447-4453 [15] 程嘉兴, 谢凤, 李斌. 碳纳米润滑添加剂的应用研究[J]. 当代化工, 2016, 45(4): 843-846 Cheng J X, Xie F, Li B. Application of nano-carbon lubricating oil additives [J]. Contemporary Chemical Industry, 2016, 45(4): 843-846 (in Chinese) [16] 黄飞, 张哲, 魏先文, 等. 富勒烯C60衍生物纳米材料制备及其应用研究进展[J]. 化工新型材料, 2016, 44(4): 1-3 Huang F, Zhang Z W, Wei X W, et al. Research progress of preparation method and application of [60] fullerene derivative nanomaterials [J]. New Chemical Materials, 2016, 44(4): 1-3 (in Chinese) [17] Lambin P. Electronic structure of carbon nanotubes [J]. Comptes Rendus Physique, 2003, 4(9): 1009-1019 [18] 王香爱. 碳纳米管复合材料的研究进展[J]. 化工科技, 2016, 24(2): 78-82 Wang X A. Research progress of carbon nanotube composites [J]. Science & Technology in Chemical Industry, 2016, 24(2): 78-82 (in Chinese) [19] 胡茂杰, 潘丙才, 毛亮. 石墨烯及其衍生物在小鼠体内的分布与毒性效应[J]. 南京大学学报: 自然科学, 2014, 50(4): 431-439 Hu M J, Pan B C, Mao L. Biodistribution and toxicity of graphene and functionalized graphene in rats [J]. Journal of Nanjing University: Natural Sciences, 2014, 50(4): 431-439 (in Chinese) [20] 陈留群, 孙光辉, 李春林, 等. 从碳纳米管到石墨烯——浅谈碳纳米材料的研究进展[J]. 材料导报, 2011, 25(S2): 115-117 Chen L Q, Sun G H, Li C L, et al. From carbon nanotubes to graphene: Progress of carbon nanomaterials [J]. Materials Review, 2011, 25(S2): 115-117 (in Chinese) [21] 刘振宇, 刘彬, 王丹, 等. 纳米材料在水生环境中的行为和转化[J]. 海河水利, 2015(2): 67-70 Liu Z Y, Liu B, Wang D, et al. Behavior and conversion of nanomaterials in the aquatic environment [J]. Haihe Water Resources, 2015(2): 67-70 (in Chinese) [22] 王壮. 四种人工纳米颗粒物在水相中的转化行为及生态毒理效应[D]. 大连: 大连理工大学, 2013: 28-30 Wang Z. Aquatic transformations and ecotoxicological effects of four types of manufactured nanoparticles [D]. Dalian: Dalian University of Technology, 2013: 28-30 (in Chinese) [23] Alargova R G, Deguchi S, Tsujii K. Stable colloidal dispersions of fullerenes in polar organic solvents [J]. Journal of the American Chemical Society, 2001, 123(43): 10460-10467 [24] Deguchi S, Alargova R G, Tsujii K. Stable dispersions of fullerenes, C60and C70, in water. Preparation and characterization [J]. Langmuir, 2001, 17(19): 6013-6017 [25] Andrievsky G V, Klochkov V K, Karyakina E L, et al. Studies of aqueous colloidal solutions of fullerene C60by electron microscopy [J]. Chemical Physics Letters, 1999, 300(3): 392-396 [26] Ruoff R S, Tse D S, Malhotra R, et al. Solubility of fullerene (C60) in a variety of solvents [J]. The Journal of Physical Chemistry, 1993, 97(13): 3379-3383 [27] Li H, Jia X, Li Y, et al. A salt-free zero-charged aqueous onion-phase enhances the solubility of fullerene C60in water [J]. The Journal of Physical Chemistry B, 2006, 110(1): 68-74 [28] Espinasse B, Hotze E M, Wiesner M R. Transport and retention of colloidal aggregates of C60in porous media: Effects of organic macromolecules, ionic composition, and preparation method [J]. Environmental Science and Technology, 2007, 41(21): 7396-7402 [29] 方华, 沈冰冰, 荆洁, 等. 水中C60纳米颗粒的稳定性研究[J]. 环境科学, 2014, 35(4): 1337-1342 Fang H, Shen B B, Jing J, et al. Stability of C60nanoparticles in aquatic systems [J]. Environmental Science, 2014, 35(4): 1337-1342 (in Chinese) [30] Hyung H, Fortner J D, Hughes J B, et al. Natural organic matter stabilizes carbon nanotubes in the aqueous phase [J]. Environmental Scienceand Technology, 2007, 41(1): 179-184 [31] Girifalco L A, Hodak M, Lee R S. Carbon nanotubes, buckyballs, ropes, and a universal graphitic potential [J]. Physical Review B, 2000, 62(19): 13104-13110 [32] Moore V C, Strano M S, Haroz E H, et al. Individually suspended single-walled carbon nanotubes in various surfactants [J]. Nano letters, 2003, 3(10): 1379-1382 [33] Lin D, Xing B. Tannic acid adsorption and its role for stabilizing carbon nanotube suspensions [J]. EnvironmentalScience and Technology, 2008, 42(16): 5917-5923 [34] Karajanagi S S, Yang H, Asuri P, et al. Protein-assisted solubilization of single-walled carbon nanotubes [J]. Langmuir, 2006, 22(4): 1392-1395 [35] Li D, Mueller M B, Gilje S, et al. Processable aqueous dispersions of graphene nanosheets [J]. Nature Nanotechnology, 2008, 3(2): 101-105 [36] Lanphere J D, Luth C J, Walker S L. Effects of solution chemistry on the transport of graphene oxide in saturated porous media [J]. Environmental Science and Technology, 2013, 47(9): 4255-4261 [37] Chowdhury I, Duch M C, Mansukhani N D, et al. Colloidal properties and stability of graphene oxide nanomaterials in the aquatic environment [J]. Environmental Science and Technology, 2013, 47(12): 6288-6296 [38] Lecoanet H F, Bottero J Y, Wiesner M R. Laboratory assessment of the mobility of nanomaterials in porous media [J]. Environmental Science and Technology, 2004, 38(19): 5164-5169 [39] Lecoanet H F, Wiesner M R. Velocity effects on fullerene and oxide nanoparticle deposition in porous media [J]. Environmental Science and Technology, 2004, 38(16): 4377-4382 [40] Cheng X, Kan A T, Tomson M B. Study of C60transport in porous media and the effect of sorbed C60on naphthalene transport [J]. Journal of Materials Research, 2005, 20(12): 3244-3254 [41] Feriancikova L, Xu S. Deposition and remobilization of graphene oxide within saturated sand packs [J]. Journal of Hazardous Materials, 2012, 235: 194-200 [42] Chowdhury I, Duch M C, Mansukhani N D, et al. Deposition and release of graphene oxide nanomaterials using a quartz crystal microbalance [J]. Environmental Science and Technology, 2014, 48(2): 961-969 [43] Hamano T, Mashino T, Hirobe M. Oxidation of [60] fullerene by cytochrome P450chemical models [J]. Journal of the Chemical Society, Chemical Communications, 1995 (15): 1537-1538 [44] Kokubo K, Matsubayashi K, Tategaki H, et al. Facile synthesis of highly water-soluble fullerenes more than half-covered by hydroxyl groups [J]. ACS Nano, 2008, 2(2): 327-333 [45] Henderson C C, Cahill P A. C60H2: Synthesis of the simplest C60hydrocarbon derivative [J]. Science, 1993, 259(5103): 1885-1887 [46] Ballenweg S, Gleiter R, Krätschmer W. Hydrogenation of buckminsterfullerene C60via hydrozirconation: A new way to organofullerenes [J]. Tetrahedron letters, 1993, 34(23): 3737-3740 [47] Jin C, Hettich R, Compton R, et al. Direct solid-phase hydrogenation of fullerenes [J]. The Journal of Physical Chemistry, 1994, 98(16): 4215-4217 [48] Rüchardt C, Gerst M, Ebenhoch J, et al. Transfer hydrogenation and deuteration of buckminsterfullerene C60by 9, 10-dihydroanthracene and 9, 9′, 10, 10′[D4] dihydroanthracene [J]. Angewandte Chemie International Edition in English, 1993, 32(4): 584-586 [50] Darwish A D, Abdul-Sada A K, Langley G J, et al. Polyhydrogenation of [60]- and [70]-fullerenes [J]. Journal of the Chemical Society, Perkin Transactions 2, 1995(12): 2359-2365 [51] David R M. Formation of hydrides of fullerene-C60and fullerene-C70[J]. Journal of the Chemical Society, Perkin Transactions 2, 1994(1): 15-22 [52] Attalla M I, Vassallo A M, Tattam B N, et al. Preparation of hydrofullerenes by hydrogen radical induced hydrogenation [J]. The Journal of Physical Chemistry, 1993, 97(24): 6329-6331 [53] Fukuzumi S, Suenobu T, Kawamura S, et al. Selective two-electron reduction of C60by 10-methyl-9,10-dihydroacridine via photoinduced electron transfer [J]. Chemical Communications, 1997(3): 291-292 [54] Zhang J P, Wang N X, Yang Y X, et al. Hydrogenation of [60] fullerene with lithium in aliphatic amines [J]. Carbon, 2004, 42(3): 675-676 [55] Allen B L, Kichambare P D, Gou P, et al. Biodegradation of single-walled carbon nanotubes through enzymatic catalysis [J]. Nano Letters, 2008, 8(11): 3899-3903 [56] Datsyuk V, Kalyva M, Papagelis K, et al. Chemical oxidation of multiwalled carbon nanotubes [J]. Carbon, 2008, 46(6): 833-840 [57] Osmond-McLeod M J, Poland C A, Murphy F, et al. Durability and inflammogenic impact of carbon nanotubes compared with asbestos fibres [J]. Particle and Fibre Toxicology, 2011, 8: 15-32 [58] Russier J, Ménard-Moyon C, Venturelli E, et al. Oxidative biodegradation of single-and multi-walled carbon nanotubes [J]. Nanoscale, 2011, 3(3): 893-896 [60] Schreiner K M, Filley T R, Blanchette R A, et al. White-rot basidiomycete-mediated decomposition of C60fullerol [J]. Environmental Science and Technology, 2009, 43(9): 3162-3168 [61] Vlasova I I, Vakhrusheva T V, Sokolov A V, et al. Peroxidase-induced degradation of single-walled carbon nanotubes: Hypochlorite is a major oxidant capable ofinvivodegradation of carbon nanotubes [J]. Journal of Physics: Conference Series, 2011, 291(1): 1-5 [62] Allen B L, Kotchey G P, Chen Y, et al. Mechanistic investigations of horseradish peroxidase-catalyzed degradation of single-walled carbon nanotubes [J]. Journal of the American Chemical Society, 2009, 131(47): 17194-17205 [63] Zhao Y, Allen B L, Star A. Enzymatic degradation of multiwalled carbon nanotubes [J]. The Journal of Physical Chemistry A, 2011, 115(34): 9536-9544 [64] Wu C H. Studies of the equilibrium and thermodynamics of the adsorption of Cu2+onto as-produced and modified carbon nanotubes [J]. Journal of Colloid and Interface Science, 2007, 311(2): 338-346 [65] Kagan V E, Konduru N V, Feng W, et al. Carbon nanotubes degraded by neutrophil myeloperoxidase induce less pulmonary inflammation [J]. Nature Nanotechnology, 2010, 5(5): 354-359 [66] Shvedova A A, Kapralov A A, Feng W H, et al. Impaired clearance and enhanced pulmonary inflammatory/fibrotic response to carbon nanotubes in myeloperoxidase-deficient mice [J]. PLoS one, 2012, 7(3): e30923(1-9) [67] 白伟, 张程程, 姜文君, 等. 纳米材料的环境行为及其毒理学研究进展[J]. 生态毒理学报, 2009, 4(2): 174-182 Bai W, Zhang C C, Jiang W J, et al. Progress in studies on environmental behaviors and toxicological effects of nanomaterials [J]. Asian Journal of Ecotoxicology, 2009, 4(2): 174-182 (in Chinese) [68] Lovern S B, Strickler J R, Klaper R. Behavioral and physiological changes inDaphniamagnawhen exposed to nanoparticle suspensions (titanium dioxide, nano-C60, and C60HxC70Hx) [J]. Environmental Science and Technology, 2007, 41(12): 4465-4470 [69] Oberdörster E, Zhu S, Blickley T M, et al. Ecotoxicology of carbon-based engineered nanoparticles: Effects of fullerene (C60) on aquatic organisms [J]. Carbon, 2006, 44(6): 1112-1120 [70] Klaper R, Crago J, Barr J, et al. Toxicity biomarker expression in daphnids exposed to manufactured nanoparticles: Changes in toxicity with functionalization [J]. Environmental Pollution, 2009, 157(4): 1152-1156 [71] Tao X, Fortner J D, Zhang B, et al. Effects of aqueous stable fullerene nanocrystals (nC60) onDaphniamagna: Evaluation of sub-lethal reproductive responses and accumulation [J]. Chemosphere, 2009, 77(11): 1482-1487 [72] Oberdörster E. Manufactured nanomaterials (fullerenes, C60) induce oxidative stress in the brain of juvenile largemouth bass [J]. Environmental Health Perspectives, 2004, 112(10): 1058-1062 [73] Usenko C Y, Harper S L, Tanguay R L.Invivoevaluation of carbon fullerene toxicity using embryonic zebrafish [J]. Carbon, 2007, 45(9): 1891-1898 [74] 朱小山, 朱琳, 郎宇鹏, 等. 人工纳米材料富勒烯(C60)低剂量长期暴露对鲫鱼的氧化伤害[J]. 环境科学, 2008, 29(4): 855-861 Zhu X S, Zhu L, Lang Y P, et al. Oxidative damages of long-term exposure to low level fullerenes (C60) inCarassiusauratus[J]. Environmental Science, 2008, 29(4): 855-861 (in Chinese) [75] 朱小山. 几种人工纳米材料的生态毒理学研究[D]. 天津: 南开大学, 2007: 28-53 Zhu X S. Aquatic ecotoxicities of several manufactured nanomaterials [D]. Tianjin: Nankai University, 2007: 28-53 (in Chinese) [76] Wei L, Thakkar M, Chen Y, et al. Cytotoxicity effects of water dispersible oxidized multiwalled carbon nanotubes on marine alga,Dunaliellatertiolecta[J]. Aquatic toxicology, 2010, 100(2): 194-201 [77] 禹露, 唐志强, 梁跃, 等. 碳纳米管材料的释放途径, 生态毒性及环境归趋[J]. 化工新型材料, 2014, 42(8): 1-3 Yu L, Tang Z Q, Liang Y, et al. Release pathways, ecotoxicity and environmental fate of carbon nanotubes [J]. New Chemical Materials, 2014, 42(8): 1-3 (in Chinese) [78] Roberts A P, Mount A S, Seda B, et al.Invivobiomodification of lipid -coated carbon nanotubes byDaphniamagna[J]. Environmental Science and Technology, 2007,41(8): 3025-3029 [79] 刘魁, 岳霞, 赵进顺. 医学纳米材料毒理学研究进展[J]. 中华疾病控制杂志, 2013, 17(1): 72-76 Liu K, Yue X, Zhao J S. Progress in research on toxicology of nanomaterials used in nanomedicine [J]. Chinese Journal of Disease Control & Prevention, 2013, 17(1): 72-76 (in Chinese) [80] 刘信勇, 朱琳. 多壁碳纳米管存在环境下Pb、Zn对斑马鱼毒性的变化[J]. 生态毒理学报, 2009, 4(6): 829-833 Liu X Y, Zhu L. The change of the toxicity of Pb and Zn on zebrafish in the case of the existence of multi-walled carbon nanotubes [J]. Asian Journal of Ecotoxicology, 2009, 4(6): 829-833 (in Chinese) [81] 刘信勇, 朱琳, 黄碧捷, 等. 多壁碳纳米管对斑马鱼体组织内酶活性的影响[J]. 环境科学研究, 2009(7): 838-842 Liu X Y, Zhu L, Huang B J, et al. Effects of multi-walled carbon nanotubes on enzyme activity in tissues of zebrafish [J]. Research of Environmental Sciences, 2009(7): 838-842 (in Chinese) [82] 尤宏, 吕丽娜, 赵雪松, 等. 几种纳米材料对斑马鱼孵化和致畸效应的影响[J]. 哈尔滨工业大学学报, 2013, 45(12): 48-52 You H, Lu L N, Zhao X S, et al. Effects of nanomaterials on the hatching and malformation rate of zebrafish embryos [J]. Journal of Harbin Institute of Technology, 2013, 45(12): 48-52 (in Chinese) [83] 唐志扬, 许楠, 李振山. 单壁碳纳米管对斑马鱼生理生化特性的影响[J]. 生态与农村环境学报, 2012, 28: 694-699 Tang Z Y, Xu N, Li Z S. Effects of single-walled carbon nanotubes on physiological and biochemical characteristics of zebrafish [J]. Journal of Ecology and Rural Environment, 2012, 28: 694-699 (in Chinese) [84] Hu X, Lu K, Mu L, et al. Interactions between graphene oxide and plant cells: Regulation of cell morphology, uptake, organelle damage, oxidative effects and metabolic disorders [J]. Carbon, 2014, 80: 665-676 [85] Guo X, Dong S, Petersen E J, et al. Biological uptake and depuration of radio-labeled graphene byDaphniamagna[J]. Environmental Science and Technology, 2013, 47(21): 12524-12531 [86] Chen Y, Hu X, Sun J, et al. Specific nanotoxicity of graphene oxide during zebrafish embryogenesis [J]. Nanotoxicology, 2016, 10(1): 42-52 [87] 朱哲. 纳米材料水生态环境效应的研究进展[J]. 化工管理, 2016(10): 103 Zhu Z. Research progress on aquatic eco-environmental effect of nanomaterials [J]. Chemical Enterprise Management, 2016(10): 103 (in Chinese) [88] Wang X, Lu J, Xing B. Sorption of organic contaminants by carbon nanotubes: Influence of adsorbed organic matter [J]. Environmental Science and Technology, 2008, 42(9): 3207-3212 [89] Shen M, Xia X, Wang F, et al. Influences of multiwalled carbon nanotubes and plant residue chars on bioaccumulation of polycyclic aromatic hydrocarbons byChironomusplumosuslarvae in sediment [J]. Environmental Toxicology and Chemistry, 2012, 31(1): 202-209 [90] Baun A, Sørensen S N, Rasmussen R F, et al. Toxicity and bioaccumulation of xenobiotic organic compounds in the presence of aqueous suspensions of aggregates of nano-C60[J]. Aquatic Toxicology, 2008, 86(3): 379-387 [91] Kim K T, Klaine S J, Lin S, et al. Acute toxicity of a mixture of copper and single-walled carbon nanotubes toDaphniamagna[J]. Environmental Toxicology and Chemistry, 2010, 29(1): 122-126 [92] Spohn P, Hirsch C, Hasler F, et al. C60 fullerene: A powerful antioxidant or a damaging agent? The importance of an in-depth material characterization prior to toxicity assays [J]. Environmental Pollution, 2009, 157(4): 1134-1139 [93] Kovochich M, Espinasse B, Auffan M, et al. Comparative toxicity of C60aggregates toward mammalian cells: Role of tetrahydrofuran (THF) decomposition [J]. Environmental Science and Technology, 2009, 43(16): 6378-6384 [94] Shvedova A, Castranova V, Kisin E, et al. Exposure to carbon nanotube material: Assessment of nanotube cytotoxicity using human keratinocyte cells [J]. Journal of Toxicology and Environmental Health Part A, 2003, 66(20): 1909-1926 [95] Murray A R, Kisin E, Leonard S S, et al. Oxidative stress and inflammatory response in dermal toxicity of single-walled carbon nanotubes [J]. Toxicology, 2009, 257(3): 161-171 [96] Kagan V E, Tyurina Y Y, Tyurin V A, et al. Direct and indirect effects of single walled carbon nanotubes on RAW 264.7 macrophages: Role of iron [J]. Toxicology Letters, 2006, 165(1): 88-100 [97] Jones C F, Grainger D W.Invitroassessments of nanomaterial toxicity [J]. Advanced Drug Delivery Reviews, 2009, 61(6): 438-456 [98] Yang K, Zhu L, Xing B. Adsorption of polycyclic aromatic hydrocarbons by carbon nanomaterials [J]. Environmental Science and Technology, 2006, 40(6): 1855-1861 [99] Lee H J, Park J, Yoon O J, et al. Amine-modified single-walled carbon nanotubes protect neurons from injury in a rat stroke model [J]. Nature Nanotechnology, 2011, 6(2): 121-125 [100] Mitchell L A, Lauer F T, Burchiel S W, et al. Mechanisms for how inhaled multiwalled carbon nanotubes suppress systemic immune function in mice [J]. Nature Nanotechnology, 2009, 4(7): 451-456 [101] Liu Z, Sun X, Nakayama-Ratchford N, et al. Supramolecular chemistry on water-soluble carbon nanotubes for drug loading and delivery [J]. ACS Nano, 2007, 1(1): 50-56 [102] Luan B, Huynh T, Zhao L, et al. Potential toxicity of graphene to cell functions via disrupting protein-protein interactions [J]. ACS Nano, 2014, 9(1): 663-669 [103] Kagan V E, Konduru N V, Feng W, et al. Carbon nanotubes degraded by neutrophil myeloperoxidase induce less pulmonary inflammation [J]. Nature Nanotechnology, 2010, 5(5): 354-359 [104] Liu C W, Xiong F, Jia H Z, et al. Graphene-based anticancer nanosystem and its biosafety evaluation using a zebrafish model [J]. Biomacromolecules, 2013, 14(2): 358-366 [105] Hu X, Zhou M, Zhou Q. Ambient water and visible-light irradiation drive changes in graphene morphology, structure, surface chemistry, aggregation, and toxicity [J]. Environmental Science and Technology, 2015, 49(6): 3410-3418 [106] 程艳红, 陈金媛, 李何荣, 等. 纳米材料的水生毒性研究进展[J]. 环境与健康杂志, 2014, 31(4): 371-376 Cheng Y H, Chen J Y, Li H R, et al. Aquatic toxicity of nanomaterials: A review of recent studies [J]. Journal of Environment and Health, 2014, 31(4): 371-376 (in Chinese) [107] Linse S, Cabaleiro-Lago C, Xue W F, et al. Nucleation of protein fibrillation by nanoparticles [J]. Proceedings of the National Academy of Sciences, 2007, 104(21): 8691-8696 [108] 葛春梅, 黄茜枝, 林道辉, 等. 人工纳米材料对贝类生态毒理效应的研究进展[J]. 生态毒理学报, 2015, 10(4): 1-16 Ge C M, Huang X Z, Lin D H, et al. Research progress in ecotoxic effects of manufactured nanomaterials on shellfish [J]. Asian Journal of Ecotoxicology, 2015, 10(4): 1-16 (in Chinese) [109] Zhou H, Zhao K, Li W, et al. The interactions between pristine graphene and macrophages and the production of cytokines/chemokines via TLR-and NF-κB-related signaling pathways [J]. Biomaterials, 2012, 33(29): 6933-6942 [110] Van Zijverden M, Granum B. Adjuvant activity of particulate pollutants in different mouse models [J]. Toxicology, 2000, 152(1): 69-77 [111] Zhu Y, Ran T C, Li Y G, et al. Dependence of the cytotoxicity of multi-walled carbon nanotubes on the culture medium [J]. Nanotechnology, 2006, 17(18): 4668-4674 [112] Zhu X, Zhu L, Li Y, et al. Developmental toxicity in zebrafish (Daniorerio) embryos after exposure to manufactured nanomaterials: Buckminsterfullerene aggregates (nC60) and fullerol [J]. Environmental Toxicology and Chemistry, 2007, 26(5): 976-979 [113] Matsuura K, Saito T, Okazaki T, et al. Selectivity of water-soluble proteins in single-walled carbon nanotube dispersions [J]. Chemical Physics Letters, 2006, 429(4): 497-502 [114] Nair R, Varghese S H, Nair B G, et al. Nanoparticulate material delivery to plants [J]. Plant Science, 2010, 179(3): 154-163 [115] 王震宇, 赵建, 李娜, 等. 人工纳米颗粒对水生生物的毒性效应及其机制研究进展[J]. 环境科学, 2010, 31(6): 1409-1418 Wang Z Y, Zhao J, Li N, et al. Review of ecotoxicity and mechanism of engineered nanoparticles to aquatic organisms [J]. Environmental Science, 2010, 31(6): 1409-1418 (in Chinese) [116] Ma X, Geiser-Lee J, Deng Y, et al. Interactions between engineered nanoparticles (ENPs) and plants: Phytotoxicity, uptake and accumulation [J]. Science of The Total Environment, 2010, 408(16): 3053-3061 [117] Kang S, Herzberg M, Rodrigues D F, et al. Antibacterial effects of carbon nanotubes: Size does matter [J]. Langmuir, 2008, 24(13): 6409-6413 [118] Yang X Y, Edelmann R E, Oris J T. Suspended C60nanoparticles protect against short-term UV and fluoranthene photo-induced toxicity, but cause long-term cellular damage inDaphniamagna[J]. Aquatic Toxicology, 2010, 100(2): 202-210 [119] Nogueira P F M, Nakabayashi D, Zucolotto V. The effects of graphene oxide on green algaeRaphidocelissubcapitata[J]. Aquatic Toxicology, 2015, 166: 29-35 [120] Hu W, Peng C, Luo W, et al. Graphene-based antibacterial paper [J]. ACS Nano, 2010, 4(7): 4317-4323 [121] Choi J E, Kim S, Ahn J H, et al. Induction of oxidative stress and apoptosis by silver nanoparticles in the liver of adult zebrafish [J]. Aquatic Toxicology, 2010, 100(2): 151-159 [122] Zhao X, Striolo A, Cummings P T. C60binds to and deforms nucleotides [J]. Biophysical Journal, 2005, 89(6): 3856-38622.2 碳纳米材料在多孔介质中的传输
2.3 碳纳米材料在水环境中的转化与降解
3 碳纳米材料对水生生物的毒性效应及机理(Toxic effect of carbon nanomaterials on aquatic organisms and its mechanism)
3.1 碳纳米材料对水生生物的毒性效应
3.2 碳纳米材料可能的毒性机理
4 研究展望(Research prospects)