真性红细胞增多症急性髓细胞白血病转化4例分析*
2018-01-29冶秀鹏魏玉萍李叶琼宋丽君牛玉捷
冶秀鹏,包 慎,魏玉萍,智 峰,郭 营,李叶琼,宋丽君,牛玉捷,孙 月
(宁夏回族自治区人民医院/西北民族大学第一附属医院,银川 750002)
真性红细胞增多症(PV)是起源于造血干细胞的恶性克隆性骨髓增殖性疾病,进展缓慢,极少数PV患者最终会发生致命的急性髓细胞白血病(AML)转化。现分析本院诊断的4例PV转化为AML的病例,以提高临床医师对此类疾病的认识。
1 资料与方法
1.1一般资料 2009年1月至2017年4月本院共收住4例PV转化为AML的患者,男2例,女2例,年龄范围53~84岁。
1.2方法
1.2.1实验室检查 所有患者均行血常规、生化、末梢血涂片,骨髓涂片及活检,JAK2V617F、BCR-ABL突变检测;染色体核型分析,骨髓流式细胞术,胸片,腹部超声等。
1.2.2治疗 患者均给予GAA(促粒素200 μg/d,比柔吡星10 mg d1~d5、阿糖胞苷20 mg 每12小时1次 d1~d7)等治疗。
2 结 果
2.1临床症状及体征 临床表现均有头晕、乏力,发热,均有高血压病及冠状动脉粥样硬化性心脏病(以下简称冠心病)史,1例患者曾患心肌梗死及脑梗死,所有患者均脾脏肿大。
2.2实验室检查 所有患者JAK2V617F阳性,BCR-ABL融合基因阴性,末梢血涂片及骨髓涂片原始细胞均大于20%,1例患者骨髓活检:骨髓结构完全破坏,伴纤维组织重度增生,造血组织少见,骨小梁明显增厚,原始细胞呈簇片状分布;其余3例患者骨髓活检:骨髓增生极度活跃,原始细胞弥漫性浸润。4例骨髓流式细胞术符合AML免疫表型;白血病31种融合基因检测均阴性。例2患者染色体核型分析46,XY,del(7)(q31q36),del(18)(q22)[10],其余3例染色体未见异常,见表1。
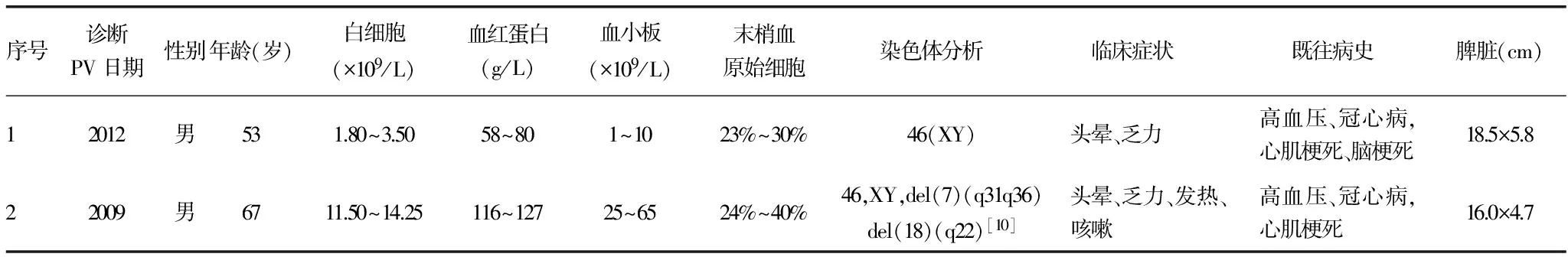
表1 4例PV转化AML患者资料
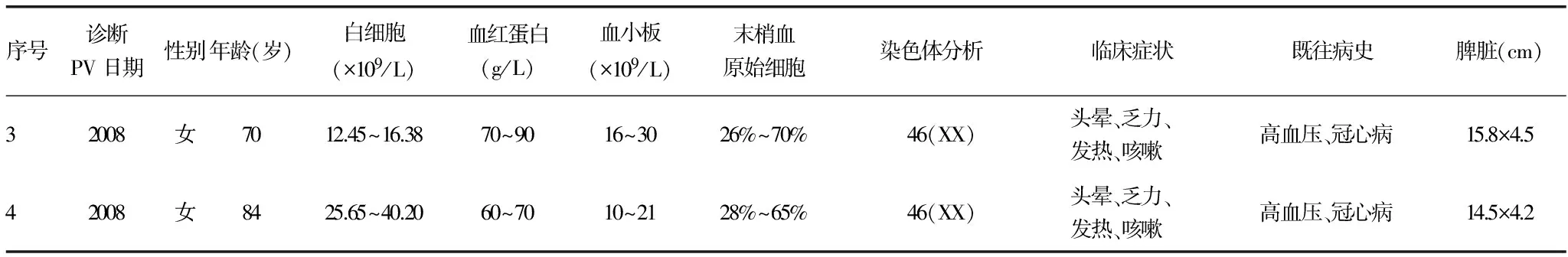
续表1 4例PV转化AML患者资料
血常规、血红蛋白、血小板为转白时的数值
2.3治疗结果 除例2患者目前仍在治疗外(确诊PV 2年后转化为AML,转化为AML后目前生存1个月余),其余3例均于确诊转化为AML后3月内死亡。
3 讨 论
PV系慢性骨髓增殖性肿瘤,迄今发病原因尚不清楚,目前仅明确其造血干细胞发生了JAK2相关的基因突变[1-2]。PV最终会发生致命的并发症,如血栓、出血、转化为骨髓纤维化或AML。1例患者10年前被误诊为“肝硬化”未及时治疗,先后并发心肌梗死及脑梗死。此外,4例患者均有高血压,可能系PV引起的症状性高血压。
多血期后骨髓纤维化(post-PVMF)和AML转化到底是疾病自然进展,还是与先前的治疗有关,目前还不清楚。PV很少发生AML转化,通常被认为是晚期事件,单用放血治疗患者的发病率为1%~2%[3-4]。本研究例1患者诊断时即处于post-PVMF,属PV自然病程的终末期,病程转归经历了病理学上的多血期、多血后期和post-PVMF,符合经典PV的自然发展过程,仅后期短时间应用羟基脲(HU)治疗,转化可以排除与HU有关,应属疾病的自然转归。
PV治疗相关性AML(t-AML)的发病率为5%~15%[5]。发病风险和某些细胞毒制剂如烷化剂有关[6]。几乎所有的患者都有染色体异常,包括5号和7号染色体[7]。按诊断规则先前有接受细胞毒性治疗的患者,如发生AML,要优先考虑t-AML。例2、3、4患者确诊后即长期应用HU治疗,且例2患者发现7号染色体异常,均在疾病的多血期就直接转化为AML,理应考虑为t-AML。因此,长期应用HU的安全性应该受到质疑,此3例患者白血病转化可能均不是疾病的自然转归。因此,需要重新审视长期应用HU对于PV无害的观点,当然,这需要今后更多临床研究来证实。
有研究报道HU有致白血病作用[6-7],单用其治疗PV并发AML的发生率为10.5%,大多在用药的前4年发生。当然,亦有研究表明运用HU与单纯放血相比,AML转化率差异无统计学意义(P>0.05)[6,8]。
t-AML预后很差,5号或7号染色体异常者更差,无论原始细胞计数如何,中位生存期都不到1年[7,9]。本研究中例1、3、4患者在转化为AML后,虽经积极治疗,均于3个月内死亡。
综上所述,PV是逐渐进展的恶性克隆性疾病,可向post-PVMF、AML等转化,其原因可能是疾病的自然病程,但不能排除长期应用HU所致,其安全性应当受到重视,一旦转化为白血病后无良好治疗方法,最佳治疗方案需要进一步探索。
[1]JAMES C,UGO V,LE COUÉDIC J P,et al.A unique clonal JAK2 mutation leading to constitutive signalling causes polycythaemia vera[J].Nature,2005,434(737):1144-1148.
[2]PUTRA J,TOOR A,NOCE T A,et al.Multiple liver lesions in a patient with Budd-Chiari syndrome secondary to polycythemia vera[J].Ann Hepatol,2015,14(4):547-549.
[3]BLUM S,MARTINS F,ALBERIO L.Ruxolitinib in the treatment of polycythemia vera:patient selection and special considerations[J].J Blood Med,2016,7(23):205-215.
[5]GRAHAM A,MILLIGAN G,MANUEL L,et al.Symptoms,concomitant conditions and cardiac risk in European hydroxyurea treated polycythemia Vera patients[J].Value Health,2015,18(7):A436.
[7]BJORKHOLM M,HULTCRANTZ M,DEROLF A R.Leukemic transformation in myeloproliferative neoplasms:therapy-related or unrelated?[J].Best Pract Res Clin Haematol.2014;27(2):141-153.
[8]KILADJIAN J J,CHEVRET S,DOSQUET C,et al.Treatment of polycythemia vera with hydroxyurea and pipobroman:final results of a randomized trial initiated in 1980[J].J Clin Oncol,2011,29(29):3907-3913.
[9]KUNDRANDA M N,TIBES R,MESA R A.Transformation of a chronic myeloproliferative neoplasm to acute myelogenous leukemia:does anything work?[J].Curr Hematol Malig Rep,1994,7(1):51-52.
