83例急性淋巴细胞白血病中枢浸润患者的临床特征及预后分析
2018-01-29赵婷婷
杨 艳,伦 燕,赵婷婷,李 清,吴 俣
(四川大学华西医院血液内科,成都 610041)
中枢神经系统白血病(CNSL)是白血病细胞侵袭至蛛网膜、脑实质、颅神经等中枢神经组织而产生的一系列临床症状和体征。CNSL主要发生于急性白血病,其中急性淋巴细胞白血病(ALL)占大多数。而中枢神经系统也是ALL髓外浸润最常发生的部位。独立的或是伴发的CNSL预后均较差。近年来,由于对神经系统肿瘤微环境的深入了解、CNSL的预防性治疗及化疗方案的改进使得成人ALL中枢复发率有所下降,但其依然是导致ALL治疗失败的重要隐患。本研究将本院诊治的ALL伴CNSL的患者的临床特点、治疗方案及预后进行回顾性分析,现报道如下。
1 资料与方法
1.1一般资料 收集2005年1月至2015年1月本院血液科收治的诊断为ALL伴CNSL患者83例临床资料,所有患者既往均无中枢神经系统疾病。其中男52例(62.65%),女31例(37.35%),男女比例1.68∶1.00。中位年龄27(15~72)岁。初诊CNSL 11例(13.25%),单独中枢复发8例,骨髓+中枢系统复发53例。59例患者伴有明显临床症状,27例患者出现多种合并的症状。出现头痛、头昏、呕吐、抽搐、意识障碍等脑膜或脑实质受累表现的46例,复视、听觉/视觉丧失、面瘫、吞咽困难等颅神经受累为表现的32例,肢体的无力、神经根痛、膀胱及肠道的功能异常等脊髓受累表现的8例。24例患者无明显临床表现,通过腰穿检查结果诊断CNSL。
1.2方法
1.2.1临床资料 收集性别、年龄、临床表现、实验室检查、影像学检查等临床资料。实验室检查分为外周血检查、骨髓检查和脑脊液(CSF)检查。外周血检查包括患者初诊时外周血白细胞计数、血小板计数、血色素、乳酸脱氢酶水平。骨髓检查包括诊断时的骨髓涂片、免疫分型、染色体核型分析相关的基因检测。患者均在预防性鞘内注射前或首次鞘内注射治疗前完善CSF压力测定,并收集标本行CSF常规、生化检查,必要时完善CSF流式细胞学检查(FCM)。影像学检查包括胸部CT、腹部超声等对其他髓外浸润部位的筛查,部分患者行头部磁共振(MRI)或头部CT。
1.2.2诊断标准 ALL的诊断与分型参考WHO 2016标准和中国成人ALL诊断与治疗指南(2016年版)[1],CNSL的诊断参考NCCN(2017)指南,定义CNSL为CSF白细胞计数大于或等于5×106个/L(5个/μL),且离心标本证明存在原始细胞者。定义完全缓解(CR)为治疗后状态满足以下4点:(1)外周血无原始细胞且无髓外浸润;(2)三系造血正常且骨髓原始细胞小于5%;(3)中性粒细胞绝对计数大于1×109个/L;(4)血小板计数大于100×109个/L;(5)4周内无复发[2]。CR诊断参考骨髓涂片及骨髓流式细胞术检测微小残留(MRD)的情况。明确以下定义,初诊CNSL:为ALL诊断时或是在诊断后首次腰穿发现的CNSL(排除创伤性腰穿所致)。单独中枢复发:治疗达CR后中枢复发,且4周内无骨髓复发或其他髓外部位复发。骨髓+中枢系统复发:中枢神经系统复发且前后4周内有骨髓复发[3]。
1.2.3随访与结局 随访至2017年5月,结局指标包括死亡、CR存活、带病存活。总生存(OS)期定义为从诊断到患者死亡的时间或末次随访时间或是研究截止时间。
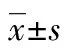
2 结 果
2.1外周血和CSF检查 初诊时表现为高白细胞计数(WBC≥100×109/L)24例,血小板计数均值为 (60.44±75.00)×109/L,血色素均值为(89.5±30.4)g/L,乳酸脱氢酶水平升高(LDH≥600 U/L)40例。CSF压力升高(≥180 mm H2O)19例,蛋白高于正常(≥0.45 g /L)47例,有核细胞数高于正常 (≥5×109/L)34例。63例患者行CSF流式检查,其中45例查见原始细胞。
2.2骨髓检查 骨髓涂片及免疫分型符合ALL诊断。83例患者中T细胞ALL(T-ALL)19例,B细胞ALL(B-ALL)54例[其中BCR-ABL(+) 26例,BCR-ABL(-)28例],Burkitt淋巴瘤/白血病3例,急性淋巴母细胞白血病(T/B 淋巴细胞)2例,分型未明5例。B-ALL中4例前B-ALL,30例早期前B-ALL,16例普通型B-ALL,1例成熟B-ALL,3例未明确分型。T-ALL中,1例早期前T-ALL,6例前T-ALL,7例皮质T-ALL,2例成熟T-ALL,3例未明确分型。有81例患者行融合基因检查,其中BCR-ABL(+)26例,BCR-ABL(-)的55例。BCR-ABL(-)中发现异常融合基因8例,包括SIL-TAL1(+)4例,E2A-PBX1(+)2例,MLL-AF4(+)1例,EVI1(+)1例。14例患者行染色体核型分析,异常的染色体核型9例,其中Ph染色体阳性7例,在Ph(+)ALL中还包括1例复杂核型44~46,XX,t(9,22)(q34;q11),+der(22)t(9;22),inc[cp2]/46,XX[13],1例亚二倍体45,XX,del(9)(p22),t(9;22)(q34;q11),add(17)(p13),-21。在Ph(-)ALL中,超二倍体2例,分别为47,XX,+Xx(12)/46,XX(8)和47,XX,+Xx(12)/46,XX(8)。
2.3影像检查 10例患者通过筛查发现有肝、脾、淋巴结、肾脏、肺、乳房、附件、皮肤等其他髓外浸润部位。42例行头部MRI或头部CT检查的患者中,19例未见明显异常,其余23例中可见的异常影像学部位包括腰骶椎体、脑膜、小脑、大脑额顶叶、乳突、垂体、视神经、额窦、筛窦等。
2.4治疗及随访结果 在本研究中,CNSL 的预防措施均采用甲氨蝶呤(10~15 mg)+阿糖胞苷(30~50 mg)+地塞米松三联或二联鞘内注射化疗。治疗方面,所有患者均接受全身化疗同时联合鞘内注射化疗,部分患者选择性进行局部放疗(头部或头部+脊髓)、造血干细胞移植、嵌合抗原受体T细胞免疫疗法(CAR-T)。其中接受放疗(全脑或全脑+全脊髓)20例,剂量根据患者一般情况及化疗方案的强度进行选择,全脑放疗总剂量2 000~2 400 cGy、脊髓放疗总剂量1 800~2 000 cGy,均分次完成。造血干细胞移植5例,均为异基因造血干细胞移植。嵌合抗原受体T细胞免疫疗法(CAR-T)2例。治疗期间有65例患者达到CR,51例患者第1次化疗即达CR(CR1)。患者中可收集到57例患者CR后的MRD水平,平均值为0.37%。截止于随访日期,中位随访时间10(1~52)个月。83例患者中3例存活(1例为CR存活,2例带病生存),69例死亡,11例失访,生存曲线见图1。
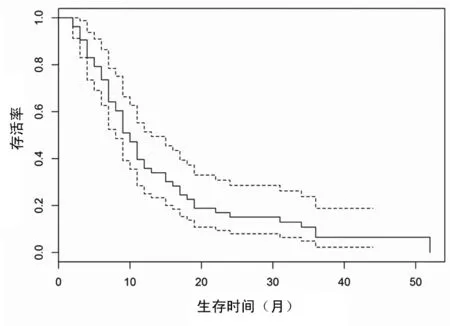
图1 83例ALL-CNSL患者总生存曲线
2.5预后分析
2.5.1临床特征对患者预后的影响 根据诊断时的年龄、白细胞计数、LDH水平、CSF压力、CSF蛋白水平、CNSL是否为初诊、有无其他部位受累、是否有BRC-ABL融合基因将患者分组进行预后对比,结果显示,诊断时高白细胞计数是预后的不良因素,而年龄、LDH升高、CSF压力、CSF蛋白水平、CNSL是否为初诊、有无其他部位受累、是否有BCR-ABL融合基因对患者预后没有影响(P>0.05),见表1、图2。
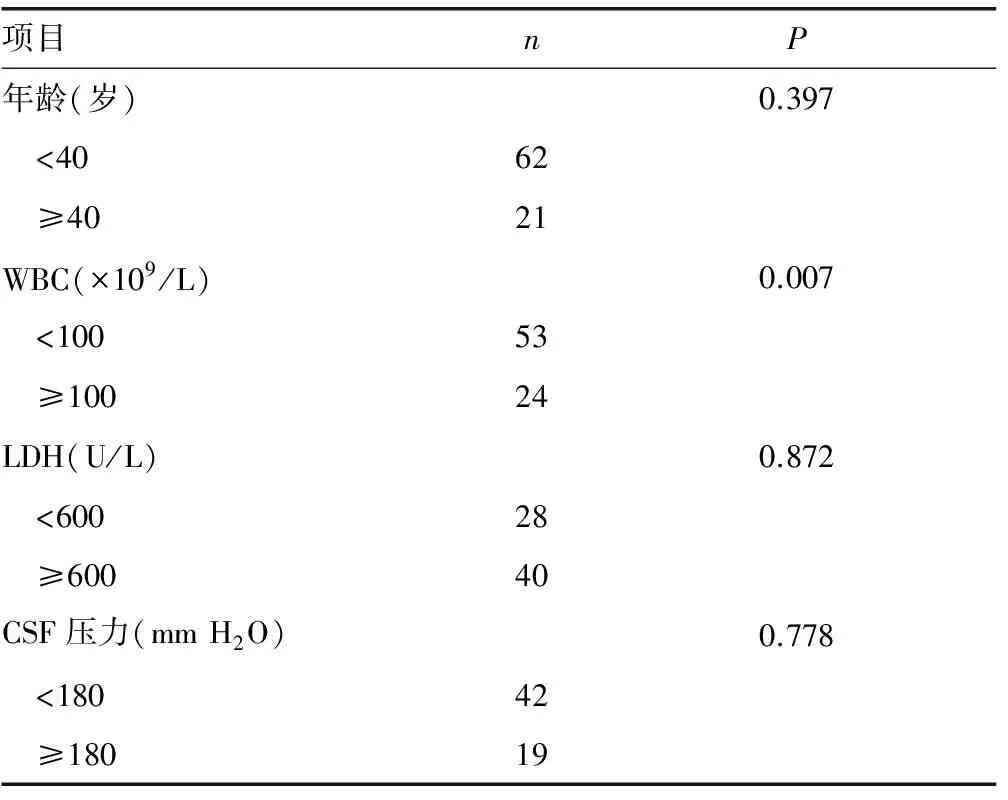
表1 83例ALL-CNSL患者临床特征对预后影响的单因素分析
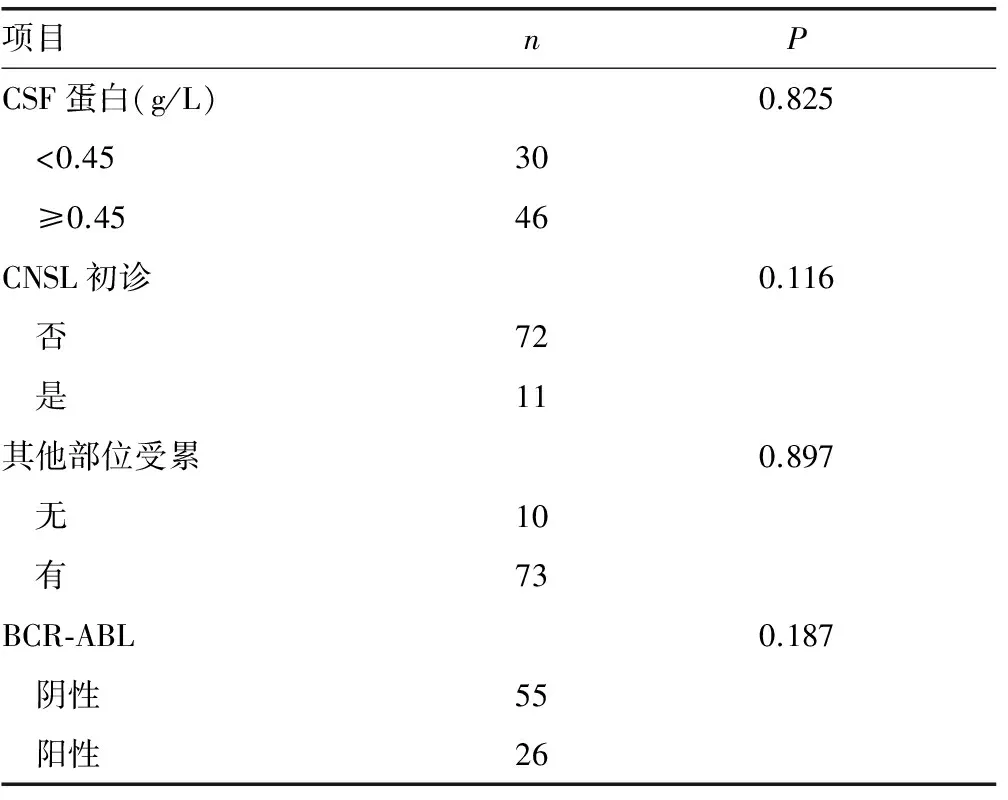
续表1 83例ALL-CNSL患者临床特征对预后影响的单因素分析
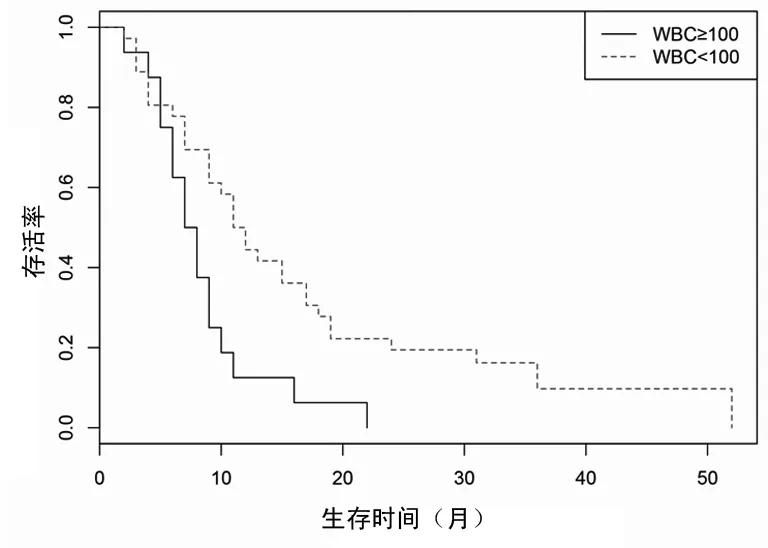
图2 初诊时不同白细胞水平的ALL-CNSL患者生存曲线比较
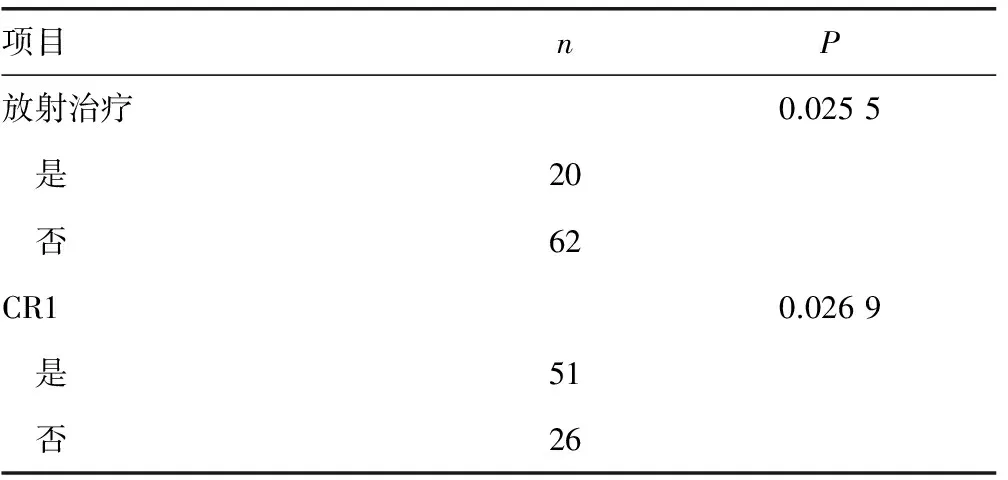
表2 83例ALL-CNSL患者治疗及疗效对预后影响的单因素分析
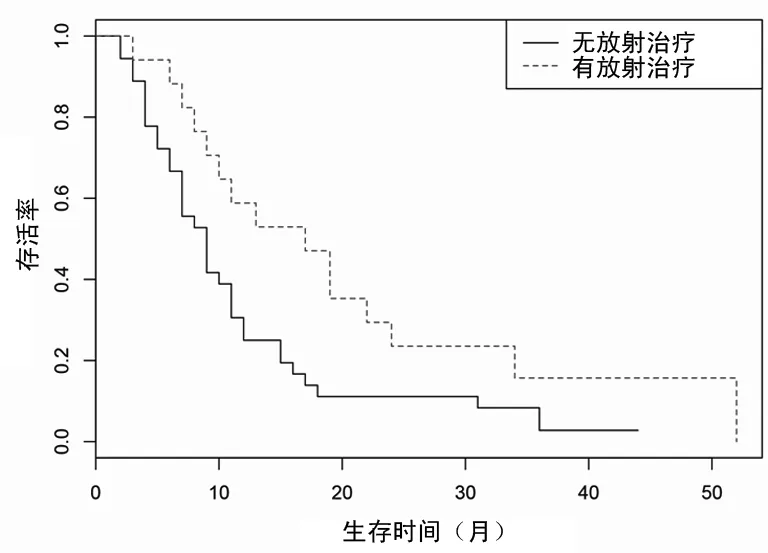
图3 放射治疗对ALL-CNSL患者预后的影响
2.5.2不同治疗方案及疗效对患者预后的影响 根据患者是否行放射治疗、1个疗程化疗后骨髓形态学评估是否达CR分组进行预后分析,结果显示,行放射治疗、1个疗程化疗后达CR的患者预后相对较好。在57例可收集到MRD水平的患者中,Cox回归分析显示MRD水平与总体生存时间相关性差异无统计学意义(P=0.982),见表2、图3、4。
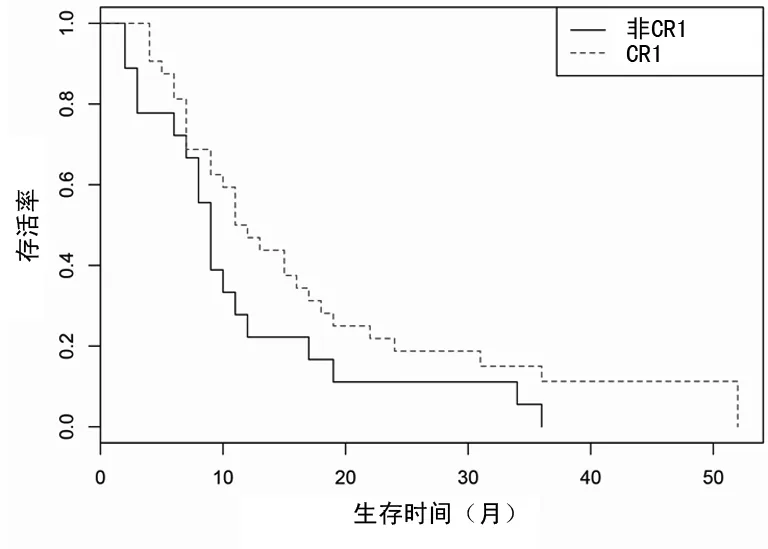
图4 1个疗程化疗后对患者预后的影响
2.5.3多因素分析 选择白细胞计数、LDH、是否放射治疗、1疗程化疗后是否达CR进行Cox风险比例模型回归分析,结果显示白细胞计数是影响总体生存率(OS)的独立预后因素(P=0.007),见表3。
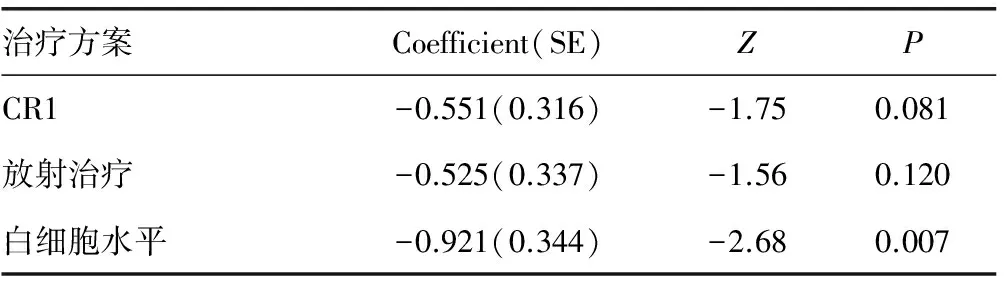
表3 影响83例ALL-CNSL患者总生存期的多因素分析
3 讨 论
近年,成人ALL的缓解率得到了显著的提高,在首次联合化疗后,有60%~90%的患者可以达到CR[4],然而CNSL的复发率却高达到15%[5]。由于血脑屏障的存在,化疗药物对中枢神经系统内的白血病细胞的治疗效果受限,进而导致ALL复发难治。但白血病细胞侵入中枢的方式及其在中枢内存活的条件目前还处于研究过程[6]。
CNSL的临床表现各异。本研究中,大部分患者以头痛、恶心、呕吐等脑膜或脑实质的受累为主要表现,面瘫、视/听觉障碍等颅神经的受累为其次。CNSL的临床症状不具有特异性,中枢神经系统的感染、出血、其他肿瘤性病变等都可出现类似的改变,相反部分存在中枢浸润的患者也可没有明确的临床体征。
CNSL的标准诊断方法尚存在争议。本研究中,笔者主要采取FCM来检测CSF中的白血病细胞,有63例患者行该检查,其中45例查见原始细胞,阳性检出率高于既往文献中报道的常规细胞学检测(CC)[7]。与CC相比,FCM可从更少的细胞数量中发现异常细胞,提高CNSL的诊断率,但由于技术要求较高,其准确性仍受到质疑。一项包括38例ALL/淋巴母细胞淋巴瘤患者的临床研究证实,CC(-)/ FCM(+)的患者比CC(-)/FCM(-)的患者表现出更短OS期,这提示了单独FCM(+)对于患者预后的意义[7]。目前也有观点认为应将两种检测手段联合应用以提高CSF样本中肿瘤细胞的检出率[8]。
早期的中枢预防可显著降低CNSL的复发,所以中枢预防是ALL治疗中的关键步骤[9]。在本研究中,所有患者均采用甲氨蝶呤+阿糖胞苷+地塞米松三联或二联鞘内注射化疗的预防措施。鞘内注射化疗是应用最广泛的中枢预防措施,它可以维持治疗药物在CSF中的有效浓度[10]。有研究证实三联鞘注阿糖胞苷、甲氨蝶呤、氢化可的松可使儿童ALL患者5年的累计中枢复发率降低至1.2%[11]。脂质体阿糖胞苷是一种应用于鞘注的相对较新的药物,虽然已有研究表明其疗效,但因相关研究还较少,且有难以耐受的不良反应的报道,目前还未在临床应用[12-13]。系统化疗预防CNSL常选用中大剂量甲氨蝶呤和阿糖胞苷为基础的全身化疗。相比于其他两种措施,局部放射治疗因其中枢毒性不推荐用于预防阶段。近年来推荐对患者进行CNSL风险评估,并依此进行预防措施的选择。这种方案的提出有助于确定合适的中枢神经系统预防方式,同时可避免对中枢神经系统复发风险不高的患者的过度治疗[14]。
即使通过早期的预防,依然有5%~10%的ALL患者发生CNSL。CNSL的治疗方案与预防基本相同,但是可以考虑更频繁的鞘注和加强全身化疗的策略,同时中枢放疗也不失为一种补救措施。虽然可能伴随神经内分泌紊乱、认知功能障碍等后续不良反应,但SANDERS等[15]研究证实了其在成人CNSL患者中的治疗也起到一定作用。本研究中接受全脑或全脑+全脊髓放疗的患者共20例,生存分析的结果同样支持放疗的应用,认为其对延长患者的生存期有影响。
Ph(+)- ALL 中枢受累相对少见,首选酪氨酸激酶抑制剂(TKI)为基础的治疗手段。有报道显示使用第一代TKI 制剂伊马替尼的Ph(+)- ALL患者仍有高达20%中枢性复发[16],这与伊马替尼的中枢渗透性不足相关[17]。同为第二代TKI制剂的达沙替尼和尼罗替尼,均已在不同的研究中被证实了在治疗中枢浸润性Ph(+)白血病中的临床价值[18-19]。本研究中1位50岁男性Ph(+)-ALL患者,第1次行诱导化疗后达到CR,在第2次巩固化疗后中枢复发。再次予诱导化疗,并加强鞘注频率,行全脑+全脊髓放疗,但患者反复中枢及骨髓复发,遂换用达沙替尼继续治疗,至随访结束期,患者依然存活且达到部分缓解。
造血干细胞移植(SCT)也是CNSL的一种治疗方案。日本成人ALL工作组1项回顾性分析显示,成人ALL伴CNSL患者在CR期且体力状态良好时接受SCT,其总体生存率与接受移植的无中枢受累的ALL患者无明显差别,而体力状态差或高龄患者更易发生移植相关的死亡[20]。本研究接受SCT的5例患者中,2例因发生移植相关并发症而死亡。SCT后的中枢神经系统复发是也一个相对棘手的临床问题,在本研究中,2例接受SCT后发生中枢神经系统+骨髓复发,1例同时合并重症肺炎,放弃治疗自动出院;1例行多次鞘内注射,死于再次诱导化疗期间发生的严重骨髓抑制。有研究结果指出ALL患者比其他类型的白血病患者更容易在SCT 后发生中枢浸润[21]。因此认为有必要在CNSL患者接受SCT时为其制定包括鞘内注射、系统化疗等在内的预防中枢神经系统再次复发的方案。
针对CD19或CD20抗原的工程化CAR-T细胞技术也逐渐应用于有中枢受侵的ALL患者的治疗。几个不同临床试验均已发现了CAR-T细胞可通过血脑屏障进入CSF的直接证据[20-22]。GRUPP等[22]也曾报道过2名ALL伴CNSL患者,经输注以CD19嵌合抗原受体修饰的自体T细胞达到CR,且在随后6个月的随访中未再检测到CSF中的原始细胞,且无CNSL复发。在本研究中,2例行CAR-T治疗的患者均为复发难治性CNSL,虽在治疗后可在CSF中检测到持续存在的CAR-T细胞,但因疾病进展迅速,均死于中枢+骨髓系统复发。
既往文献中报道的CNS复发患者的中位OS为6个月,5年OS为0[23-24],与CNSL相关的不良预后因素包括年龄大于30岁、Ph(+)-ALL、1个疗程化疗后未达CR、缓解后未行SCT等[5]。本研究结果显示初诊WBC≥100×109/L、1个疗程未达CR为预后不良因素(P<0.05),多因素分析中初诊WBC≥100×109/L是影响患者OS期的独立预后因素(P<0.05)。在本组患者中,是否进行SCT对患者远期生存并无影响,可能是因为与本组患者中3例患者行移植前未达CR且2例为拯救性移植有关。本研究中,研究对象是已经确诊的CNSL患者,对其预后进行了临床资料的分析,如果能够进行同期ALL患者的病例对照研究或配对研究,并扩大样本量,将能同时更好地诠释ALL伴CNSL的高危因素。
[1]中国抗癌协会血液肿瘤专业委员会. 中国成人急性淋巴细胞白血病诊断与治疗指南(2016年版)[J]. 中华血液学杂志, 2016, 37(10):837-845.
[2]BROWN P A,SHAH B,FATHI A,et al.NCCN Guidelines Insights:Acute Lymphoblastic Leukemia,Version 1.2017[J].Journal of the National Comprehensive Cancer Network Jnccn,2017,15(9):1091.
[3]SURAPANENI U R,CORTES J E,THOMAS D,et al.Central nervous system relapse in adults with acute lymphoblastic leukemia[J].Cancer,2002,94(3):773-779.
[4]THOMAS X,BOIRON J M,HUGUET F,et al.Outcome of treatment in adults with acute lymphoblastic leukemia:analysis of the LALA-94 trial[J].J Clin Oncol,2004,22(20):4075-4086.
[5]REMAN O,PIGNEUX A,HUGUET F,et al.Central nervous system involvement in adult acute lymphoblastic leukemia at diagnosis and/or at first relapse:results from the GET-LALA group[J].Leuk Res,2008,32(11):1741-1750.
[6]FRISHMAN-LEVY L,IZRAELI S.Advances in understanding the pathogenesis of CNS acute lymphoblastic leukaemia and potential for therapy[J].Br J Haematol,2017,176(2):157-167.
[7]DEL PRINCIPE M I,BUCCISANO F,CEFALO M,et al.High sensitivity of flow cytometry improves detection of occult leptomeningeal disease in acute lymphoblastic leukemia and lymphoblastic lymphoma[J].Ann Hematol,2014,93(9):1509-1513.
[8]CANOVI S,CAMPIOLI D.Accuracy of flow cytometry and cytomorphology for the diagnosis of meningeal involvement in lymphoid neoplasms:a systematic review[J].Diagn Cytopathol,2016,44(10):841-856.
[9]PUI C H.Acute lymphoblastic leukemia in children[J].Curr Opin Oncol,2000,12(1):3-12.
[10]DEANGELIS L,BATCHELOR T.Primary CNS lymphoma:is there a role for prophylaxis against lymphomatous meningitis?[J].Expert Review of Neurotherapeutics,2004,4(4):S19.
[11]PUI C H,MAHMOUD H H,RIVERA G K,et al.Early intensification of intrathecal chemotherapy virtually eliminates central nervous system relapse in children with acute lymphoblastic leukemia[J].Blood,1998,92(2):411-415.
[12]GÖKBUGET N,HARTOG C M,BASSAN R,et al.Liposomal cytarabine is effective and tolerable in the treatment of central nervous system relapse of acute lymphoblastic leukemia and very aggressive lymphoma[J].Haematologica,2011,96(2):238-244.
[13]CHAMBERLAIN M C,GLANTZ M J.Neurologic complications associated with intrathecal liposomal cytarabine given prophylactically in combination with high-dose methotrexate and cytarabine to patients with acute lymphocytic leukemia[J].Blood,2007,110(5):1698.
[14]PUI C H.Toward optimal central nervous system-directed treatment in childhood acute lymphoblastic leukemia[J].J Clin Oncol,2003,21(2):179-181.
[15]SANDERS K E,HA C S,CORTES-FRANCO J E,et al.The role of craniospinal irradiation in adults with a central nervous system recurrence of leukemia[J].Cancer,2004,100(10):2176-2180.
[16]LEIS J F,STEPAN D E,CURTIN P T,et al.Central nervous system failure in patients with chronic myelogenous leukemia lymphoid blast crisis and Philadelphia chromosome positive acute lymphoblastic leukemia treated with imatinib(STI-571)[J].Leuk Lymphoma,2004,45(4):695-698.
[17]TAKAYAMA N,SATO N,O′BRIEN S G,et al.Imatinib mesylate has limited activity against the central nervous system involvement of Philadelphia chromosome-positive acute lymphoblastic leukaemia due to poor penetration into cerebrospinal fluid[J].Br J Haematol,2002,119(1):106-108.
[18]PORKKA K,KOSKENVESA P,LUNDN T,et al.Dasatinib crosses the blood-brain barrier and is an efficient therapy for central nervous system Philadelphia chromosome-positive leukemia[J].Blood,2008,112(4):1005-1012.
[19]REINWALD M,SCHLEYER E,KIEWE P,et al.Efficacy and pharmacologic data of second-generation tyrosine kinase inhibitor nilotinib in bcr-abl-positive leukemia patients with central nervous system relapse after allogeneic stem cell transplantation[J].biomed research international,2016,2014(6):637059.
[20]MAUS M V,GRUPP S A,PORTER D L,et al.Antibody-modified T cells:CARs take the front seat for hematologic malignancies[J].Blood,2014,123(17):2625-2635.
[21]GE L,YE F,MAO X L,et al.Extramedullary relapse of acute leukemia after allogeneic hematopoietic stem cell transplantation:different characteristics between acute myelogenous leukemia and acute lymphoblastic leukemia[J].Biol Blood Marrow Transplant,2014,20(7):1040-1047.
[22]GRUPP S A,KALOS M,BARRETT D,et al.Chimeric antigen receptor-modified T cells for acute lymphoid leukemia[J].N Engl J Med,2013,368(16):1509-1518.
[23]MAUDE S L,FREY N,SHAW P A,et al.Chimeric antigen receptor T cells for sustained remissions in leukemia[J].N Engl J Med,2014,371(16):1507-1517.
[24]FIELDING A K,RICHARDS S M,CHOPRA R,et al.Outcome of 609 adults after relapse of acute lymphoblastic leukemia(ALL);an MRC UKALL12/ECOG 2993 study[J].Blood,2007,109(3):944-950.
