沉默MagT1影响大鼠心肌细胞内Mg2+水平和细胞凋亡的研究*
2018-01-29滕飞翔沈之君赵洪侠张栋梁杨留才
滕飞翔,沈之君,赵洪侠,张栋梁,杨留才△
(1.江苏医药职业学院基础医学部,江苏盐城 224005;2.南通大学医学院病理学与病理生理学系,江苏南通 226001;3.潍坊护理职业学院医学基础部,山东潍坊 261041)
镁离子(Mg2+)是一种对心肌细胞生命活动有重要影响的二价阳离子,其具有舒缓血管平滑肌、改善缺血心肌的能量代谢、纠正缺血心肌的不应期等作用[1]。当Mg2+代谢失衡时,会导致患者出现心力衰竭、心房颤动、心律不齐、冠状动脉粥样硬化性心脏病等症状[2-6]。有研究表明,Mg2+进出细胞会通过离子通道或转运体等来实现,目前已经发现了多种跨细胞膜转运Mg2+的通道或转运体,普遍存在于哺乳动物的各组织和器官内[7-11]。
镁离子转运蛋白1(magnesium transporter 1,MagT1)存在于哺乳动物的多种细胞内,含有335个氨基酸[12]。GOYTAIN等[12]研究显示MagT1是一种特异性的Mg2+转运体。ZHOU等[13]实验表明MagT1在维持细胞内外Mg2+稳态中起非常重要作用。还有研究表明,MagT1通过调节Mg2+的转运,影响多种组织和器官,对骨细胞分化、骨整合、癌细胞诊断、妊娠胎盘和胚胎发育起到重要作用,还会导致XMEN综合征、免疫缺陷相关疾病等[14-22]。
目前MagT1的相关研究较少,本研究应用 RNA干扰(RNA interference,RNAi)技术,体外合成siRNA并转染大鼠心肌细胞,沉默心肌细胞内的MagT1,观察其对胞内Mg2+浓度和心肌细胞生存及正常生命活动的影响,现报道如下。
1 材料与方法
1.1实验动物 1 d龄SD大鼠(南京青龙山动物养殖场和南通大学医学院实验动物中心提供)10只,雌雄不限。
1.2试剂 DMEM培养基购自日本Nissui pharmaceutical公司,胎牛血清购自美国Hycolone公司;siRNA序列购自上海吉玛公司;Trypsine、Trizol、LipofectamineTMRNAiMAX、荧光二抗购自美国Invitrogen公司;Ⅱ型胶原酶购自美国GIB- CO公司;Taq DNA 聚合酶、反转录试剂盒购自日本TaKaRa公司;MagT1兔抗购自北京奥维亚公司;α-actin鼠抗购自美国Abcam公司;异硫氰酸荧光素标记的膜联蛋白V(Annexin V-FITC)0凋亡试剂盒购自美国Biouniquer公司。
1.3仪器 PCR 扩增仪(美国 Bio-Rad公司);凝胶成像系统(上海培清科技有限公司);稳压稳流电泳仪(北京市六一仪器厂,型号 DYY-Ⅲ2 型);DYCp-31D 型水平电泳槽(北京市六一仪器厂);高速低温离心机(德国 Eppendorf公司);常温离心机(德国 Eppendorf公司);隔水式恒温培养箱(上海一恒科技有限公司,型号GHP-9080);微量移液器(德国 Gilson公司);pH计(上海雷磁);正置荧光显微镜(日本OLYMPUS公司,型号BX51);细胞培养箱(美国 Thermo公司);流式细胞仪(美国贝克曼库尔特公司)。
1.4方法
1.4.1大鼠心肌细胞原代培养 10只1 d龄的普通级SD大鼠,无菌条件下剪取心脏,使用D-Hanks液漂洗3次。在小培养皿中剪下心尖(心室肌)部分,把心尖部分剪碎至1~2 mm3碎块。将碎块置于小瓶中加入0.08%胰酶+Ⅱ型胶原酶混合液,置于37℃水浴恒温振荡仪中反应10 min,弃去上清液;沉淀部分重复上述步骤,反应后反复吹打沉淀,把浑浊的液体吸出置于离心管中,加含15%血清的DMEM培养液终止胰酶消化,以1 000 r/min的速度离心10 min,弃去上层液体后加入含15%血清的DMEM培养液重悬沉淀中的细胞,放于培养瓶中置于37 ℃、5% CO2培养箱中1.5 h,进行差速贴壁[23]。 随后以105/mL的密度种于6孔板中,24 h后更换培养基,加0.01 mmol/L的5-溴脱氧尿嘧啶核苷(Brdu)[24]抑制成纤维细胞的生长。将细胞悬液与1%的台盼蓝溶液1∶1混合进行存活度计数,被染色的代表死细胞。培养的大鼠心肌细胞中常混有成纤维细胞,本研究选择一种心肌细胞具有但成纤维细胞没有的α-actin蛋白一抗[25]进行免疫荧光反应,以鉴定心肌细胞的纯度。
1.4.2siRNA转染心肌细胞 本研究委托上海吉玛公司设计生产4对MagT1 siRNA和1对阴性对照siRNA,本课题组前期的研究[26]筛选出沉默效果最好的1对siRNA(序列为5′-GAU UGG ACU UGU UGU GUU ATT-3′,5′-UAA CAC AAC AAG UCC AAU CTT-3′),阴性对照siRNA序列为5′-UUC UCC GAA CGU GUC ACG UTT-3′,5′-ACG UGA CAC GUU CGG AGA ATT -3′。本研究设空白对照组、阴性siRNA组、siRNA组。使用LipofectamineTM RNAiMAX试剂,按照说明书要求将siRNA转染进大鼠心肌细胞。
1.4.3反转录PCR方法检测MagT1 mRNA表达 Trizol法提取大鼠心肌组织总RNA,使用2%琼脂糖凝胶电泳检验总RNA条带的完整性。使用紫外分光光度计检测总RNAOD260/280吸光度比值(比值大于1.8为合格),并计算总RNA浓度。按照反转录PCR试剂盒操作说明书进行反转录和PCR反应,以人β-actin为内参,MagT1引物序列为5′-GAA GCA GCC AAG CAC AGT TTG TAG-3′,5′-CAA TAT CCA TGT CAG AGG CAG CA-3′ ;β-actin引物序列为5′-GGA GAT TAC TGC CCT GGC TC CTA-3′,5′-GAC TCA TCG TAC TCC TGC TTG CTG-3′。扩增条件为95 ℃预变性3 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,共计30个循环;72 ℃延伸10 min,最后使用琼脂糖凝胶电泳检验结果。本研究使用反转录PCR方法检测0 d(刚出生)、21 d(哺乳期结束)和63 d(性成熟)3个不同发育时期的大鼠心肌细胞中MagT1的mRNA表达水平,使用反转录RCR方法对siRNA转染48和60 h的大鼠心肌细胞MagT1 mRNA沉默效率进行检测。
1.4.4Western blot方法检测MagT1蛋白质表达 使用1 mL组织裂解液作用于100 mg大鼠心肌组织,取得总蛋白质,考马斯亮蓝法检测蛋白质浓度。按5∶1比例混入6倍浓度的上样缓冲液,煮沸5 min使蛋白质变性,进行聚丙烯酰胺凝胶电泳(5%浓缩胶,电压80 V,时间1 h;12%分离胶,电压120 V,直至电泳结束)。蛋白质分离后,使用180 mA转膜2 h,将蛋白质转至 PVDF膜上。膜置于Western封闭液(3% BSA TBST中)中处理1 h,然后置于纯化的一抗稀释液(1∶1 000)中室温孵育2 h或4 ℃过夜。TBST清洗后,将膜置于二抗稀释液(1∶3 000)中,室温孵育1 h。使用X光片取得印迹结果,并采用Quantity One 扫描软件分析相对灰度值。本研究使用Western blot方法对siRNA转染48和60 h的大鼠心肌细胞MagT1蛋白质沉默效率进行检测。
1.4.5Mag-indo-1检测心肌细胞内Mg2+浓度变化 Mag-indo-1是一种特异性的Mg2+荧光探针,可以检测细胞内Mg2+浓度变化。6孔板中用盖玻片进行心肌细胞爬片,24 h后转染MagT1 siRNA,过48 h或60 h向含盖玻片孔中加入Mag-indo-1和D-Hanks混合液,然后放于37 ℃、5% CO2培养箱中孵育1 h。将盖玻片倒置放于滴好甘油的载玻片上,在荧光显微镜下拍照,最后使用Image J软件对细胞荧光照片进行半定量分析。本研究使用Mag-indo-1免疫荧光方法对siRNA转染48和60 h后的大鼠心肌细胞Mg2+浓度进行检测。
1.4.6流式细胞仪检测细胞凋亡 使用AnnexinⅤ-FITC/PI试剂盒对各实验组细胞进行染色,使用流式细胞仪对细胞的凋亡情况进行检测。贴壁心肌细胞用不含乙二胺四乙酸(EDTA)的胰酶收集;用磷酸盐缓冲液(PBS)洗涤细胞2次(2 000 r/min离心5 min)收集(1~5)×105个细胞;加入500 μL的Annexin Ⅴ Binding Buffer悬浮细胞;加入5 μL Annexin Ⅴ-FITC混匀后,加入5 μL Propidium Iodide,混匀避光、室温反应10 min;用流式细胞仪检测(Ex=488 nm;Em=530 nm)细胞凋亡情况。本研究使用流式细胞法对siRNA转染48和60 h后的大鼠心肌细胞细胞凋亡率进行检测。
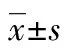
2 结 果

A:大鼠心肌细胞;B:大鼠心肌细胞α-actin蛋白质免疫荧光;C:大鼠心肌细胞DAPI免疫荧光
图1大鼠心肌细胞免疫荧光图
2.1大鼠心肌细胞存活度、形态和纯度检测 点数400个细胞进行台盼蓝染色,染色细胞数量为31个,细胞存活率为92.25%(369/400)。细胞未贴壁时呈圆形。2 h后细胞开始贴壁,初期呈梭形,之后进行舒展。24 h后全部贴壁,呈梭形、菱形或多角形,大部分进行搏动。72 h后形成细胞簇,搏动同步化,每分钟65~85次。心肌细胞纯度免疫反应结果显示,心肌细胞呈绿色荧光,成纤维细胞无荧光,见图1。在荧光显微镜下点数染色的细胞,计算纯度。选取了10个不同视野,每个视野点数200个细胞。而2 000个细胞中被染色的细胞有1 932个,即心肌细胞纯度为96.60%(1 932/2 000)。
2.2不同时期大鼠心肌细胞MagT1 mRNA表达情况 0、21和63 d大鼠心肌细胞中MagT1 mRNA表达水平差异无统计学意义(P>0.05),见图2。
2.3siRNA沉默大鼠心肌细胞MagT1并检测沉默效率 siRNA转染心肌细胞48 h后,MagT1 mRNA的沉默效率为51.83%,MagT1蛋白质的沉默效率为56.75%。转染60 h后,MagT1 mRNA的沉默效率为86.91%,MagT1蛋白质的沉默效率为83.85%,差异均有统计学意义(P<0.05),见图3。
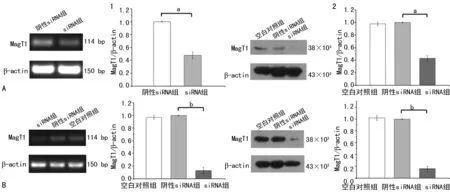
2.4大鼠心肌细胞MagT1沉默后细胞内Mg2+浓度检测 siRNA转染大鼠心肌细胞48和60 h后,胞内Mg2+浓度分别降低29.13%和41.32%,差异均有统计学意义(P<0.05),见图4。

A:大鼠心肌细胞MagT1 mRNA 的反转录PCR分析;B:大鼠心肌细胞MagT1 mRNA 表达
图2 0、21、63 d大鼠心肌细胞MagT1 mRNA的表达情况
A:转染48 h;B:转染60 h;1:MagT1 mRNA沉默情况;2:MagT1蛋白质沉默情况;a:P<0.05;b:P<0.01
图3 siRNA转染心肌细胞48和60 h后的MagT1 mRNA和蛋白质沉默效率
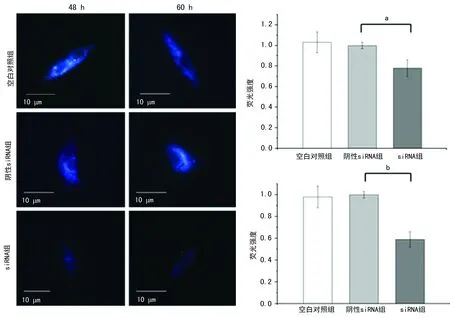
2.5大鼠心肌细胞MagT1沉默后细胞凋亡检测 siRNA转染大鼠心肌细胞48 h后,空白对照组和阴性siRNA组的细胞凋亡率分别是2.86%和3.09%,差异无统计学意义(P>0.05);而siRNA组的细胞凋亡率(31.18%)比阴性siRNA组显著增高,差异均有统计学意义(P<0.05),见图5。siRNA组细胞的密度和体积小于空白对照组和阴性siRNA组,折光性降低,伪足变细,搏动节律降为每分钟30~50次,见图6。
siRNA转染大鼠心肌细胞60 h后,空白对照组和阴性siRNA组的细胞凋亡率分别是5.77%和5.48%,差异无统计学意义(P>0.05);而siRNA组的细胞凋亡率(40.61%)比阴性siRNA组显著增高,差异均有统计学意义(P<0.05),见图5。另外siRNA组细胞的密度和体积更小,结构更紧密,搏动节律降为每分钟20~30次,见图6。
a:P<0.05,b:P<0.01
图4 siRNA转染心肌细胞48和60 h后细胞内Mg2+浓度变化

a:P<0.05;b:P<0.01
图5 siRNA转染大鼠心肌细胞48和60 h后的凋亡检测图
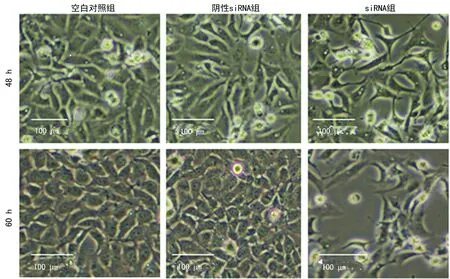
图6 siRNA转染大鼠心肌细胞48和60 h后的细胞形态图
3 讨 论
与其他原代大鼠心肌细胞培养方法[27-28]相比,从新生乳大鼠、清洗液种类、胰酶浓度、胶原酶配比组成、胎牛血清浓度和细胞混液离心时间等方面进行轻微改良,得到了存活率和纯度高、生命活动强的细胞。在不同发育时期的大鼠心肌细胞中,MagT1表达水平差异无统计学意义(P>0.05),说明MagT1有可能在心肌细胞起着稳定而重要作用。
本研究设计并合成了MagT1 siRNA后,先经过预实验,选出沉默效果最好的1对siRNA[25]。根据siRNA说明书和其他研究情况,选取了转染48和60 h两个时间点进行MagT1的沉默情况检测,发现转染48 h后心肌细胞MagT1蛋白质被沉默了56.75%,而60 h后MagT1蛋白质被沉默了83.85%,达到了预定的目标,为后续的实验进行奠定了基础。
ZHOU等[13]使用siRNA显著降低HEK-293T细胞中MagT1表达水平,当胞外具有相同的Mg2+浓度(10 mmol/L)时,MagT1 siRNA处理过的细胞中游离Mg2+浓度会比阴性siRNA对照组减少50%~60%。本研究与ZHOU等[13]结果相似,发现显著沉默MagT1后,大鼠心肌细胞内的Mg2+浓度显著降低。TASHIRO等[29]使用缺镁食物喂养大鼠4~6周后,与对照组相比,缺镁大鼠血清Mg2+总浓度显著降低,心室肌细胞膜上包括MagT1在内的5种Mg2+通道或转运体表达都有所上调,使心室肌细胞内Mg2+浓度无显著降低。本课题组与TASHIRO等[29]研究结果共同说明MagT1在维持心肌细胞内Mg2+稳态起着重要作用。
以斑马鱼为实验动物的研究中,MagT1蛋白质表达显著下降,会影响胚胎细胞的正常功能及生存[13]。与ZHOU等[13]结果相似,本研究发现大鼠心肌细胞中的MagT1被显著沉默后,细胞凋亡率显著升高,细胞形态和搏动也出现了异常,说明MagT1对心肌细胞的生存与正常生命活动产生了很大影响。推测这种现象可能是由于MagT1被显著下调,导致大鼠心肌细胞内的Mg2+浓度显著降低,从而导致细胞的生存与正常生命活动被影响,这有待于进一步研究。
综上所述,siRNA有效沉默大鼠心肌细胞MagT1,使细胞内Mg2+浓度显著下降、细胞凋亡率显著上升,对细胞生存和正常生命活动有较大影响为今后探索心肌细胞内Mg2+浓度变化与凋亡的关系和MagT1沉默诱导的心肌凋亡机制奠定了实验基础。
[1]DELVA P.Magnesium and cardiac arrhythmias[J].Mol Aspects Med,2003,24(1):53-62.
[2]KUNUTSOR S K,KHAN H,LAUKKANEN J A.Serum Magnesium and risk of new onset heart failure in men:the kuopio ischemic heart disease study[J].Eur J Epidemiol,2016,31(10):1035-1043.
[3]DAS U N.Nutritional factors in the prevention and management of coronary artery disease and heart failure[J].Nutrition,2015,31(2):283-291.
[4]JIANG L,HE P,CHEN J,et al.Magnesium levels in drinking water and coronary heart disease mortality risk:a meta-analysis[J].Nutrients,2016,8(1):5.
[5]KIEBOOM B C,NIEMEIJER M N,LEENING M J,et al.Serum Magnesium and the risk of death from coronary heart disease and sudden cardiac death[J].J Am Heart Assoc,2016,5(1):e002707.
[6]LEE S Y,HYUN Y Y,LEE K B,et al.Low serum Magnesium is associated with coronary artery calcification in a Korean population at low risk for cardiovascular disease[J].Nutr Metab Cardiovasc Dis,2015,25(11):1056-1061.
[8]CHUBANOV V,FERIOLI S,WISNOWSKY A,et al.Epithelial Magnesium transport by TRPM6 is essential for prenatal development and adult survival[J].Elife,2016,5:e20914.
[9]HUGUET F,CALVEZ M L,BENZ N,et al.Function and regulation of TRPM7,as well as intracellular Magnesium content,are altered in cells expressing F508-CFTR and G551D-CFTR[J].Cell Mol Life Sci,2016,73(17):3351-3373.
[10]TSAO Y T,SHIH Y Y,LIU Y A,et al.Knockdown of SLC41A1 Magnesium transporter promotes mineralization and attenuates Magnesium inhibition during osteogenesis of mesenchymal stromal cells[J].Stem Cell Res Ther,2017,8(1):39.
[11]SHINDO Y,YAMANAKA R,SUZUKI K,et al.Altered expression of Mg2+transport proteins during Parkinson′s disease-like dopaminergic cell degeneration in PC12 cells[J].Biochim Biophys Acta,2016,1863(8):1979-1984.
[12]GOYTAIN A,QUAMME G A.Identification and characterization of a novel mammalian Mg2+transporter with channel-like properties[J].BMC Genomics,2005,6:48.
[13]ZHOU H,CLAPHAM D E.Mammalian MagT1 and TUSC3 are required for cellular Magnesium uptake and vertebrate embryonic development[J].Proc Natl Acad Sci U S A,2009,106(37):15750-15755.
[14]ZHENG J,MAO X,LING J,et al.Role of Magnesium transporter subtype 1 (MagT1) in the osteogenic differentiation of rat bone marrow stem cells[J].Biol Trace Elem Res,2016,171(1):131-137.
[15]YU Y,JIN G,XUE Y,et al.Multifunctions of dual Zn/Mg ion co-implanted Titanium on osteogenesis,angiogenesis and bacteria inhibition for dental implants[J].Acta Biomater,2017,49:590-603.
[16]MOLEE P,ADISAKWATTANA P,REAMTONG O,et al.Up-regulation of AKAP13 and MAGT1 on cytoplasmic membrane in progressive hepatocellular carcinoma:a novel target for prognosis[J].Int J Clin Exp Pathol,2015,8(9):9796-9811.
[17]WILLIS S,VILLALOBOS V M,GEVAERT O,et al.Single gene prognostic biomarkers in ovarian cancer:a meta-analysis[J].PLoS One,2016,11(2):e0149183.
[18]SCHLEGEL R N,CUFFE J S,MORITZ K M,et al.Maternal hypomagnesemia causes placental abnormalities and fetal and postnatal mortality[J].Placenta,2015,36(7):750-758.
[19] TRAPANI V,SHOMER N,RAJCAN-SEPAROVIC E.The role of MAGT1 in genetic syndromes[J].Magnes Res,2015,28(2):46-55.
[20]LI F Y,CHAIGNE-DELALANDE B,RAO V K,et al.Clinical utility gene card for:X-linked immunodeficiency with Magnesium defect,epstein-barr virus infection,and neoplasia (XMEN)[J].Eur J Hum Genet,2015,23(6):889.
[21]LENARDO M,LO B,LUCAS C L.Genomics of immune diseases and new therapies[J].Annu Rev Immunol,2016,34:121-149.
[22]SORTE H S,OSNES L T,FEVANG B,et al.A potential founder variant in CARMIL2/RLTPR in three Norwegian families with warts,molluscum contagiosum,and T-cell dysfunction[J].Mol Genet Genomic Med,2016,4(6):604-616.
[23]BES S,ROUSSEL P,LAUBRIET A,et al.Influence of deep hypothermia on the tolerance of the isolated cardiomyocyte to ischemia-reperfusion[J].J Mol Cell Cardiol,2001,33(11):1973-1988.
[24]WU Y,SHI X,LI Y,et al.Carbon nanohorns promote maturation of neonatal rat ventricular myocytes and inhibit proliferation of cardiac fibroblasts:a promising scaffold for cardiac tissue engineering[J].Nanoscale Res Lett,2016,11(1):284.
[25]HUBER S A.T cells expressing the gamma delta T cell receptor induce apoptosis in cardiac myocytes[J].Cardiovasc Res,2000,45(3):579-587.
[26]滕飞翔,吴隽松.siRNA抑制大鼠心肌细胞MagT1基因表达的研究[J].中国老年保健医学,2013,11(6):25-26.
[27]蒋学友,张丽,俞晨,等.SD乳鼠心肌细胞原代培养及纯化方法的优化探索[J].四川大学学报(医学版),2015,46(2):301-304.
[28]程俊,曾晓荣,谭晓秋,等.一种改良的原代大鼠乳鼠心肌细胞分离及培养方法[J].四川生理科学杂志,2016,38(4):187-189.
[29]TASHIRO M,INOUE H,KONISHI M.Magnesium homeostasis in cardiac myocytes of Mg-deficient rats[J].PLoS One,2013,8(9):e73171.
