侧脑室注射瘦素对2型糖尿病大鼠阿黑皮素原及神经肽Agouti相关蛋白的影响*
2018-01-29吕春凤李文化
董 迎,吕春凤,李文化
(天津市北辰医院内分泌科 300400)
瘦素是一种肽类蛋白质,由白色脂肪组织细胞分泌。上世纪50年代至今瘦素在机体代谢方面的获益被逐步证实。随着重组瘦素技术的发展,瘦素相关的基础及临床实验也有广泛开展。近期有研究证实低剂量瘦素在不减少动物进食量及体质量的情况下仍然会降低2型糖尿病大鼠血糖水平[1]。这项研究首次证实瘦素可独立于其对体质量及进食量的作用之外而调节血糖水平。在另外一项实验中未经瘦素治疗的肥胖大鼠在进食量与经瘦素治疗的大鼠相等的情况下并不能达到瘦素治疗组大鼠达到的控制血糖的水平[2]。有趣的是在1型糖尿病大鼠中,瘦素同样表现出了治疗糖尿病的作用[3-4],这表明瘦素独立于胰岛素之外的调节血糖的作用是通过中枢神经系统及其介质实现的[5]。
瘦素在大脑中调节抗2型糖尿病作用的特定区域在2005年首次被确定,该研究证实仅在下丘脑的弓状核(ARH)恢复瘦素表达可以降低肥胖,高胰岛素血症和严重高血糖大鼠的血糖水平,而不影响其进食量和体质量[6]。并且,仅在下丘脑的弓状核(ARH)的阿黑皮素原(POMC)分泌神经元选择性表达瘦素的情况下对瘦素缺乏的糖尿病大鼠便可达到显著的血糖控制效果[7]。这些结果证实ARH的POMC的表达是瘦素在2型糖尿病大鼠中抗糖尿病作用的重要途径[7]。另外,在野生型大鼠中选择性消除POMC的表达并未出现预期的严重高血糖表现[8]。这表明除POMC之外的其他分泌性神经元同样参与瘦素介导的血糖控制作用。ARH同时包含有与POMC类似的神经肽Agouti相关蛋白(AGRP)分泌神经元[6]。AGRP是中枢黑皮素系统中的重要的神经肽成分具有拮抗α-促黑素细胞激素与黑皮素受体4(MC4R)结合的作用[9]。这些受体在中枢神经体用的神经元中广泛表达,这些神经元通过轴突与POMC和AGRP表达神经元广泛连接,作为瘦素表达神经元的二阶神经元[10-11],MC4R的缺失在大鼠及人体都会引起肥胖[9]。本研究通过对2型糖尿病大鼠进行侧脑室瘦素注射,并随后进行空腹血糖、POMC及AGRP的测定,以观察瘦素在中枢神经系统中对上述神经递质的影响,进一步明确瘦素对2型糖尿病大鼠血糖控制作用的上游通路。
1 材料与方法
1.1材料
1.1.1实验动物 8周龄2型糖尿病SD雄性大鼠80只,购自北京华阜康生物科技股份有限公司[实验动物机构许可证号SCXK(京)2014-0004],平均体质量为(200±20)g。
1.1.2主要试剂 重组瘦素购自美国R&D Systems 公司;链脲佐菌素(STZ)美国SIGMA公司生产;大鼠POMC ELISA分析检测试剂盒及AGRP ELISA分析检测试剂盒购自德赛诊断(上海)有限公司。
1.2方法
1.2.12型糖尿病SD大鼠模型制备 健康雄性SD大鼠以高糖高脂饲料(10%猪油、20%蔗糖、10%蛋黄粉、0.5%胆酸钠、59.5%基础饲料)喂养,4周后腹腔注射STZ 30 mg/kg,继续高糖高脂饮食。4周以后断尾,便携式血糖仪测定大鼠尾尖血糖,选取空腹血糖持续1周稳定大于或等于16.7 mmol/L作为2型糖尿病模型,并同时观察大鼠是否出现多饮、多食、尿量增多、生长迟缓、身体消瘦等糖尿病症状[12]。
1.2.2实验分组 将大鼠分为侧脑室内注射瘦素组(n=40)和侧脑室内注射vehicle对照组(n=40)。
1.2.3侧脑室定位 以40 mg/kg剂量腹腔注射2%戊巴比妥钠,使各组大鼠麻醉。平整放好麻醉后大鼠,将其牙齿扣在齿杆上并扭紧鼻夹,耳杆插入双耳外耳道中,使两边耳杆刻度一致,固定好头部。适当调节大鼠身体高度,使大鼠身体和头部保持水平,并将其固定好。用棉球蘸取聚维酮碘消毒头部皮肤,眼科剪剪开头部皮肤并用手术刀片剥离骨膜,并用3%过氧化氢灼烧骨膜使冠状缝和矢状缝的交点(前囟)充分暴露,并用记号笔将此点标记[13]。根据Paxinos-Watson鼠脑定位图谱,以前囟为中心定好坐标,读取立体定位仪上读数并记录。调节 XYZ 轴至指定位点,使用记号笔将此点标记,见图1A。
1.2.4侧脑室注射瘦素 在上述指定的位点处使用电动颅骨钻将颅骨钻开一个直径约0.5 mm的小孔,见图1B。将已固定好位置的装有瘦素的微量进样器缓缓地插入到4.5 mm深度时停止。观察大鼠的呼吸情况,若没有异常情况把药物缓缓地注射完毕。瘦素注射剂量为5 μL/kg,对照组注射等剂量vehicle。注射完毕后停顿2 min,使得微量进样器中所有药物进入到大鼠脑内。慢慢地取出微量进样器,并使用聚羧酸锌水门汀封闭伤口,并以肌内注射3.2万单位/鼠青霉素进行抗感染治疗[14]。将已注射大鼠清醒后进行独笼饲养,术后12 h对其禁食但不禁水。
1.2.5血液样本 各组分别在造模后48 h并禁食4 h后剪尾取血4 mL,用Surestep Life scan血糖仪检测大鼠静脉血糖水平,剩余血样室温放置1 h后,以2 000 r/min离心10 min,分离血清,放置于-80 ℃的超低温冰箱中保存。按相应的血液指标检测试剂盒说明书测定各组POMC及AGRP。

A:使用脑立体定位仪将大鼠头部固定;B:使用微量进样器将瘦素注入大鼠侧脑室部位
图1侧脑室定位及注射瘦素
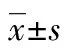
2 结 果
与对照组相比,侧脑室注射瘦素组大鼠平均空腹血糖为(35.40±3.02)mmol/L,显著低于对照组大鼠空腹血糖(39.62±2.66)mmol/L(t=1.548,P<0.05),侧脑室注射瘦素组大鼠血清POMC表达显著高于对照组(P<0.05),侧脑室注射瘦素组大鼠血清神经肽Agouti相关蛋白(AGRP)表达显著低于对照组(P<0.05),见图2、3。

图2 两组大鼠POMC水平比较

图3 两组大鼠AGRP水平比较
3 讨 论
尽管近年来糖尿病的治疗药物及手段都有了发展,且其就医渠道也得到了改善,但糖尿病患者仍面临血糖控制不理想、并发症较多、生活质量较差的问题[15-16],其心血管事件仍呈高发状态[17-18],美国有报道指出40%的糖尿病患者血糖没有得到良好控制[19]。尽管胰岛素的发展使1、2型糖尿病得到了良好控制,但这些药物并未重建糖尿病患者的代谢平衡,且随着治疗时间延长,还会带来严重的并发症状,所以,探讨一种新的平衡代谢的药物是很有必要的。
瘦素作为一种由脂肪组织产生、分泌的激素,可与中枢神经系统中的瘦素受体相结合激发一系列的下游效应以达到调节机体代谢的作用[20-21],位于第3脑室底部的弓状核在瘦素的能量代谢调节过程中发挥主要作用。弓状核含有两类不同的瘦索反应性一级神经元,即分泌神经肽Y(NPY)/AGRP神经元和POMC神经元,前者能增强食欲、抑制能量消耗,后者所分泌的POMC的降解产物α-黑色素细胞刺激素(α-MSH)可起到抑制食欲和促进能量消耗的作用。瘦素可抑制NPY/AGRP神经元产生和释放NPY、AGRP,另一方面则可促进POMC神经元产生和释放POMC,从而调节机体的能量代谢。本研究通过对进行脑室注射瘦素大鼠的2型糖尿病大鼠POMC及AGRP的测定,观察到瘦素在中枢神经系统中对上述神经递质的影响,进一步明确瘦素对2型糖尿病大鼠血糖控制作用的上游通路。进一步的分析瘦素-中枢神经系统-血糖通路相关分子机制显然是必要的,以进一步明确瘦素作用从而使其有机会开发为抗糖尿病治疗的新途径。
[1]PELLEYMOUNTER M A,CULLEN M J,BAKER M B,et al.Effects of the obese gene product on body weight regulation in ob/ob mice[J].Science,1995,269(5223):540-543.
[2]SCHWARTZ M W,BASKIN D G,BUKOWSKI T R,et al.Specificity of leptin action on elevated blood glucose levels and hypothalamic neuropeptide Y gene expression in ob/ob mice[J].Diabetes,1996,45(4):531-535.
[3]LIN C Y,HIGGINBOTHAM D A,JUDD R L,et al.Central leptin increases insulin sensitivity in streptozotocin-induced diabetic rats[J].Am J Physiol Endocrinol Metab,2002,282(5):1084-1091.
[4]CHINOOKOSWONG N,WANG J L,SHI Z Q.Leptin restores euglycemia and normalizes glucose turnover in insulin-deficient diabetes in the rat[J].Diabetes,1999,48(7):1487-1492.
[5]FUJIKAWA T,CHUANG J C,SAKATA I,et al.Leptin therapy improves insulin-deficient type 1 diabetes by CNS-dependent mechanisms in mice[J].Proc Nati Acad Sci USA,2010,107(40):17391-17396.
[6]COPPARI R,ICHINOSE M,LEE C E,et al.The hypothalamic arcuate nucleus:A key site for mediating leptin′s effects on glucose homeostasis and locomotor activity[J].Cell Metab,2005,1(1):63-72.
[7]HUO LIHONG,GAMBER K,GREELEY S,et al.Leptin-dependent control of glucose balance and locomotor activity by POMC neurons[J].Cell Metab,2009,9(6):537-547.
[8]BALTHASAR,NINA,COPPARI,et al.Leptin receptor signaling in POMC neurons is required for normal body weight homeostasis[J].Neuron,2004,42(6):983-991.
[9]CONE R D.Anatomy and regulation of the central melanocortin system[J].Nat Neurosci,2005,8(5):571-578.
[10]BAGNOL D,LU X Y,KAELIN C B,et al.Anatomy of an endogenous antagonist:relationship between Agouti-related protein and proopiomelanocortin in brain[J].J Neurosci,1999,19(18):RC26.
[11]KISHI T,ASCHKENASI C J,LEE C E,et al.Expression of melanocortin 4 receptor mRNA in the central nervous system of the rat[J].J Comp Neurol,2003,457(3):213-235.
[12]段薇,张学梅,于萌,等.2型糖尿病大鼠急性心肌缺血对心肌新生血管的影响[J].中华糖尿病杂志,2012,4(6):361-364.
[13]刘清忠,王大斌,韩丽梅,等.侧脑室注射丹参酮对脑瘫模型大鼠神经行为学的影响[J].中国中医急症,2016,25(7):1281-1284.
[14]李聃丹.侧脑室注射CART对T2DM大鼠胰岛素调节作用及机制初步研究[D].重庆:第三军医大学,2014.
[15]WISLICKI L.Diabetes mellitus and cancer[J].Eur J Int Med,1971,1(5744):245-252.
[16]MAZZONE T,CHAIT A,PLUTZKY J.Cardiovascular disease risk in type 2 diabetes mellitus:insights from mechanistic studies[J].Lancet,2008,371(9626):1800-1809.
[17]LARSEN J,BREKKE M,SANDVIK L,et al.Silent coronary atheromatosis in type 1 diabetic patients and its relation to long-term glycemic control[J].Diabetes,2002,51(8):2637-2641.
[18]ORCHARD T J,OLSON J C,ERBEY J R,et al.Insulin resistance-related factors,but not glycemia,predict coronary artery disease in type 1 diabetes:10-year follow-up data from the pittsburgh epidemiology of diabetes complications study[J].Diabetes Care,2003,26(5):1374-1379.
[19] HOERGER T J,SEGEL J E,GREGG E W,et al.Is glycemic control improving in U.S.adults?[J].Diabetes Care,2008,31(1):81-86.
[20]FRIEDMAN J M.Leptin at 14 years of age:an ongoing story[J].Am J Clin Nutr,2009,89(3):973-979.
[21]FLIER J S,MARATOS-FLIER E.Lasker lauds leptin [J].Cell,2010,143(1):9-12.
