γ-H2AX的表达对初诊多发性骨髓瘤患者的预后影响*
2018-01-29唐海龙董红娟顾宏涛舒汨汨白庆咸董宝侠陈协群高广勋
曹 春,徐 莉,冯 娟,唐海龙,董红娟,顾宏涛,舒汨汨,白庆咸, 梁 蓉,张 涛,杨 岚,董宝侠,陈协群,高广勋
(第四军医大学第一附属医院血液内科/中国人民解放军血液病专病中心,西安 710032)
多发性骨髓瘤(MM)是血液系统第二常见的恶性肿瘤,病理特点为骨髓中浆细胞恶性克隆并分泌大量免疫球蛋白或其片段(M蛋白),造成靶器官损害并引发相关临床表现。在新药时期,靶向治疗明显改善了患者的临床预后,但并不能完全治愈MM,大多数患者最终仍死于疾病的进展和复发[1]。虽然Durie-Salmon、国际分期体系(ISS)、R-ISS、mSmart等预后分期体系及危险分层体系目前已在临床用于患者的预后评估[2],但仍不能完全有效地评估患者预后。此外,随着对MM发病的分子生物学的研究不断深入,其他潜在预测患者预后的生物学标志也越来越受到关注。γ-H2AX是DNA双链断裂(DSB)的早期标志物,γ-H2AX灶是细胞老化和肿瘤发生的标志,由γ-H2AX蛋白在DSB位点上大量聚集而成[3]。有研究表明,在肿瘤增殖、浸润和转移过程中,γ-H2AX均扮演了相当重要的角色。更有研究发现,γ-H2AX表达增高与肿瘤患者的不良预后关系密切。因此本研究拟探究MM患者骨髓中γ-H2AX的表达情况及其与患者预后的关系。
1 资料与方法
1.1一般资料 选取2012年1月1日至2016年12月31日本院确诊的初诊MM患者为病例组,MM的诊断标准是中国MM工作组于2015年制定的《中国MM诊治指南》,在此之前的患者均依据2015年的指南来重新评估其病历及诊断,符合者纳入研究,并排除不符合者,疾病分期采用 2005年ISS系统。对照组则选择本院非造血系统肿瘤者经骨髓细胞涂片和活检均显示其造血系统无明显异常者。所有MM患者及对照者均在取骨髓活检组织前均已签署知情同意书。
1.2方法
1.2.1临床和病理资料的收集 (1)一般人口学资料:性别,年龄,联系方式等;临床检查资料:血常规、血生化、免疫球蛋白系列、免疫固定电泳、乳酸脱氢酶(LDH)、β2微球蛋白(β2-MG)、血清游离轻链、X射线、磁共振(MRI)、正电子发射计算机断层显像(PET-CT)等;细胞、分子遗传学资料:流式细胞学和FISH结果;治疗:治疗方案和疗效评估。(2)病理资料:收集病例组MM患者和对照者的骨髓活检标本。
1.2.2免疫组织化学检测γ-H2AX在骨髓中的表达 (1)石蜡包埋组织切片,烤片2 h;(2)二甲苯梯度乙醇常规脱蜡至水;(3)柠檬酸钠100 ℃水浴修复抗原20 min,磷酸缓冲盐溶液(PBS)冲洗5 min×3次;(4)3%的过氧化氢阻断30 min,PBS冲洗5 min×3次,山羊血清封闭2 h;(5)兔抗人γ-H2AX多克隆抗体(Abcam,ab2893,1∶1 000)4 ℃过夜,PBS冲洗5 min×3次,SP-9001兔SP试剂盒(北京中杉金桥)中生物素标记的二抗室温孵育2 h,PBS冲洗5 min×3次,辣根过氧化物酶标记的链霉卵白素室温孵育2 h,PBS冲洗5 min×3次;(6)二氨基联苯胺(DAB)显色(北京中杉金桥),苏木素复染,0.5%盐酸乙醇分化;(7)梯度乙醇脱水,二甲苯透明;(8)树胶封片。
1.2.3免疫组织化学结果判读 每张切片随机取5个尽可能避开骨髓间质部分的视野(×400),采用显微成像系统(Olympus bx50)拍摄照片,然后利用 Image-ProPlus6.0(IPP)图像分析系统对图片进行分析,测量每张照片的累积光密度值(integral optical density,IOD),并计算其平均光密度(mean density,MD)值,MD=IOD/区域面积×5,表示每个测试者骨髓组织中γ-H2AX的相对表达量。再分别计算病例组和对照组所有入组患者MD的均值,分别用MD1和MD2表示,比较其γ-H2AX表达的差异性。对于病例组患者,根据MD1值将其分为两组,一组为γ-H2AX相对表达量大于或等于MD1所代表的患者,定义为γ-H2AX强表达组;另一组为γ-H2AX表达量小于MD1者,定义为γ-H2AX弱表达组。
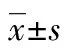
2 结 果
2.1一般临床资料的统计 病例组共入组102例初诊MM患者,其中男61例,女41例,中位发病年龄为56.5(32~77)岁;对照组32例,其中男15例,女17例,中位年龄35.5(23~65)岁。病例组患者ISS分期:Ⅰ期18例,Ⅱ期34例,Ⅲ期50例;M蛋白分型:IgG型42例,IgA型26例,IgD1例,IgM1例,λ轻链型24例,κ轻链型8例;LDH均值为(178.6±79.6)μmol/L。FISH结果采用2015年国际MM工作组(IMWG)分类标准,将FISH-MM系列阴性视为正常组,48例;探针检测到del(17p),t(4;14)(p16;q32)或t(14;16)(q32;q23)易位中任何一项视为高危组,10例;介于两者之间为标危组,44例。入组患者治疗方案及治疗效果见表1,连续4个疗程治疗结束后根据 IMWG 疗效标准评估疗效反应将部分缓解(PR)及其以上的治疗效果视为治疗有效,其余记为疗效欠佳,治疗的总体有效率为61.8%。对入组患者电话随访至2016年12月31日,75人存活,27人死亡,中位生存时间为23(6~51)个月。
2.2γ-H2AX在病例及对照组间的表达 病例组及对照组骨髓中均可见γ-H2AX的表达,阳性细胞表达定位在细胞核内,表现为棕色、棕黄色或黄色的颗粒物质。病例组γ-H2AX表达的MD值为(6.78±3.47),对照组为(1.10±0.83),病例组MM患者的γ-H2AX表达明显强于对照组(P<0.05),见图1。
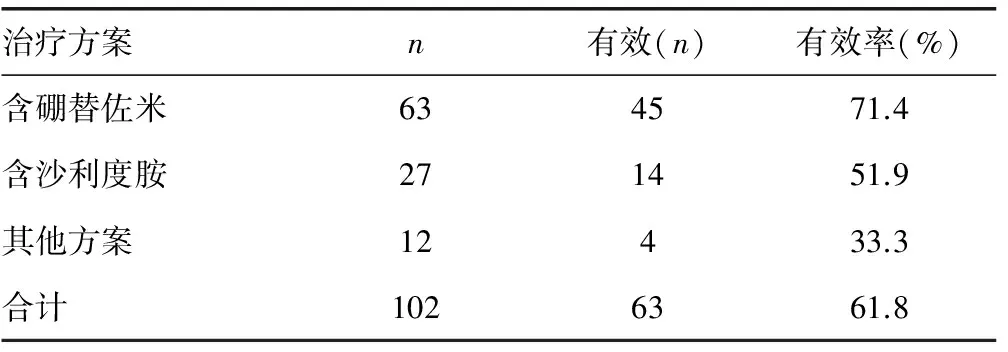
表1 各诱导方案的治疗效果
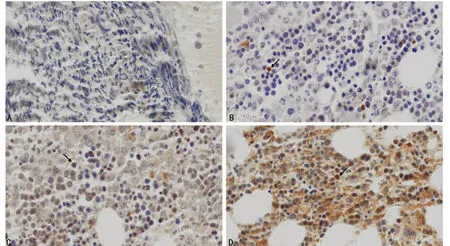
A:对照组γ-H2AX的IHC染色;B、C、D:病例组患者γ-H2AX的IHC染色;B:γ-H2AX弱表达组;C、D:γ-H2AX强表达组
图1 γ-H2AX在不同骨髓组织中的表达情况(×400)
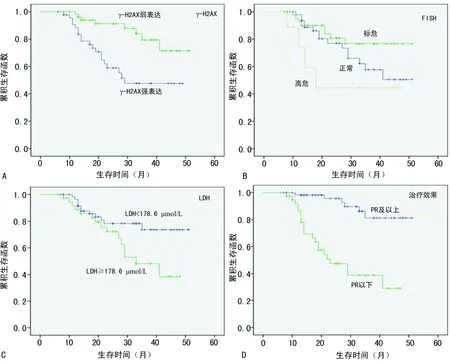
A:γ-H2AX染色结果;B:FISH结果;C:LDH水平;D:治疗效果对患者生存时间的影响
图2患者生存曲线与各影响因素的关系
2.3γ-H2AX的表达与患者临床特征间的关系 γ-H2AX蛋白的表达与患者的年龄、性别、疾病类型、疾病分期及FISH结果等均无明显相关性(P>0.05),见表2。
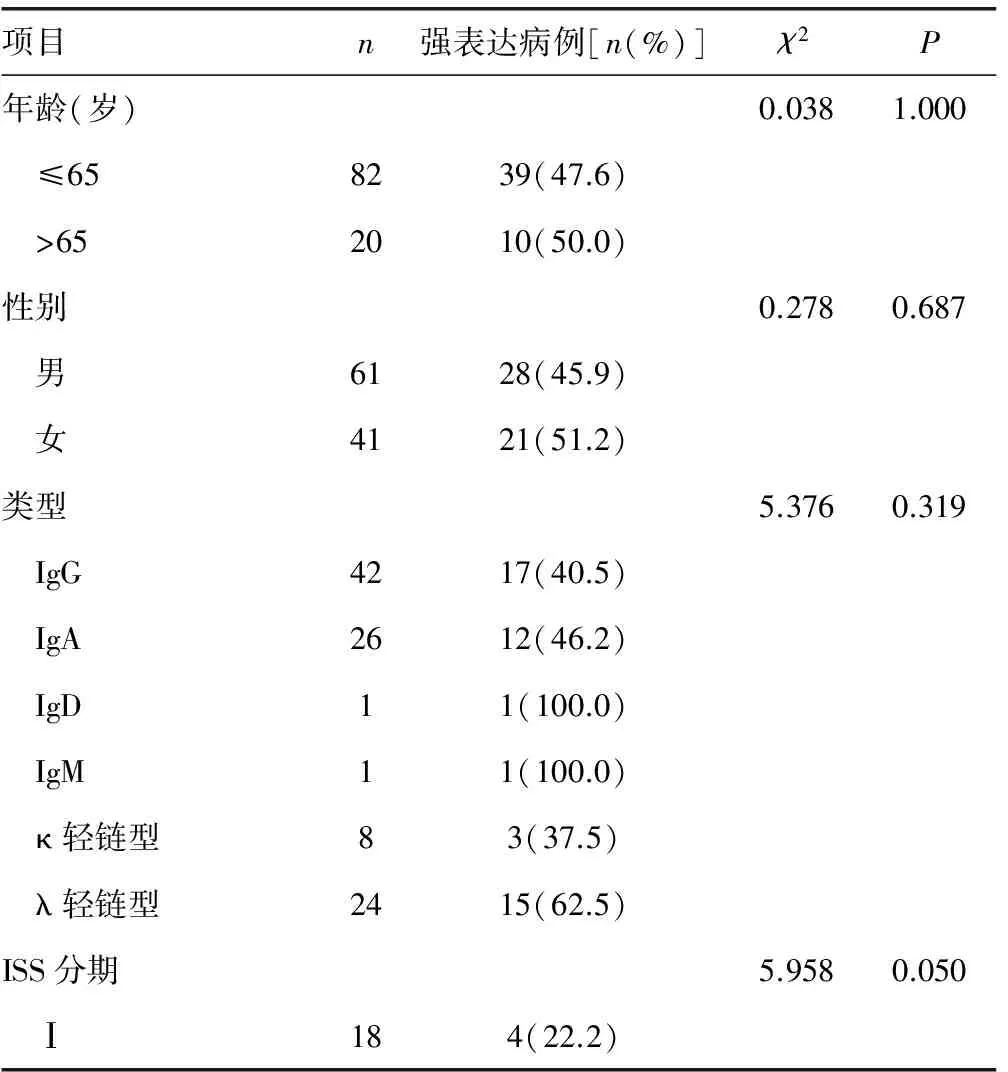
表2 γ-H2AX的表达与MM患者不同临床病理特征的关系
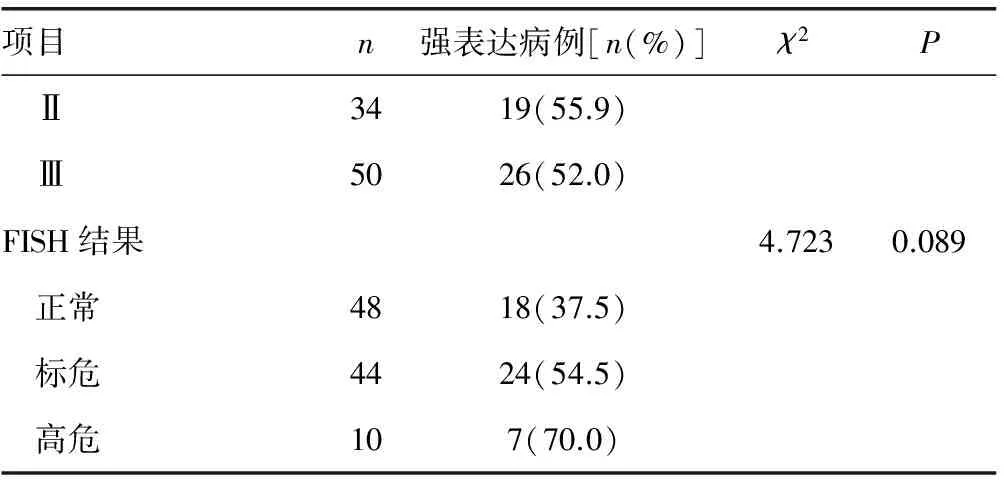
续表2 γ-H2AX的表达与MM患者不同临床病理特征的关系
2.4γ-H2AX的表达与MM患者预后的关系 由Kaplan-Meier生存曲线图和Log-rank检验的单因素分析可知患者的LDH水平、FISH结果、治疗效果和γ-H2AX染色结果都是影响患者平均存活时间的因素(P<0.05);而年龄、性别和ISS分期则与其平均存活时间无明显相关(P>0.05),见表3、图2。
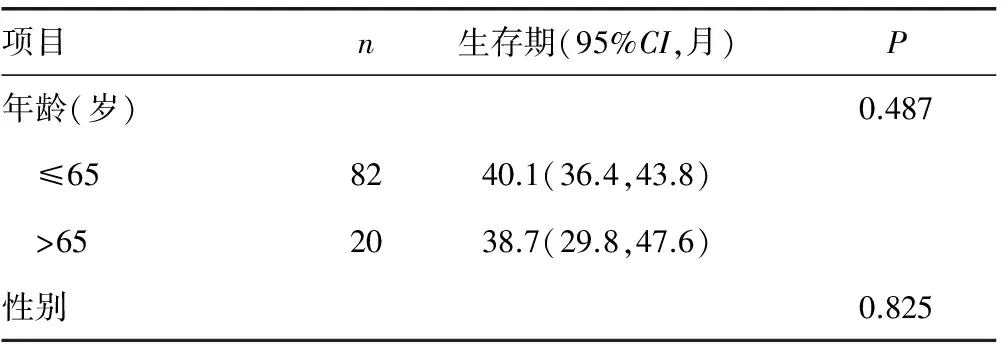
表3 MM患者生存的Log-rank单因素分析
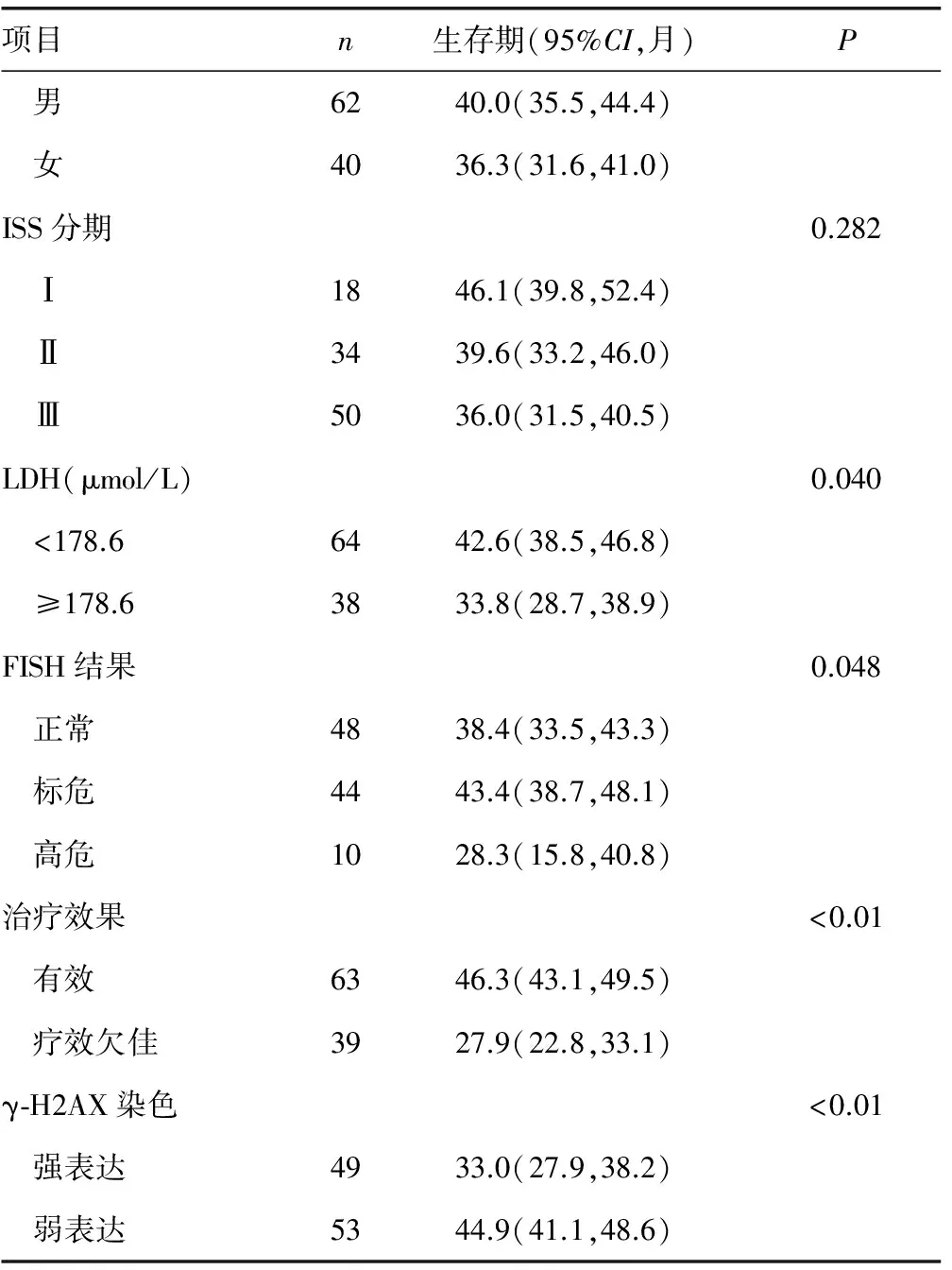
续表3 MM患者生存的Log-rank单因素分析
2.5影响患者生存的多因素分析 为进一步探讨上述各因素是否为患者的独立预后因素,Cox比例风险回归模型的多因素分析显示,FISH结果和LDH水平不作为患者的预后独立危险因素(P>0.05),而γ-H2AX染色结果和治疗效果均与患者的预后相关(P<0.05)。即γ-H2AX的高表达与患者的不良预后有关,可作为患者预后的独立相关因素,见表4。
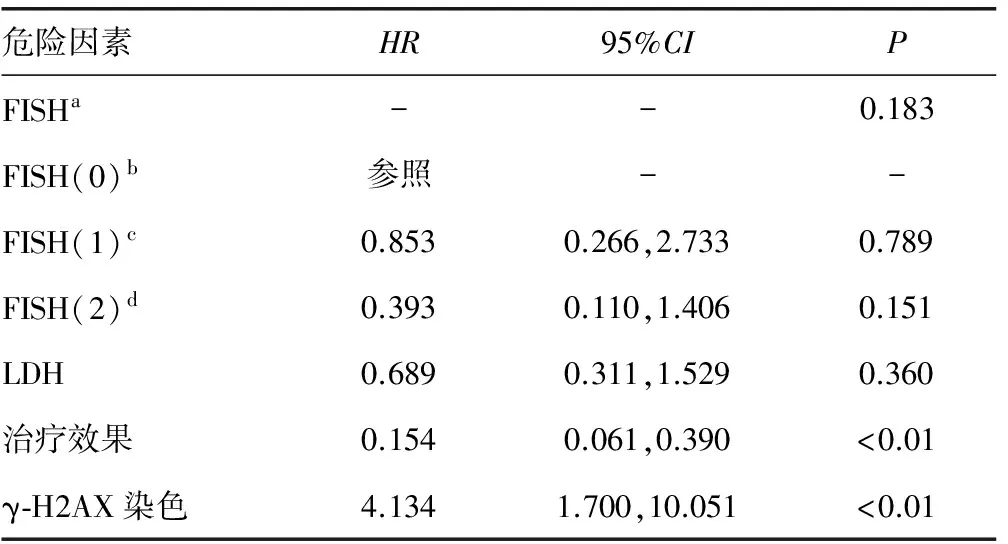
表4 影响患者生存的多因素分析
a:所有FISH结果对患者的生存影响分析;b:正常组FISH结果作为参照;c:标危组和正常组FISH结果比较后对患者的生存影响分析;d:高危组和正常组FISH结果比较后对患者的生存影响分析
3 讨 论
MM患者的临床表现多样,预后差异也较大。从发病到病程演变,MM细胞不断接受来自骨髓微环境中各种因子的刺激,相互作用下可调整MM细胞的功能状态并介导促肿瘤生长因子的产生,如白细胞介素6(IL-6)和胰岛素样生长因子(IGF-1)等,因此针对MM细胞及其所处环境的一些生物因子的变化研究,更能解释疾病的发展与转归[4-5]。
γ-H2AX是细胞发生DSB后,H2AX组蛋白上的第139位的丝氨酸发生磷酸化而形成的,因此是DSB的早期标志物。外源性或内源性损伤造成DSB后,γ-H2AX的修复作用重大,它可阻滞细胞周期诱导细胞凋亡并促进DNA修复,保持基因的稳定性。而未被修复或错误修复的细胞则可能会发生细胞凋亡、突变或转变为肿瘤细胞。未完全修复的细胞,其γ-H2AX灶将进一步扩大。一般内源性γ-H2AX灶在正常人原代细胞和组织中很少表达,但在肿瘤细胞和癌前病变中,即使无外源性DSB,也可检测到高水平的γ-H2AX[6-7]。有研究者发现黑色素瘤、结肠癌、骨肉瘤、纤维肉瘤和宫颈癌等癌组织中γ-H2AX表达增高,这预示着γ-H2AX与肿瘤的发生密切相关[8]。MATSUDA等[9]研究发现肝癌的癌前病变组织内γ-H2AX表达增加,是预测肝癌发生的重要生物学事件;另有研究发现BRCA1/ BRCA2突变的输卵管上皮细胞(此类细胞高风险向肿瘤细胞转变)中γ-H2AX异常高表达[10]。以上均提示DNA损伤反应在肿瘤的发生中扮演重要角色。本研究中γ-H2AX的半定量工作由IPP软件完成,因γ-H2AX表达于细胞核,所以IPP识别图中所有细胞核部位的着色,但未区分MM细胞和其他基质细胞,因此γ-H2AX的表达量是指患者发生MM后骨髓中γ-H2AX表达的整体情况。结果显示病例组和对照组的骨髓组织中均有γ-H2AX的表达,但γ-H2AX在MM患者骨髓中的表达明显强于对照组,这一结果与上述基础结论相符,说明γ-H2AX的高表达是随MM发生而出现的。单克隆免疫球蛋白疾病(MGUS)可向MM高风险转化,被认为是MM的癌前病变,γ-H2AX在其骨髓中是否同样高表达,尚未可知。
此外,γ-H2AX与肿瘤的发展和预后也关系密切。THANAN等[11]研究发现部分CD133和Oct3/4阳性的胆管癌患者,γ-H2AX大量表达,从而造成细胞基因组失稳定,使肿瘤的侵袭性增强。OKA等[12]发现在结肠癌进展的过程中,由氧化、复制和机械应力引起的DNA损伤反应(DDR)始终处于激活状态,但由DDR引发的肿瘤细胞凋亡却极少,相反,γ-H2AX的表达却持续维持在较高水平,提示γ-H2AX的高表达与结肠癌的不良预后有关。在部分临床预后较差的三阴性乳腺癌患者的病理组织中也可检测到大量表达的γ-H2AX[13]。另有研究证明γ-H2AX是非小细胞肺癌患者的独立预后危险因素,γ-H2AX高表达患者的生存时间相对较短;对术后喉部鳞状细胞癌患者的预后研究也得出了同样的结论[8,14-15]。
以上研究说明γ-H2AX的高表达与肿瘤的发生、发展及预后密切相关。本研究已经明确MM患者的γ-H2AX表达高于对照者,为进一步探讨γ-H2AX与MM患者预后的关系,分析了γ-H2AX的表达与患者的临床病理特征之间的关系,结果显示γ-H2AX在不同年龄和不同性别的患者中的表达差异无统计学意义(P>0.05),在不同疾病类型、分期及不同遗传学分层的患者中的表达差异无统计学意义(P>0.05)。单因素分析显示γ-H2AX高表达与MM患者的生存时间呈负相关关系;多因素分析进一步提示γ-H2AX的高表达是MM患者生存时间的独立危险因素。
综上所述,γ-H2AX在MM患者的骨髓组织中的表达水平增高,且γ-H2AX的强表达与MM患者的生存时间呈负相关,预示患者较差的临床结局,因此γ-H2AX的表达升高可能是影响MM患者生存的不良预后因素。
[1]ROLLIG C,KNOP S,BORNHAUSER M.Multiple myeloma[J].Lancet,2015,385(9983):2197-2208.
[2]PALUMBO A,AVETLOISEAU H,OLIVA S,et al.Revised international staging system for multiple myeloma:a report from international myeloma working group[J].J Clin Oncol,2015,33(26):2863.
[3]PODHORECKA M,SKLADANOWSKI A,BOZKO P.H2AX phosphorylation:its role in DNA damage response and cancer therapy[J].J Nucl Aci,2010,2010(1):286-293.
[4]MAHTOUK K,MOREAUX J,HOSE D,et al.Growth factors in multiple myeloma:a comprehensive analysis of their expression in tumor cells and bone marrow environment using affymetrix microarrays[J].BMC Cancer,2010,10(1):1-18.
[5]SPRYNSKI A C,HOSE D,CAILLOT L,et al.The role of IGF-1 as a major growth factor for myeloma cell lines and the prognostic relevance of the expression of its receptor[J].Blood,2009,113(19):4614-4626.
[6]SEDELNIKOVA O A,BONNER W M.γ-H2AX in cancer cells:a potential biomarker for cancer diagnostics,prediction and recurrence[J].Cell Cycle,2006,5(24):2909-2913.
[7]OLIVE P L,BANUELOS C A,DURAND R E,et al.Endogenous and radiation-induced expression of gamma-H2AX in biopsies from patients treated for carcinoma of the uterine cervix[J].Radiother Oncol,2009,94(1):82-89.
[8]ZHANG J,CHENG L,ZHOU L.Prognostic significance of γ-H2AX in laryngeal squamous cell carcinoma after surgery[J].Chin Med J,2014,127(14):2664-2667.
[9]MATSUDA Y,WAKAI T,KUBOTA M,et al.DNA damage sensor γ -H2AX is increased in preneoplastic lesions of hepatocellular carcinoma[J].Sci World J,2013,2013(3):597095.
[10]STAFF S,TOLONEN T,LAASANEN S L,et al.Quantitative analysis of γ-H2AX and p53 nuclear expression levels in ovarian and fallopian tube epithelium from risk-reducing salpingo-oophorectomies in BRCA1 and BRCA2 mutation carriers[J].Inte J Gynecol Pathol,2014,33(3):309-316.
[11]THANAN R,PAIROJKUL C,PINLAOR S,et al.Inflammation-related DNA damage and expression of CD133 and Oct3/4 in cholangiocarcinoma patients with poor prognosis[J].Free Radi Biol Med,2013,65(4):1464-1472.
[12]OKA K,TANAKA T,ENOKI T,et al.DNA damage signaling is activated during cancer progression in human colorectal carcinoma[J].Cancer Biol Ther,2010,9(3):246-252.
[13]NAGELKERKE A,VAN KUIJK S J,SWEEP F C,et al.Constitutive expression of γ-H2AX has prognostic relevance in triple negative breast cancer[J].Radiother Oncol,2011,101(1):39-45.
[14]MATTHAIOS D,FOUKAS P G,KEFALA M,et al.γ-H2AX expression detected by immunohistochemistry correlates with prognosis in early operable non-small cell lung cancer[J].Onco Ther,2012,5:309-314.
[15]CHATZIMICHAIL E,MATTHAIOS D,BOUROS D,et al.γ-H2AX:a novel prognostic marker in a prognosis prediction model of patients with early operable non-small cell lung cancer[J].Int J Genomics,2014,2014(2):160236.
