基于表达谱芯片筛选鸡不同部位皮肤组织差异表达基因
2018-01-26姬改革束婧婷单艳菊屠云洁刘一帆巨晓军邹剑敏
姬改革,束婧婷,单艳菊,章 明,屠云洁,刘一帆,巨晓军,邹剑敏
(江苏省家禽科学研究所,江苏省家禽遗传育种重点实验室,扬州 225125)
我国居民对鸡肉的传统消费一直是以活鸡为主,具有良好肌肉品质的地方品种鸡在活鸡市场占有绝对优势。然而,自2013年以来,H7N9(H5N6)病毒反复来袭,政府出于对公共卫生安全的考虑,会暂时性的或者永久关闭活禽交易市场,提倡以冷鲜、冷冻的方式销售禽类产品,给以活鸡方式上市交易的优质肉鸡产业带来了毁灭性的打击。在屠宰上市后,原本能代表地方品种优势的外观性状如羽色等将不复存在,胴体外观的均一度、皮肤弹性和颜色、皮肤厚度以及毛囊直径、密度的大小等会受到越来越多的关注。
毛囊是动物皮肤重要而复杂的附属器官,其发生发育依赖于上皮细胞和真皮间充质细胞间的相互作用来实现[1]。关于其中存在的信号分子的研究,大多集中在哺乳动物。已发现皮肤毛囊的发育受到多个信号分子及信号通路的协同调控,是一个复杂的分子调控过程。基因组表达谱芯片技术可用来在全基因组水平上比较不同生理过程同一组织或者不同组织中差异表达基因,进一步挖掘和筛选出与性状相关的信号通路和关键基因,应用广泛。在羊上,表达谱芯片技术被用来筛选影响羊毛纤维直径性状的差异表达基因[2]和不同毛囊发育阶段的差异基因表达[3]。在禽类,陈兴勇等[4]采用表达谱芯片技术检测鹅换羽前后的差异表达基因,筛选与羽绒再生相关的重要基因。目前,在禽类皮肤毛囊方面的研究,主要集中在在肤色、羽色和产绒性能方面,如J. Q.Zhang等[5]采用转录组测序技术比较不同肤色鸡(白色皮肤和黑色皮肤)个体皮肤组织基因表达差异,筛选出影响色素沉着的主要调控基因;高广琦[6]]利用转录组测序技术检测与鸡羽毛色素沉着有关的基因;L. Zhang等[7]采用高通量测序技术检测鸭不同羽区(正羽和绒羽)皮肤毛囊的miRNA表达谱等,但是关于鸡皮肤厚度、毛囊密度和直径方面的研究较少,利用表达谱芯片技术鉴别影响不同部位皮肤厚度、毛囊直径和密度等差异候选基因的研究还未见报道。
本试验采用Agilent鸡全基因组表达谱芯片对鸡不同部位(背部和腿部)的皮肤毛囊进行差异表达基因筛选,通过对差异基因进行GO、KEGG信号通路以及蛋白表达网络分析,研究影响鸡不同部位皮肤毛囊性状的主效基因和可能的分子机制,为筛选影响鸡皮肤外观胴体性状的候选基因和冷鲜鸡新品系选育提供理论依据。
1 材料与方法
1.1 试验动物
试验动物来源于江苏省家禽科学研究所与常州立华公司联合培育的处于上市日龄(63日龄)的冷鲜鸡配套组合,随机选择处于上市日龄的4只鸡(公母各半)进行屠宰,屠宰后分别立即检测背部和腿部2 cm×2 cm内皮肤毛囊的数目,并分别采集约2 cm×2 cm大小的背部和腿部皮肤样品,其中,背部皮肤样品采集以背部正中线为轴,分左右两侧;腿部采集大腿部皮肤作为样品。将左侧背部皮肤样品和大腿部皮肤样品置于10%甲醛溶液中固定,用来检测毛囊直径和皮肤厚度,右侧背部皮肤样品和大腿部皮肤样品迅速置于液氮速冻,然后转入-80 ℃冰箱保存,用于RNA抽提和芯片分析。
1.2 皮肤毛囊性状测定
毛囊密度检测:对背部左侧和腿部皮肤2 cm×2 cm内毛囊进行计数(个·cm-2)。
皮肤厚度检测:用游标卡尺测定10%甲醛固定液中采集到的皮肤样品的厚度(mm),每个样品测定3次,求平均值。
毛囊直径检测:对采集到的10%甲醛固定液中的皮肤毛囊样品进行测定,每个样品随机挑选3~4个完整毛囊,采用游标卡尺测定毛囊直径,每个毛囊测定3~4次,计算平均值(mm)。
1.3 RNA提取、质量检测及纯化
采用RNA提取试剂盒提取皮肤组织总RNA(Applied Biosystems,AM1561);利用NanoDrop ND-2000 (Thermo Scientific)定量并经Agilent Bioanalyzer 2100(Agilent Technologies)检测RNA完整性;质检合格后使用RNeasy Mini Kit(QIAGEN,74106)纯化总RNA。
1.4 芯片杂交
所用芯片为Agilent公司的鸡全基因组4×44 K芯片(Design ID:026441)。参照Agilent公司表达谱芯片标准流程,将8个皮肤组织样本(背部和腿部皮肤各4个)的总RNA反转录成双链cDNA,进一步合成用Cyanine-3-CTP(Cy3)标记的cRNA,纯化后在60 ℃温浴30 min进行片段化,加入2× GEx Hybridization Buffer混匀,上芯片杂交。洗脱后利用Agilent Scanner G2505C (Agilent Technologies)扫描,分辨率
为5 μm,扫描仪自动以100%和10%PMT各扫描1次,2次结果Agilent软件可自动合并。采用Feature Extraction软件(version10.7.1.1, Agilent Technologies)处理原始图像提取原始数据。接着利用Genespring软件(version13.1, Agilent Technologies)进行quantile标准化和后续处理。标准化后的数据进行过滤,在用于比较的每组样本中至少有1组100%标记为Detected的探针留下进行后续分析。
1.5 芯片数据分析
利用T检验的P值和倍数变化值进行差异基因筛选,筛选的标准为上调或者下调倍数变化值(Fold change)的绝对值≥2.0且P≤0.05。功能富集分析和调控通路分析以鸡的注解信息为依据,采用GOEAST软件,对上调和下调的差异表达基因进行基因功能分类(Gene ontology, GO),得到差异表达基因参与的所有GO;基于KEGG数据库(http://www.genome.jp/kegg/),利用Fisher精确检验和卡方检验对差异表达基因参与的Pathway进行显著性分析,计算各通路中基因富集的显著程度,按照P<0.05进行筛选,得到显著性的GO和Pathway。STRING数据库是一个搜寻已知蛋白质之间和预测蛋白质之间相互作用的数据库,利用在线STRING软件(http://string-db.org/),基于鸡的数据库,对部分差异表达基因进行蛋白网络分析,查询这些基因之间的相互作用关系,下载STRING网站的相互作用关系对,采用cytoscape3.3软件绘制蛋白之间的相互作用网络关系图。
1.6 荧光定量PCR
选取5个差异表达基因,以ACTB作为内参基因,采用SYBR Green I法进行荧光实时定量PCR反应,以验证芯片结果的可靠性。根据GenBank中的基因序列设计引物,引物运用Primer 5.0软件进行设计(引物序列见表1),采用Trizol法提取背部和腿部皮肤总RNA(TIANGEN,DP424),采用反转录试剂盒(TIANGEN,KR106-02)进行cDNA合成,然后用SYBR Green 试剂盒(QIAGEN,208054)在Max3000P荧光定量PCR仪(爱普拜斯)上进行荧光定量PCR验证试验。每个样品设置3个重复。相对定量的结果采用2-ΔΔCt法进行计算。
表1荧光定量PCR引物
Table1Primersequencesusedforq-PCR

基因名称Genename上游引物(5'-3')Forwardprimer下游引物(5'-3')Reverseprimer产物大小/bpProductlengthSHHTTGGTACTCACGGCTCCTCTAACACTCTGTCTCTGTCCC122BMP8BTACTCAGCCTACTACTGCGACACGTTGTTGTTGCTGTC186IGF1CCACAAGGGAATAGTGGATGACAGAGCGTGCAGATTTAGG101PPP1R3CGATACATGGAAGACTTACACGGGCAGGAGGCAAGTCAATAG104PTPRMCATTCGTCGATTTGTAGCTCTGCATAGTTCGATACTCCAACC111ACTBTGCTGTGTTCCCATCTATCGTTGGTGACAATACCGTGTTCA150
2 结 果
2.1 鸡背部与腿部皮肤毛囊性状比较
对鸡的背部和腿部皮肤毛囊性状进行比较,结果见表2,背部和腿部皮肤在皮肤厚度、毛囊密度和直径方面都表现出显著差异。皮肤厚度方面是背部皮肤厚度极显著高于腿部(P<0.01),毛囊密度同样是背部皮肤毛囊密度极显著高于腿部(P<0.01),而背部皮肤毛囊直径则极显著低于腿部(P<0.01)。
2.2 鸡背部与腿部皮肤中的差异表达基因筛选及荧光定量PCR验证
采用Agilent鸡全基因组表达谱芯片比较鸡的背部和腿部皮肤组织基因表达谱差异,共发现差异倍数在2倍及以上的基因676个(|FC|≥2,P<0.05),以腿部皮肤作为参照,背部皮肤中上调基因223个,下调基因453个。基于已发表的文献报道,找到了一些与皮肤、毛囊生长发育相关的重要基因,详见表3。以腿部皮肤为对照,背部皮肤中PTPRM、ROR2、S100B、DKK1、SOX18、IGF1、PPP1R3C等基因的表达是上调的,而KRTAP10-4、EREG、WNT3A、FGF1、FZD5、BMP8B、FOXN1、DLX3、PCDH7、SHH等基因的表达是下调的。
表2鸡不同部位皮肤毛囊性状比较
Table2Comparisonofskincharacteristicsatdifferentskinpositionsofchicken
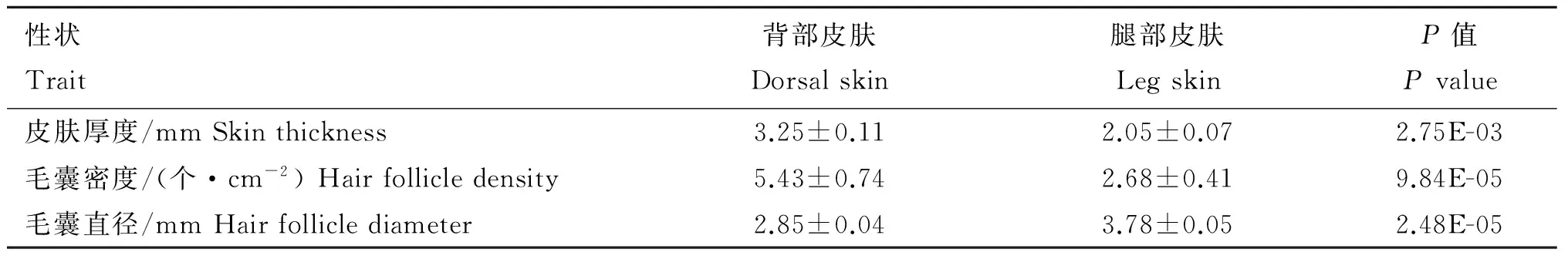
性状Trait背部皮肤Dorsalskin腿部皮肤LegskinP值Pvalue皮肤厚度/mmSkinthickness3.25±0.112.05±0.072.75E-03毛囊密度/(个·cm-2)Hairfollicledensity5.43±0.742.68±0.419.84E-05毛囊直径/mmHairfolliclediameter2.85±0.043.78±0.052.48E-05
表3鸡不同部位皮肤组织部分差异表达基因
Table3Partialdifferentiallyexpressedgenesatdifferentskinpositionsofchicken
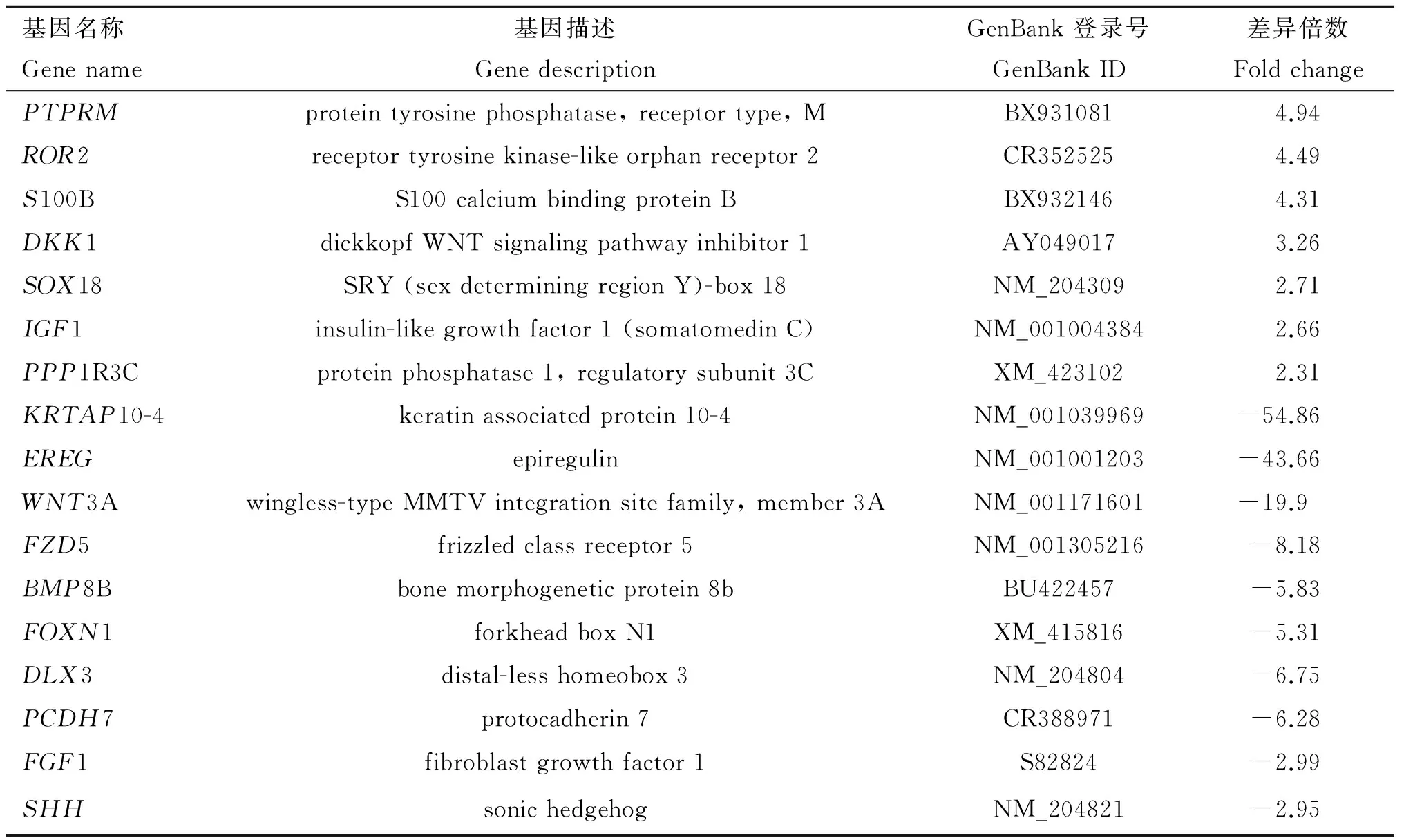
基因名称Genename基因描述GenedescriptionGenBank登录号GenBankID差异倍数FoldchangePTPRMproteintyrosinephosphatase,receptortype,MBX9310814.94ROR2receptortyrosinekinase-likeorphanreceptor2CR3525254.49S100BS100calciumbindingproteinBBX9321464.31DKK1dickkopfWNTsignalingpathwayinhibitor1AY0490173.26SOX18SRY(sexdeterminingregionY)-box18NM_2043092.71IGF1insulin-likegrowthfactor1(somatomedinC)NM_0010043842.66PPP1R3Cproteinphosphatase1,regulatorysubunit3CXM_4231022.31KRTAP10-4keratinassociatedprotein10-4NM_001039969-54.86EREGepiregulinNM_001001203-43.66WNT3Awingless-typeMMTVintegrationsitefamily,member3ANM_001171601-19.9FZD5frizzledclassreceptor5NM_001305216-8.18BMP8Bbonemorphogeneticprotein8bBU422457-5.83FOXN1forkheadboxN1XM_415816-5.31DLX3distal-lesshomeobox3NM_204804-6.75PCDH7protocadherin7CR388971-6.28FGF1fibroblastgrowthfactor1S82824-2.99SHHsonichedgehogNM_204821-2.95
在筛选到的差异表达基因中,随机挑选了5个进行荧光定量PCR验证,其中上调的3个(IGF1、PPP1R3C、PTPRM),下调的2个(BMP8B、SHH),结果见表4。5个差异表达基因在荧光定量PCR的检测结果与芯片中检测到的变化趋势相同,说明芯片检测结果是可信的。
2.3 鸡不同部位皮肤差异表达基因的GO功能分类
对差异表达基因进行GO(Gene ontology)功能注释,共发现51个显著性GO(P<0.05),主要分为生物学过程(32个显著性GO)、细胞组分(13个显著性GO)、分子功能(6个显著性GO)3个方面。在生物学过程方面,如表5所示,上调的差异表达基因主要富集在凋亡过程的负调控,上皮细胞增殖的正调控作用、正调控血管生成、细胞增殖的正调控、神经元凋亡过程的负调控等;下调的差异表达基因主要富集在Wnt信号通路、神经元分化、细胞间黏附调节、细胞命运的确定、轴突导向等。
表4芯片结果与荧光定量PCR结果的比较
Table4ComparisonofresultsatmRNAlevelsofeachgenebetweenmicroarrayandqRT-PCR

基因Gene芯片Microarray荧光定量qRT-PCR差异倍数(背皮/腿皮)Foldchange(Dorsalskin/Legskin)P值Pvalue差异倍数(背皮/腿皮)Foldchange(Dorsalskin/Legskin)P值Pvalue表达调节RegulationBMP8B-5.830.0361.050.051下调IGF12.660.0221.550.042上调PPP1R3C2.310.0384.120.025上调PTPRM4.940.0371.790.039上调SHH-2.950.0064.860.027下调
表5差异表达基因富集的GO生物学过程分析
Table5AnalysisofGObiologicalprocessofdifferentiallyexpressedgenesenrichment
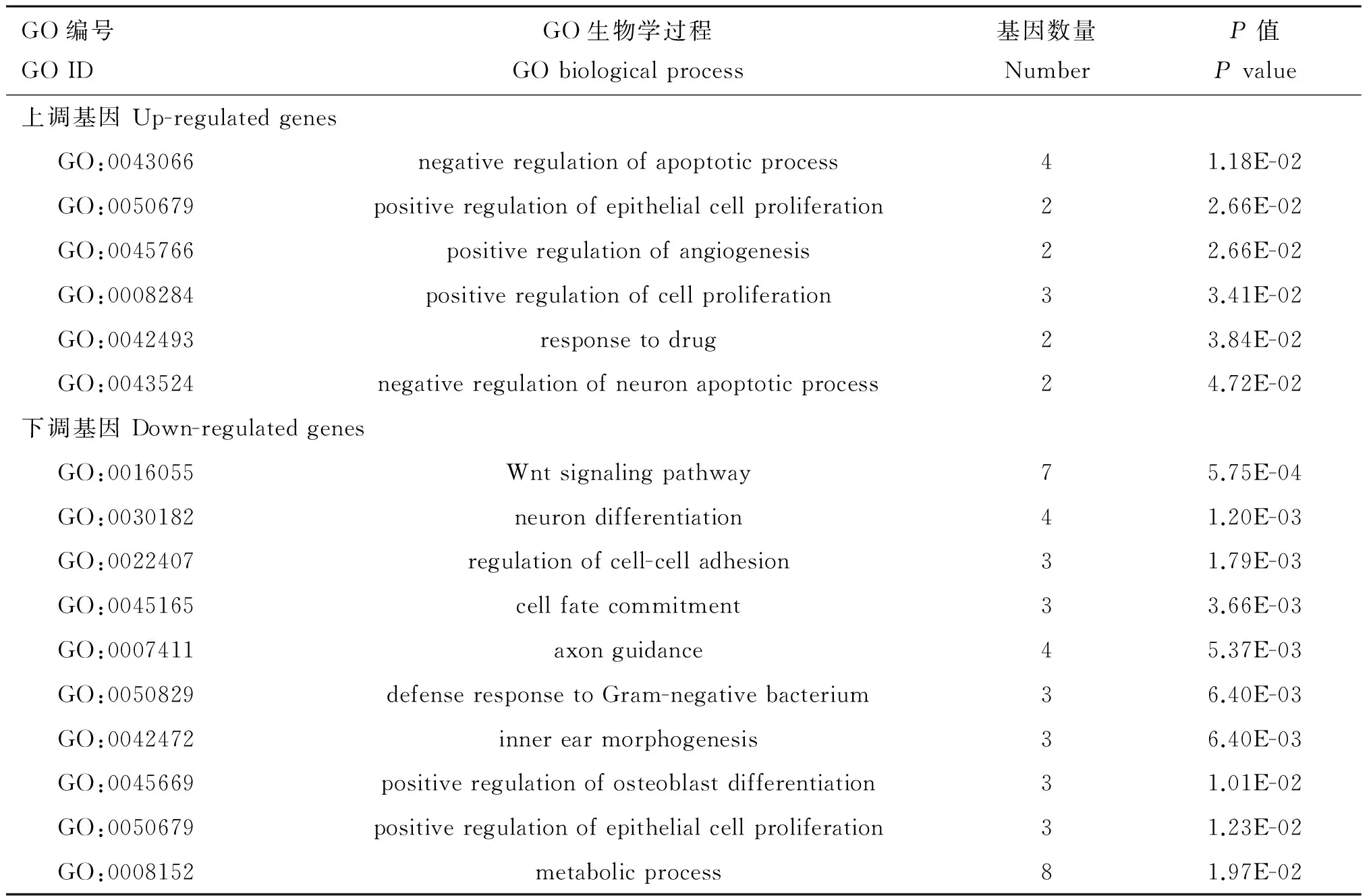
GO编号GOIDGO生物学过程GObiologicalprocess基因数量NumberP值Pvalue上调基因Up-regulatedgenesGO:0043066negativeregulationofapoptoticprocess41.18E-02GO:0050679positiveregulationofepithelialcellproliferation22.66E-02GO:0045766positiveregulationofangiogenesis22.66E-02GO:0008284positiveregulationofcellproliferation33.41E-02GO:0042493responsetodrug23.84E-02GO:0043524negativeregulationofneuronapoptoticprocess24.72E-02下调基因Down-regulatedgenesGO:0016055Wntsignalingpathway75.75E-04GO:0030182neurondifferentiation41.20E-03GO:0022407regulationofcell-celladhesion31.79E-03GO:0045165cellfatecommitment33.66E-03GO:0007411axonguidance45.37E-03GO:0050829defenseresponsetoGram-negativebacterium36.40E-03GO:0042472innerearmorphogenesis36.40E-03GO:0045669positiveregulationofosteoblastdifferentiation31.01E-02GO:0050679positiveregulationofepithelialcellproliferation31.23E-02GO:0008152metabolicprocess81.97E-02
2.4 鸡不同部位皮肤差异表达基因的信号通路分析
利用KEGG数据库对差异表达基因进行信号通路分析,结果如表6所示。上调的差异表达基因主要参与细胞外基质(Extracellular matrix,ECM)受体相互作用、黏着、细胞黏附分子(CAMs)、淀粉蔗糖代谢、血管平滑肌收缩、ABC转运蛋白和泛酸和辅酶A的生物合成等。下调的差异表达基因被富集到多条信号通路,包括黑色素生成、过氧化物酶体、咖啡因的代谢、Hedgehog信号通路、肌动蛋白细胞骨架调节、PPAR信号通路、Wnt信号通路、脂肪酸代谢、MAPK信号通路、黏合连接以及背腹轴的形成、ErbB信号通路等。
表6差异表达基因富集的KEGG途径分析
Table6KEGGpathwayanalysisofdifferentiallyexpressedgenesenrichment

KEGG编号KEGGID通路名称Termdescription基因数目NumberP值Pvalue上调基因Up-regulatedgenesgga04512ECM-receptorinteraction71.30E-04gga04510Focaladhesion91.89E-03gga04514Celladhesionmolecules(CAMs)68.01E-03gga00500Starchandsucrosemetabolism31.87E-02gga04270Vascularsmoothmusclecontraction52.06E-02gga02010ABCtransporters32.14E-02gga00770PantothenateandCoAbiosynthesis22.60E-02下调基因Down-regulatedgenesgga04916Melanogenesis111.49E-04gga04146Peroxisome101.89E-04gga00232Caffeinemetabolism31.27E-03gga04340Hedgehogsignalingpathway63.59E-03gga04810Regulationofactincytoskeleton129.40E-03gga03320PPARsignalingpathway61.18E-02gga04310Wntsignalingpathway91.40E-02gga01212Fattyacidmetabolism51.40E-02gga04520Adherensjunction62.13E-02gga04010MAPKsignalingpathway123.27E-02gga04320Dorso-ventralaxisformation33.61E-02gga04012ErbBsignalingpathway63.68E-02
2.5 鸡不同部位皮肤差异表达基因的蛋白调控网络分析
为了进一步了解差异表达基因之间的调控网络关系,我们从差异表达的基因中选择了一些差异倍数比较大、GO和KEGG信号通路分析中发现的或已知的与皮肤毛囊生长发育相关的基因,通过STRING软件查询这些基因间的相互作用关系,下载相互作用关系对,并采用cytoscape3.3软件绘制蛋白网络关系图,将游离的分支网络去掉,重点关注差异表达基因的主网络关系图(图1)。从图中可以看出,下调的差异表达基因(绿色)在关系网络图中占比例较高。Wnt信号通路中的WNT3A、WNT4、WNT6、FZD3、FZD5、FZD10等大都表现为下调,DKK1、IGF1、DRD4等表现为显著上调。SHH、WNT3A、FGF1、DKK1、IGF1、WNT6等基因的色块比较大,说明在网络中这些基因与周边的基因联系较多,在网络中的重要程度也大。SLC6A4、SLC1A3、SLC5A1、SLC13A1、SLC15A1等多个溶质载体家族的成员也出现在网络图中。

红色表示上调蛋白,绿色表示下调蛋白,色块的大小表示在网络中与周边蛋白联系程度的多少up-regulated proteins are showed in red, down-regulated proteins are showed in green. The color intensity indicate its degree of association with the surrounding proteins in the network图1 部分差异表达基因构建的蛋白调控网络Fig.1 Partial differentially expressed genes constructing a regulatory network of proteins
3 讨 论
3.1 不同部位皮肤毛囊差异表达基因筛选
不同部位皮肤的毛囊因为着生的毛发类型、发生的早晚、所处周期等的不同,形态和分布上可能会有所差别。本研究通过对处于上市日龄的商品代肉鸡的背部和腿部皮肤厚度、毛囊密度和直径进行比较,发现背部皮肤厚度显著高于腿部,与乌仁套迪等[8]的研究结果基本一致,可能与背部皮下脂肪的沉积要明显多于腿部皮肤有关。单位面积内的毛囊密度同样是背部皮肤显著高于腿部,毛囊直径则是腿部皮肤显著高于背部。X. Y.Chen等[9]研究认为,不同品种鸡同一部位皮肤毛囊密度和直径的差异,与耐热性有关。生活在热带地区的鸡背部皮肤毛囊密度显著低于温带,而直径则显著高于温带地区的鸡种。不同部位的皮肤毛囊密度和直径的差异可能是为了平衡整体散热,以应对高温天气,是动物为了适应生活环境而长期进化的结果。对于冷鲜上市的优质鸡,皮肤毛囊密而细,更易受到消费者的青睐。因此,利用鸡全基因组表达谱芯片技术筛选毛囊密度和直径具有显著差异的不同部位皮肤毛囊的差异表达基因,探索对毛囊密度等性状具有重要影响的功能基因,为优质鸡胴体外观性状遗传改良提供参考。
课题组前期采用多因素方差分析发现,同一部位皮肤组织的皮肤厚度、毛囊密度和直径在不同性别间差异均不显著,因此将公母联合在一起进行分析。以腿部皮肤为对照,以组间2倍差异为标准,筛选到676个差异表达基因。随机选取其中的5个基因进行荧光定量PCR验证,与芯片结果的变化趋势基本一致,说明芯片得出的结果是可信的。部分差异表达基因如PTPRM[10]、EREG[11]、S100B[12]、IGF1[13]、SOX18[14]、FGF1[15]、DLX3[16]等已被报道分布在皮肤、毛囊组织中,在皮肤毛囊的发育和周期变化中具有重要作用。GO生物学过程分析发现,上调的差异表达基因主要富集在细胞增殖的正调控作用、凋亡过程的负调控、神经元凋亡过程的负调控等。下调的差异表达基因主要富集在Wnt信号通路、神经元分化、细胞间黏附调节、细胞命运的确定、轴突导向等。不同部位皮肤毛囊的发育、分布等很大程度上都要受到神经活动的支配,发育过程中存在于真皮细胞和上皮细胞之间大量的信号分子通过复杂的相互作用共同调节细胞群体的增殖和分化,因此与神经活动、黏附及调控细胞增殖与凋亡等生物学过程有关的基因都被富集到。
本研究中,KEGG信号通路分析结果显示,上调的基因主要参与ECM受体相互作用、黏着、细胞黏附分子(CAMs)、糖代谢和转运等信号通路,推测不同部位皮肤毛囊性状的差异,可能与所处的周围环境有关,细胞与细胞之间及细胞与细胞外基质之间相互作用的信号分子表达的上调,增加了背部皮肤厚度和毛囊密度。T.X. Jiang等[17]的研究发现,黏附分子是独立调节,并在皮肤附属物的形态发生不同阶段做出贡献。下调的差异表达基因参与的信号通路,常见的如Wnt信号通路、Hedgehog信号通路,MAPK信号转导通路都被富集到,其中Wnt信号通路是目前研究最多的,被认为在毛囊的发生发育和分化中起重要的作用[18]。Hedgehog信号通路[19]、MAPK信号通路、PPAR信号通路、ErbB信号通路等在哺乳动物上已有报道与毛囊的生长发育相关[2,20]。除了常见的通路外,咖啡因的代谢、肌动蛋白细胞骨架调控等信号通路也被富集到,这些信号通路与皮肤毛囊发育之间的关系目前研究较少。
3.2 与皮肤毛囊生长发育相关的差异表达基因
本研究基于GO和KEGG分析中发现的或者已有文献报道的与皮肤毛囊发育相关的基因,在STRING网站中的鸡数据库中查询这些基因之间的相互作用关系,绘制蛋白相互作用网络图。通过网络分析发现,下调的基因占比例较高,背部皮肤厚度、毛囊密度的增加可能与这些基因表达的下调有关;线条大都集中在Wnt家族基因附近(图1),代表有较多的证据支持这些蛋白间存在相互关系。从色块的大小来看,表达上调的DKK1、IGF1和表达下调的WNT3A、SHH等基因的色块较大,线条汇集多,彼此相互联系,说明这些基因与周边基因相互作用较强,起到主要调控作用,能够调控周边基因的表达,可能在不同部位皮肤厚度、毛囊密度和直径的表型性状差异方面具有重要的作用。
WNT3A属于Wnt基因家族,主要通过经典的Wnt信号通路起作用。经典的Wnt信号通路是通过与Frizzled、LRP等受体结合,调控β-catenin 磷酸化,使其在细胞内富集,激活下游靶基因的转录和表达,广泛参与了毛囊发生的各个阶段,尤其是起始阶段,如毛基板、真皮凝集、毛胚芽的形成等。在鼠上,WNT3A被报道在色素细胞和表皮干细胞的增殖与分化中起重要的作用[21-22]。WNT3A能够以剂量依赖的方式在毛囊不同的发育阶段起作用[23],在鼠生长期的毛囊能检测到WNT3A的高表达,在退化期表达会逐渐下降,在静止期的毛囊中,几乎检测不到WNT3A的表达。H. Shin等[24]用WNT3A处理在体外培养的人真皮乳头细胞,发现Lef1、PTGER2的表达量都出现显著升高,与本研究结果WNT3A表达量出现显著下调,Lef1、PTGER2出现下调的结果是一致的;同时发现FGF信号通路、BMP信号通路、胞外基质信号和受体的相关基因同样受到WNT3A不同程度的表达调控,与本研究中相关信号通路基因表达出现显著变化的结果是一致的。尽管WNT3A在Wnt信号通路中有重要的作用,但目前关于其对皮肤厚度、毛囊密度和直径影响的研究还很少。
DKK能够通过与Wnt信号通路受体LRP等的结合,抑制经典的Wnt信号通路的激活。鼠上的研究显示,DKK1能够通过对毛囊周期的调控,影响毛囊长度[25]。S. Sick等[26]研究发现,DKK和WNT通过反应扩散(Reaction-diffusion)机制决定毛囊之间的距离。M.X. Lei等[27]报道,在鼠毛囊再生过程中,注射DKK1会抑制毛囊的增大。提示,在本研究结果中,DKK1可能与Wnt信号通路的其他基因相互协调,在调节皮肤毛囊密度和直径大小方面具有重要的作用。
SHH是脊椎动物中编码Hedgehog蛋白的基因之一,在细胞增殖和真皮乳头的形成方面具有重要的作用[28]。在鸡胚中,过表达SHH能够使皮肤毛囊的极性发生改变[29]。在鼠上,WNT5A被认为是SHH的一个调控目标[30],本试验发现,背部皮肤中SHH表达量显著下调2.9倍,WNT5A的下游FOXN1表达显著下调5.3倍,同时发现调控FOXN1基因表达的ROR2显著上调4.5倍,这与鼠上敲除毛囊细胞中的ROR2,导致FOXN1基因表达显著下调,功能被抑制是相矛盾的[31]。物种不同基因的调控途径可能会存在差异。在禽类上,SHH可能存在于不同于哺乳动物的作用方式,调控鸡皮肤毛囊的生长发育。
胰岛素样生长因子1(Insulin-like growth factor-1,IGF1)是动物生长轴上的重要基因,能够通过影响毛囊细胞增殖和分化、组织重塑、调控毛囊的生长周期等,在毛囊的形态发生中具有重要的作用[13, 32]。敲除IGF1的受体IGF1R,皮肤的表皮厚度显著下调,但不会影响分化或凋亡[33]。过表达IGF1能够使新出生的小鼠皮肤异常变厚和毛囊发育提前[34]。与之相似,本研究中,IGF1在背部皮肤组织中的表达显著升高,提示IGF1可能在调节不同部位皮肤厚度和毛囊发育方面具有重要的作用。
溶质载体家族(Solute-carrier gene superfamily,SLC)是一个庞大的基因家族[35],主要编码膜转运蛋白,负责细胞膜上的几种物质如氨基酸、核酸、激素等的运输。本研究发现,筛选出的29个SLC家族基因,其中上调的有8个,下调的有21个。毛囊的发生发育离不开上皮和间充质细胞间的信号传递,推测分布于膜上的SLC家族相关基因的差异表达可能在不同部位皮肤毛囊的表型差异中具有重要的作用,将这些基因作为影响皮肤厚度、毛囊密度和直径等的候选基因进行深入的研究具有一定的意义。
4 结 论
本试验采用表达谱芯片技术,筛选出鸡不同部位(背部和腿部)皮肤组织中的差异表达基因676个,差异表达基因主要参与了细胞增殖和凋亡的正负调控、神经元的分化、细胞间黏附分子等生物学过程和ECM受体相互作用、黏着、Hedgehog、Wnt等信号通路;DKK1、WNT3A、SHH、FGF1、IGF1等基因可能是影响不同部位皮肤厚度、毛囊密度和直径出现显著差异的重要候选基因。
[1] RENDL M, POLAK L, FUCHS E. BMP signaling in dermal papilla cells is required for their hair follicle-inductive properties[J].GenesDev, 2008, 22(4): 543-557.
[2] 狄 江, 拉扎提·艾尼瓦尔, 徐新明, 等. 不同羊毛纤维直径细毛羊皮肤组织差异表达基因研究[J]. 畜牧兽医学报, 2013, 44(5): 681-689.
DI J, AINIWAER L Z T, XU X M, et al. Genome array on differentially expressed genes of skin tissue in fine wool sheep with different fiber diameter[J].ActaVeterinariaetZootechnicaSinica, 2013, 44(5): 681-689. (in Chinese)
[3] NORRIS B J, BOWER N I, SMITH W J M, et al. Gene expression profiling of ovine skin and wool follicle development using a combined ovine-bovine skin cDNA microarray[J].AustJExpAgric, 2005, 45(8): 867-877.
[4] 陈兴勇, 谢珊珊, 周 丽, 等. 皖西白鹅换羽前后基因表达谱差异分析[J]. 畜牧兽医学报, 2013, 44(7): 1030-1036.
CHEN X Y, XIE S S, ZHOU L, et al. Identification of differentially expressed genes in skin of Wanxi-white goose during regeneration of downy feather[J].ActaVeterinariaetZootechnicaSinica, 2013, 44(7): 1030-1036. (in Chinese)
[5] ZHANG J Q, LIU F Z, CAO J T, et al. Skin transcriptome profiles associated with skin color in chickens[J].PLoSOne, 2015, 10(6): e0127301.
[6] 高广琦. 基于红腹锦鸡基因组、转录组测序的羽毛色素调控机制研究[D]. 呼和浩特: 内蒙古大学, 2016.
GAO G Q. researches of plumage pigmentation based on golden pheasant genome and transcriptome sequencing[D]. Hohhot: Inner Mongolia University, 2016. (in Chinese)
[7] ZHANG L, NIE Q H, SU Y, et al. MicroRNA profile analysis on duck feather follicle and skin with high-throughput sequencing technology[J].Gene, 2013, 519(1): 77-81.
[8] 乌仁套迪, 巴 拉, 宝 迪. 河南斗鸡与艾维茵肉鸡皮肤厚度及羽密度的比较[J]. 中国家禽, 2013, 35(14): 50-51.
WURENTAODI, BALA, BAODI. Comparison of skin thickness and feather density between Henan Game Fowl and Avian broiler[J].ChinaPoultry, 2013, 35(14): 50-51. (in Chinese)
[9] CHEN X Y, JIANG R S, GENG Z Y. Differential effects of two indigenous broilers exposed to cold stress and characters of follicle density and diameter[J].ItalJAnimSci, 2011, 10(1): e8.
[10] PENG H, PARK J K, KATSNELSON J, et al. microRNA-103/107 family regulates multiple epithelial stem cell characteristics[J].StemCells, 2015, 33(5): 1642-1656.
[11] SIBILIA M, KROISMAYR R, LICHTENBERGER B M, et al. The epidermal growth factor receptor: from development to tumorigenesis[J].Differentiation, 2007, 75(9): 770-787.
[12] KIZAWA K, ITO M. Characterization of epithelial cells in the hair follicle with S100 proteins[M]//TURKSEN K. Epidermal Cells. New York: Humana Press, 2005: 209-222.
[13] WEGER N, SCHLAKE T. IGF-I signalling controls the hair growth cycle and the differentiation of hair shafts[J].JInvestDermatol, 2005, 125(5): 873-882.
[14] OLSSON J E, KAMACHI Y, PENNING S, et al.Sox18 expression in blood vessels and feather buds during chicken embryogenesis[J].Gene, 2001, 271(2): 151-158.
[15] NAKAYAMA F, HAGIWARA A, KIMURA M, et al. Evaluation of radiation-induced hair follicle apoptosis in mice and the preventive effects of fibroblast growth factor-1[J].ExpDermatol, 2009, 18(10): 889-892.
[16] HWANG J, MEHRANI T, MILLAR S E, et al. Dlx3 is a crucial regulator of hair follicle differentiation and cycling[J].Development, 2008, 135(18): 3149-3159.
[17] JIANG T X, CHUONG C M. Mechanism of skin morphogenesis. I. Analyses with antibodies to adhesion molecules tenascin, N-CAM, and integrin[J].DevBiol, 1992, 150(1): 82-98.
[18] TSAI S Y, SENNETT R, REZZA A, et al. Wnt/β-catenin signaling in dermal condensates is required for hair follicle formation[J].DevBiol, 2014, 385(2): 179-188.
[19] MICHNO K, BORAS-GRANIC K, MILL P, et al.Shhexpression is required for embryonic hair follicle but not mammary gland development[J].DevBiol, 2003, 264(1): 153-165.
[20] BILLONI N, BUAN B, GAUTIER B, et al. Expression of peroxisome proliferator activated receptors (PPARs) in human hair follicles and PPARα involvement in hair growth[J].ActaDermVenereol, 2000, 80(5): 329-334.
[21] GUO H Y, YANG K, DENG F, et al. Wnt3a promotes melanin synthesis of mouse hair follicle melanocytes[J].BiochemBiophysResCommun, 2012, 420(4): 799-804.
[22] JIA L W, ZHOU J X, PENG S, et al. Effects of Wnt3a on proliferation and differentiation of human epidermal stem cells[J].BiochemBiophysResCommun, 2008, 368(3): 483-488.
[23] CHANG C H, TSAI R K, TSAI M H, et al. The roles of Frizzled-3 and Wnt3a on melanocyte development:invitrostudies on neural crest cells and melanocyte precursor cell lines[J].JDermatolSci, 2014, 75(2): 100-108.
[24] SHIN H, KWACK M H, SHIN S H, et al. Identification of transcriptional targets of Wnt/β-catenin signaling in dermal papilla cells of human scalp hair follicles: EP2 is a novel transcriptional target of Wnt3a[J].JDermatolSci, 2010, 58(2): 91-96.
[25] MI H K, KIM M K, KIM J C, et al. Dickkopf 1 promotes regression of hair follicles[J].JInvestDermatol, 2012, 132(6): 1554-1560.
[26] SICK S, REINKER S, TIMMER J, et al. WNT and DKK determine hair follicle spacing through a reaction-diffusion mechanism[J].Science, 2006, 314(5804): 1447-1450.
[27] LEI M X, GUO H Y, QIU W M, et al. Modulating hair follicle size withWnt10b/DKK1 during hair rege-neration[J].ExpDermatol, 2014, 23(6): 407-413.
[28] GALLEGO M I, BEACHY P A, HENNIGHAUSEN L, et al. Differential requirements for Shh in mammary tissue and hair follicle morphogenesis[J].DevBiol, 2002, 249(1): 131-139.
[29] TING-BERRETH S A, CHUONG C M.Sonichedgehogin feather morphogenesis: induction of mesenchymal condensation and association with cell death[J].DevDyn, 1996, 207(2): 157-170.
[30] REDDY S, ANDL T, BAGASRA A, et al. Characterization ofWntgene expression in developing and postnatal hair follicles and identification ofWnt5aas a target of Sonic hedgehog in hair follicle morphogenesis[J].MechDev, 2001, 107(1-2): 69-82.
[31] HU B, LEFORT K, QIU W Y, et al. Control of hair follicle cell fate by underlying mesenchyme through a CSL-Wnt5a-FoxN1 regulatory axis[J].GenesDev, 2010, 24(14): 1519-1532.
[32] UMEDA-IKAWA A, SHIMOKAWA I, DOI K. Time-course expression profiles of hair cycle-associated genes in male mini rats after depilation of telogen-phase hairs[J].IntJMolSci, 2009, 10(5): 1967-1977.
[33] STACHELSCHEID H, IBRAHIM H, KOCH L, et al. Epidermal insulin/IGF-1 signaling control interfollicular morphogenesis and proliferative potential through Rac activation[J].EMBOJ, 2008, 27(15): 2091-2101.
[34] BOL D K, KIGUCHI K, GIMENEZ-CONTI I, et al. Overexpression of insulin-like growth factor-1 induces hyperplasia, dermal abnormalities, and spontaneous tumor formation in transgenic mice[J].Oncogene, 1997, 14(14): 1725-1734.
[35] HE L, VASILIOU K, NEBERT D W. Analysis and update of the human solute carrier (SLC) gene superfamily[J].HumGenomics, 2009, 3(2): 195-206.
