叶酸口腔速溶膜剂的质量控制
2018-01-26周禹宏张金芬房志仲
周禹宏,张金芬,房志仲
(天津医科大学药学院,天津市临床药物关键技术重点实验室,天津300070)
药物速溶传递系统(fast dissolving drug delivery systems,FDDDS)最早开发于上世纪 70年代,作为可代替传统片剂、胶囊剂及糖浆剂的新兴剂型[1],口腔速溶膜剂常用作儿童、老年人以及吞咽困难的患者人群的传统剂型替代产品,具有纤薄柔韧、易于吞咽、剂量准确、快速崩解溶化等优点[2-4],便于患者自主给药,提高患者的顺应性。近年来,人们逐渐发现了叶酸的其它新的治疗作用。对于H型高血压[5]、萎缩性胃炎[6]和骨性关节炎[7]均具有有效的治疗作用;另外,对胃癌、肝癌、大肠癌等多种癌症有明显的辅助治疗作用[8-12]。因此,叶酸被不断应用于多种疾病的预防、治疗和诊断。目前,国内市场的叶酸制剂只有片剂、胶囊剂、颗粒剂等普通剂型。叶酸口腔速溶膜剂具有药物速溶传递系统的优点,它的出现极大改善了患者的用药体验,特别适合儿童、老人、吞咽困难和精神疾病患者等特殊人群的预防治疗用药需求,具有良好的市场前景。本课题对自制的叶酸口腔速溶膜剂进行了质量控制方面的研究,建立了检测叶酸的质量控制方法,确保所建立方法准确、可靠、简便、易行。
1 材料与方法
1.1 试药 叶酸(河北冀衡集团药业有限公司,批号:61410001);羟丙甲纤维素 E15(HPMC E15,安徽山河药用辅料股份有限公司,批号:150509);丙二醇(青岛优索化学科技有限公司,批号:I94102224);β-环糊精(β-CD,安徽山河药用辅料股份有限公司,批号:150506);三氯蔗糖(安徽山河药用辅料有限公司,批号:150319);DL-苹果酸(常茂生物化学工程股份有限公司,批号:20150708);甜橙香精(天津市香源商贸有限公司,批号:1000506149);对照品:叶酸标准品(中国食品药品检定研究院,供含量测定用);供试品:叶酸口腔速溶膜剂(自制);甲醇(天津市康科德科技有限公司,色谱纯,批号:20150724);磷酸二氢钾(天津市光复科技发展有限公司,分析纯,批号:20151121);氢氧化钾(天津市风船化学试剂科技有限公司,分析纯,批号:20150724);氨水(天津市风船化学试剂科技有限公司,25%,批号:20150723);重蒸水自制。
1.2 仪器 高效液相色谱仪(Waters 2690);柱温箱(CBL Model 100型,天津科贝尔公司);色谱柱(Inn oval.ODS-2,250 mm ×4.6 mm,5 μm;Phenomenex.luna,250 mm×4.6 mm,5 μm);Empower色谱工作站;CPA225D电子分析天平(赛多利斯科学仪器(北京)有限公司);AFA-Ⅱ型自动涂膜机(上海亚培实业有限公司);电子数显千分尺(量程:0~25 mm,桂林广陆数字测控股份有限公司);78X-3C片剂多用崩解测定仪(上海黄海药检仪器有限公司)。
1.3 方法[13-14]
1.3.1 色谱条件 色谱柱:Innoval ODS-2 C18色谱柱(250 mm×4.6 mm,5 μm);流动相:甲醇-0.054 mol/L磷酸二氢钾缓冲盐溶液(调节 pH=6.3±0.1)(8:92);检测波长:λ=254 nm;流速1.0 mL/min;进样量为20 μL;柱温为(30±1)℃。
1.3.2 供试品的制备 采用溶剂浇铸法制备口腔速溶膜剂。精密称取处方量的成膜材料HPMC E15,加入适量纯净水,搅拌均匀使其充分溶胀,形成均匀而质地黏稠的胶液。向胶液中加入处方量丙二醇,搅拌均匀后,依次按照处方称取主药、填充剂以及其他矫味剂,先后加入胶液中,再持续搅拌15 min,静置脱气。待胶液呈无气泡的均匀混悬黏稠状态时,涂膜,于50℃下干燥30min。脱膜,切割成所需大小。1.3.3 溶液的制备 (1)流动相的制备:称取6.8 g磷酸二氢钾与70 mL 0.1 mol/L氢氧化钾溶液,加水稀释至850 mL,用0.5%氨溶液调节pH至6.3±0.1。加入80 mL甲醇,用水稀释至1 000 mL,即得。(2)对照品储备液的制备:精密称取叶酸对照品55.0 mg置于25 mL量瓶中,加入15 mL 0.5%氨溶液,使之溶解,加水稀释至刻度,摇匀,即得对照品储备液。(3)对照品溶液的制备:精密称取叶酸对照品11.0 mg置于50 mL量瓶中,加入30 mL 0.5%氨溶液溶解,加水稀释至刻度并摇匀,即得对照品溶液。(4)供试品溶液的制备:取叶酸口腔速溶膜5片量(约含叶酸2 mg),称重后置于10 mL量瓶中,加入6 mL 0.5%氨溶液使之溶解,再加水稀释至刻度,充分振荡,摇匀。用0.45 μm微孔滤膜过滤,取续滤液作为供试品溶液。(5)阴性对照溶液的制备:按照自制处方制得不含叶酸的空白膜剂,依上述供试品溶液的制备方法配制阴性对照溶液。(6)空白溶液的制备:取30 mL 0.5%氨溶液于50 mL量瓶中,加水稀释至刻度,摇匀,即得。
1.3.4 厚度考察 膜剂厚度的均匀性关系到其剂量准确性和溶化速度的大小。通过电子数显千分尺来测量膜剂的厚度。任意选取3片自制叶酸口腔速溶膜,在膜上任意选取3点测定厚度,求其平均值,并计算标准差[15]。
1.3.5 溶化时限的考察 本研究借鉴《中国药典》2015版克霉唑口腔药膜溶化时限的测定方法,将膜剂剪成1 cm2大小,取6片分别用两层筛孔内径为2.0 mm的不锈钢丝夹住,置于上述吊篮的玻璃管中依崩解时限检查法片剂项下的方法(通则0921)检查。在盛有 (37±1)℃纯净水的1 000 mL烧杯中,以30~32次/min的速度上下移动(55±2)mm,当膜剂出现崩裂时,记录所用时间,计算其平均值和RSD。
1.3.6 系统适用性试验 分别取空白溶液和对照品溶液各20 μL进样,按照“1.3.1项下”的色谱条件进行测定,记录色谱图。
1.3.7 专属性试验 分别取“1.3.3项下”空白溶液、阴性对照溶液、对照品溶液和供试品溶液进样20μL,依照“1.3.1项下”的色谱条件进行测定,并记录色谱图。
1.3.8 定量限考察 精密移取“1.3.3项下”对照品溶液1 mL于100 mL量瓶中,加水稀释至刻度,充分摇匀,得到的待测溶液,记为浓度1。再分别取上述溶液4 mL、5 mL于10 mL量瓶中,加水稀释至刻度,充分摇匀,得到的待测溶液,依次记为浓度2、浓度3。分别进样,测定其信噪比。将所确定的定量限浓度溶液连续进样6次,记录其信噪比,并求其平均值和RSD。
1.3.9 线性关系考察 用移液管分别精密移取0.7、0.9、1.0、1.1 和 1.3 mL 对照品储备液,置 10 mL量瓶中,用水稀释至刻度,摇匀,即得浓度分别为70%、90%、100%、110%、130%的样品溶液。取对照品储备液1 mL至50 mL量瓶中,加水稀释至刻度,摇匀,即得浓度为20%的样品溶液。另精密移取“1.3.3项下”对照品溶液1 mL于200 mL量瓶中,加水稀释至刻度,充分摇匀,得到浓度为0.5%的样品溶液。将上述样品溶液分别进样20 μL,按照“1.3.1项下”的色谱条件进行测定并记录峰面积。
1.3.10 精密度试验 (1)日内精密度:取“1.3.3项下”所制供试品溶液,同一天内连续进样6次,依照“1.3.1项下”的色谱条件进行测定,并计算峰面积的RSD。(2)中间精密度:取“1.3.3项下”所制供试品溶液,在同一实验室,不同时间由不同分析人员用不同设备于同一天内连续进样6次,依照“1.3.1项下”的色谱条件进行测定,并计算峰面积的RSD。
1.3.11 稳定性试验 按照自制处方制得叶酸口腔速溶膜胶液,静置备用。分别取室温放置0、1、2、4、8、12和24 h胶液约300 mg,精密称定,置于50 mL棕色量瓶中,加入30 mL 0.5%氨试液振荡溶解,用水稀释至刻度,混匀,用0.45 μm微孔滤膜过滤,取续滤液作为供试品溶液,同法平行配制两份供试品溶液。依照“1.3.1项下”的色谱条件进行测定,计算其含量,统计其平均值与RSD。另外,分别取室温放置 0、1、2、4、8、12 和 24 h 的对照品溶液、空白溶液和供试品溶液进样,依照“1.3.1项下”的色谱条件进行测定,计算其含量,统计其平均值与RSD。
1.3.12 耐用性试验 根据“1.3.1项下”的色谱条件,依次变动色谱柱、柱温、检测波长、流动相流速、流动相比例和流动相pH等条件测定叶酸含量,取“1.3.3项下”的对照品溶液和供试品溶液分别进样2次,使用外标一点法计算叶酸的含量,并计算RSD。1.3.13 回收率试验 分别精密移取0.8、1.0和
1.2 mL对照品储备液于10 mL量瓶中,加水稀释至刻度,摇匀,离心,取上清液过滤,所得续滤液即为标准浓度80%、100%、120%的供试品溶液。将上述每个浓度平行配制3个样品。依照“1.3.1项下”的色谱条件进行测定并计算回收率。
1.3.14 含量测定 根据“1.3.3项下”的供试品溶液的制备方法对3批样品进行处理,得到样品溶液,进样,依照“1.3.1项下”的色谱条件进行测定,使用外标一点法计算叶酸的含量。
1.3.15 含量均匀度的测定 精密移取对照品溶液2 mL于10 mL量瓶中,加水稀释至刻度,摇匀,作为含量均匀度测定试验的对照品溶液。另取10片自制叶酸膜样品分别置于10个10 mL量瓶中,加入6 mL 0.5%氨溶液使溶解。加水稀释至刻度,摇匀,离心。取上清液用0.45 μm微孔滤膜过滤,所得滤液即为待测样品溶液。进样,依照“1.3.1项下”的色谱条件进行测定。计算每一片药膜的含量,统计其平均值与标准差,按照《中国药典》2015版(二部)附录ⅩE规定进行测定。
2 结果
2.1 厚度考察结果 见表1。所得叶酸口腔速溶膜厚度均匀。
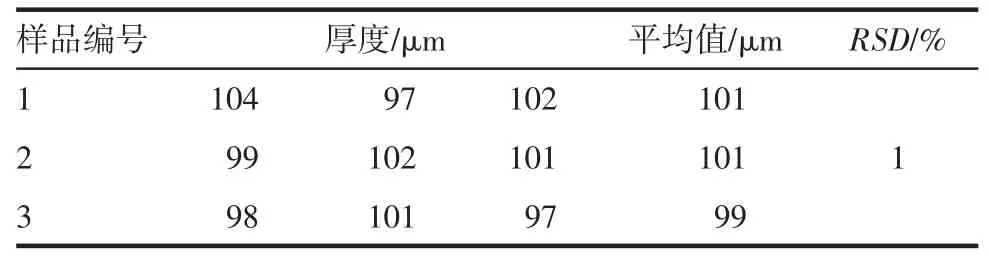
表1 叶酸口腔速溶膜的厚度考察Tab 1 The thickness of rapidly dissolving oral film of folic acid
2.2 溶化时限考察结果 见表2。平均溶化时限为18.17 s,且均不超过 30 s。
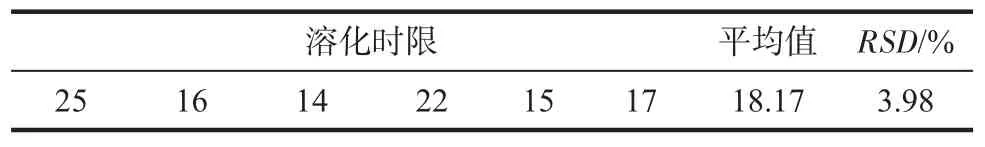
表2 叶酸口腔溶解膜的溶化时限Tab 2 The disintegration time of rapidly dissolving oral film of folic acid
2.3 系统适用性试验色谱图 见图1。于“1.3.1项下”的色谱条件下测得的色谱图,主峰分离度大于1.5,理论塔板数大于2 000且拖尾因子为0.91,符合要求,该色谱系统有效适用。
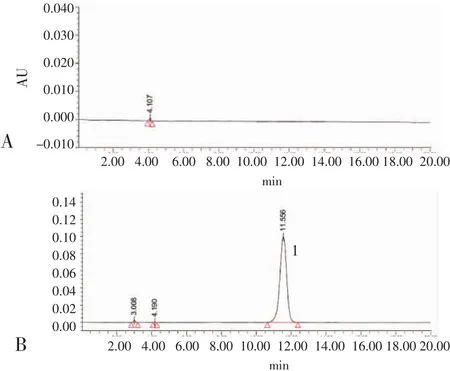
图1 系统适用性试验Fig 1 System adaptability test
2.4 专属性试验结果 见图2。在“1.3.1项下”的色谱条件下,主药与辅料之间可明显分离,互不干扰。该色谱方法有良好的专属性。
2.5 定量限的考察结果 样品浓度为1.0 μg/mL时,平行测定6次,信噪比为11.0,RSD为1.08%。确定该浓度为定量限浓度。
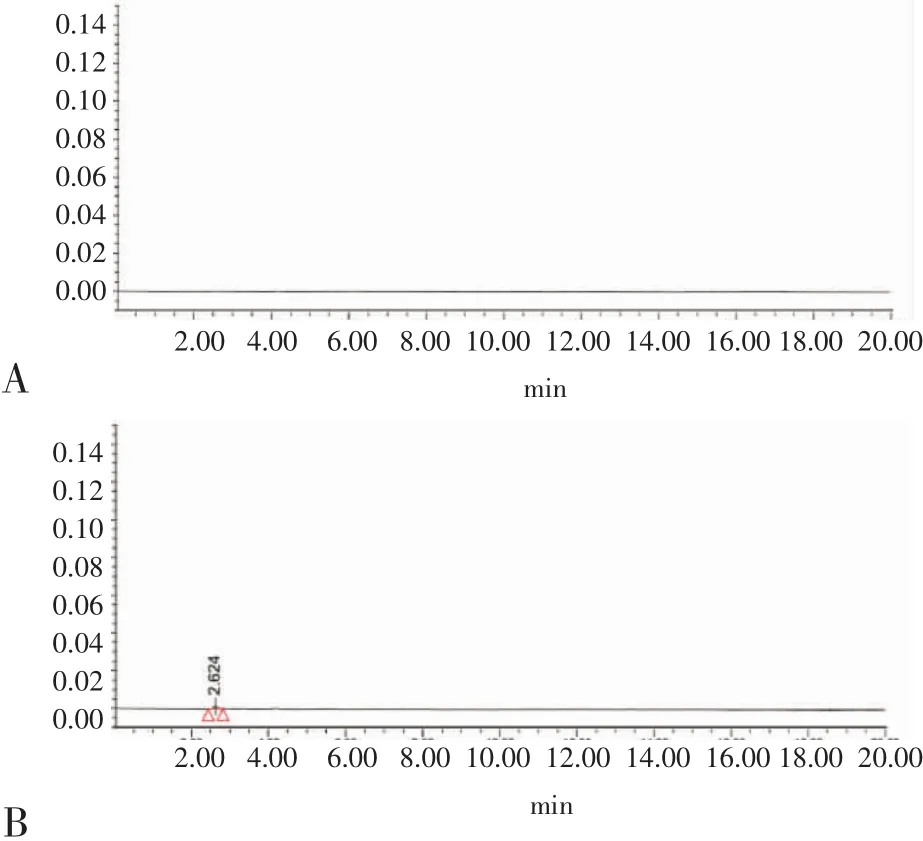
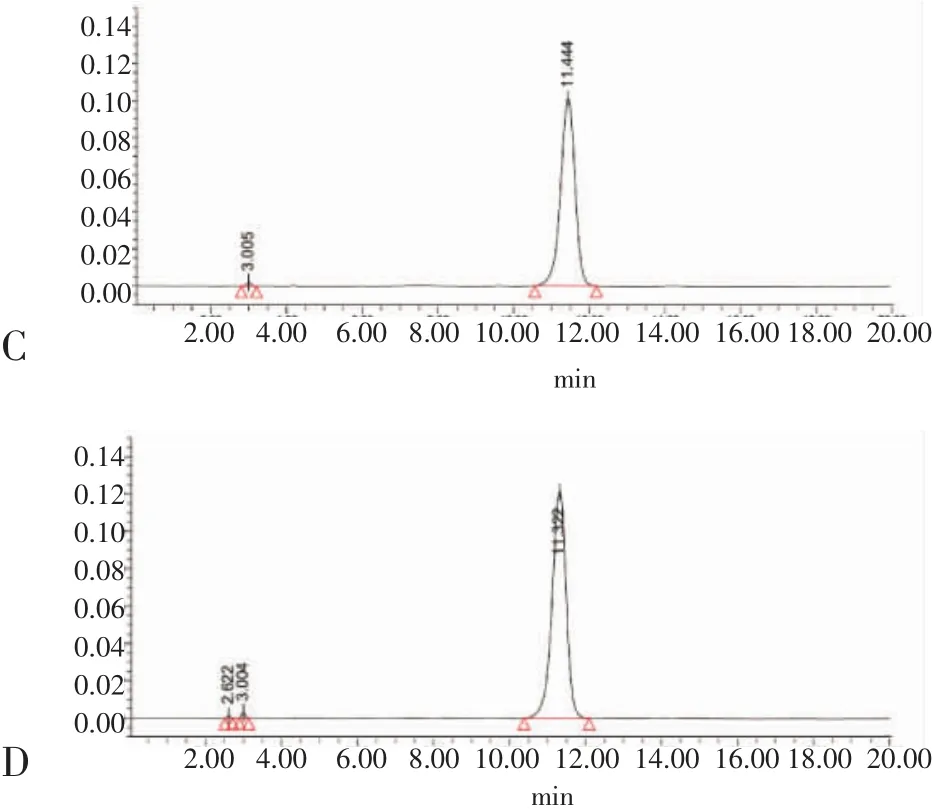
图2 专属性试验Fig 2 Specific test
2.6 线性关系考察结果 以叶酸的峰面积(A)对浓度(C)做线性回归的标准曲线,得到线性方程为A=14551C-15665,R=0.999 8,表明叶酸在 40.0~260.0 μg/L的浓度范围内线性关系良好。
2.7 精密度试验结果 叶酸的日内精密度试验的RSD 为 0.23%(n=6),日间精密度的 RSD 为 0.26%(n=6),表明精密度良好。
2.8 稳定性试验结果 自制处方制得的叶酸口腔速溶膜胶液的RSD为0.82%,叶酸对照品溶液的RSD 为 1.44%,供试品溶液的 RSD 为 0.86%,表明叶酸口腔速溶膜胶液、叶酸对照品和供试品溶液室温放置24 h稳定。
2.9 耐用性试验结果 依次变动色谱柱、柱温[(25±2)℃、(30±2)℃和(35±2)℃]、检测波长(252 nm、254nm、256nm)、流动相流速(0.9mL/min、1.0mL/min、1.1 mL/min)、流动相比例(有机相-水相=6∶94、8∶92、10∶90)和流动相 pH(6.1±0.1、6.3±0.1、6.5±0.1),其它条件不变测定叶酸含量,其RSD为0.70%。结果表明,在测定条件有小的变动时,含量测定结果基本不受影响,该测定方法具有良好的耐用性。
2.10 回收率试验结果 叶酸的平均加样回收率为99.02%,RSD 为 0.41%,符合要求,详细测定结果见表3。
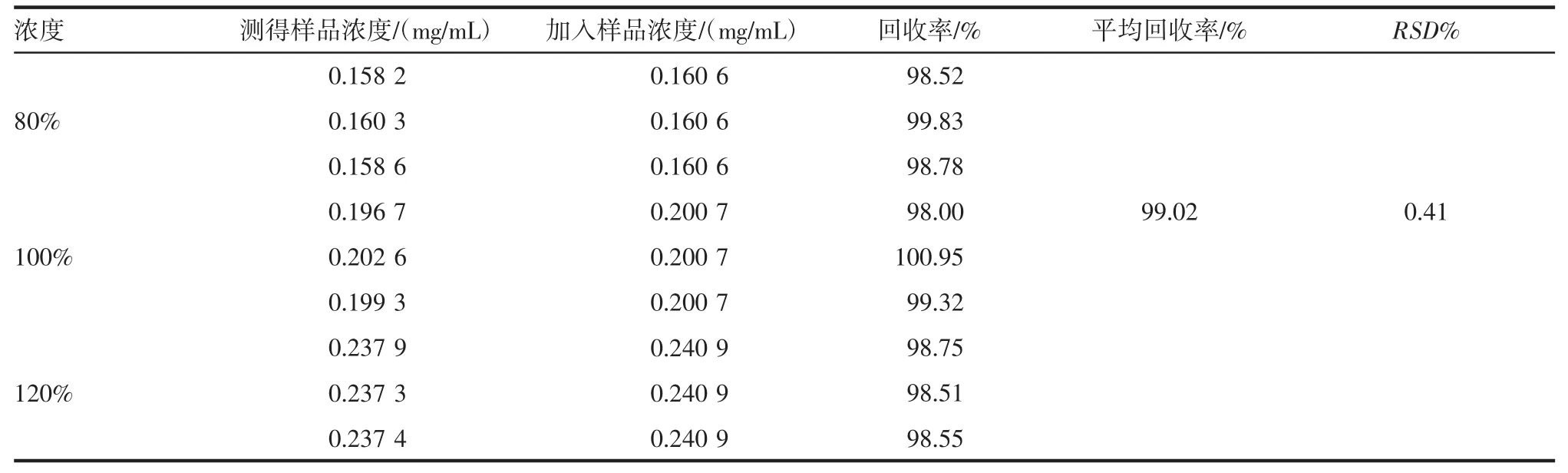
表3 叶酸的回收率试验Tab 3 The recovery tests of folic acid
2.11 含量测定结果 3批样品中叶酸的含量测定结果见表4。
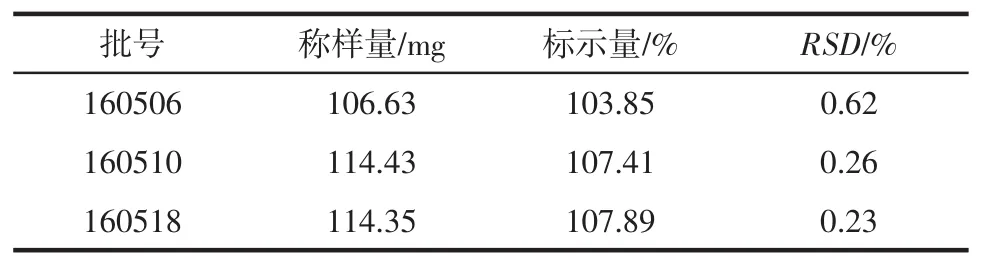
表4 叶酸的含量测定结果Tab 4 Content determination of folic acid
2.12 含量均匀度的测定结果 根据测得含量计算A+2.2S=1.42<15.0,表明自制叶酸口腔速溶膜中,叶酸的含量均匀度良好。
3 讨论
3.1 供试品的制备方法 本研究采用溶剂浇铸法制备叶酸口腔速溶膜剂,筛选和调整了几种辅料的种类与配比,并从成膜性、脱膜性、溶化时限、耐折度等几个方面考察其特性。所得膜剂外形美观,柔韧性良好,实现了30 s内迅速溶化。相比于传统的叶酸片剂,该制剂具有速溶起效快、生物利用度高、患者顺应性好等优点。但该制剂尚存在载药量较小、对包装要求较高等缺点,这就需要与其他学科共同发展,以期克服上述困难,使其应用范围更加广泛。
3.2 溶化时限的测定方法 目前,口腔速溶膜剂的溶化时限测量方法尚未给出官方指导。因此,本研究借鉴 CDER(CenterforDrugEvaluationandResearch)[16]给出的口腔崩解片的指导说明,即崩解时间不超过30 s,来规范开发阶段的定性指标。
3.3 研究现状 本制剂具有口腔速溶膜剂的优良特性,制备过程简单易行,工艺较为成熟,易于实现产业化,或可为科研工作者提供有益的借鉴。但本研究尚未完成对该制剂的黏性测试、表面pH测试和部分机械性能考察,仍需要进一步补充完善。
[1] Bhattarai M,Gupta A K.Fast dissolving oral films:a novel trend to oral drug delivery system[J].STCJ,2016,2(1):58
[2] Padamwar P A,Phasate P P.Formulation and evaluation of fast dissolving oral film of bisoprolol fumarate[J].IJPSR,2015,6(1):135
[3] Jyoti A,Gurpreet S,Seema S,et al.Fast dissolving films:a novel approach to oral drug delivery[J].IRJP,2013,2(12):69
[4] 陈芳,夏怡然,侯惠民.口腔膜剂的研发及应用[J].中国医药工业杂志,2012,43(6):484
[5] 杜彪,张杰,谢星星,等.马来酸依那普利叶酸片治疗H型高血压的系统评价[J].中国现代应用药学,2015,32(12):1488
[6] 李祎群,谢建群,龚雨萍,等.叶酸治疗幽门螺旋杆菌阴性慢性萎缩性胃炎的疗效[J].中国临床医学,2014,21(5):523
[7] Hsu H C,Chang W M,Wu J Y,et al.Folate deficiency triggered apoptosis of synoviocytes:role of overproduction of reactive oxygen species generated via NADPH oxidase/mitochondrial complex II and calcium perturbation[J].Plos One,2016,11(1):13
[8] 朱舜时,Joel M,施尧,等.叶酸对胃癌和其他胃肠道癌发生的干预作用—临床试验七年随访[J].胃肠病学,2002,7(2):73
[9]杨小珊,曾令福.叶酸在体外对人肝癌细胞生长的抑制作用[J].中国组织工程研究,2006,10(48):136
[10]陆嵘,王霞,房静远.叶酸对二甲肼诱发小鼠大肠癌干预及其机制的研究[J].中华肿瘤防治杂志,2009,16(9):645
[11]Zhang L,Zhu W,Yang C,et al.A novel folate-modified self-microemulsifyingdrugdeliverysystemofcurcuminforcolontargeting[J].Int J Nanomed,2012,7(9):151
[12]Kumar M,Singh G,Arora V,et al.Cellular interaction of folic acid conjugated superparamagnetic iron oxide nanoparticles and its use as contrast agent for targeted magnetic imaging of tumor cells[J].Int J Nanomed,2012,7(7):3503
[13]GB 15570-2010.食品安全国家标准食品添加剂叶酸[S].2010:3
[14]国家药典委员会.中国药典[S].二部.北京:中国医药科技出版社,2015:447
[15]ShrutiCP,SarveshDP,AmithaS,etal.Areviewonfastdissolvingsublingual films for systemic drug delivery[J].IJPCS,2014,3(2):501
[16]Center for Drug Evaluation and Research.Guidance and Manuals[EB/OL].https://www.fda.gov/AboutFDA/CentersOffices/Officeof Medical ProductsandTobacco/CDER/ucm269999.html,2014-11-21/2017-06-08
