术前外周血NLR与PLR对胃癌预后的评估价值
2018-01-26赵忠治王金淼魏颖戚峰
赵忠治,王金淼,魏颖,戚峰
(天津医科大学总医院普通外科,天津300052)
胃癌是最常见的恶性肿瘤之一,东亚胃癌患者数占世界总数近一半,而我国为亚洲高发地区[1]。目前,对于胃癌的诊断与治疗方案多种多样,近年来,对于血液指标评估胃癌患者分期与预后的研究越来越多,包括外周血中血小板、中性粒细胞、淋巴细胞、中性粒细胞与淋巴细胞计数的比值(NLR)、血小板与淋巴细胞计数的比值(PLR)、C反应蛋白(CRP)及血白蛋白浓度等。本文主要研究术前血常规中常见指标对胃癌患者预后的评估价值。
1 资料与方法
1.1 临床资料 2008年3月-2016年3月,天津医科大学总医院胃肠外科病区行D2胃癌根治手术治疗的胃癌患者,所有患者均具有完整临床病理资料及随访结果,术前半年内均无活动性出血、DIC、严重感染,创伤、心肺疾病、血液及结缔组织病,未使用过升白细胞或升血小板类药物等,术前1周内行血常规检查且血红蛋白在13 g/L以上,术后pTNM分期IB以上行规律化疗。最终纳入病例共154例,其中男性 112例(78.2%),女性 42例(27.8%),年龄(62.4±11.3)岁;TNM 分期:I期 19 例,II期 25 例,III期107例,IV期3例(AJCC第七版胃癌TNM分期标准)(表 1)。
1.2 信息采集 初步筛选病例资料后,通过病案系统详细采集患者临床病理资料,包括:年龄、性别、发病部位、肿瘤大小、分化类型、浸润深度、淋巴结分期、淋巴结转移率、TNM病理分期及患者术前中性粒细胞计数、血小板数计数、淋巴细胞计数等。
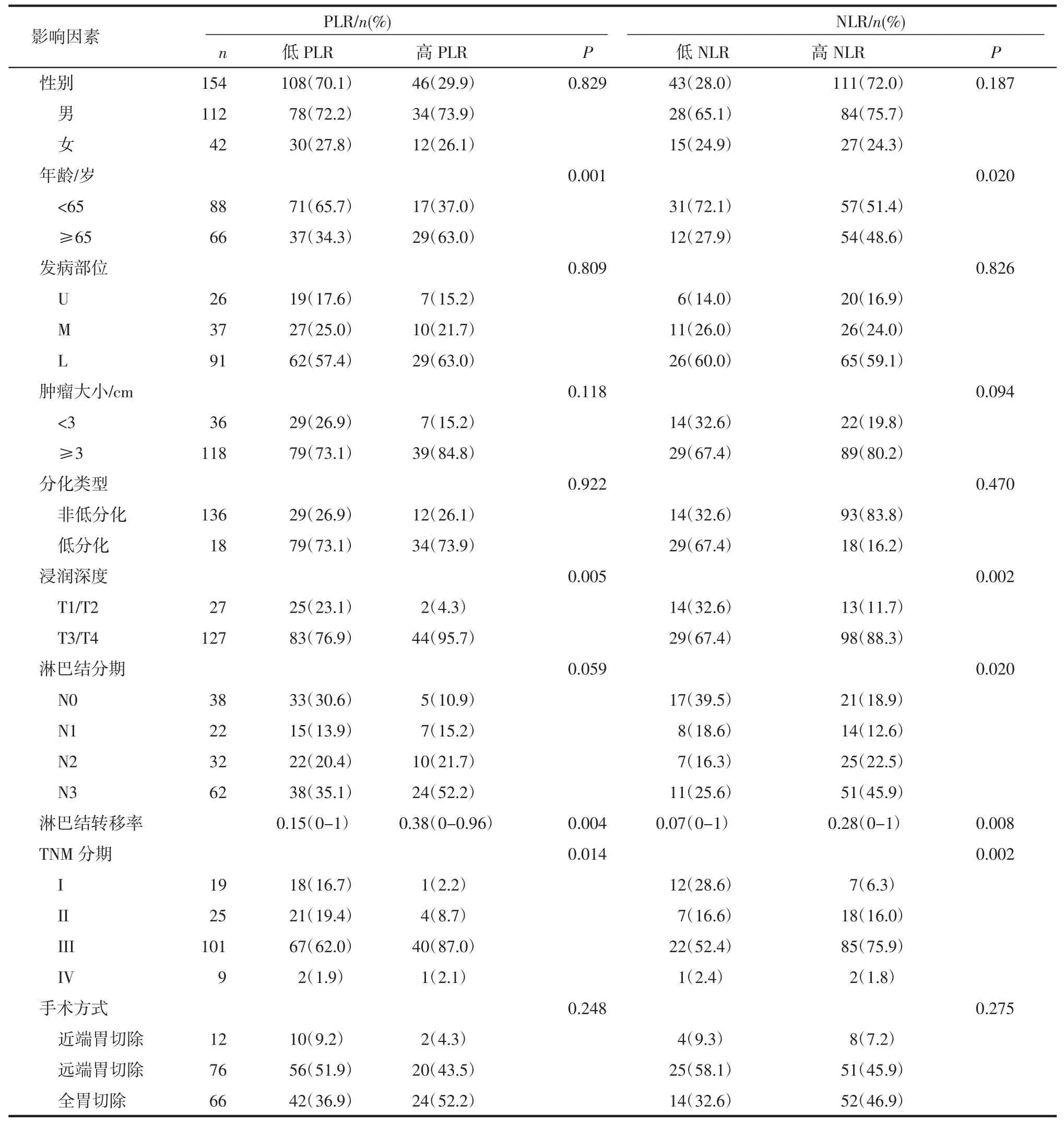
表1 154名胃癌患者临床病理特征Tab 1 Clinicopathological features of the154 patients with gastric cancer
1.3 随访 通过病案系统查询患者相关家属的联系方式,主要以电话随访为主,每3月至半年随访1次,随访截止日期为2017年6月1日,生存时间为手术当天至死亡日期或随访截止日期。
1.4 统计学方法 采用SPSS 22.0软件和Excel软件进行统计学分析,ROC曲线确定NLR及PLR相应cutoff值后,根据相应数值将所有患者分为高PLR组、低PLR组和高NLR组、低NLR组。分析NLR、PLR与临床病理资料之间的关系时,计数资料采取χ2检验,计量资料采取U检验。采用Log rank检验分析比较不同分组患者生存率。分析影响患者预后独立风险因素采用多因素COX回归模型,所有检验结果以P<0.05为具有统计学意义。
2 结果
2.1 PLR及NLR与临床病理特征分析 根据图1中ROC曲线,NLR的曲线下面积为0.702,P值为0.005,95%CI为 0.571-0.832,约登指数(敏感度+特异度-1)为 0.402,cutoff值为 1.46;PLR 曲线下面积为 0.701,P 值为 0.005,95%CI为 0.593-0.809,约登指数为0.288,cutoff值为148。根据cutoff值将NLR分为高 NLR(≥1.46)组和低 NLR(<1.46)组;将 PLR分为高 PLR(≥148)组和低 PLR(<148)组。其中高PLR组共46例,占总人数的29.9%,低PLR组共108例,占总人数的70.1%;高NLR组共111例,占总人数的72%,低NLR组43例,占总人数的28%。根据不同分组(表1),分析各组临床病理特征,发现年龄、浸润深度、淋巴结转移率及TNM分期在高低NLR组及高低PLR组中均有显著差异(P<0.05),而淋巴结分期(P=0.02)在高低NLR组中具有显著差异(P<0.05)。
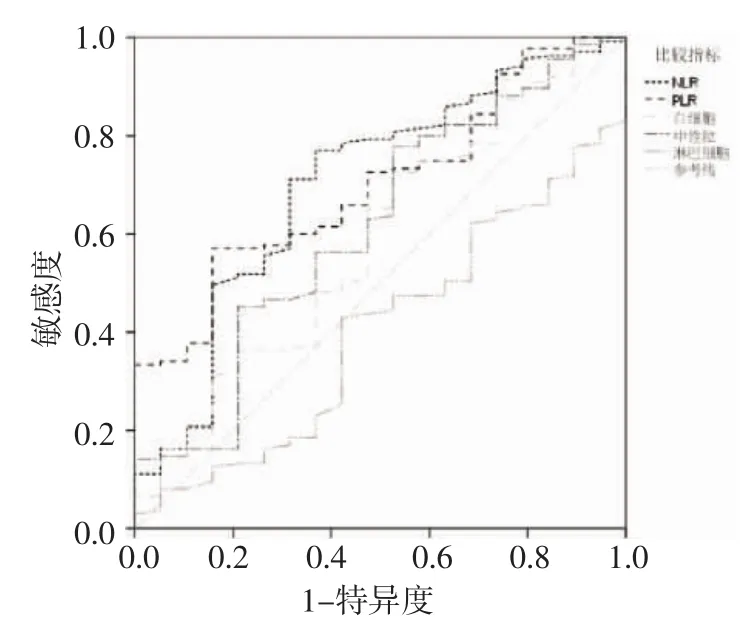
图1 根据患者的血液指标绘制ROC曲线Fig 1 The ROC curve based on the blood parameters of gastric cancer patients
2.2 影响胃癌患者预后的单因素分析 共随访154位患者,失访患者12位,纳入生存分析的患者共142位,其中63位患者死于胃癌,79位至今存活,随访时间为3~111月,中位生存时间为30月,其中1年、3年、5年生存率分别为75%、49%、32%。采用Log rank检验单因素分析临床病理因素不同组别患者预后情况,其中肿瘤大小(P=0.025)、分化类型(P=0.021)、浸润深度(P=0.007)、淋巴结分期(P<0.001)、淋巴结转移率(P<0.001)、TNM 分期(P<0.001)、PLR(P<0.001)、NLR(P<0.001)、手术方式(P=0.013)为影响胃癌患者预后的危险因素(表2)。高低NLR组及高低PLR组患者的生存曲线如图 2、图 3,差异有统计学意义(P<0.001)。
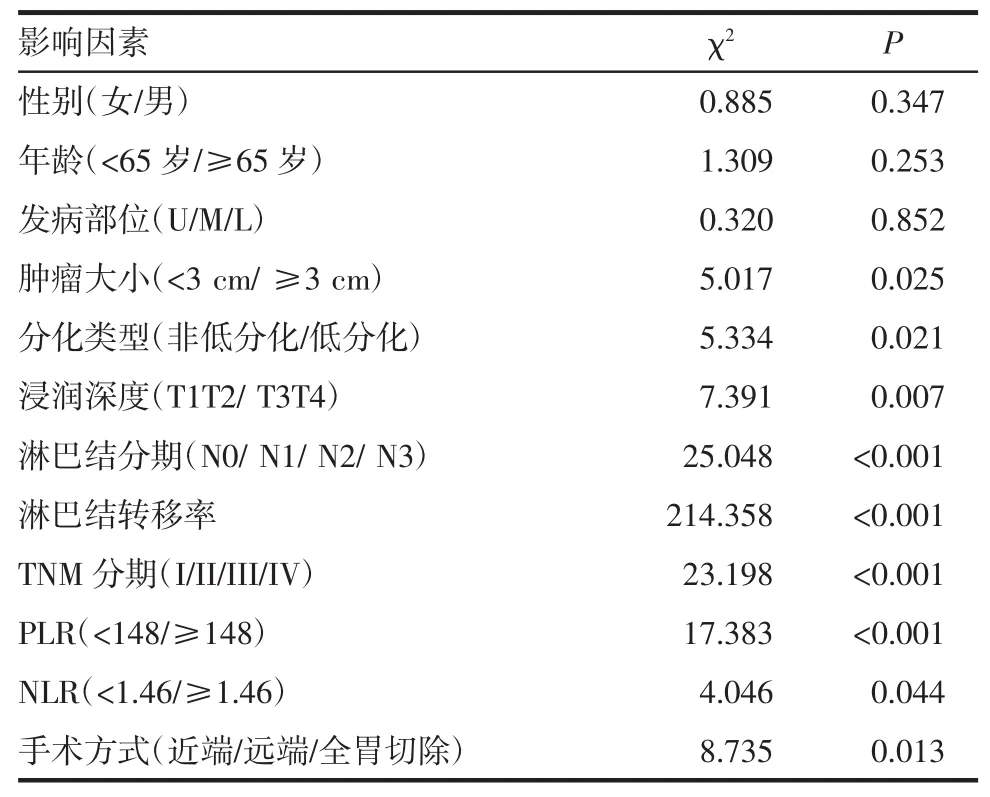
表2 影响胃癌患者预后临床病理特征的单因素分析Tab 2 Univariate analyses of clinicopathologic factors related to gastric cancer prognosis
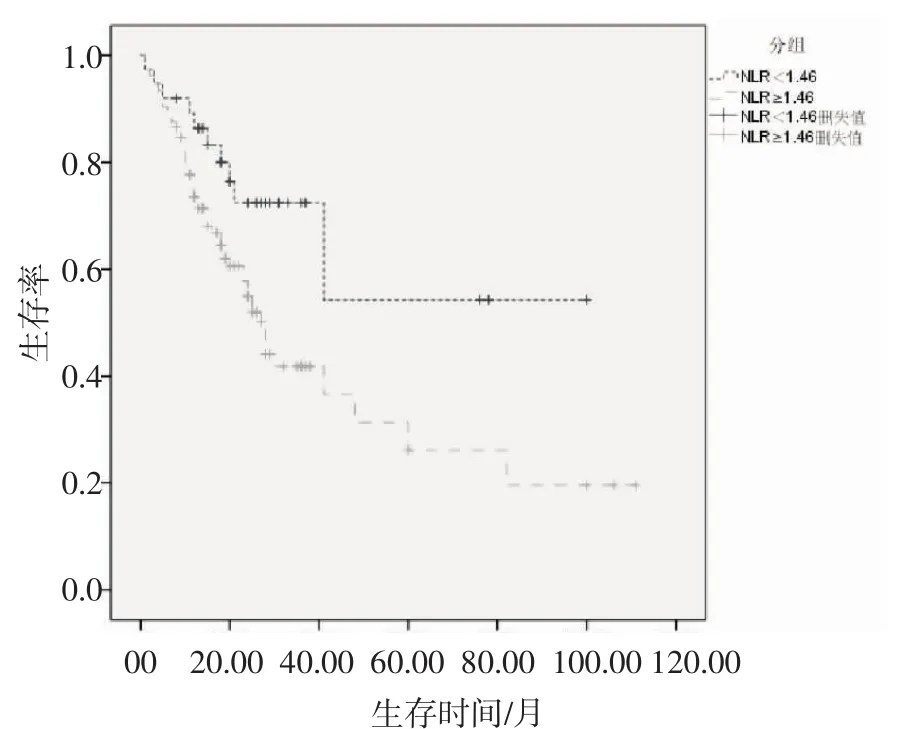
图2 高NLR组与低NLR组生存曲线图Fig 2 Survival curves of high NLR and low NLR groups
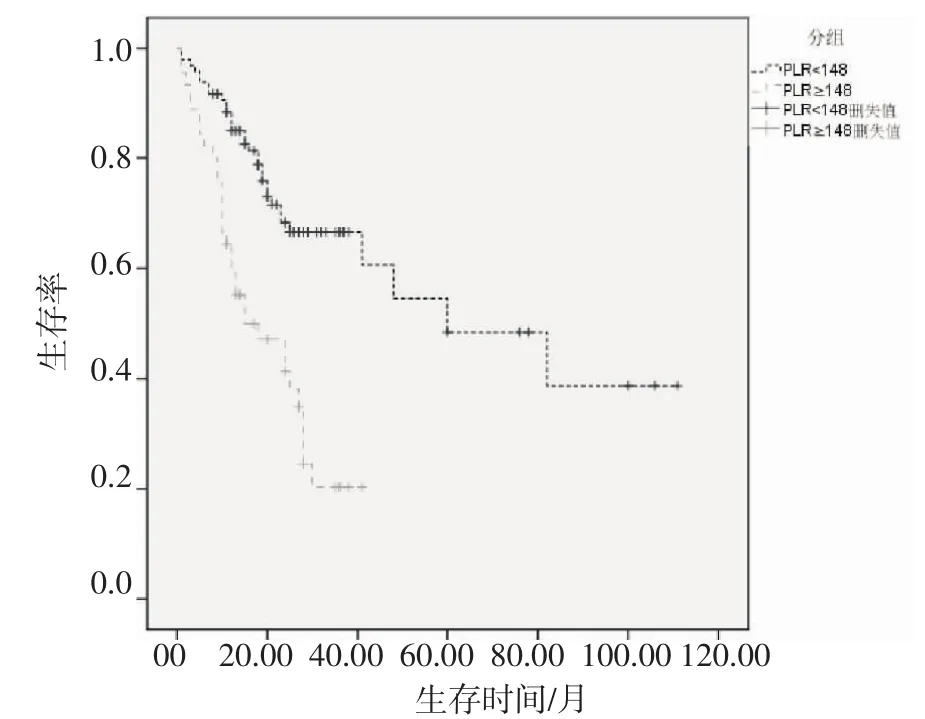
图3 高PLR组与低PLR组生存曲线图Fig 3 Survival curves for high PLR group and low PLR group
2.3 影响胃癌患者预后的多因素分析 采用多因素COX回归模型多因素分析肿瘤大小、分化类型、浸润深度、淋巴结分期、淋巴结转移率、TNM分期、PLR、NLR对胃癌患者预后的影响,其中肿瘤大小(P=0.941)、分化类型(P=0.431)、浸润深度(P=0.617)、淋巴结分期(P=0.920)、NLR(P=0.667)P 值大于0.05,差异无统计学意义,淋巴结转移率(P=0.004)、TNM 分期(P=0.005)、PLR(P=0.001)差异有统计学意义,可能为影响胃癌预后的独立危险因素(表 3)。
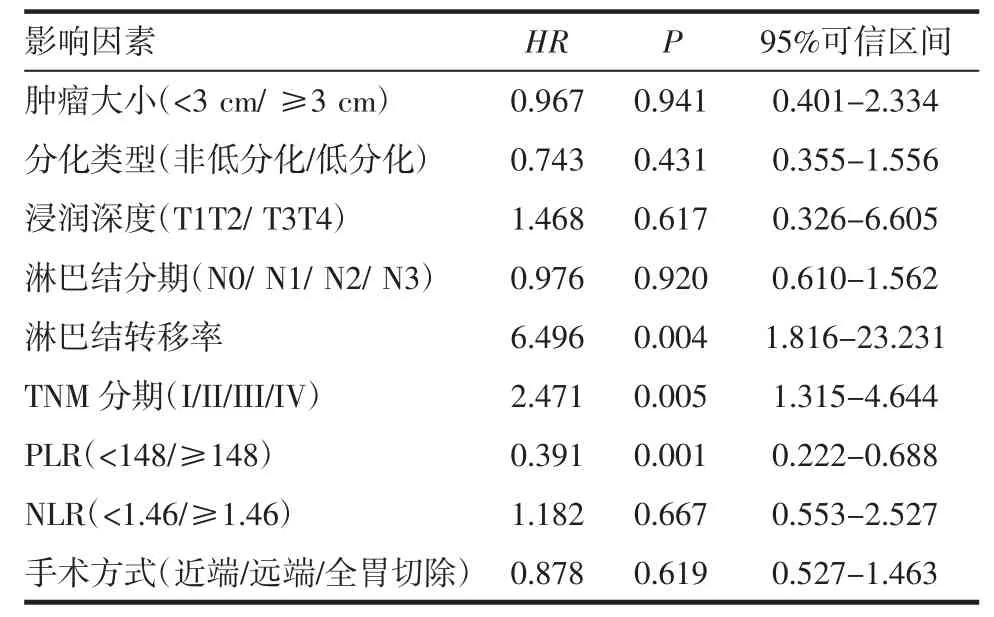
表3 影响胃癌患者预后临床病理特征的多因素分析Tab 3 Multivariate analyses of clinicopathologic factors related to gastric cancer prognosis
3 讨论
炎症在众多类型肿瘤的发病机制及进展过程中发挥着重要作用[2],近年来,多项研究证明炎症反应与肿瘤术后的生存率密切相关[3-4]。癌细胞内外炎症刺激与其增殖有关,癌细胞通过调节内在的炎症基因产生释放促炎因子和趋化因子(如GCSF、IL-1、IL-6)抑制细胞免疫并促进癌细胞生长,而外在的慢性炎症反应是促进肿瘤增殖的微环境[5]。外周血中性粒细胞、淋巴细胞及血小板数目的异常为癌细胞提供增殖的微环境,中性粒细胞及巨噬细胞释放的VGFR、HGF、IL-6、IL-8 及血小板释放 VGFR、PF4、TGF-β、PDGF等因子在一定程度上能够促进肿瘤的增殖与转移,淋巴细胞数目反映机体免疫状态,一般认为相对高水平中性粒细胞及血小板有利于促炎反应,相对低水平淋巴细胞抑制细胞免疫过程。目前多项研究报道了NLR及PLR与食管癌、结直肠癌、乳腺癌、肺癌、胃癌、卵巢癌、肝癌等恶性肿瘤的预后有关[3,6]。
NLR可以反映机体肿瘤炎性反应和免疫反应的平衡状态,高水平的NLR提示炎症指标朝向利于肿瘤增殖转移的方向,而低水平的NLR可能提示预后相对较好。Zhao等[4]回顾性分析了378名进展期恶性肿瘤(包括胃肠道、甲状腺、泌尿系、头颈部等恶性肿瘤)患者,通过多因素分析临床病理特征与生存率的关系,结果显示NLR为影响进展期恶性肿瘤患者预后的独立危险因素。NLR值可能影响肿瘤患者的治疗方案,近年来,由于化疗的副反应较大,关于简化癌症患者的治疗方案也受到重视,对于进展期的患者,化疗可以使一些NLR增高的患者指标逐渐降低并恢复正常,可能有利于患者的预后,对于NLR恢复正常的患者,简化或者早期终止化疗方案可能会提高患者的生存质量[7]。
PLR在一定程度上反映与肿瘤细胞相关的炎症反应。增殖的肿瘤细胞会产生并释放IL-1、IL-6促进血小板过度增生[8]。在肿瘤的微环境中,大量的血小板可以释放相应因子(如VEGF)促进肿瘤细胞的生长。淋巴细胞在抑制肿瘤细胞增殖及免疫逃逸中有着不可替代的作用。淋巴细胞的减少会引起淋巴细胞相关的免疫反应减弱。因此,血小板增多及淋巴细胞减少会使免疫机制相对减弱,也利于肿瘤的转移,从而影响癌症患者的预后。单纯血小板增多或淋巴细胞减少可能不能全面反映全身炎症反应状态,所以采用NLR来评估可能相对合理[9-10]。
高水平的NLR及PLR与肿瘤相关的全身炎症反应有关,并影响患者的预后。多数研究认为NLR为影响胃癌患者预后的独立危险因素[11-12],而对于PLR是否可以作为影响胃癌预后的独立危险因素,目前研究尚未有一致性的结论[13]。进展期胃癌患者,大量癌细胞周围的炎症反应会引起高水平的NLR。Shimada等[12]回顾性分析了1 028名胃癌患者认为NLR为影响胃癌术后生存率降低的独立危险因素。而Wang等[14]回顾性分析了324名胃癌患者认为,PLR不能用于评价胃癌预后,NLR可以用于评价胃癌预后但不能作为影响胃癌预后的独立危险因素。一项Meta分析总共纳入13项临床研究共6 280名患者,认为高水平的PLR与淋巴结的转移有关,并且可以用来评估胃癌患者的OS(总生存率),但不能评估 DFS(无病进展率)[15]。
对于评价胃癌患者预后的炎症指标尚未有一致性的结论证明何种指标相对合理,Sun等[16]回顾性分析了305名I、II期行根治性手术治疗的胃癌患者,通过比较各种炎症指标NLR、PLR、PLTNLR、NLR-PLR认为NLR-PLR能更好地评价患者的总生存率。本研究回顾性分析154名胃癌术后患者,认为肿瘤大小、分化类型、浸润深度、淋巴结分期、淋巴结转移率、TNM分期、PLR、NLR可以用来评价患者预后,而淋巴结转移率、TNM分期、PLR可能为影响预后总生存率的独立危险因素。慢性炎症对肿瘤的发展尤其是侵袭转移有促进作用,NLR、PLR可以反应机体免疫状态及肿瘤状态,且检测方便宜行,为术前评估肿瘤风险、判断预后等提供了比较快捷方便的方法,但由于尚未有一致性结论,仍需更多循证医学证据的支持。
[1] Ferlay J,Soerjomataram I,Dikshit R,et al.Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012[J].Int J Cancer,2015,136(5):E359
[2] Pedrazzani C,Mantovani G,Fernandes E,et al.Assessment of neutrophil-to-lymphocyte ratio,platelet-to-lymphocyte ratio and platelet count as predictors of long-term outcome after R0 resection for colorectal cancer[J].Sci Rep,2017,7(1):1494
[3] Templeton A J,Mcnamara M G,Šeruga B,et al.Prognostic role of neutrophil-to-lymphocyte ratio in solid tumors:a systematic review and meta-analysis[J].J Natl Cancer Inst,2014,106(6):dju124
[4] Zhao W W,Wu Z Y,Li Y T,et al.Pretreatment neutrophil-tolymphocyte ratio and its dynamic changes are associated with the overall survival in advanced cancer patients undergoing palliative care[J].Sci Rep,2016,6(1):31394
[5] Caronni N,Savino B,Bonecchi R.Myeloid cells in cancer-related inflammation[J].Immunobiology,2015,220(2):249
[6] Guthrie G J,Charles K A,Roxburgh C S,et al.The systemic inflammation-based neutrophil-lymphocyte ratio:Experience in patients with cancer[J].Crit Rev Oncol Hematol,2013,88(1):218
[7] Lee Y,Kim S H,Han J Y,et al.Early neutrophil-to-lymphocyte ratio reduction as a surrogate marker of prognosis in never smokers with advanced lung adenocarcinoma receiving gefitinib or standard chemotherapyasfirst-line therapy[J].J Cancer Res Clin Oncol,2012,138(12):2009
[8] Michael G,ALEXANDRAKIS,Freda H,et al.Levels of serum cytokines and acute phase proteins in patients with essential and cancer-related thrombocytosis[J].Am J Clin Oncol(CCT),2003,26(2):135
[9] You J,Zhang H X,Shen Y Y,et al.Impact of platelet to lymphocyte ratio and metabolic syndrome on the prognosis of colorectal cancer patients[J].Onco Targets Ther,2017,10:2199
[10]Wang J,Qu J L,Li Z,et al.Pretreatment platelet-to-lymphocyte ratio is associated with the response to first-line chemotherapy and survival in patients with metastatic gastric cancer[J].J Clin Lab Anal,2017,10:e22185
[11]Jung M R,Park Y K,Jeong O,et al.Elevated preoperative neutrophil to lymphocyte ratio predicts poor survival following resection in late stage gastric cancer[J].J SurgOncol,2011,104(5):504
[12]Shimada H,Takiguchi N,Kainuma O,et al.High preoperative neutrophil-lymphocyte ratio predicts poor survival in patients with gastric cancer[J].Gastric Cancer,2010,13(3):170
[13]Pan Q X,Su Z J,Zhang J H,et al.A comparison of the prognostic value of preoperative inflammation-based scores and TNM stage in patients with gastric cancer[J].Onco Targets Ther,2015,8:1375
[14]Wang D S,Ren C,Qiu M Z,et al.Comparison of the prognostic value of various preoperative inflammation-based factors in patients with stage III gastric cancer[J].TumourBiol,2012,33(3):749
[15]Gu X B,Gao X S,Cui M,et al.Clinicopathological and prognostic significance of platelet to lymphocyte ratio in patients with gastric cancer[J].Oncotarget,2016,7(31):49878
[16]Sun X W,Liu X C,Liu J J,et al.Preoperative neutrophil-tolymphocyte ratio plus platelet-to-lymphocyte ratio in predicting survival for patients with stage I-II gastric cancer[J].Chin J Cancer,2016,35(1):57
