小鼠小细胞肺癌模型的建立
2018-01-26王子乔张雪茜孟凡荣
王子乔,张雪茜,孟凡荣,刘 喆
(天津医科大学医学检验学院,天津300070)
肺癌占全世界肿瘤发病率的12.7%、死亡率的18.2%,是目前最常见的引发死亡的疾病之一[1]。在临床和组织病理学上,肺癌分为两大类,小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non-small cell lung cancer,NSCLC)。小细胞肺癌大约占肺癌的20%,而更具有肿瘤异质性的非小细胞肺癌大约占80%[2]。小细胞肺癌与非小细胞肺癌相比恶性程度较高,转移早而广泛,尽管小细胞肺癌对化疗、放疗敏感,但很快出现复发或病情进展[3],目前尚无有效的靶向治疗药物,因此小细胞肺癌是研究肿瘤转移很好的模型。由于人小细胞肺癌中肿瘤抑制基因Trp53和Rb1的高突变率,所以Trp53和Rb1基因的缺失可能为建立小鼠小细胞肺癌模型提供了合理的手段[4],我们利用Cre-loxP系统来特异性敲除Trp53loxP/loxP;Rb1loxP/loxP小鼠肺上皮细胞中Rb1和Trp53,其Ad-Cre重组腺病毒是通过气管插管来感染小鼠。因此体内气道上皮和肺泡Ⅱ型细胞中敲除Rb1和Trp53,诱发小鼠的小细胞肺癌。
1 材料和方法
1.1 材料 Trp53loxP/loxP;Rb1loxP/loxP小鼠由中科院上海生化细胞研究所季红斌教授馈赠,所用腺病毒Ad-Cre来自 VECTOR BIOLABS(The Gene Delivery Company,货号 1045)。
1.2 试剂 PCR试剂盒购自北京全式金生物技术有限公司。DAB显色试剂购自北京中杉金桥。CgA抗体购自美国ABcam公司(货号ab15160)。Cgrp抗体购自Milipore(货号AB5920)。TTF-1抗体购自迈新试剂(货号MAB-0599)。小鼠麻醉剂购自美国Sigma公司(货号T48402)。
1.3 小鼠的鉴定 Trp53基因型鉴定引物:5′-CGCAATCCTTTATTCTGTTCG-3′,5′-AGCACATAG GAGGCAGAGAC-3′,5′-TGAGACAGGGTCTTGCTA TTG-3′。Rb1 基因型鉴定引物:5′-GAAAGGAAAGT CAGGGACATTGGG-3′,5′-GGCGTGTGCCATCAA TG-3′。
1.4 小鼠小细胞肺癌动物模型的建立 首先腹腔注射麻醉剂麻醉2月龄小鼠,再以Ad-CreCaPi(Ad-Cre CaPi:滴度为107PfU的Ad-Cre2μL加入到246.8μL的MEM中,再加入1.2μL的2mol/LCaCl2)的共沉淀物插管吸入小鼠气管,每只小鼠吸入约100μL。病毒诱导7个月后收集死亡小鼠的肺、肝等组织进行石蜡包埋、切片、HE染色以及相关病理分析。
1.5 免疫组化检测 通过对小鼠肺组织切片进行TTF-1、CgA、Cgrp等特异性标记蛋白的免疫组化染色,可确定肿瘤细胞是否表达 TTF-1、CgA、Cgrp,从而确定是否为小细胞肺癌。
2 结果
2.1 小鼠的鉴定 取小鼠尾部组织消化并提取基因组DNA,以基因组DNA为模板进行聚合酶链式反应,扩增得到Trp53loxP/loxP和WT对照小鼠的产物以及Rb1loxP/loxP和WT对照小鼠的产物,鉴定产物见图1。

图1 小鼠基因型鉴定Fig 1 PCR result of mouse genome DNA
2.2 小鼠小细胞肺癌模型的建立 17只Trp53loxP/loxP;Rb1loxP/loxP小鼠成功给予Ad-Cre病毒,病毒处理后小鼠质量逐渐降低,最终有11只(65%)小鼠造模成功。约7个月后,小鼠开始死亡,解剖死亡小鼠后肺部可观察到大量结节,暗示肺部肿瘤的形成是小鼠致死的主要原因。肺癌发生小鼠肺部表型见图2。
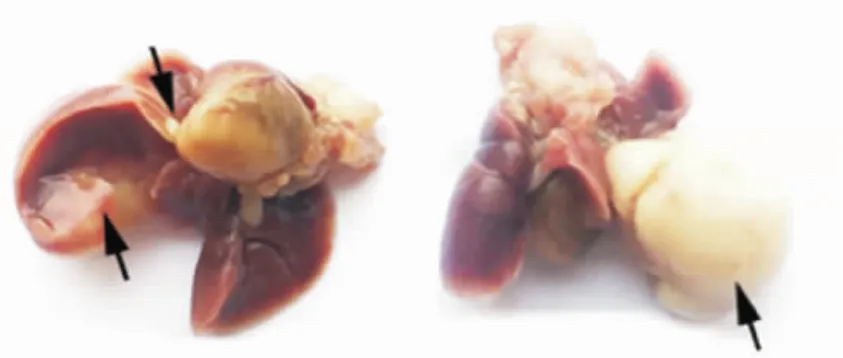
图2 小鼠肺部形成结节(黑色箭头所示为结节)Fig 2 Pulmonary nodules in mouse lung(Black arrow indicates pulmonary nodules)
2.3 小鼠肺组织切片病理染色 收集小鼠肺组织石蜡切片并进行HE染色,发现肺部有大量肿瘤灶的形成,且肿瘤细胞较小,挤压变形,核浆比增大,呈现明显的小细胞肺癌的特性。小鼠肺部切片HE染色结果见图3。
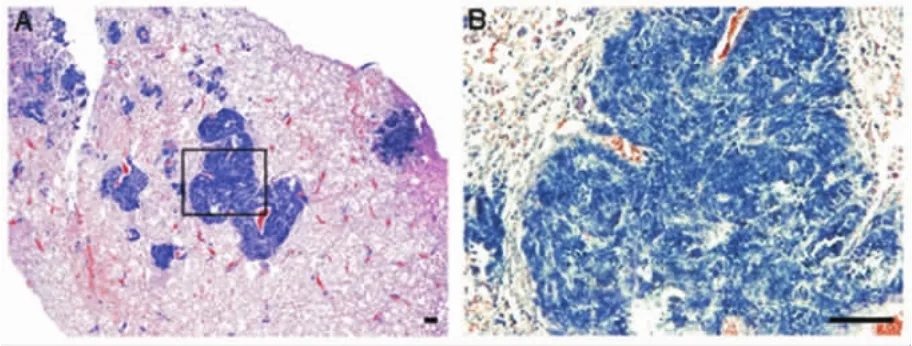
A.小鼠肺组织HE染色显示肿瘤形成;B.A图区域放大。标尺:100μm图3 小鼠肺组织切片HE染色Fig 3 Representative HE stain of lungs from mice
2.4 小鼠肺组织切片免疫组化染色 将上述肿瘤组织切片分别进行TTF-1、CgA、Cgrp免疫组化染色(图4),发现在肺部肿瘤灶中TTF-1、CgA、Cgrp的表达水平显著升高,大部分肿瘤细胞呈现TTF-1、CgA阳性以及Cgrp阳性,说明小鼠肺部肿瘤为小细胞肺癌。

图4 小鼠肺组织TTF-1、CgA、Cgrp免疫组化染色Fig 4 IHCstainingwithanti-TTF-1,anti-CgA,anti-Cgrpperformed on lung tissues
2.5 小鼠小细胞肺癌模型的肝转移 对死亡小鼠进行解剖分析,发现小鼠的肝组织上出现大量结节(图5),通过石蜡切片及病理染色,肝组织中肿瘤细胞形态与肺部肿瘤细胞病理染色结果相似,说明小鼠肺部小细胞肺癌发生了肝转移。
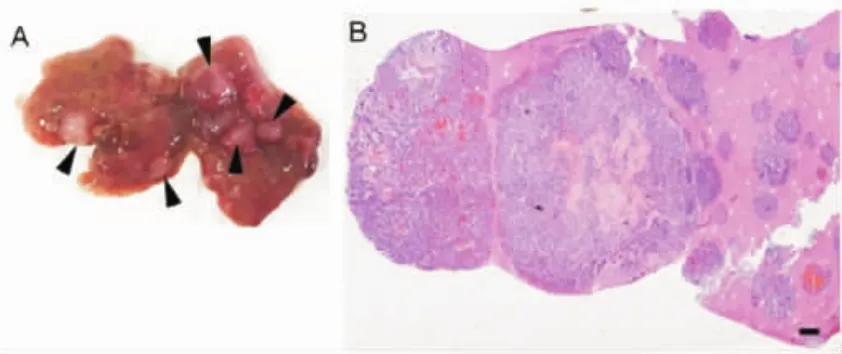
图5 小鼠小细胞肺癌的肝转移Fig 5 Liver metastasis of small cell lung cancer in mice
3 讨论
肺癌是目前世界上致死率最高的主要疾病之一,它是一个庞大的疾病分类,包含了多种不同的表型以及遗传突变,暗示着肺癌是一种高度异质性的疾病[5]。因此肺癌被分为多个不同的类型,其中最广泛应用的分类是小细胞肺癌和非小细胞肺癌。非小细胞肺癌是肺癌中最常见的一种,又可以分为腺癌、鳞癌和大细胞肺癌[6]。小细胞肺癌约占所有肺癌中的15%,具有神经内分泌细胞的特性[1]。根据2004年世界卫生组织的分类,小细胞肺癌是神经内分泌型肺癌的一种,代表了侵袭能力最高的一类肺癌[7]。在近10年中,对小细胞肺癌的治疗仍然没有新的手段,5年的生存率仍保持在7%以下。基因组学分析发现,在小细胞肺癌中存在多种重要基因突变,这些突变在小鼠小细胞肺癌模型中也得到了验证[5]。为了给小细胞肺癌的临床诊治提供新的依据,加深对小细胞肺癌的起始、进展、转移和抗药性的细胞以及分子机制的理解显得至关重要,但是到目前为止,仍然缺乏小细胞肺癌的小鼠模型。
由于人小细胞肺癌中肿瘤抑制基因Trp53和Rb1的高突变率,所以Trp53和Rb1基因的缺失可能为建立一个小鼠小细胞肺癌模型提供了合理的手段[4]。根据已有的研究,在小鼠神经内分泌型肿瘤的形成过程中,单独缺失Rb1或者Trp53并不会引起细胞凋亡[8],Rb1和Trp53是以一种协同作用的方式来发挥肿瘤抑制作用的,因此Rb1和Trp53的缺失是神经内分泌型肿瘤形成的先决条件[9]。
Trp53或Rb1缺失小鼠对于研究肿瘤进程有相当重要的价值,在小鼠肺组织中敲除Trp53会产生肺腺癌[10]。而Ad-Cre病毒诱导的Rb1在肺上皮中缺失直到第18个月都不会产生任何肺肿瘤,同时在这些小鼠中也不能检测到神经内分泌细胞的异常增生。因此单独的Rb1缺失并不足以诱导神经内分泌肿瘤的形成,进一步的肿瘤进程可能还需要抑制Trp53介导的细胞凋亡[9]。根据已有的报道,Rb1与Trp53同时缺失会使得人肺腺癌更易向小细胞肺癌转化[11]。在本研究中,我们利用Trp53loxP/loxP;Rb1loxP/loxP小鼠,通过肺部气管插管给予Ad-Cre重组腺病毒来诱导小鼠肺上皮细胞中Trp53以及Rb1的特异性缺失,从而建立了小鼠肺癌模型,并通过病理染色及TTF-1、CgA、Cgrp的免疫组化染色进一步确定了该肺癌模型为小细胞肺癌模型。
对肝组织的病理分析发现,小鼠肺组织的癌细胞已经扩散到肝脏等组织中,说明构建的小鼠小细胞肺癌模型具有高度侵袭性,也进一步证实了该小鼠小细胞肺癌模型[12]与人小细胞肺癌有高度的相似性,它也具有向其他功能器官,如脑、肾上腺、骨、卵巢转移的潜能。该模型为研究小细胞肺癌的起始和早期提供了实验工具,为临床上小细胞肺癌化疗策略以及化疗药物的筛选提供了实验手段。
[1] Van Meerbeeck J P,Fennell D A,De Ruysscher D K.Small-cell lung cancer[J].Lancet,2011,378(9804):1741
[2] Rom W N,Hay J G,Lee T C,et al.Molecular and genetic aspects of lung cancer[J].Am J Respir Crit Care Med,2000,161(4 Pt 1):1355
[3] Fischer B,Arcaro A.Current status of clinical trials for small cell lung cancer[J].Rev Recent Clin Trials,2008,3(1):40
[4] Sattler M,Salgia R.Molecular and cellular biology of small cell lung cancer[J].Semin Oncol,2003,30(1):57
[5] Semenova E A,Nagel R,Berns A.Origins,genetic landscape,and emerging therapies of small cell lung cancer[J].Genes Dev,2015,29(14):1447
[6] Kamangar F,Dores G M,Anderson W F.Patterns of cancer incidence,mortality,and prevalence across five continents:defining priorities to reduce cancer disparities in different geographic regions of the world[J].J Clin Oncol,2006,24(14):2137
[7] Linnoila R I.Functional facets of the pulmonary neuroendocrine system[J].Lab Invest,2006,86(5):425
[8] Huun J,Lonning P E,Knappskog S.Effects of concomitant inactivation of p53 and pRb on response to doxorubicin treatment in breast cancer cell lines[J].Cell Death Discov,2017,3:17026
[9] Meuwissen R,Linn S C,Linnoila R I,et al.Induction of small cell lung cancer by somatic inactivation of both Trp53 and Rb1 in a conditional mouse model[J].Cancer Cell,2003,4(3):181
[10]Donehower L A.The p53-deficient mouse:a model for basic and applied cancer studies[J].Semin Cancer Biol,1996,7(5):269
[11]Lee J K,Lee J,Kim S,et al.Clonal history and genetic predictors of transformation into small -cell carcinomas from lung adenocarcinomas[J].J Clin Oncol,2017,12:JCO2016719096
[12]Abe R,Donnelly S C,Peng T,et al.Peripheral blood fibrocytes:differentiation pathway and migration to wound sites[J].J Immunol,2001,166(12):7556
