蒿鳖养阴软坚方通过Nrf2/γ-GCS信号转导通路抑制酒精性肝纤维化作用及其机制
2018-01-26李杉杉刘悦唐诗慧方步武
李杉杉,刘悦,唐诗慧,方步武
(天津医科大学药理学系,天津300070)
肝星状细胞(hepatic stellate cells,HSCs)是肝纤维化发病的关键细胞。细胞外基质(extracellular matrix,ECM)合成与其降解平衡遭到外界因素破坏,导致肝脏内部ECM合成过多同时降解太少而形成肝纤维化[1]。常年过量摄入酒精可导致机体获得酒精肝病,临床常见特征为肝脏脂肪性病变同时炎症损伤,严重时可产生肝纤维化,最终演变为难以逆转的肝硬化,甚至于无法挽救的肝癌[2]。本实验小组研究的复方药物主要由中药白花蛇舌草、鳖甲、地瑜、虎杖、青蒿等构成。该方剂的组方原则为活血化疲、清热利湿、软坚散结,其组成药物对治疗慢性肝炎、肝纤维化有较好的疗效[3]。本课题组前期工作证明,先水后醇60%提取方案的蒿鳖养阴软坚方对大鼠肝星状细胞具有抑制作用。本实验在制备的酒精性大鼠肝纤维化模型上,进一步研究其他不同提取方案的蒿鳖养阴软坚方抗肝纤维化的作用及机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级健康Wistar大鼠80只,雌雄各半,体质量120~150 g,由军事医学科学院实验动物中心提供。合格证号:SCXK-(军)2016-014。实验前,大鼠在动物房适应环境7日,自由进食正常大鼠饲料及饮水。动物房温度20~22℃,24 h恒温。
1.1.2 试剂及仪器 复方鳖甲软肝片:规格250 mg,天津市南开医院提供,批号:Z19991011。BCA蛋白浓度测定试剂盒:江苏碧云天生物技术研究所,产品编号:P0010。Nrf2抗体:武汉博士德生物工程有限公司,批号:PB0327。γ-GCS抗体:武汉博士德生物工程有限公司,批号:PB0197。β-actin抗体:碧云天生物技术研究所,产品编号:AA128。辣根过氧化物酶标记山羊抗兔lgG(H+L):碧云天生物技术研究所,批号:K9908。兔超敏二步法检测试剂盒:北京中杉金桥生物技术有限公司,编号:PV-9001。垂直电泳槽(Bio-rad公司),高速冷冻离心机(Sigma公司)。
1.2 方法
1.2.1 复方提取 先水后醇60%复方提取方案:每份药材称取141.6 g,先将鳖甲加入6倍量总药材体积的水浸泡2 h,加入剩下的其余药材共同文火煎煮1次,1次1 h,过滤并收集水提液。再向剩余药渣中加入6倍量总药材体积的60%乙醇共同文火煎煮两次,每次30 min,过滤并收集醇提液,次日用旋蒸仪进行水提液、醇提液的浓缩备用。复方先水后醇95%提取方案:每份药材称取141.6 g,先将鳖甲加入6倍量总药材体积的水浸泡2 h,加入剩下的其余药材共同文火煎煮1次,1次1 h,过滤并收集水提液。再向剩余药渣中加入6倍量总药材体积的95%乙醇共同文火煎煮两次,每次30 min,过滤并收集醇提液,次日用旋蒸仪进行水提液、醇提液的浓缩备用。复方水提醇沉提取方案:每份药材称取141.6 g,先将鳖甲加入8倍量总药材体积的水浸泡2 h,加入剩下的其余药材共同文火煎煮1次,1次2 h,过滤并收集水提液。待水提液冷却后,边搅拌边加入一定量的95%乙醇,静置于4℃冰箱并过夜。次日缓慢取上清液并用真空泵抽滤,收集所得液体,浓缩备用。
1.2.2 模型制备 造模大鼠8:00灌胃白酒,每日1次,酒精浓度逐渐增加,依次为10%、20%、30%、40%、50%、60%,每个浓度灌胃2 d,最后增至65%并维持该浓度再灌胃8周,体积均为1.2 mL。100g-1·d-1(相当于 6.2 g·kg-1·d-1),并用吡唑 25 mg·kg-1·d-1溶于酒内灌胃。期间,正常组大鼠正常进食动物标准饲料并每天灌胃同一组蒸馏水。
1.2.3 分组给药 对全部80只大鼠按质量随机区组法分为正常组,模型组,先水后醇60%组,先水后醇95%高、低剂量组,水提醇沉高、低剂量组,复方鳖甲软肝片组。同时对6个治疗组进行预防性用药,每天1次于傍晚灌胃不同提取方案的复方治疗药物,以复方鳖甲软肝片的临床等效剂量 [按公式dB=dA*(RB/RA)*(WA/WB)]计算出各组大鼠用药剂量,由此算得的蒿鳖养阴软坚方用量作为低剂量(2.59 g·kg-1·d-1)以该剂量的10倍作为高剂量(8.2g·kg-1·d-1);同时软肝片组剂量为0.09mg·kg-1·d-1。正常组每天早上8点和下午5点进行灌胃蒸馏水,模型组则每天下午5点灌胃蒸馏水。每日1次,维持10周。
1.2.4 动物处理 10周实验结束后处理动物。记录大鼠质量,腹腔注射乌拉坦(质量分数20%)(0.5 mL/100 g),大鼠取卧位切开腹部,腹腔静脉取血制备血清,-20℃保管。及时分离存取3部分肝组织,先用10%中性缓冲甲醛液固定,再以脱水剂(氯仿∶甲醇=2∶1,V/V)脱脂脱水,放入-80 ℃保存。
1.2.5 肝组织中羟脯氨酸含量测定 采用酸水解法测定羟脯氨酸含量。将肝组织用研钵研磨成粉,60℃烘干粉末至恒重,称取30 mg放入定做的透明的15 mL安瓿瓶中,加入8 mL 6 mol/L的HCl,用酒精喷灯封口,置烘箱内105℃恒温水解18 h,冷却后过滤,取50 μL滤液于试管内,60℃烘干。依次加入50%异丙醇、0.56%氯胺T溶液和ER液,充分混匀,50℃水浴90 min。蒸馏水调零,试剂空白校正,测定波长558 nm处OD值。对肝纤维化程度进行定量分析。
1.2.6 肝组织Nrf2蛋白与γ-GCS蛋白表达水平分析 采用Western blotting法。称取约50 mg的肝组织,加入约200 μL RIPA裂解液。冰浴条件下匀浆,使其充分裂解。4℃10 000×g离心5 min,取上清液,-20℃保存。BCA蛋白质浓度测定试剂盒进行蛋白定量。上样相当于50 μg的总蛋白,15%的SDSPAGE电泳分离,使其转至PVDF膜上,用含5%的脱脂奶粉的TBST室温封闭2 h,一抗(1∶500)于4℃孵育过夜,第2天置于二抗中(1∶1 000)室温孵育2 h。使用ECL试剂盒进行显色反应。β-actin作为正常蛋白水平的对照。胶片扫描后采用Image J软件进行图像分析。
1.2.7 肝组织Nrf2蛋白与γ-GCS蛋白的病理表达 采用免疫组化法测定。分别用二甲苯、无水乙醇、95%乙醇、75%乙醇梯度脱蜡至水,3%H2O2封闭内源性过氧化物酶,于柠檬酸-柠檬酸钠缓冲溶液(pH6.8)中高压,10%正常羊血清孵育,滴加一抗,4℃冰箱中过夜,PBS缓冲液振荡清洗后分别滴加二抗,DAB显色,苏木素复染,常规封片。采用Image-Pro Plus软件分析免疫组化图片阳性面积(Area)以及其累计光密度(IOD)值,结果以平均光密度(meandensity=IOD/Area)表示。
2 结果
2.1 不同提取方案的蒿鳖养阴软坚方对实验大鼠一般情况的影响 正常组大鼠生长良好,饮食规律;模型组大鼠日渐消瘦,行为迟缓,进食减少;各治疗组大鼠体瘦,但活动尚好,先水后醇95%提取组和复方鳖甲软肝片组之间无明显差异。
2.2 肝组织中胶原蛋白含量结果 与正常组比较,模型组大鼠肝组织胶原蛋白含量增高(P<0.01);与模型组比较,各治疗组大鼠肝组织胶原含量均降低(P<0.05),且先水后醇 60%组,先水后醇 95%高、低剂量组以及复方鳖甲软肝片组胶原蛋白含量显著降低(P<0.01)。与水提醇沉高剂量组比较,先水后醇60%高剂量组、先水后醇95%高剂量组胶原蛋白含量显著降低(P<0.01)(表 1)。
2.3 肝组织Nrf2蛋白与γ-GCS蛋白的Western blotting结果 与正常组比较,模型组大鼠肝组织Nrf2蛋白与 γ-GCS蛋白表达增高(P<0.01);与模型组比较,各治疗组大鼠肝组织Nrf2蛋白与γ-GCS蛋白表达增高(P<0.01);与先水后醇60%组比较,先水后醇95%高剂量组肝组织Nrf2蛋白与γ-GCS蛋白表达增高(P<0.01)(表 2、图 2)。
表1 酒精性肝纤维化大鼠肝组织中胶原蛋白含量变化 (±s)Tab 1 Changes of collagen content in the liver tissue of alcoholic liver fibrosis rats (±s)
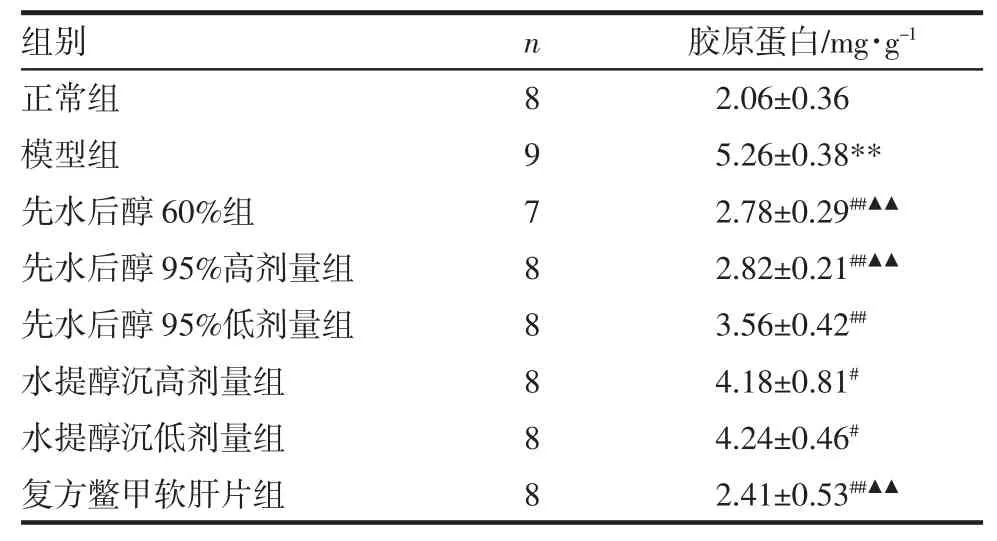
表1 酒精性肝纤维化大鼠肝组织中胶原蛋白含量变化 (±s)Tab 1 Changes of collagen content in the liver tissue of alcoholic liver fibrosis rats (±s)
与正常组比较 **P<0.01;与模型组比较 #P<0.05,##P<0.01;与水提醇沉高剂量组比较▲▲P<0.01
组别 n 胶原蛋白/mg·g-1正常组 8 2.06±0.36模型组 9 5.26±0.38**先水后醇 60%组 7 2.78±0.29##▲▲先水后醇 95%高剂量组 8 2.82±0.21##▲▲先水后醇 95%低剂量组 8 3.56±0.42##水提醇沉高剂量组 8 4.18±0.81#水提醇沉低剂量组 8 4.24±0.46#复方鳖甲软肝片组 8 2.41±0.53##▲▲
表2 不同提取方案复方对酒精性肝纤维化大鼠肝组织中Nrf2和γ-GCS 蛋白表达的影响 (±s,n=8)Tab 2 Effects of different extraction schemes of HBYYRJP on the expressions of Nrf2 and γ-GCS (±s,n=8)
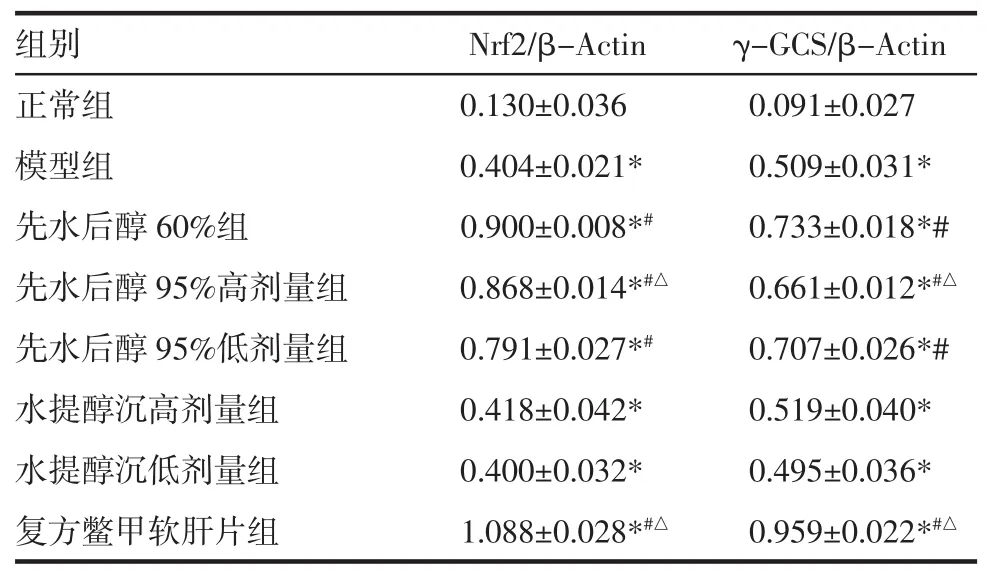
表2 不同提取方案复方对酒精性肝纤维化大鼠肝组织中Nrf2和γ-GCS 蛋白表达的影响 (±s,n=8)Tab 2 Effects of different extraction schemes of HBYYRJP on the expressions of Nrf2 and γ-GCS (±s,n=8)
与正常组比较,*P<0.01;与模型组比较,#P<0.01;与先水后醇 60%提取方案组比较,△P<0.01
组别 Nrf2/β-Actin γ-GCS/β-Actin正常组 0.130±0.036 0.091±0.027模型组 0.404±0.021* 0.509±0.031*先水后醇 60%组 0.900±0.008*# 0.733±0.018*#先水后醇 95%高剂量组 0.868±0.014*#△ 0.661±0.012*#△先水后醇 95%低剂量组 0.791±0.027*# 0.707±0.026*#水提醇沉高剂量组 0.418±0.042* 0.519±0.040*水提醇沉低剂量组 0.400±0.032* 0.495±0.036*复方鳖甲软肝片组 1.088±0.028*#△ 0.959±0.022*#△

图2 不同提取方案的复方对肝组织中Nrf2蛋白与γ-GCS蛋白表达的影响Fig 2 Effects of different extraction schemes of HBYYRJP on the expressions of Nrf2 and γ-GCS in liver tissue
2.4 肝组织Nrf2与γ-GCS蛋白的免疫组化染色结果 与正常组比较,模型组可显著上调肝细胞胞浆中的 Nrf2和 γ-GCS蛋白的表达(P<0.01);与模型组比较,先水后醇95%高、低剂量组的细胞核和细胞浆中Nrf2和γ-GCS蛋白的棕色颗粒明显增多(P<0.01);与低剂量组比较,高剂量组出现明显的核转位(P<0.01)(表 3、图 3、4)。
表3 先水后醇95%提取方案对大鼠肝组织Nrf2和γ-GCS蛋白表达的影响 (±s,n=8)Tab 3 Effects of water followed by 95%ethyl alcohol extraction scheme on the expressions of Nrf2 and γ-GCS in the liver tissue of alcoholic liver fibrosis rats (±s,n=8)
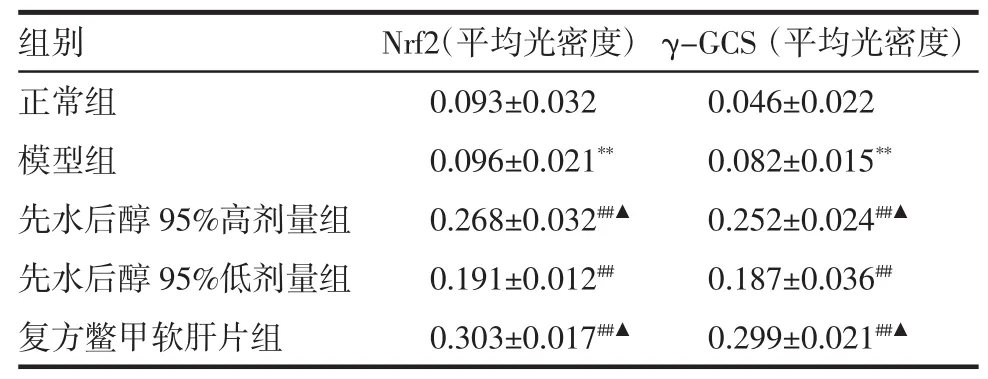
表3 先水后醇95%提取方案对大鼠肝组织Nrf2和γ-GCS蛋白表达的影响 (±s,n=8)Tab 3 Effects of water followed by 95%ethyl alcohol extraction scheme on the expressions of Nrf2 and γ-GCS in the liver tissue of alcoholic liver fibrosis rats (±s,n=8)
与正常组比较 **P<0.01;与模型组比较 ##P<0.01;与低剂量组比较▲P<0.01
组别 Nrf2(平均光密度) γ-GCS(平均光密度)正常组 0.093±0.032 0.046±0.022模型组 0.096±0.021** 0.082±0.015**先水后醇 95%高剂量组 0.268±0.032##▲ 0.252±0.024##▲先水后醇 95%低剂量组 0.191±0.012## 0.187±0.036##复方鳖甲软肝片组 0.303±0.017##▲ 0.299±0.021##▲
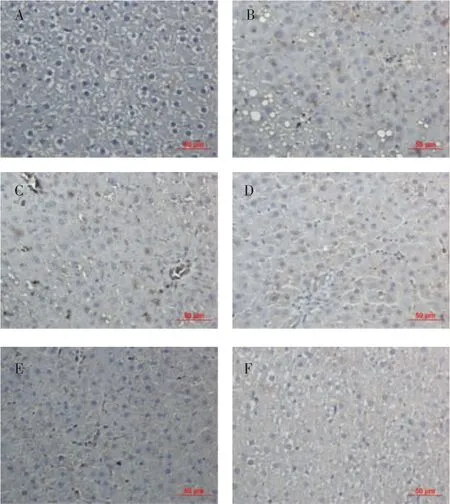
图3 先水后醇95%提取方案对大鼠肝组织Nrf2蛋白表达的影响(×400)Fig 3 Effectsofwaterfollowedby95%ethylalcoholextractionscheme on the expressions of Nrf2 in the liver tissue of alcoholic liver fibrosis rats(×400)
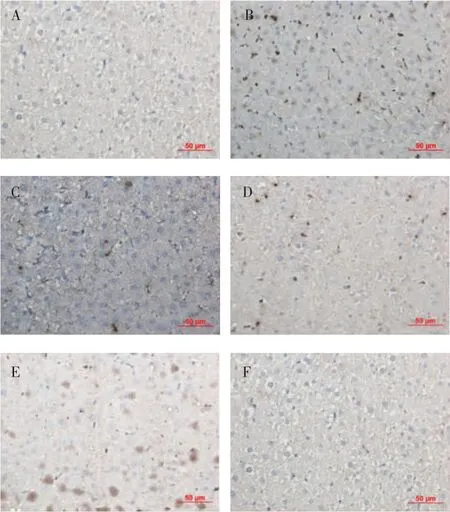
图4 先水后醇95%提取方案对大鼠肝组织γ-GCS蛋白表达的影响(×400)Fig 4 Effectsofwaterfollowedby95%ethylalcoholextractionscheme on the expresstion of γ-GCS in the liver tissue of alcoholic liver fibrosis rats(×400)
3 讨论
酒精性肝病(alcoholic liver disease,ALD)包含着较广范围的肝病,即包括脂肪肝(脂肪性肝炎)以及更严重的肝损伤类型,如酒精性脂肪肝、肝纤维化、肝硬化以及肝细胞癌(HCC)[4]。ALD拥有着庞大且繁杂的发病机制,乙醇进入肝脏代谢生成乙酸过程中产生的活性氧簇(ROS)发挥了重要作用[5]。
ROS通过激发相关通路参与机体氧化应激反应,进一步加剧机体肝纤维化进程,Nrf2/ARE通路就是现在肝纤维化相关研究领域的热点。研究发现,ROS通过产生一定的细胞内刺激,导致Keap1蛋白构象发生改变,会与Nrf2解离并促进其移位入核[6],核转录相关因子-2(Nrf2)可以调控一系列具有抗氧化和解毒作用基因的转录因子。通过结合抗氧化反应元件(ARE)启动子序列,激活与GSH合成与再生表达相关的酶,包括γ-谷氨酰半胱氨酸连接酶的催化和调控亚单位(即γ-GCS以及GCLm)[7]。Nrf2与γ-GCS抗氧化因子之间的协同作用,有利于机体对抗自由基避免肝细胞损伤,同时增强γ-GCS、GSH等相关酶活性在氧化防御中的关键作用,进而减慢肝纤维化进程[8]。
中药丹参、鳖甲、白花蛇舌草、虎杖以及青蒿等成分是蒿鳖养阴软坚方的主要组成药物。韩仕庆[9]发现丹参含药血清可以抑制HSCs的活化,可能是通过诱导HSCs中Smo蛋白和α-SMA mRNA的活化表达发挥其作用。前期体内实验已表明先水后醇60%提取方案的复方通过抗脂质过氧化损伤从而减轻酒精性肝损伤。
本研究旨在进一步探讨其他提取方案的蒿鳖养阴软坚方抗肝纤维化的作用机制。实验采用的酒精性大鼠模型是经过改良且最为接近人类长期酗酒肝纤维化病理过程[10]。实验结果表明,正常组、先水后醇60%提取方案组以及先水后醇95%提取方案大鼠肝组织内胶原蛋白含量显著低于模型组,而水提醇沉提取方案效果不佳。说明先水后醇提取方案的复方可以减少肝脏中沉积的胶原纤维进而防止ECM沉积,且醇提浓度较低时更明显,提示复方中的醇溶性成分较水溶性成分抗肝纤维化作用更明显。此外,先水后醇95%提取方案组大鼠肝组织中Nrf2和γ-GCS蛋白表达量较正常组和模型组显著提高,说明此提取方案得到的复方通过上调Nrf2和γ-GCS蛋白表达发挥抗氧化应激作用,从而减轻甚至逆转酒精性肝纤维化。此外,高剂量组Nrf2和γ-GCS蛋白表达量高于其他治疗组,说明此提取方案的复方上调Nrf2和γ-GCS蛋白表达抗纤维化作用呈一定剂量依赖性。
综上所述,先水后醇95%提取方案的蒿鳖养阴软坚方通过上调Nrf2/γ-GCS通路,增加Nrf2和γ-GCS蛋白表达,显著降低肝组织胶原蛋白含量,从而发挥抗肝纤维化的作用。本实验研究结果为提取工艺优化后的蒿鳖养阴软坚方在治疗酒精性肝纤维化方面提供了一定的理论基础和实验依据。
[1] Fausther M,Pritchard M T,Popov Y V,et al.Contribution of liver nonparenchymal cells to hepatic fibrosis:interactions with the local microenvironment[J].Bio Med Res Int,2017,59(4):1577
[2] Wang K.Molecular mechanisms of hepaticapoptosis[J].Cell Death Dis,2016,5(1):202
[3] 彭龙希,高思楠,王媛,等.青蒿琥酯在大鼠体内外抗肝纤维化的作用[J].中国药理学通报,2016,32(5):658
[4] Dubuquoy L.Lipocalin 2 highlights the complex role of neutrophils in alcoholic liver disease[J].J Hepatol,2016,64(4):770
[5] Singh S,Arcaroli J,Thompson D C,et al.Acetaldehyde and retinaldehyde metabolizing enzymes in colon and pancreatic cancers[J].BiologicalBasisofAlcoholInducedCancer,2017,7(1):281[6] Tessoulin B,Descamps G,Moreau P,et al.PRIMA-1 met induces myeloma cell death independent of Nrf2 by impairing the GSH/ROS balance[J].Blood,2016,124(10):1626
[7] Lushchak V I.Free radicals,reactive oxygen species,oxidative stress and its classification[J].Chemico Bio Int,2016,224(2):164
[8] Glade M J,Meguid M M.A Glance,et al.ethanol consumption,GSH suppressionandoxidativeliverdamage[J].Nutrition,2017,33(2):199[9] 韩仕庆,曹文富,何娟,等.丹参含药血清对HSCs中Smo和α-SMA表达的影响[J].中药药理与临床,2016,31(5):79
[10]Goutzourelas N,Stagos D,Housmekeridou A,et al.Grape pomace extract exerts antioxidant effects through an increase in GCS levels and GST activity in muscle and endothelial cells[J].Int J Mol Med,2016,36(6):433
