PCI术后消化道出血患者发生心脏缺血事件的危险因素分析
2018-01-26杨锦龙刘欢罗远林周学锋罗永全刘洪波
杨锦龙,刘欢,罗远林,周学锋,罗永全,刘洪波
冠状动脉粥样硬化性心脏病(冠心病)患者经皮冠状动脉(冠脉)介入术(PCI)后,接受阿司匹林、氯吡格雷联合抗血小板治疗已经成为预防支架内血栓形成的标准化治疗。据统计,我国2008年行PCI的患者约16万,2015年已超过50万[1]。由于行PCI的患者数目庞大,术后服用双联抗血小板治疗(DAPT)带来的副作用,尤其上消化道出血事件也越来越多。在行PCI的患者中有2.3%患者因服用双联抗血小板导致出血[2],一旦发生消化道出血,必将影响抗血小板治疗,甚至需停用抗血小板治疗,但随之而来的心脏缺血事件(CIE)的发生又是致命的,这使临床医生处于两难境地。一项美国研究纳入2006年~2012年共4 376 950例接受PCI治疗的患者,其中消化道出血发生率为1.1%,但院内死亡率从2006年的7.9%大幅上升至2012年的10.78%,2010年达到峰值的12%[3],可见PCI后一旦发生上消化道出血而导致CIE的发生会明显增加患者的院内死亡率。本研究通过回顾性分析117例PCI后DAPT导致上消化道出血的患者,根据是否发生CIE分为两组,分析两组间临床资料并进一步统计其危险因素,为我们更好地管理此类患者提供参考。
1 资料与方法
1.1 研究对象和分组 收集2006年1月~2016年1月于四川省乐山市人民医院行PCI治疗后应用阿司匹林联合氯吡格雷抗血小板治疗导致消化道出血并住院治疗的117例冠心病患者资料。入选标准:①所有患者均为PCI后1年内,且按医嘱能够规律口服阿司匹林100 mg/d,氯吡格雷75 mg/d抗血小板治疗者[4];②上消化道出血定义:发生呕血或黑便的患者,经临床判断符合上消化道出血诊断标准;无呕血、黑便,仅为大便隐血试验阳性患者,均通过内镜检查确诊上消化道出血,并排除其他部位所致的出血。排除标准:①消化道肿瘤、肝硬化失代偿期胃底管静脉曲张的患者;②口服其他非甾体类抗炎药物、糖皮质激素、不明成分中成药及保健类药物;③血液病及凝血功能障碍;④严重肝肾功能不全、其他心脑肝肺肾等器官严重疾病。
1.2 方法 收集患者相关病史及一般资料,记录所有临床数据,包括:相关病史、是否合并有心力衰竭、是否输血治疗、住院期间最低血细胞比容、抗血小板药物及其他相关药物使用情况等。根据患者有无发生CIE分为:CIE组(n=32)和非CIE组(n=85)。CIE定义为:明确缺血性胸痛、胸闷、心电图ST-T改变、心肌损伤标志物阳性。
1.3 统计学方法 应用SPSS 17.0软件进行统计分析。计量资料采用均数±标准差(±s)表示,两组间均数的比较采用t检验,计数资料采用例数(构成比)表示,组间比较采用χ2检验。采用Logistic回归分析发生CIE的危险因素。双侧P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床特征的对比 对纳入研究的117例患者,根据有无发生CIE分为:CIE组和非CIE组。比较两组间的一般情况、相关病史、是否合并有心力衰竭、是否输血治疗、住院期间最低血细胞比容、抗血小板药物及其他相关药物使用情况等。结果显示:年龄、男性、糖尿病史、合并有心力衰竭、胃溃疡病史、出血前DAPT时间、出血后停用DAPT时间、出血后单独使用氯吡格雷差异均有统计学意义(P均<0.05),表1。
2.2 出血后发生CIE危险因素的分析 以是否发生CIE为自变量,以各危险因素为协变量,对各变量进行单因素及多因素Logistic回归分析,结果显示:年龄、男性、糖尿病史、合并有心力衰竭、胃溃疡病史、出血后停用DAPT时间均是PCI术后使用DAPT导致上消化道出血患者发生CIE的危险因素,而出血后单独使用氯吡格雷是其保护因素,表2。
3 讨论
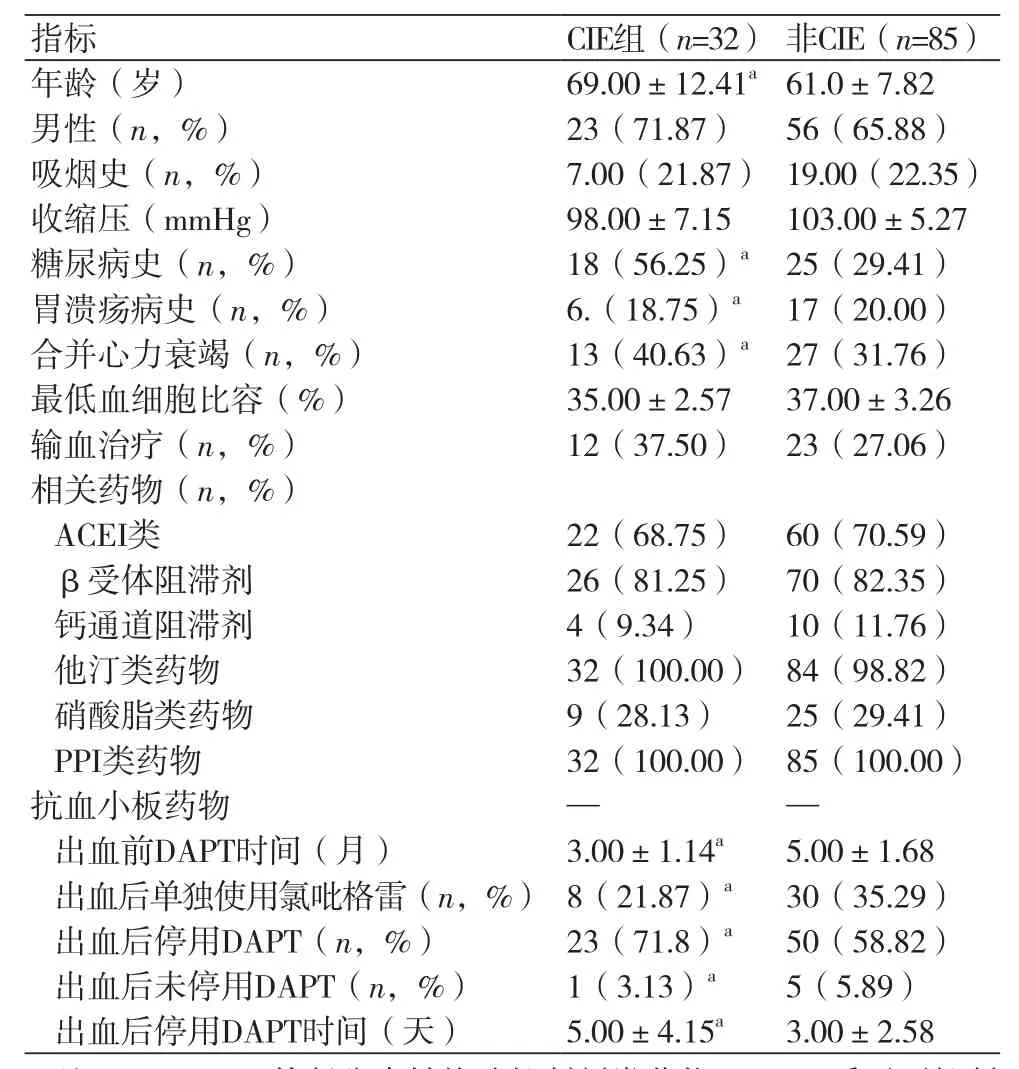
表1 两组患者临床特征的比较
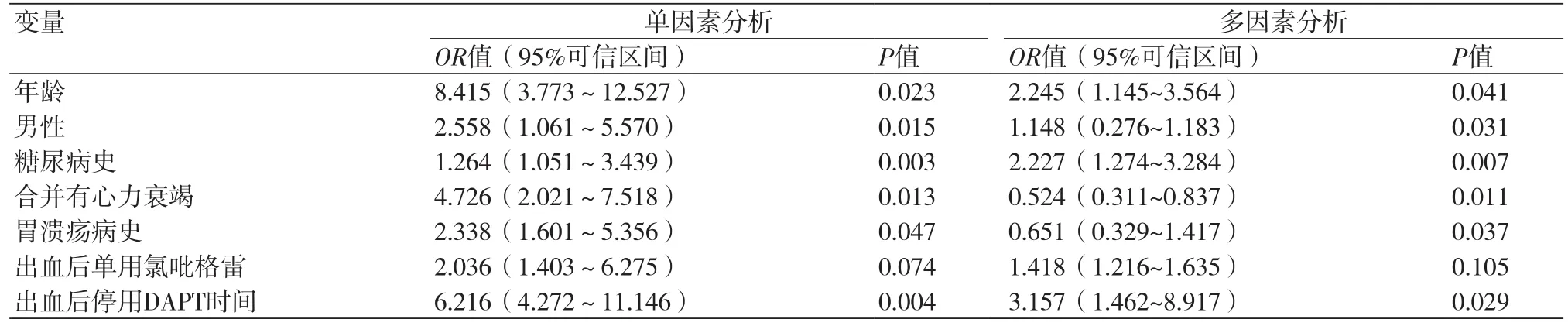
表2 Logistic回归分析结果
冠脉支架治疗在上世纪90年代开始,挽救了大量严重冠脉病变的患者,但在早期使用金属裸支架后,支架相关的血栓事件发生率高达10%~15%[5]。在抗血小板干预治疗后,术后12个月内支架相关血栓事件发生率降至1%左右[6]。2003年随着第一代药物涂层支架的上市,抗血小板治疗的治疗策略又发生了新的变化,近年来先后有大量临床实验如(CREDO、TRITON、PLATO)等研究证实,在急性冠脉综合征尤其是置入支架的患者,阿司匹林联合氯吡格雷的DAPT,服用1年以上获益更大[7]。有研究指出PCI术后停用抗血小板治疗,支架内血栓发生率增加约90倍,停用氯吡格雷,支架内血栓发生率增加约57倍[8]。然而PCI术后DAPT也导致上消化道出血的风险明显增加。在面对上消化道活动性出血时,常需停用抗血小板药物治疗,直到出血情况稳定。但某些患者因停用抗血小板药物会增加CIE的发生[9]。如何平衡出血风险与心脏缺血事件的发生率,根据不同患者的情况制定出合理的临床管理方案,对患者的预后尤为重要。本研究通过对纳入研究的117例冠心病患者PCI术后DAPT致消化道出血患者发生CIE的分析,发现年龄、男性、糖尿病史、合并有心力衰竭、胃溃疡病史、出血后停用DAPT均是PCI术后DAPT导致上消化道出血患者发生CIE的独立危险因素,而出血后单独使用氯吡格雷是其保护因素。
大量研究证实年龄和男性是冠心病患者发生CIE的独立危险因素[10],高龄患者是抗血小板药物消化道损伤的高危人群,年龄越大,危险越大,Honda等[11]报道年龄>80岁是PCI术后晚期出血事件的独立预测因素。消化道出血后必然导致血红蛋白下降,影响了正常的冠脉供需平衡引起CIE,同样在合并有心力衰竭时,心脏前后负荷的增加导致心输出量的减少,直接影响到冠脉灌注。大量循证医学证据表明糖尿病和冠心病两者互为危险因子,产生乘积效应,血糖异常可加速冠脉粥样硬化进程,是冠心病患者发生CIE的独立危险因素[12]。而消化性溃疡是PCI术后消化道出血独立危险因素,国内一个单中心的研究报道其优势比(OR)为12.68[13],消化道出血除了与DAPT对胃黏膜的损伤有直接关系外,与患者同时患有消化性溃疡明显相关。
本研究发现在同时患有消化性溃疡的患者中上消化道出血后CIE的发生率明显增加(P<0.05),溃疡面积大小和对胃黏膜不同程度的侵犯,进一步增加了DAPT出血风险以及出血后愈合的时间。PCI术前对胃溃疡患者筛查及预防性治疗可显著预防PCI术后DAPT导致上消化道出血,继而减少CIE。DAPT对消化道的损伤与时间和剂量呈正相关[14],然而本研究发现,PCI术后上消化道出血患者中DAPT时间较短的患者更容易发生CIE(P<0.05),可能与冠状动脉在支架植入后短时间内内皮化程度不完全以及心肌细胞的缺血预适应时间较短有关,需待进一步研究。临床上面对PCI术后消化道出血,大多选择在出血活动期停用DAPT治疗,而抗血小板空白时间直接增加CIE的风险,DAPT可引起对血小板聚集不可逆的抑制,一般在停用DAPT 5~7 d后,随着骨髓细胞产生一定数量的血小板取代已受抑制的外周血小板,血小板聚集功能逐渐恢复。本研究同样提示,停用DAPT时间较长的患者CIE的发生率明显增加(P<0.05),在出血稳定后尽快重启DAPT可有效的减少CIE。另外本研究还发现,PCI术后DAPT导致上消化道出血的患者单独使用氯吡格雷可显著减少CIE的发生(P<0.05)。这与两种药物不同抗血小板途径有关,阿司匹林在抗血小板同时增加胃黏膜屏障的损害,而氯吡格雷则主要是影响血小板二相聚集不破坏胃黏膜屏障。
综上所述,在临床上面对PCI术后使用DAPT导致上消化道出血患者,在积极控制消化道出血的同时应该密切评估患者心功能的变化,尤其是体液负荷增加会导致CIE的发生。在上消化道出血基本控制或出血量明显减少时,尽早重启抗血小板治疗,并在出血风险较小的患者建议单独使用氯吡格雷抗血小板治疗,可以有效减少此类患者CIE的发生。而对于高龄男性患者PCI术后使用DAPT致上消化道出血发生CIE的风险较高,更有有效的方法是在DAPT早期严格把握抗血小板治疗的适应证,通过筛查与根除幽门螺杆菌、应用H2受体拮抗剂或质子泵抑制剂预防消化道出血。
[1] 陈伟伟,高润霖,刘力生,等.《中国心血管病报告2015》概要[J]. 中国循环杂志,2016,31(6):617-22.
[2] Patel NJ,Pau D,Nalluri N,et al. Temporal Trends, Predictors, and Outcomes of In-Hospital Gastrointestinal Bleeding Associated With Percutaneous Coronary Intervention[J]. Am J Cardiol,2016,118(8):1150-7.
[3] Komiya R,Kamintani K,Kubo E,et al. Perioperative management and postoperative complication rates of patients on dual antiplatelet therapies after coronary drug eluting stent implantation[J].Masui,2014,63(6):629-35.
[4] 陈纪林,高立建. 经皮冠状动脉介入治疗术后双联抗血小板治疗研究进展[J]. 中国循环杂志,2014,29(3):161-3.
[5] Finkel JB,Marhefka GD,Weitz HH. Dual antiplatelet therapy with aspirin and clopidogrel: what is the risk in noncardiac surgery? A narrative review[J]. Hosp Pract (1995),2013,41(1):79-88.
[6] Karim S,Ador-Dionisio ST,Karim M,et al. Assessment of safety of performing percutaneous coronary intervention after a recent episode of gastrointestinal bleeding[J]. Acute Card Care, 2016,18(1):1-6.
[7] Levine GN,Bates ER,Blankenship JC,et al. 2011 ACCF/AHA/SCAI Guideline for Percutaneous Coronary Intervention: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines and the Society for Cardiovascular Angiography and Interventions[J]. JACC,2012,79(3):453.
[8] 中华医学会心血管病学分会,中华心血管病杂志编辑委员会. 抗血小板治疗中国专家共识[J]. 中华心血管病杂志,2013,41(3):183-94.
[9] Elmariah S,Mauri L,Doros G,et al. Extended duration dual antiplatelet therapy and mortality: a systematic review and meta-analysis[J]. Lancet,2015,385(9970):792-8.
[10] Chen PF,Wang DN,Chen K,et al. Outcomes of percutaneous coronary intervention in patients ≥75 years: one-center study in a Chinese patient group[J]. J Geriatr Crdiol,2015,12(6):626-33.
[11] Honda Y,Yamawaki M,Mori S,et al. Frequency and predictors of bleeding events after 2nd generation drug-eluting stent implantation differ depending on time after implantation[J]. J Cardiol,2017,69(4):632-9.
[12] Bertoluci MC,Rocha VZ. Cardiovascular risk assessment in patients with diabetes[J]. Diabetol Metab Syndr,2017,9:25.
[13] Lee JM,Park SY,Choi JH,et al. Clinical Risk Factors for Upper Gastrointestinal Bleeding after Percutaneous Coronary Intervention: A Single-Center Study[J]. Gut Liver, 2016,10(1):58-62.
[14] Sharma SK,Baber U. The Shifting Pendulum for DAPT After PCI:Balancing Long-Term Risks for Bleeding and Thrombosis[J]. J Am Coll Cardiol,2015,66(9):1046-9.
