气相色谱-质谱联用测定化妆品中硫酸二甲酯与硫酸二乙酯
2018-01-25吴楚森刘冬虹吴玉銮侯向昶冼燕萍
吴楚森,王 斌,王 莉,刘冬虹,吴玉銮,侯向昶,冼燕萍
(广州质量监督检测研究院,广东 广州 511447)
化妆品与人类生活密切相关,2014年化妆品类商品的国内销售总额达1 824.7亿元人民币,近3年平均增幅13.4%[1]。巨大的市场发展潜力对化妆品产品质量控制提出了更高的要求。我国现行的《化妆品安全技术规范》对化妆品中禁、限用组分进行了明确的规定,其中硫酸二甲酯和硫酸二乙酯为禁用组分[2]。化妆品工业生产中可能引入硫酸二甲酯和硫酸二乙酯。硫酸二甲酯属高毒类,其作用与芥子气相似,毒性比氯气大15倍[3]。国外动物实验报告表明,急性硫酸二甲酯中毒后可引起染色体畸变。硫酸二乙酯也可能引起遗传性基因损害和致癌。欧盟REACH法规将硫酸二甲酯和硫酸二乙酯列入高关注物质清单[4]。
关于药物、纺织品等样品中硫酸二甲酯和硫酸二乙酯的检测方法包括气相色谱法[5-7]、气相色谱-质谱联用法[8-9]、气相色谱-串联质谱法[10]、液相色谱-串联质谱法[11]。但针对化妆品中硫酸二甲酯和硫酸二乙酯的检测方法研究鲜见报道。
由于化妆品形态多样,包括固体、液体、乳状等,各类样品基体不同,成分复杂,且基质干扰多,因此需根据检测目标,选择合适的样品前处理技术[12]。本文采用溶剂萃取的方式,过滤后以GC-MS测定,优化了提取溶剂种类、体积,考察了方法的基质效应,建立了水基类、乳液类、膏霜类、啫喱类、粉类和油状化妆品中硫酸二甲酯和硫酸二乙酯的气相色谱-质谱联用检测方法。
1 实验部分
1.1 仪器与试剂
7890A-5975C气相色谱质谱联用仪(GC-MS,美国安捷伦公司),配EI源;涡旋混匀器(德国IKA公司)。
硫酸二甲酯和硫酸二乙酯标准品,纯度均大于99%,购自德国Dr.Ehrenstorfer公司;甲醇(色谱纯,美国Fisher公司),四氢呋喃、乙酸乙酯、氯化钠(分析纯,广州化学试剂厂),超纯水(18.2 MΩ·cm)。
1.2 标准溶液的配制
用甲醇分别将硫酸二甲酯和硫酸二乙酯配成质量浓度为1 000.0 mg/L的标准储备液。分别吸取适量的2种化合物标准储备液,用甲醇配成质量浓度为50 mg/L的混合标准溶液。均置于-4 ℃保存。临用前,以甲醇逐级稀释成所需浓度的系列标准工作溶液。
1.3 样品处理
1.3.1水基类、乳液类、膏霜类与啫喱类化妆品称取试样0.2 g(精确至0.01 g)于15 mL具塞玻璃离心管中,加入4.0 mL乙酸乙酯和0.5 g无水硫酸钠,涡旋振荡2 min,2 500 r/min离心3 min,取清液过0.22 μm滤膜,待测定。
1.3.2粉类化妆品称取试样0.2 g(精确至0.01 g)于15 mL具塞玻璃离心管中,加入4.0 mL甲醇和0.5 g无水硫酸钠,涡旋振荡2 min,2 500 r/min离心3 min,取清液过0.22 μm滤膜,待测定。
1.3.3蜡基类化妆品称取试样0.1 g(精确至0.01 g)于15 mL具塞玻璃离心管中,加入0.5 mL四氢呋喃,涡旋振荡2 min,再加入3.5 mL甲醇,涡旋振荡2 min,2 500 r/min离心3 min,取清液过0.22 μm滤膜,待测定。
1.3.4油状化妆品称取试样0.5 g(精确至0.01 g)于15 mL具塞玻璃离心管中,加入乙酸乙酯定容至5.0 mL,涡旋振荡1 min,2 500 r/min离心3 min,取清液过0.22 μm滤膜,待测定。
1.4 实验条件
1.4.1色谱条件色谱柱:DB-35MS毛细管柱(30 m×250 μm×0.25 μm);进样口温度:250 ℃;色谱柱升温程序:初始温度50 ℃,保持2 min,以10 ℃/min升至130 ℃,再以25 ℃/min升至280 ℃,保持2 min;载气为高纯氦气(纯度≥99.99%);流速为1.0 mL/min,恒流;进样量:1 μL,分流模式,分流比10∶1,传输线温度为280 ℃。
1.4.2质谱条件离子源:EI,70 eV;离子源温度230 ℃;四极杆温度150 ℃;选择离子监测(SIM)模式。目标分析物的参考保留时间、定性和定量离子碎片见表1。

表1 硫酸二甲酯和硫酸二乙酯的质谱分析条件Table 1 MS parameters for the analysis of dimethyl sulfate and diethyl sulfate
2 结果与讨论
2.1 进样口温度的优化
样品在进样口受热气化,较高的进样口温度可降低化合物在衬管表面的吸附,提高目标物的信号强度[13]。考察了进样口温度分别为180、220、250、260、270、280、290、300 ℃时硫酸二甲酯和硫酸二乙酯的响应,结果显示,硫酸二甲酯在250 ℃时响应最高,硫酸二乙酯在180~250 ℃时峰面积相近,二者响应均在进样口温度为260 ℃时快速下降,综合考虑选择进样口温度为250 ℃。
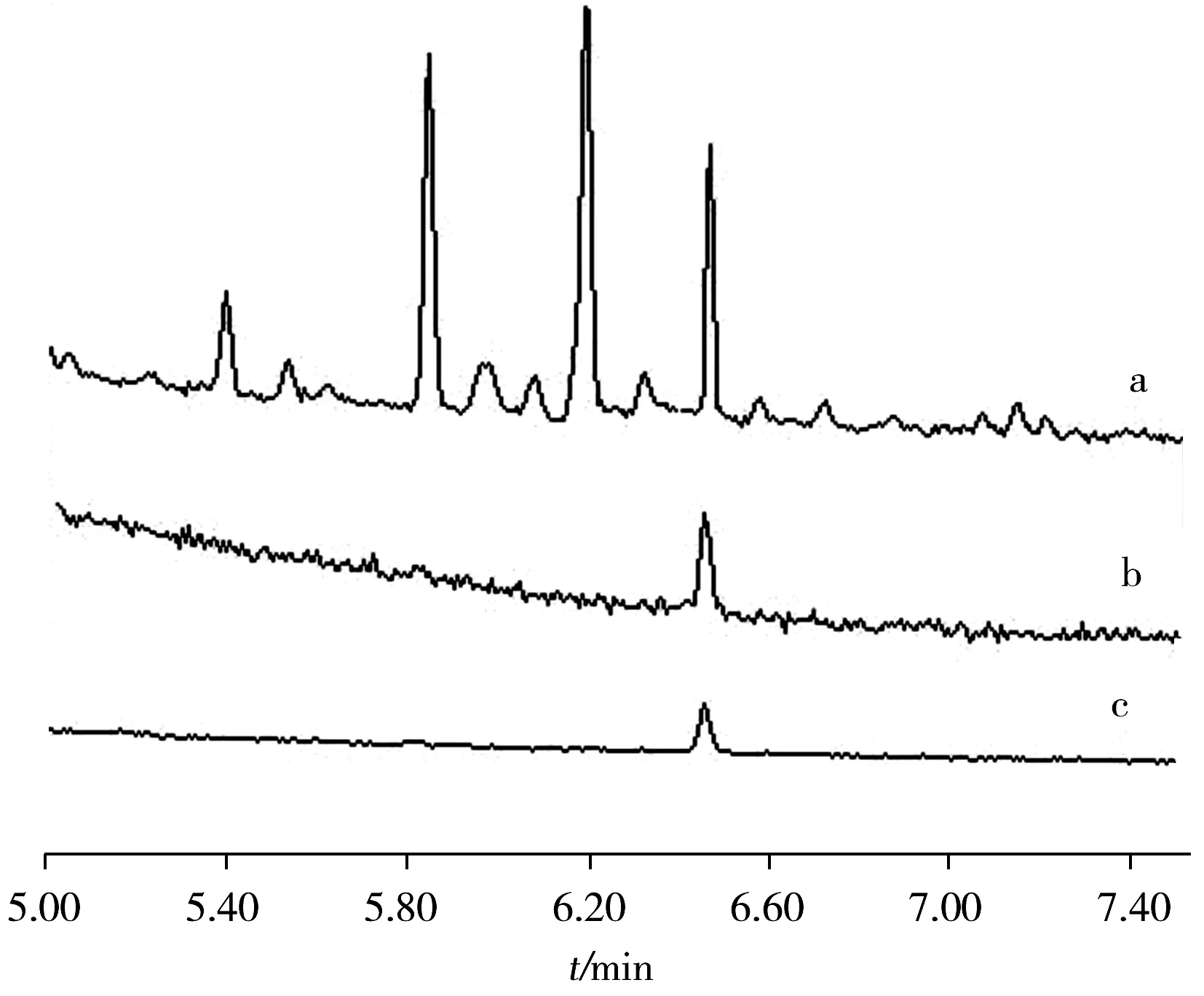
图1 水基类化妆品在不同分流模式下硫酸二甲酯的提取离子色谱图Fig.1 SIM of dimethyl sulfate in water-based cosmetics with different inlet modesa:splitless mode;b:split ratio 10∶1;c:split ratio 20∶1
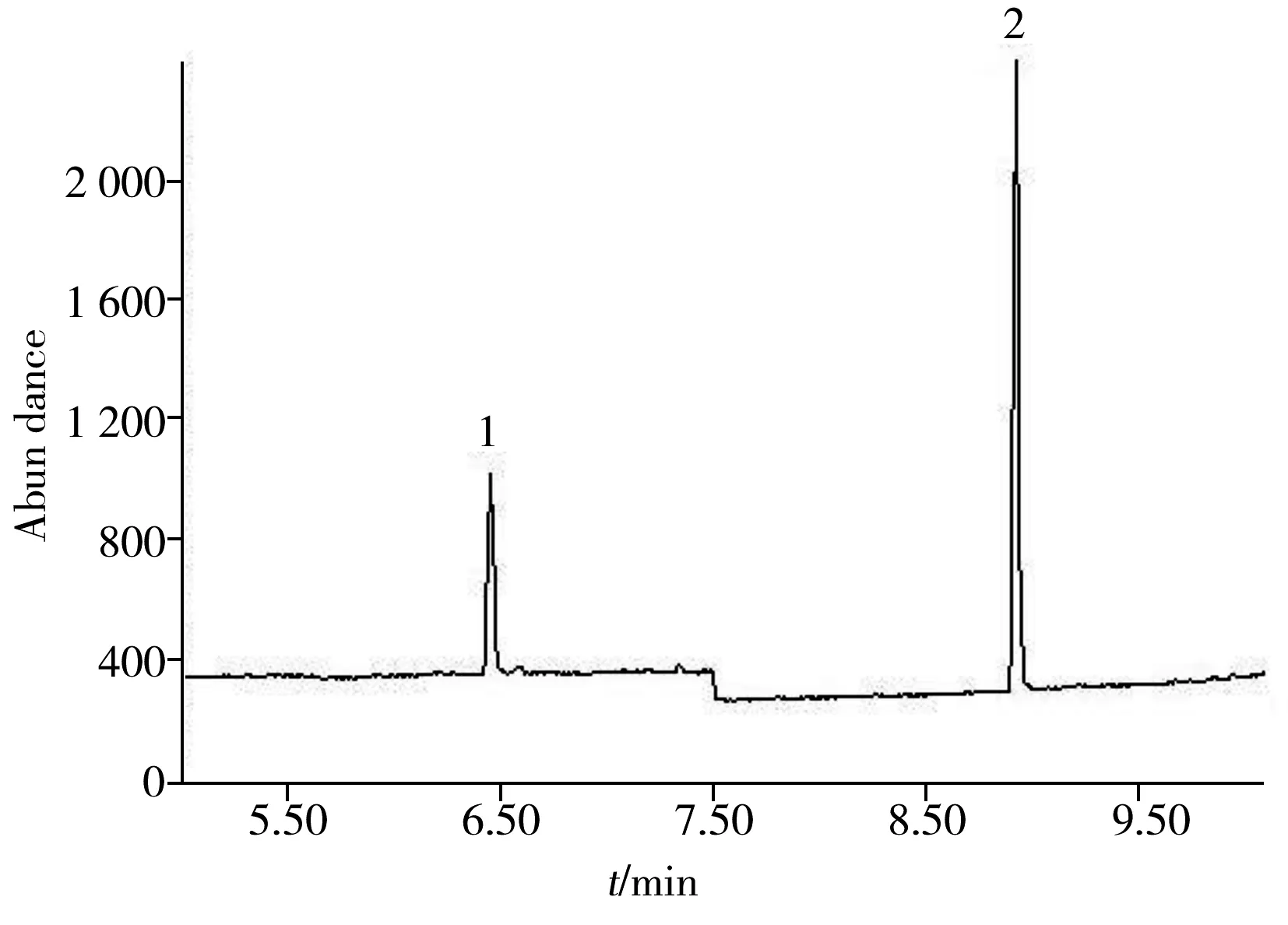
图2 硫酸二甲酯和硫酸二乙酯的总离子流色谱图Fig.2 TIC of dimethyl sulfate and diethyl sulfate1:dimethyl sulfate;2:diethyl sulfate
2.2 分流比的优化
实验比较了3种进样模式(不分流、分流比为10∶1和20∶1 )下硫酸二甲酯和硫酸二乙酯检出限的差异。结果表明,不分流模式下两者的仪器检出限最低,随着分流比的增加,仪器检出限提高。
待测液中除了含有目标分析物,还有在前处理中被共萃取出的基体“杂质”。杂质随着进样次数的增加而累积在进样口和色谱柱前端,影响分析的准确性。以水基类化妆品中硫酸二甲酯为例,比较了3种进样模式下样品的色谱总离子流图(图1)。由图1可知,不分流模式下,硫酸二甲酯附近干扰峰较多,对其测定存在一定干扰;增大分流比,干扰物在进样口被分流,色谱干扰峰减少。采用分流比为10∶1,既可减少干扰峰,又可获得合适的检出限,所以本文选择分流比为10∶1。在优化的色谱质谱条件下测定的硫酸二甲酯和硫酸二乙酯的提取离子色谱图见图2。
2.3 提取溶剂种类的优化
2.3.1水基类、乳液类、膏霜类与啫喱类化妆品水基类化妆品基材为水,本文考察了可与水互溶的甲醇、与水不互溶的正己烷和乙酸乙酯对硫酸二甲酯和硫酸二乙酯的提取效果。样品加入正己烷涡旋后,待测液乳化明显,加入盐(NaCl)后破乳、离心,上层液体仍浑浊,无法满足GC-MS分析要求。样品经甲醇和乙酸乙酯提取,加入无水硫酸钠,可除去提取液中残留的水。提取液经GC-MS分析后结果显示,甲醇提取液中干扰峰比乙酸乙酯提取液多,且同浓度添加水平下目标物的响应值均低于乙酸乙酯。综合考虑,水基类化妆品采用乙酸乙酯提取。
针对乳液类、膏霜类和啫喱类化妆品,本文考察了甲醇、二氯甲烷、乙酸乙酯和正己烷对硫酸二甲酯和硫酸二乙酯的提取效果,实验结果如表2所示。

表2 不同溶剂对硫酸二甲酯和硫酸二乙酯的提取回收率Table 2 Extract recoveries of dimethyl sulfate and diethyl sulfate with different solvents Recovery(%)
从表2可以看出,甲醇提取液中目标物的回收率在104.9%~129.7%之间,由于甲醇对3类化妆品均具有较好的溶解度,杂质溶于提取液中,增强了目标化合物电离而导致回收率偏高;啫喱类样品中,正己烷提取液的目标物回收率也偏高;二氯甲烷对乳液类中目标物的回收率较乙酸乙酯低,而膏霜类和啫喱类样品在离心后浮于二氯甲烷提取液上方,不利于待测液的吸取;乙酸乙酯对乳液类、膏霜类和啫喱类化妆品中目标物的回收率较好,且乙酸乙酯毒性较小,对实验人员毒害小,综合考虑选择乙酸乙酯作为提取溶剂。
2.3.2粉类化妆品粉类化妆品有干粉和湿粉两种,干粉基质简单,呈粉末状。湿粉含极少量溶剂(水等),呈湿润状。粉类样品用甲醇直接提取,涡旋振荡分散。考虑到湿粉含有少量水分,须加入无水硫酸钠除水。为了提高前处理方法的通用性,粉类化妆品中均加入无水硫酸钠。
2.3.3蜡基类化妆品蜡基类化妆品常加入蜂蜡等蜡质,呈粘性块状。由于样品基质复杂,直接用常规溶剂提取效果不佳。采用四氢呋喃可有效溶解样品,使样品分散。由于蜡不溶于甲醇等极性溶剂,加入四氢呋喃分散后再加入甲醇,提取目标物的同时可使蜡质形成沉淀而除去。
2.3.4油状化妆品油状化妆品中含有辛酸/癸酸甘油酯类、高级脂肪酸等油脂成分,常加入乙酸乙酯等有机溶剂分散。采用乙酸乙酯对样品进行稀释后检测,方法简单快捷。
2.4 提取溶剂体积的优化
为提高分析效率,本文采用有机溶剂萃取后直接上机检测,但化妆品成分复杂,易引入杂质导致基质效应,因此采用增加样品稀释倍数,即降低单位体积杂质含量的方法来消除基质效应。在固定称样量的前提下,对比了提取溶剂体积为2 、3 、4、5、6 mL时待测液的基质效应。基质效应(MF)根据公式计算:MF=Kb/Ka,式中Kb为基质校准曲线的斜率,Ka为纯溶剂标准曲线的斜率。若MF>1,为基质增强;MF<1,为基质抑制。
实验结果显示,提取溶剂体积为2 mL时,水基类、膏霜类、乳液类和油状化妆品的MF值大于1,基质增强效应显著;随着提取溶剂体积的增加,基质效应降低,当提取溶剂体积为4~6 mL时,MF值降低且趋于1,基质效应消减,其中油状化妆品在提取溶剂体积为5~6 mL时MF值趋于稳定;啫喱类、粉类和蜡基类化妆品的基质效应不显著。综合考虑,确定水基类、膏霜类、乳液类、啫喱类、粉类和蜡基类化妆品的萃取液体积为4.0 mL,其中蜡基类为V(四氢呋喃+甲醇)=(0.5+3.5) mL=4.0 mL,油状化妆品的提取溶剂体积为5 mL。
2.5 线性范围、检出限与定量下限
采用优化的方法,对硫酸二甲酯和硫酸二乙酯进行加标实验,分别按信噪比(S/N)为3和10计算检出限(MDL)和定量下限(MLOQ)。通过加标实验测得,水基类、粉类、膏霜类、乳液类和啫喱类化妆品的MDL均为1.5 mg/kg,MLOQ均为5.0 mg/kg;蜡基类化妆品的MDL为3.0 mg/kg,MLOQ为10.0 mg/kg;油状化妆品的MDL为5.0 mg/kg,MLOQ为16.0 mg/kg。以目标化合物的质量浓度(x,mg/L)为横坐标,响应值的峰面积(y)为纵坐标建立标准曲线,计算目标化合物的回归方程、相关系数和线性范围,结果见表3。
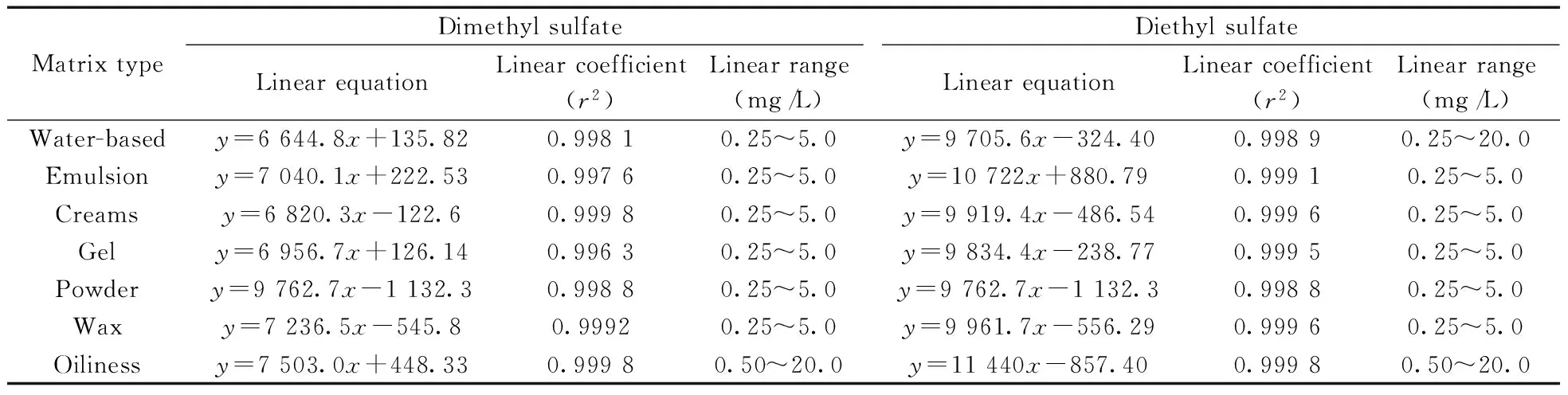
表3 硫酸二甲酯和硫酸二乙酯的线性方程、相关系数和线性范围Table 3 Linear equation,linear coefficient and linear range of dimethyl sulfate and diethyl sulfate in matrix
2.6 回收率与精密度
选取阴性水基类、膏霜类、乳液类、啫喱类、粉类、蜡基类和油状化妆品,按本方法进行3个水平(1MLOQ、2MLOQ、10MLOQ)的加标回收试验,每个水平平行测定6次,回收率和相对标准偏差(RSD)见表4。由实验结果可知,在加标水平范围内,硫酸二甲酯的平均回收率为83.8%~104.7%,RSD为2.7%~8.2%;硫酸二乙酯的平均回收率为84.7%~104.8%,RSD为3.5~8.7%。
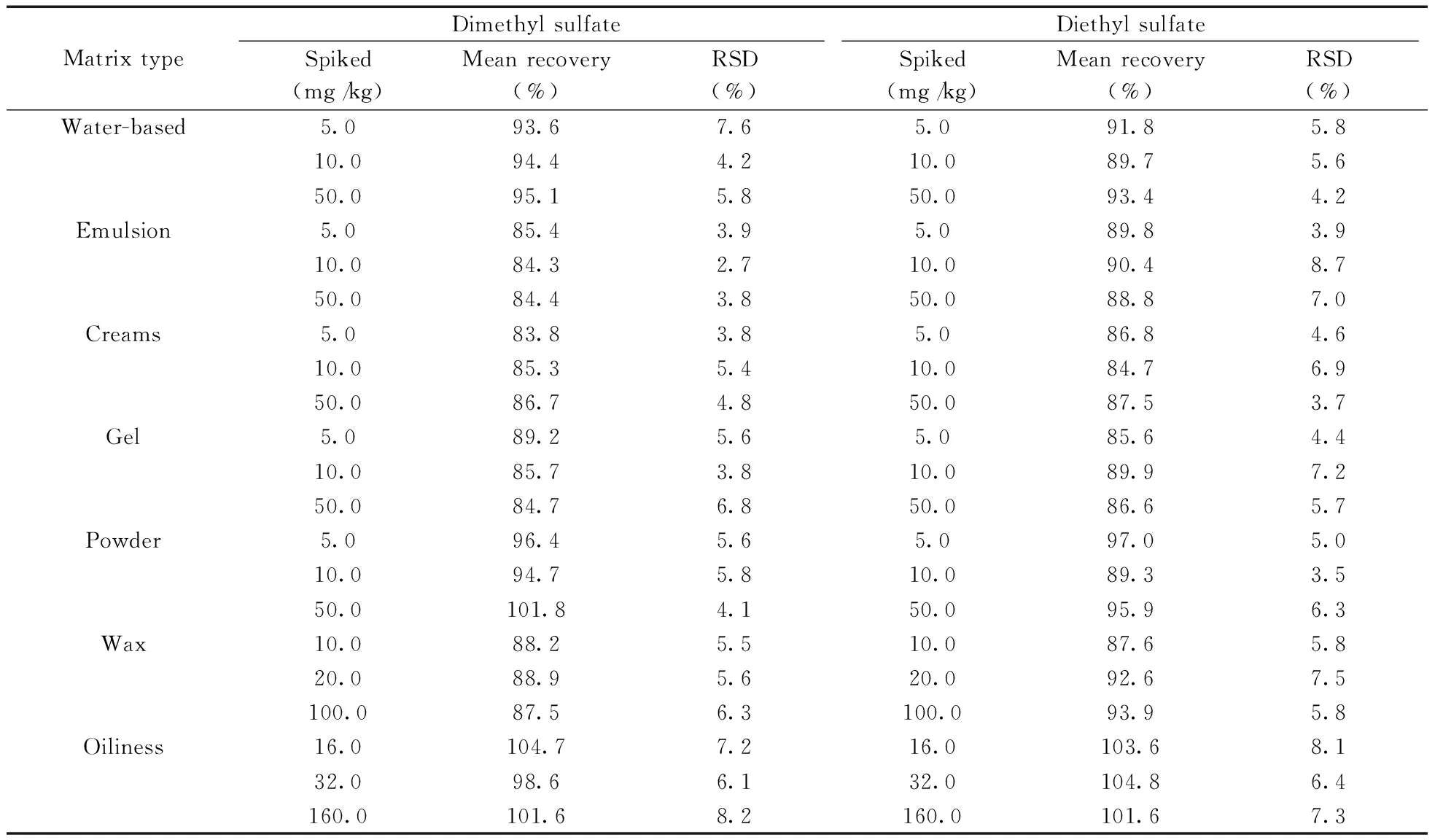
表4 硫酸二甲酯和硫酸二乙酯的回收率与精密度(n=6)Table 4 Recoveries and precision of dimethyl sulfate and diethyl sulfate(n=6)
2.7 实际样品检测
随机抽取市售的26个化妆品样品,其中水基类样品5个,乳液类、膏霜类、啫喱类和粉类样品各4个,蜡基类样品3个,油状样品2个。按本方法进行检测,26个化妆品样品中均未检出硫酸二甲酯和硫酸二乙酯。
3 结 论
本研究建立了同时测定化妆品中硫酸二甲酯和硫酸二乙酯的气相色谱-质谱联用法。样品经溶剂提取后采用GC-MS测定,外标法定量。本方法前处理简单,灵敏度高,适用于水基类、乳液类、膏霜类、啫喱类、粉类和油状化妆品中硫酸二甲酯和硫酸二乙酯的检测。
[1] Meng X S,Ma Q,Bai H,Li W T,Wang C.J.Instrum.Anal.(孟宪双,马强,白桦,李文涛,王超.分析测试学报),2016,35(2):143-155.
[2] Year 2015 No.268 Bulletin of Sate Food and Drug Administration(国家食品药品监督管理总局关于发布化妆品安全技术规范(2015年版)的公告(2015年第268号)).[2015-12-23].http://www.sda.gov.cn/WS01/CL0053/140161.html.
[3] Li X J,Ma Y J.Chin.J.Ind.Med.(李小娟,马永建.中国工业医学杂志),2010,(4):301-302.
[4] Candidate List of Substances of Very High Concern for Authorisation(欧盟ECHA:需授权高度关注物质候选清单)[2012-12-19].https://echa.europa.eu/candidate-list-table.
[5] Qin X F,Zou X L,Li Y Q,Zeng H Y,Li Y.J.SichuanUniv.:Med.Sci.Ed.(覃宣富,邹晓莉,黎源倩,曾红艳,李岩.四川大学学报:医学版),2010,41(5):877-880.
[6] Yang Z Q,Yang G,Yang B,Wang C Y,Ding S T.Chin.J.Anal.Chem.(杨子芹,杨光,杨博,王春宇,丁松涛.分析化学),2015,43(6):924-928.
[7] Deng G F,Yao T W.J.ZhejiangUniv.:Med.Sci.Ed.(邓桂凤,姚彤炜.浙江大学学报:医学版),2008,37(2):156-158.
[8] Pei D J.Chin.J.Anal.Lab.(裴德军.分析试验室),2015,34(1):31-34.
[9] Chen L H,Xu X C,Tu H Y,Wang J S,Zhang H B,Yu Y,Zhang Q.TextileDyeingandFinishingJournal(陈丽华,徐晓春,涂红雨,王俊苏,张后兵,余燕,张庆.染整技术),2016,38(2):50-53.
[10] Lin J F,Mai Z X,Wang C Y,Zhong S Y,Shen Y L,Chu N Q.FujianAnalysisandTesting(林君峰,麦志喜,王成云,钟声扬,沈雅蕾,褚乃清.福建分析测试),2017,26(1):7-12.
[11] Shi Y,He Z G.Chin.J.Clin.Pharm.(施燕,何志高.中国临床药学杂志),2016,(3):164-167.
[12] Zhang Y S,Lin Z H,Hu Y L,Li G K.J.Instrum.Anal.(张艳树,林振华,胡玉玲,李攻科.分析测试学报),2016,35(2):127-136.
[13] Han W Q,Luo H Y,Chen L W,Wu Y L,Xian Y P,Wang B.Chin.J.Anal.Chem.(韩婉清,罗海英,陈立伟,吴玉銮,冼燕萍,王斌.分析化学),2014,(10):1441-1446.
