基于上转换荧光纳米粒子和金纳米粒子间荧光共振能量转移的高灵敏赭曲霉毒素A检测方法研究
2018-01-25张莹莹钱志娟谢正军彭池方
张莹莹,钱志娟,谢正军,彭池方,3*
(1.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;2.扬州出入境检验检疫局,江苏 扬州 225000;3.江南大学 食品学院,江苏 无锡 214122)
赭曲霉毒素(Ochratoxins)是由曲霉属的7种曲霉和青霉属的6种青霉菌产生的一组真菌毒素,包括赭曲霉毒素A(Ochratoxin A ,OTA)、赭曲霉毒素B(Ochratoxin B,OTB)、赭曲霉毒素C(Ochratoxin C,OTC)、赭曲霉毒素α(Ochratoxin α,OTα),其中OTA的毒性最大、分布最广、对农产品污染最重、与人类健康关系最为密切[1]。OTA广泛存在于各种食品和饲料中,如咖啡、酒类、坚果、谷物等[2]。OTA对人类和动物的毒性作用主要是致畸、致癌、致突变、肾脏毒、肝毒以及免疫抑制[3],国际癌症组织(IARC)将其定为2B类致癌物[4]。目前,检测OTA的方法主要有免疫化学分析方法[5-6](ELISA)、薄层色谱法[7](TLC)、高效液相色谱法(HPLC)[6,8-9]、液相色谱-串联质谱法(LC-MS/MS)[10-11]、表面增强拉曼光谱[12-13](SERS)及电化学检测法[14-16]等。这些方法精度好、灵敏度高、特异性强,但存在耗时长、仪器昂贵、需专业人员操作、操作复杂、不便携带等不足,不利于实际应用。因此,开发一种简单方便、成本低、灵敏度高、特异性好的OTA快速检测方法具有重要的应用价值。
荧光共振能量转移(Fluorescence resonance energy transfer,FRET) 作为一种均相分析检测技术,由于操作简单、灵敏度高、选择性好、时间和空间分辨率高等优点,近年来在食品安全检测领域得到广泛应用。FRET是指两个不同的荧光基团,其中1个荧光基团作为能量供体(Donor),另1个作为能量受体(Acceptor),当能量供体的发射光谱与能量受体的激发光谱能够有效重叠,并且二者之间的距离处于1.0~10.0 nm之间,用能量供体的激发光来激发时,会观察到供体的能量向受体转移,发生一种非辐射的能量转移[17]。对于提高FRET的效率,选择合适的供体和受体非常关键。相对于传统的有机染料以及半导体量子点等下转换荧光供体,上转换荧光材料(Upconversion nanoparticles,UCNPs)由于优异的光化学特性备受研究者青睐。上转换荧光材料发光由近红外光(尤其是980 nm)激发,在可见光区发射[18],克服了生物组织自体荧光干扰和组织穿透深度不足等问题[19]。同时,UCNPs还具有较高的光稳定性及化学稳定性、较低的生物毒性、较大的比表面积、较低的成本[20-21];并且由于较窄的激发和发射光谱以及较大的斯托克斯位移,避免了背景及受体发光信号的干扰,提高了检测的灵敏度[22],因此,UCNPs是FRET的理想供体。例如,Wu等[23]利用UCNPs及碳纳米粒子之间的FRET效应来检测癌胚抗原;Saleh等[24]利用UCNPs及金纳米粒子之间的FRET效应检测了生物素及亲和素之间的相互作用;Long等[25]利用UCNPs与金纳米粒子之间静电作用产生的FRET效应来检测有机磷农药。
在以UCNPs作为能量供体的FRET反应中,金纳米粒子(AuNPs)由于较高的消光系数及猝灭效率被广泛用作能量受体[21,26]。本实验将UCNPs及AuNPs分别修饰OTA适配体和互补链制成能量供体探针及受体探针,利用核酸杂交反应拉近两种材料的空间距离,实现FRET和UCNPs荧光猝灭;进一步加入OTA后,UCNPs荧光恢复,实现对OTA的定量检测。该方法具有灵敏度高、特异性好、操作简单、成本较低等优点。
1 实验部分
1.1 实验材料与设备
YCl3·6H2O(99.99%)、YbCl3·6H2O(99.9%)、ErCl3(99.9%)、1-十八烯(1-ODE,90%)、氯金酸(HAuCl4·4H2O)、吗啉乙磺酸(MES)、硫酸庆大霉素,以上试剂购自上海阿拉丁生化科技股份有限公司;聚丙烯酸(PAA,相对分子质量2 000)购自上海麦克林生化科技有限公司;1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC·HCl)、N-羟基琥珀酰亚胺磺酸钠盐(sulfo-NHS)购自西格玛奥德里奇(上海)有限公司;甲醇、乙醇、油酸(OA)、二甘醇(DG)、乙二醇(EDG)、甲苯、氢氧化钠(NaOH)、氟化铵(NH4F)、三(羟甲基)氨基甲烷(Tris)、氯化钠(NaCl)、氯化钾(KCl)、氯化钙(CaCl2)等试剂购自国药集团化学试剂有限公司;赭曲霉毒素A购自江苏美正生物科技有限公司;黄曲霉毒素B1购自玛雅试剂有限公司;交链孢酚单甲醚、交链孢酚购自青岛普瑞邦生物工程有限公司;实验用水为18.2 MΩ·cm的Millipore超纯水,其余试剂均为市售分析纯。赭曲霉毒素A适配体序列[27]为氨基修饰:5'-GAT CGG GTG TGG GTG GCG TAA AGG GAG CAT CGG ACA-NH2-3',赭曲霉毒素A适配体互补序列为巯基修饰:5'-CCT TTA CGC CAC CCA CAC CCG ATC-SH-3',以上所有寡核苷酸序列均由生工生物工程(上海)有限公司合成。
F-7000 全波长荧光扫描仪(日本日立有限公司);980 nm 半导体激光器(北京海特光电有限责任公司);紫外分光光度计(UV-2802 pcs,优尼柯公司);透射电镜(JEOL-2100,日本电子株式会式);VS-100C恒温混匀仪(无锡沃信仪器有限公司);傅立叶红外光谱仪(美国Nicolet公司);X射线衍射仪(德国布鲁克科技有限公司);HI-6A型数字控温磁力搅拌电热套(北京中兴伟业仪器有限公司);分析天平、pH计(梅特勒-托利多仪器上海有限公司);电热恒温鼓风干燥箱(上海精宏实验设备有限公司);高速冷冻离心机(上海力申科学仪器有限公司);超声波清洗仪(上海卓博精密机械有限公司)。
1.2 实验方法
1.2.1金纳米粒子的制备金纳米粒子(AuNPs)采用柠檬酸三钠还原的方法合成[28]:将100 mL 0.01%的氯金酸溶液加入锥形瓶中搅拌加热至沸腾;保持沸腾5 min后,将2 mL 1%的柠檬酸三钠快速加入上述溶液;继续加热至溶液颜色变为酒红色,再煮沸10 min停止加热,搅拌冷却至室温。所得AuNPs的浓度为3 nmol/L。
1.2.2上转换荧光纳米材料的制备及表面改性根据文献[29]的方法用高温热解法合成NaYF4∶Yb,Er UCNPs:取0.208 0 g YCl3·6H2O、0.110 8 g YbCl3·6H2O和0.007 8 g ErCl3加入烧瓶中;然后加入6 mL 油酸及15 mL 1-十八烯,将上述混合溶液搅拌加热至160 ℃;待形成透明溶液后,冷却至室温;将10 mL甲醇溶液(含有0.1 g NaOH,0.148 2 g NH4F)缓慢加至上述溶液中搅拌30 min;然后将上述溶液加热至100 ℃,100 ℃加热30 min以除去甲醇;最后将温度升至300 ℃ ,并在氩气的保护下反应1 h;反应完成后冷却至室温,所得溶液用乙醇沉淀离心清洗3次,即得油酸包裹的NaYF4∶Yb,Er UCNPs。
油酸包裹的NaYF4∶Yb,Er UCNPs溶于非极性溶剂,为将其用于生物标记等,根据文献[30]方法利用链交换法对其进行表面改性,使其可以溶于极性溶液:首先将150 mg 聚丙烯酸加入30 mL二甘醇中;将混合物加热到110 ℃,待形成透明溶液后,加入50 mg 油酸包被的NaYF4∶Yb,Er UCNPs甲苯溶液2 mL;在氩气的保护下110 ℃保持1 h,然后升温至240 ℃反应2 h,反应结束后待溶液冷却至室温;加入乙醇沉淀材料,离心收集并用乙醇和水分别清洗3次,即得水溶性的PAA-NaYF4∶Yb,Er UCNPs。
1.2.3赭曲霉毒素A能量供体探针的制备称取5 mg PAA-NaYF4∶Yb,Er UCNPs分散于5 mL10 mmol/L的MES溶液(pH 5.6)中,超声至充分溶解;加入0.6 mL 2 mg/mL的EDC溶液及0.2 mL 2 mg/mL的NHS 溶液,将上述溶液混匀后于37 ℃活化2 h;离心收集材料并用10 mmol/L pH 7.0的PB缓冲液清洗3次,最后重悬于5 mL PB缓冲液中,并加入10 μL 100 μmol/L的OTA适配体37 ℃过夜孵育;孵育完成后,离心收集沉淀并用PB缓冲液清洗3次,得到OTA适配体修饰的上转换荧光纳米探针apt-UCNPs,将其重悬于BB 缓冲液(10 mmol/L Tris,pH 8.5,120 mmol/L NaCl,5 mmol/L KCl 和 20 mmol/L CaCl2)中,4 ℃保存。所得apt-UCNPs质量浓度为 1 mg/mL。
1.2.4赭曲霉毒素A能量受体探针的制备取1 mL AuNPs溶液与2 μL 500 μmol/L的OTA适配体互补链混匀,37 ℃孵育30 min;然后加入500 mmol/L pH 3.0的柠檬酸盐5 μL,混匀后37 ℃孵育2 h;孵育完成后12 000 r/min离心15 min,得到OTA适配体互补链修饰的金纳米粒子 cDNA-AuNPs,将其重悬于1 mL 10 mmol/L PBS缓冲液中,4 ℃保存备用。
1.2.5赭曲霉毒素A的检测将100 μL 0.1 mg/mL apt-UCNPs用稀释10倍后的BB缓冲液(0.1BB缓冲液)稀释,与40 μL cDNA-AuNPs室温孵育1 h后;加入60 μL不同浓度的OTA标准品(0.1BB缓冲液稀释)继续孵育1 h,利用980 nm激光源激发反应溶液,测量其荧光强度。
1.2.6特异性分析分别配制质量浓度均为10 μg/L的赭曲霉毒素A、黄曲霉毒素B1、硫酸庆大霉素、交链孢酚单甲醚和交链孢酚(Alternariol,AOH)标准品溶液。利用上述适配体传感器测定荧光强度,通过对比荧光强度的变化值来评价构建的OTA适配体传感器的特异性。
1.2.7加标回收实验首先对超市所购买的啤酒样品进行预处理[31]:取脱气酒类试样(含CO2的酒类样品先置于4 ℃冷藏30 min,过滤或者超声)20 g,置于25 mL容量瓶中,加提取液(称取 150 g 氯化钠、20 g 碳酸氢钠,加水定容至 1 L)定容至刻度,混匀,用玻璃纤维滤纸过滤至滤液澄清,收集滤液备用。将3种不同浓度的OTA标准品加入稀释5倍的市售啤酒样品中,利用上述OTA适配体传感器检测OTA含量,计算回收率。
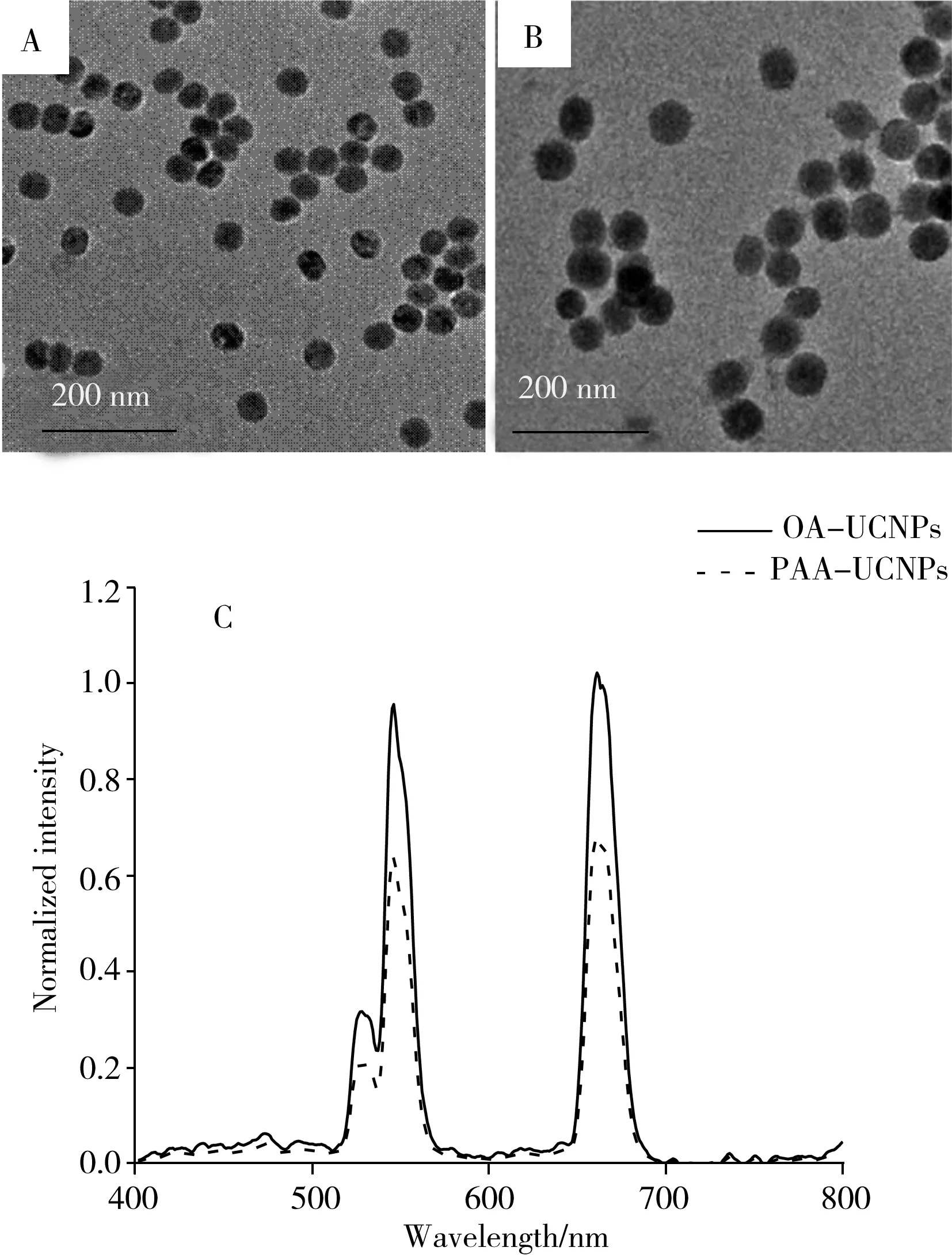
图1 OA-NaYF4∶Yb,Er UCNPs(A) 与PAA-NaYF4∶Yb,Er UCNPs(B)的TEM图以及OA-NaYF4∶Yb,Er UCNPs及PAA-NaYF4∶Yb,Er UCNPs相同浓度下的荧光光谱图(C)Fig.1 TEM images of OA-NaYF4∶Yb,Er UCNPs(A) and PAA-NaYF4∶Yb,Er UCNPs(B),and fluorescence spectra of OA-NaYF4∶Yb,Er UCNPs and PAA-NaYF4∶Yb,Er UCNPs(C)
2 结果与讨论
2.1 纳米材料的表征
2.1.1上转换荧光纳米材料的表征通过透射电镜(TEM)观察可知,油酸包裹的NaYF4∶Yb,Er UCNPs在甲苯中的单分散性良好,粒径约为35 nm(图1A);通过PAA改性后的NaYF4∶Yb,Er UCNPs在水中的单分散性依旧良好,粒径约为43 nm(图1B)。由荧光光谱图(图1C)可见,NaYF4∶Yb,Er UCNPs于980 nm激发下,在532、546、662 nm处有明显的特征发射峰,其分别代表了2H11/2、4S3/2及4F9/2向4I15/2的能级跃迁[32]。虽然PAA改性后的NaYF4∶Yb,Er UCNPs相对于油酸包裹的NaYF4∶Yb,Er UCNPs的荧光强度减弱,但并不影响后续使用。
通过X射线衍射图谱(XRD,图2)可知,材料改性前后晶相的 XRD 峰与标准卡 JCPDS NO.28-1192 的出峰位置相匹配,说明材料改性前后的晶相均属于六方相,具有较高的结晶度;经过键交换改性后,晶相并未改变。由傅立叶红外图谱(FT-IR)(图3)可知,OA-NaYF4∶Yb,Er UCNPs在2 924 cm-1和 2 854 cm-1处分别有亚甲基(—CH2—)的非对称和对称伸缩振动峰,在 1 568 cm-1和 1 465 cm-1处有羧基(COO—)的非对称和对称伸缩振动峰;进行链交换之后,PAA-NaYF4∶Yb,Er UCNPs在2 926 cm-1处—CH2—的吸收峰几乎消失,而在 1 732 cm-1及1 409 cm-1处出现强羧基吸收峰,表明PAA-NaYF4∶Yb,Er UCNPs表面的羧基数量增加并且取代了油酸阴离子。
2.1.2金纳米粒子的表征通过TEM观察可知(图4A),AuNPs的粒径大约为25 nm,单分散性良好。由紫外吸收光谱(图4B)可知,AuNPs在523 nm处有最强吸收,其纵向吸收峰与PAA-NaYF4:Yb,Er UCNPs的发射光谱有很大程度的重合,有助于提高荧光共振能量转移效率。
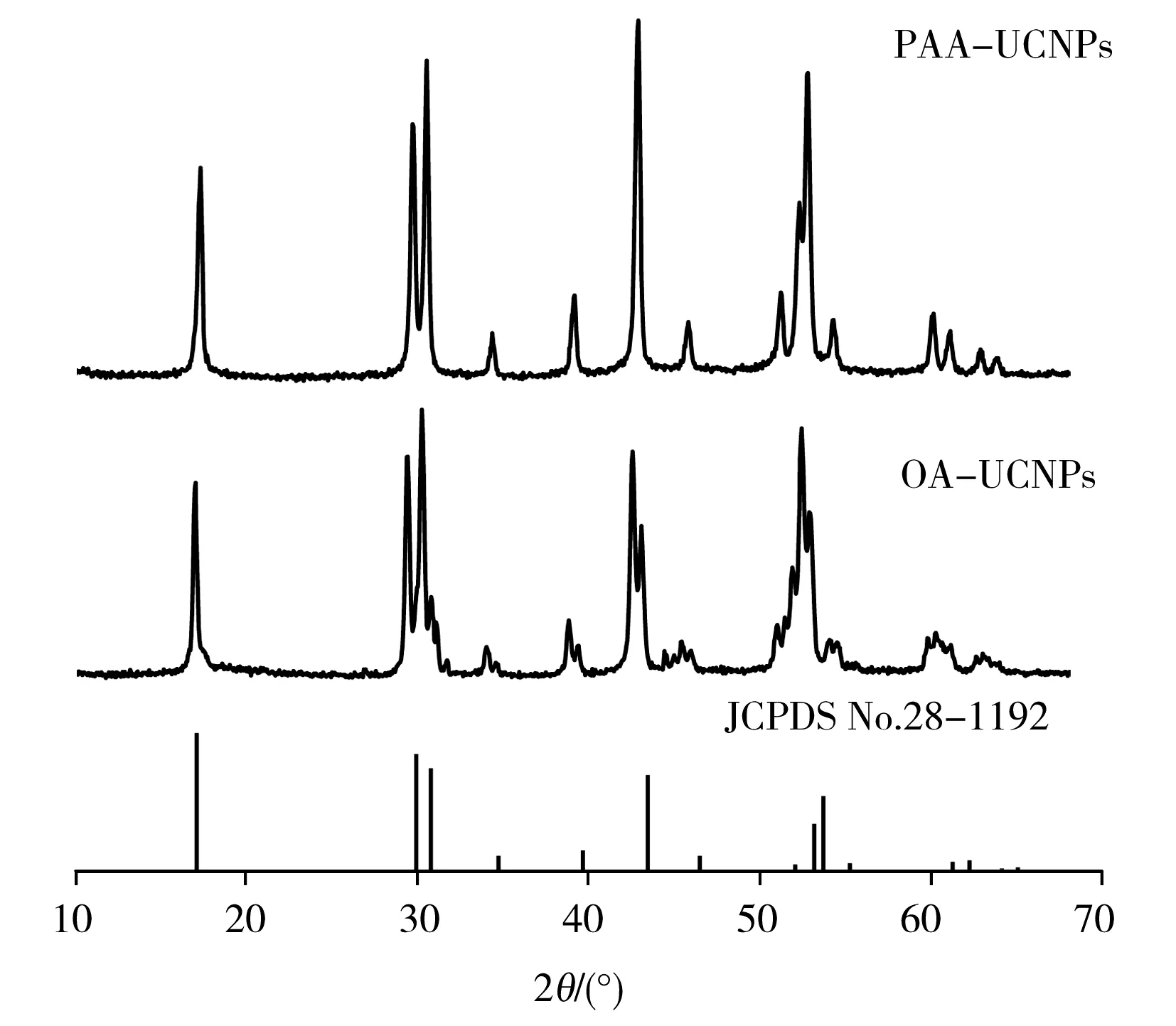
图2 OA-NaYF4∶Yb,Er UCNPs及PAA-NaYF4∶Yb,Er UCNPs的XRD图Fig.2 XRD patterns of OA-NaYF4∶Yb,Er UCNPs and PAA-NaYF4∶Yb,Er UCNPs
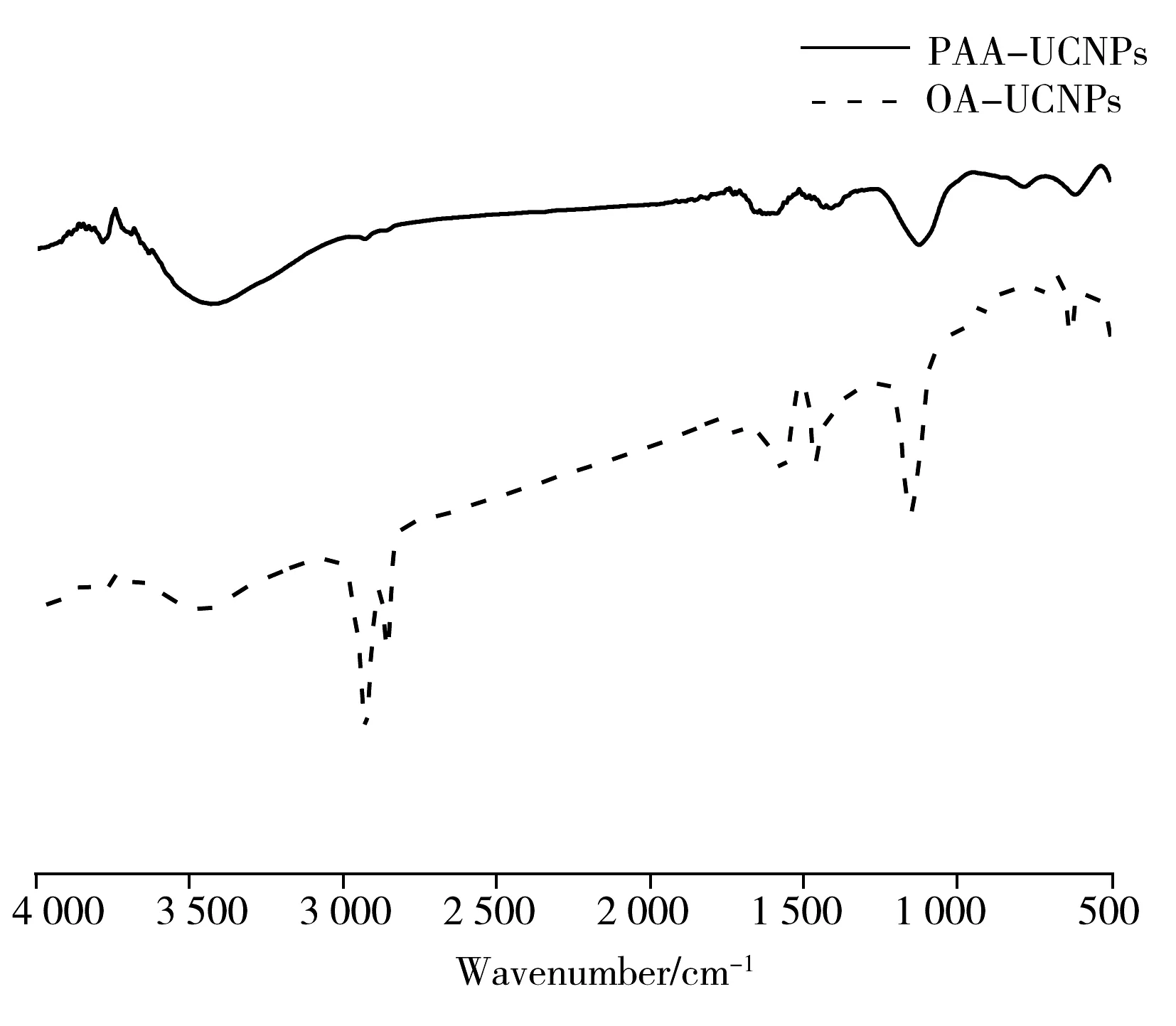
图3 OA-NaYF4∶Yb,Er UCNPs及PAA-NaYF4∶Yb,Er UCNPs的FT-IR图Fig.3 FT-IR spectra of OA-NaYF4∶Yb,Er UCNPs and PAA-NaYF4∶Yb,Er UCNPs

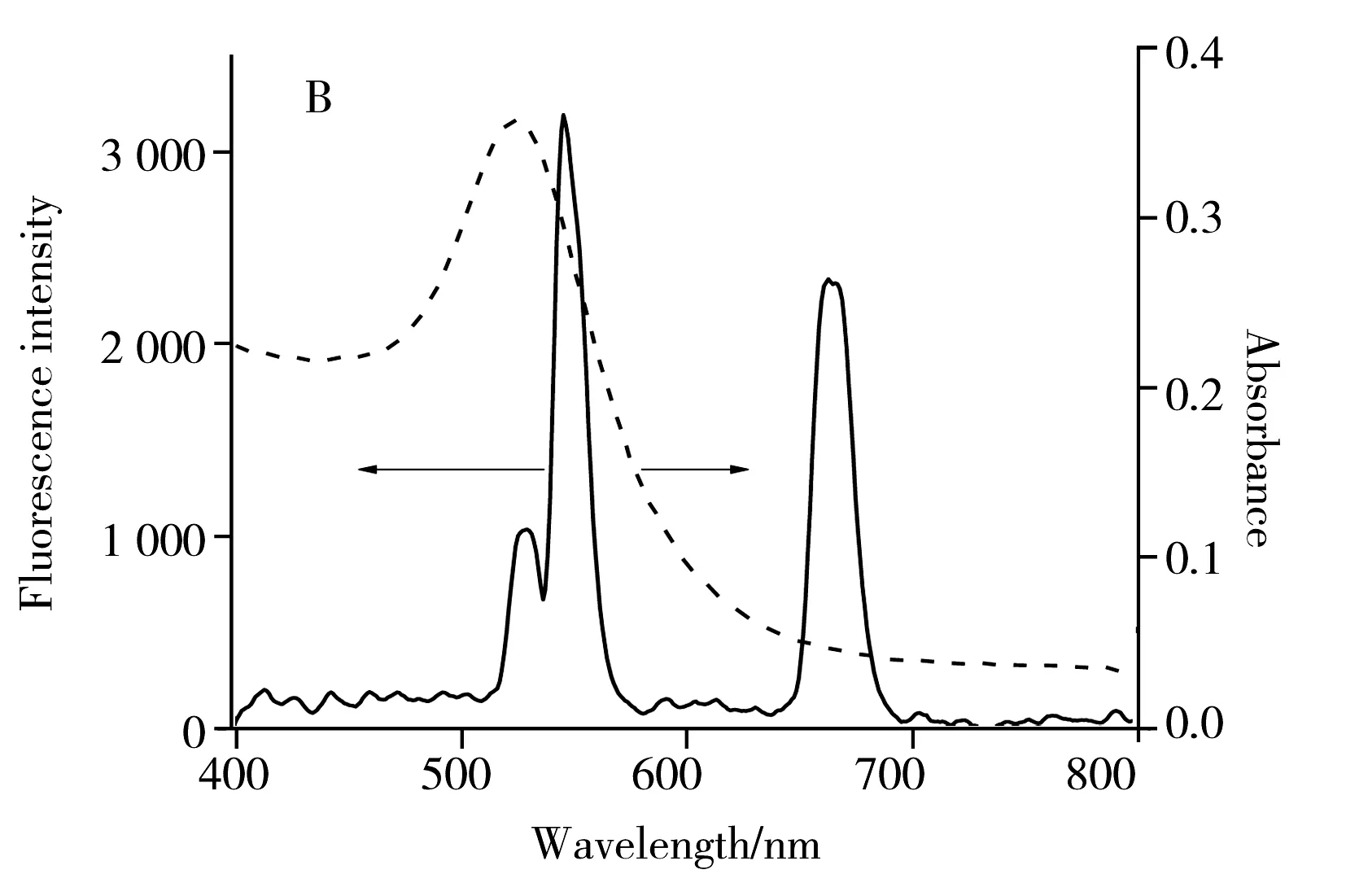
图4 AuNPs的TEM图(A)与PAA-NaYF4∶Yb,Er UCNPs的荧光光谱及AuNPs的紫外吸收光谱(B)Fig.4 TEM image of AuNPs(A) and fluorescence spectrum of PAA-NaYF4∶Yb,Er UCNPs and UV-Vis spectrum of AuNPs(B)
2.2 赭曲霉毒素A能量供体及受体探针的表征
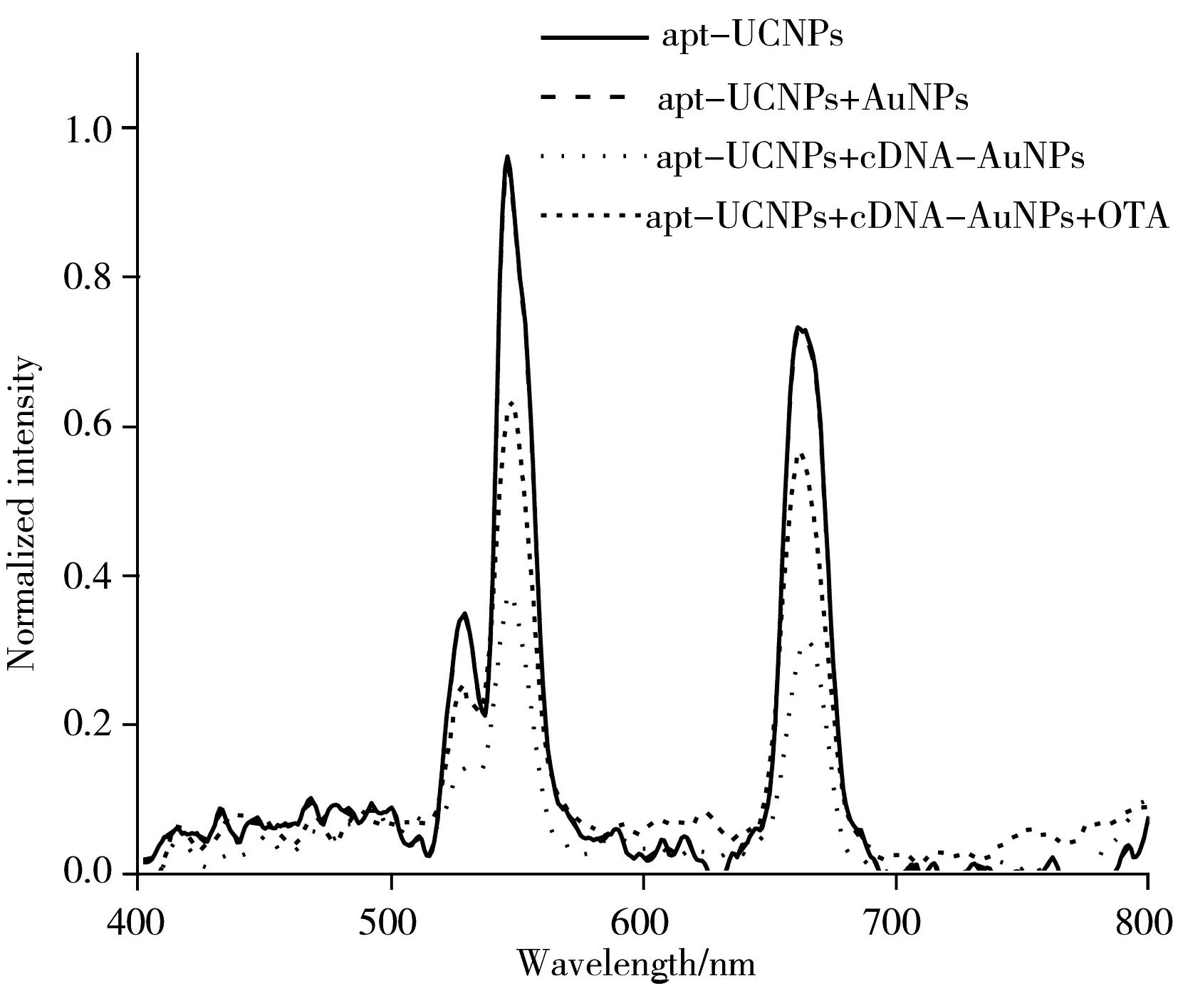
图5 apt-UCNPs,apt-UCNPs与AuNPs孵育,apt-UCNPs与cDNA-AuNPs孵育,apt-UCNPs与cDNA-AuNPs孵育后加OTA孵育的荧光光谱图Fig.5 Fluorescence spectra of apt-UCNPs,apt-UCNPs+AuNPs,apt-UCNPs+cDNA-AuNPs and apt-UCNPs+cDNA-AuNPs+OTA
AuNPs的紫外吸收光谱显示,AuNPs在与巯基化的OTA适配体互补链孵育连接后,在260 nm出现DNA的最大吸收峰,说明AuNPs与OTA适配体互补链形成了Au—S键,cDNA成功连接到AuNPs表面;AuNPs加入NaCl后很容易聚集,而cDNA-AuNPs具有较高的耐盐性,进一步证明了cDNA已连接到AuNPs表面,成功制备能量受体。而NaYF4∶Yb,Er UCNPs的紫外吸收光谱显示,PAA-NaYF4∶Yb,Er UCNPs在紫外区没有吸收,在与氨基化的OTA适配体孵育连接之后,在260 nm处出现了DNA的特征吸收峰,说明OTA适配体连接到PAA-NaYF4∶Yb,Er UCNPs表面,成功制备能量供体探针。
本实验的设计原理是基于能量供体和能量受体之间合适的空间距离和光谱的高度重叠实现荧光共振能量转移,导致UCNPs的荧光猝灭;而当体系中加入OTA时,OTA优先与能量供体适配体结合,导致两种探针的空间距离拉大,不再满足FRET的发生条件,所以UCNPs被猝灭的荧光得以恢复。通过对照实验来进一步证明此原理。由图5的荧光光谱可知,apt-UCNPs与AuNPs孵育时并不会连接发生FRET导致荧光猝灭,只有修饰了cDNA-AuNPs才会与apt-UCNPs通过核酸杂交结合导致荧光猝灭;而当体系中加入OTA时,由于OTA与apt-UCNPs上OTA适配体的特异性结合,破坏了FRET,apt-UCNPs的荧光得以恢复。
2.3 基于上转换荧光纳米材料与金纳米粒子荧光共振能量转移检测赭曲霉毒素A的方法研究
2.3.1赭曲霉毒素A适配体浓度的影响本实验将OTA适配体连接PAA-NaYF4∶Yb,Er UCNPs作为能量供体,其中OTA适配体的浓度会影响apt-UCNPs的猝灭程度,通过加入不同浓度的OTA适配体与PAA-NaYF4∶Yb,Er UCNPs结合来优化最佳浓度。实验结果显示,随着OTA适配体浓度的增加,apt-UCNPs在546 nm处的猝灭程度I/I0(I0代表只有apt-UCNPs时的荧光强度,I代表加入cDNA-AuNPs时apt-UCNPs的荧光强度)不断增强,当OTA适配体浓度增加至100 μmol/L时,猝灭达到饱和,因此选择100 μmol/L作为OTA适配体的浓度。
2.3.2BB缓冲液浓度的优化高浓度的BB缓冲液可能会导致cDNA-AuNPs的聚集,低浓度的BB缓冲液不利于apt-UCNPs与OTA及cDNA-AuNPs的结合[33],从而影响荧光共振能量转移,因此需通过不同浓度的BB缓冲液稀释apt-UCNPs来优化BB缓冲液的浓度。结果显示,当BB缓冲液稀释倍数为10时,apt-UCNPs在546 nm处的猝灭程度最高,因此选择稀释10倍的BB缓冲液(0.1BB)用于后续实验。
2.3.3能量受体探针体积的影响能量受体cDNA-AuNPs的浓度会影响apt-UCNPs的猝灭程度以及荧光恢复程度,从而影响检测的灵敏度。通过改变cDNA-AuNPs的体积来改变体系中cDNA-AuNPs的浓度优化出最佳的猝灭效果。实验发现,随着cDNA-AuNPs体积的增加,apt-UCNPs在546 nm处的猝灭程度I/I0不断增强。当达到40 μL时,猝灭接近饱和;继续增大cDNA-AuNPs的体积,猝灭效果会更好,但过量的cDNA-AuNPs易导致非特异性猝灭,不利于荧光恢复,因此选择cDNA-AuNPs的体积为40 μL。
2.3.4能量供体探针浓度的影响能量供体探针的浓度会影响猝灭效果,进而影响检测的灵敏度,因此对apt-UCNPs的浓度进行了优化。结果表明,当apt-UCNPs为0.1 mg/mL 时,apt-UCNPs在546 nm处的猝灭效果最好;随着apt-UCNPs浓度的增大,猝灭效果减弱,因此选择apt-UCNPs的质量浓度为0.1 mg/mL。
2.3.5能量供体及受体探针反应时间的影响由于碱基互补配对使能量供体apt-UCNPs与能量受体cDNA-AuNPs结合发生荧光共振能量转移现象,导致能量供体apt-UCNPs的荧光猝灭。将apt-UCNPs与cDNA-AuNPs孵育不同的时间,通过对比apt-UCNPs的猝灭程度来选出最佳的孵育时间。结果显示,随着时间的增加,apt-UCNPs在546 nm处的猝灭程度不断增加。当孵育60 min时,猝灭程度达到最大;之后,随着反应时间的增加,猝灭程度基本保持不变,说明apt-UCNPs与cDNA-AuNPs已经完全结合,因此选择apt-UCNPs与cDNA-AuNPs的反应时间为60 min。
2.3.6赭曲霉毒素A孵育时间的影响apt-UCNPs与cDNA-AuNPs结合发生荧光共振能量转移导致apt-UCNPs的荧光猝灭;而OTA的加入会使得OTA适配体改变空间结构与OTA结合形成复合物,使得apt-UCNPs与cDNA-AuNPs分离,两者之间的距离拉大,apt-UCNPs的荧光得到恢复。为了达到最佳的荧光恢复效果,需对OTA的孵育时间进行优化。将OTA标准液加入能量供体及受体反应后的体系中,结果显示,随着孵育时间的增加,apt-UCNPs在546 nm处的荧光恢复率(Ia-I)/I0(式中,I0代表只有apt-UCNPs时的荧光强度,I代表加入cDNA-AuNPs时apt-UCNPs的荧光强度,Ia代表apt-UCNPs和cDNA-AuNPs反应后的体系中加入OTA之后的荧光强度)不断增加。当孵育60 min后,荧光恢复达到最大;之后基本保持平衡,因此选择OTA的孵育时间为60 min。
2.3.7赭曲霉毒素A检测的标准曲线利用cDNA-AuNPs导致apt-UCNPs荧光猝灭,而OTA的加入对apt-UCNPs起到荧光恢复的作用,构建了OTA适配体传感器。在上述最优实验条件下,得到加入不同浓度OTA孵育后的荧光光谱。当OTA质量浓度在0.001~10 ng/mL范围内时,apt-UCNPs 在546 nm处的荧光恢复率(Ia-I)/I0与OTA的浓度呈线性关系,线性方程为y=0.077 22logx+0.033 88,r2=0.980 5,检出限(S/N=3)为0.001 ng/mL。与基于纳米材料检测OTA的其他方法作比较(表1),结果发现该方法与其他方法相比具有一定的优势。

表1 几种基于纳米粒子检测OTA的方法比较Table 1 Comparison of several methods for OTA detection based on nanoparticles
2.4 特异性分析
选用黄曲霉毒素B1(AFB1)、硫酸庆大霉素(GS)、交链孢酚单甲醚(AME)和交链孢酚(AOH)作为可能的共存毒素作特异性研究。结果显示,10 ng/mL的其他毒素对于反应体系的荧光强度没有明显的荧光恢复作用,这说明本实验所构建的OTA适配体传感器具有良好的特异性。
2.5 啤酒样品加标回收实验
为了检验该反应体系的实用性,将其应用于市售啤酒样品的加标回收检测。结果如表2所示,回收率为100%~119%,相对标准偏差(RSD)为4.3%~4.9%,说明本方法在实际样品的检测中具有一定的准确性及可靠性。

表2 啤酒样品中OTA的加标回收实验(n=3)Table 2 Recovery results of added standard OTA in beer samples using the method(n=3)
3 结 论
本研究通过上转换荧光纳米材料与金纳米粒子之间的荧光共振能量转移建立了OTA适配体传感器。经过对检测条件的优化发现,当cDNA-AuNPs的体积为40 μL,apt-UCNPs的质量浓度为0.1 mg/mL,探针之间及靶标孵育时间为60 min时,OTA的检测范围为0.001~10 ng/mL,检出限可达0.001 ng/mL。经过特异性研究及加标回收实验,证明该方法可用于实际样品检测,具有方法灵敏度高、特异性好、操作简单、成本低的优点,有望应用于食品等领域中OTA的检测。
[1] Meulenberg E P.Toxins(Basel),2012,4(4):244-266.
[2] Lv Z,Chen A,Liu J,Guan Z,Zhou Y,Xu S,Yang S,Li C.PLoSONE,2014,9(1):e85968.
[3] Bazin I,Nabais E,Lopez-Ferber M.Toxins(Basel),2010,2(9):2230-2241.
[4] Lai X,Liu R,Ruan C,Zhang H,Liu C.FoodControl,2015,50:401-404.
[5] Novo P,Moulas G,França Prazeres D M,Chu V,Conde J P.Sensor.ActuatorsB,2013,176:232-240.
[7] Pittet A,Royer D.J.Agric.FoodChem.,2002,50(2):243-247.
[8] Skarkova J,Ostry V,Malir F,Roubal T.Anal.Lett.,2013,46(10):1495-1504.
[9] López Grío S J,Garrido Frenich A,Martínez Vidal J L,Romero-González R.J.Sep.Sci.,2010,33(4/5):502-508.
[10] Sun W H,Yang H,Cao Z Y,Ma Y N,Qin M L,Chai S S,Chen M X.J.Instrum.Anal.(孙伟华,杨欢,曹赵云,马有宁,秦美玲,柴爽爽,陈铭学.分析测试学报),2017,36(1):47-53.
[11] Wu Z X,Bao L,Lü N,Mu Z C,Zhang X Y,Jing P.J.Instrum.Anal.(吴振兴,鲍蕾,吕宁,牟志春,张雪琰,静平.分析测试学报),2012,31(Z1):106-110.
[12] Ganbold E O,Lee C M,Cho E M,Son S J,Kim S,Joo S W,Yang S I.Anal.Methods,2014,6(11):3573-3577.
[13] Galarreta B C,Tabatabaei M,Guieu V,Peyrin E,Lagugné-Labarthet F.Anal.Bioanal.Chem.,2013,405(5):1613-1621.
[14] Bonel L,Vidal J C,Duato P,Castillo J R.Biosens.Bioelectron.,2011,26(7):3254-3259.
[15] Wu J,Chu H,Mei Z,Deng Y,Xue F,Zheng L,Chen W.Anal.Chim.Acta,2012,753:27-31.
[16] Xie S,Chai Y,Yuan Y,Bai L,Yuan R.Biosens.Bioelectron.,2014,55:324-329.
[17] Chen G,Song F,Xiong X,Peng X.Ind.Eng.Chem.Res.,2013,52(33):11228-11245.
[18] Wu Q,Long Q,Li H,Zhang Y,Yao S.Talanta,2015,136:47-53.
[19] Wu S,Duan N,Ma X,Xia Y,Wang H,Wang Z P,Zhang Q.Anal.Chem.,2012,84(14):6263-6270.
[20] Qiu P,Zhou N,Chen H,Zhang C,Gao G,Cui D.Nanoscale,2013,5(23):11512-11525.
[21] Chen H,Fang A,Zhang Y,Yao S.Talanta,2017,174:148-155.
[22] Soukka T,Rantanen T,Kuningas K.Ann.NY.Acad.Sci.,2008,1130(1):188-200.
[23] Wu Z,Li H,Liu Z.Sensor.ActuatorsB,2015,206:531-537.
[24] Saleh S M,Ali R,Hirsch T,Wolfbeis O S.J.Nanopart.Res.,2011,13(10):4603-4611.
[25] Long Q,Li H,Zhang Y,Yao S.Biosens.Bioelectron.,2015,68:168-174.
[26] Li C,Zuo J,Li Q,Chang Y,Zhang Y,Tu L,Liu X M,Xue B,Zhao H Y,Zhang H,Kong X G.Biosens.Bioelectron.,2017,92:335-341.
[27] Wang C,Qian J,Wang K,Wang K,Liu Q,Dong X,Wang C,Huang X.Biosens.Bioelectron.,2015,68:783-790.
[28] Peng C F,Pan N,Xie Z J,Wu L L.Anal.Methods,2016,8(5):1021-1025.
[29] Li Z,Zhang Y.Nanotechnology,2008,19(34):345606.
[30] Dai S,Wu S,Duan N,Wang Z.Microchim.Acta,2016,183(6):1909-1916.
[31] GB/T 23502-2009.Determination of Ochratoxin A in Food.National Standards of the People's Republic of China(食品中赭曲霉毒素 A 的测定.中华人民共和国国家标准).
[32] Chen H Q,Yuan F,Wang L.Anal.Methods,2013,5(11):2873-2879.
[33] Cruz-Aguado J A,Penner G.J.Agric.FoodChem.,2008,56(22):10456-10461.
[34] Barthelmebs L,Hayat A,Limiadi A W,Marty J L,Noguer T.Sensor.ActuatorsB,2011,156(2):932-937.
[35] Chen J,Zhang X,Cai S,Wu D,Chen M,Wang S,Zhang J.Biosens.Bioelectron.,2014,57:226-231.
[36] Yang C,Wang Y,Marty J L,Yang X.Biosens.Bioelectron.,2011,26(5):2724-2727.
[37] Anfossi L,Giovannoli C,Giraudi G,Biagioli F,Passini C,Baggiani C.J.Agric.FoodChem.,2012,60(46):11491-11497.
[38] Huang X,Zhan S,Xu H,Meng X,Xiong Y,Chen X.Nanoscale,2016,8(17):9390-9397.
[39] Hu W,Chen H,Zhang H,He G,Li X,Zhang X,Liu Y,Li C M.J.ColloidInterf.Sci.,2014,431:71-76.
