热处理对γ-Al2O3和θ-Al2O3性质的影响
2018-01-25李建华刘海燕朱海波鲍晓军
李建华,刘海燕,冯 瑶,朱海波,鲍晓军
1.中国石油大学(北京)重质油国家重点实验室,北京 102249;2.福州大学至诚学院化学工程系,福建 福州 350002;3.福州大学化肥催化剂国家工程研究中心,福建 福州 350116
Al2O3可以用作分析试剂、有机溶剂的脱水和吸附剂、有机反应的催化剂、研磨剂、抛光剂、冶炼铝的原料和耐火材料等[1,2]。根据性质可将其分为过渡态Al2O3和稳态Al2O3,稳态Al2O3为刚玉(即α-Al2O3),过渡态 Al2O3是由氢氧化铝等在不同温度下制取的其它晶相 Al2O3的总称。过渡态 Al2O3根据其生成温度可以分为低温Al2O3和高温Al2O3两大类,低温Al2O3(如:γ-Al2O3)是在不超过600 ℃焙烧得到的,而高温Al2O3(如:θ-Al2O3)是在900~1 000 ℃焙烧制得的[3]。
过渡态Al2O3是重要的催化剂载体,广泛应用于催化燃烧和汽车尾气净化等高温反应中[4],因此其热稳定性对高温反应催化剂具有非常重要的影响[5]。高温反应下,稳定的载体是保证催化剂性能稳定的前提条件,因此 Al2O3热稳定性的研究得到了广泛关注[6]。张立忠等[1]研究了焙烧温度对氧化铝热稳定性的影响,但目前国内外关于焙烧温度和时间等热处理条件对不同晶型Al2O3的结构和性能的稳定性影响还没有系统的研究。本工作系统地研究了γ-Al2O3和θ-Al2O3在不同热处理条件下的变化过程,利用 X射线衍射(XRD)、N2物理吸附-脱附、傅里叶红外(FT-IR)和热分析(TGA-DSC)等技术对热处理前后的样品进行了表征,揭示了焙烧温度和时间对这两种Al2O3的晶相结构、比表面积和孔结构等物理性质的影响规律。最后,简要分析了Al2O3的相变机理。
1 实验部分
1.1 样品的制备
将γ-Al2O3和θ-Al2O3(Sasol公司生产,性质见表1)置于高温焙烧炉中,在不同温度和时间下焙烧得到一系列的样品,并命名为X-T-H(X为Al2O3的种类;T为焙烧温度;H为焙烧时间)。例如:γ-Al2O3在500 ℃处理4 h后得到的样品被命名为γ-Al2O3-500-4。

表 1 γ-Al2O3和 θ-Al2O3的织构性质Table 1 Textural properties of γ-Al2O3 and θ-Al2O3
1.2 样品的表征
样品的X-射线衍射(XRD)表征在日本理学的D/max Ultima IV型X-射线衍射仪上进行,Cu靶,Kα辐射源,测角仪半径285 mm,石墨单色器,管电压40 kV,管电流40 mA,扫描范围5~90°,步长0.02°,扫描速率8 (°)/min;采用美国Micromeritie公司的ASAP 2460型N2物理吸附仪测定样品的织构性质,测试前,样品在300 ℃真空处理6 h,根据BET(Brunauer-Emmett-Teller)公式计算样品的比表面积,BJH(Barret-Joyner-Halenda)模型计算孔径分布,总孔容由相对压力(P/P0)为0.99处吸附的N2体积得到;样品的傅里叶变换红外光谱(FT-IR)表征在Nicolet公司的iS50FT-IR设备上进行,扫描次数为32,分辨率为4 cm-1;热分析(TGA-DSC)表征采用德国生产的STA449F5Jupiter®型真空密闭设备,Ar氛围,测试温度30~1 300 ℃,升温速率为5 ℃/min。
2 结果与讨论
2.1 焙烧温度对γ-Al2O3和θ-Al2O3性质的影响
2.1.1 对 γ-Al2O3和 θ-Al2O3晶型的影响
随着焙烧温度升高,Al2O3由过渡态γ和θ相向稳定的α相转变,通过XRD表征可知样品的相变温度[7]。γ-Al2O3和θ-Al2O3经不同温度焙烧4 h后的样品的XRD谱图如图1(a)和(b)所示。由图1(a)可知:γ-Al2O3只存在γ晶相的特征衍射峰(JCPDS Card No 29-0063);在500~850 ℃处理4 h后,其仍为单一的γ相;当焙烧温度为900 ℃时,其转变为θ晶相(JCPDS Card No 04-0877);当焙烧温度为1 200 ℃时,其完全转变为稳定的α晶相(JCPDS Card No 10-0173)。
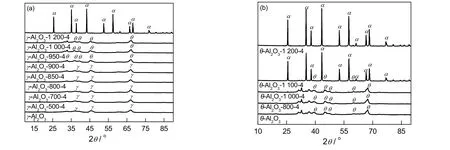
图1 不同焙烧温度处理的(a)γ-Al2O3和(b)θ-Al2O3的XRD图谱Fig.1 XRD patterns of (a) γ-Al2O3 and (b) θ-Al2O3 after treatments at different calcination temperatures
由图1(b)可以看出:θ-Al2O3样品在800~1 000 ℃焙烧4 h时,仍保持单一的θ相;当在1 100 ℃焙烧4 h后,该样品转变为θ和α混合晶相;当焙烧温度为1 200 ℃时,其完全转变为α晶相。这是由于θ-Al2O3是由氢氧化铝在900~1 000 ℃脱水所得的产物,因此在800~1 000 ℃二次焙烧后,其晶相并未发生改变。
2.1.2 对γ-Al2O3和θ-Al2O3比表面积和孔结构的影响
热处理将改变过渡态Al2O3的织构(如比表面积和孔结构)性质,织构的热稳定性是衡量过渡态Al2O3性能的另一个重要参数[8]。为了考察焙烧温度对γ-Al2O3和θ-Al2O3织构性质的影响,利用N2物理吸附仪对样品进行了表征。
图2(a)和(b)分别为γ-Al2O3和θ-Al2O3在不同焙烧温度下的N2吸附-脱附等温线。当焙烧温度不高于1 000 ℃时,这两种Al2O3的N2吸附-脱附等温线均未发生明显变化;当焙烧温度为1 100 ℃时,θ-Al2O3的N2吸附量骤然降低;当焙烧温度为1 200 ℃时,这两种Al2O3的N2吸附量均几乎为0,孔结构坍塌,这是由于其形成了致密的α-Al2O3。另外,当焙烧温度不高于1 000 ℃时,热处理后的γ-Al2O3和θ-Al2O3均呈现出相似的滞后环,根据IUPAC(international union of pure and applied chemistry)对滞后环的分类,它们均属于H2型,孔型为墨水瓶孔。这类孔的特点在于孔口小,孔腔大[9]。

图2 不同焙烧温度处理的(a)γ-Al2O3和(b)θ-Al2O3的N2吸附-脱附等温线Fig.2 N2 adsorption-desorption isotherms of (a) γ-Al2O3 and (b) θ-Al2O3 after treatments at different calcination temperatures
不同焙烧温度处理的γ-Al2O3和θ-Al2O3的比表面积如图 3所示。由图可看出,γ-Al2O3和θ-Al2O3分别在500和800 ℃焙烧4 h后,其比表面积均未发生明显变化,说明Al2O3在其对应的生成温度范围内进行二次焙烧后,所得样品的比表面积不会发生明显改变,即Al2O3在其制备温度范围内稳定性良好。随着焙烧温度升高,γ-Al2O3和θ-Al2O3经焙烧所得样品的比表面积均呈下降趋势,当焙烧温度为1 200 ℃时,其比表面积分别由142.8和103.1 m2/g均骤降至5.6 m2/g,下降幅度分别达96.1%和94.6%,此时这两种Al2O3均完全烧结。当焙烧温度为1 000 ℃时,γ-Al2O3和θ-Al2O3样品的比表面积分别由142.8和103.1 m2/g降至109.4和95.7m2/g,由此可见,这两种不同晶相的Al2O3经1 000 ℃焙烧后,所得样品的比表面积较为接近。另外,由图3还可看出,θ-Al2O3的比表面积在焙烧温度为1 100 ℃时已发生大幅度降低,这是由于θ-Al2O3样品在1 100 ℃时由θ晶相转化为θ和α混合晶相。

图3 不同焙烧温度处理的γ-Al2O3和θ-Al2O3的比表面积Fig.3 Specific surface area of γ-Al2O3 and θ-Al2O3 after treatments at different calcination temperatures
孔结构对载体的活性、选择性、寿命、内扩散速率和机械强度都有显著的影响。为了考察焙烧温度对γ-Al2O3和θ-Al2O3总孔容和平均孔径的影响,对该系列Al2O3的孔结构进行分析,结果如图4所示。由图4(a)可以看出,随着焙烧温度的升高,γ-Al2O3和θ-Al2O3经焙烧所得样品的总孔容均呈下降趋势;当焙烧温度为1 200 ℃时,这两种Al2O3的孔结构均被完全破坏,这是由于高温烧结造成孔结构塌陷,此时γ-Al2O3-1 200-4和θ-Al2O3-1 200-4对应的孔容均为0.007 1 cm3/g。由图4(b)可知,随着焙烧温度的升高,γ-Al2O3和θ-Al2O3的平均孔径均呈现先增加后降低的趋势;由θ-Al2O3的结果可知,当焙烧温度为1 100 ℃时,其平均孔径最大。
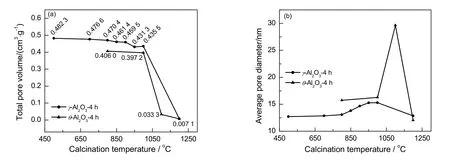
图4 不同焙烧温度处理的γ-Al2O3和θ-Al2O3的(a)总孔容和(b)平均孔径Fig.4 (a) Total pore volume and (b) average pore diameter of γ-Al2O3 and θ-Al2O3 after treatments at different calcination temperatures
2.1.3 对Al2O3骨架振动的影响
以γ-Al2O3为例,考察焙烧温度对其骨架振动的影响,结果如图5所示。由图可看出,γ-Al2O3主要在400~1 700 cm-1和3 200~3 900 cm-1波数段出现红外吸收峰。当焙烧温度不高于1 000 ℃时,热处理所得样品的FT-IR谱图与γ-Al2O3的相似,均在500~750 cm-1波数段出现了归属于4配位Al-O的振动峰,在833 cm-1处出现了归属于6配位Al-O的振动峰。由图可发现,γ(γ-Al2O3,γ-Al2O3-500-4,γ-Al2O3-700-4和γ-Al2O3-800-4)和θ(γ-Al2O3-1 000-4)晶相均呈现出AlO4以及AlO6紧密结构中的Al-O振动峰。由γ-Al2O3-1 200-4样品的 FT-IR谱图可以看出,其呈现出归属于α-Al2O3的Al-O振动峰(450和598 cm-1处)[7],且峰型较尖锐,强度较大。
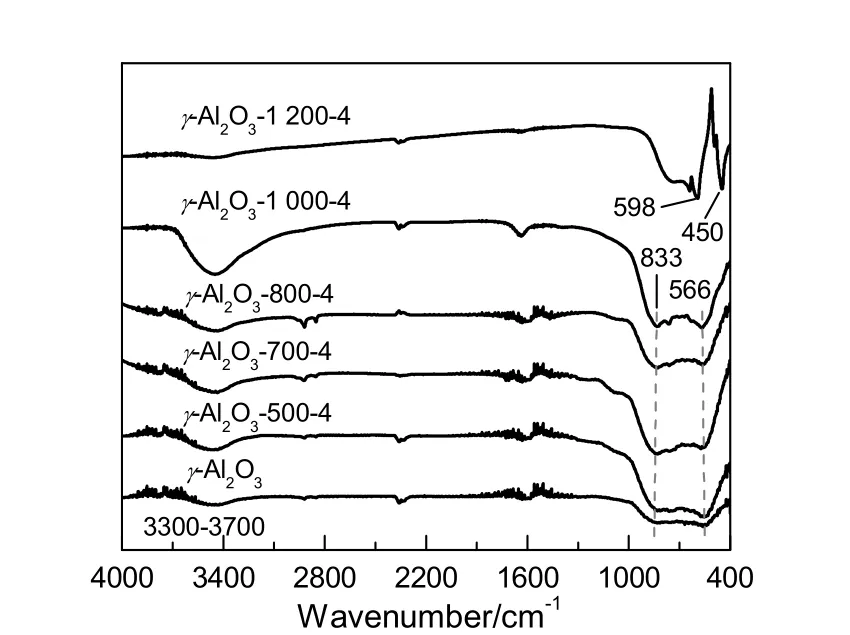
图5 不同焙烧温度处理的γ-Al2O3的FT-IR图谱Fig.5 FT-IR spectra of γ-Al2O3 after treatments at different calcination temperatures
高波数段3 200~3 900 cm-1处的红外吸收峰主要是由Al2O3的羟基引起的。根据Knozinger等[11]的羟基模型,在3 590,3 690,3 710,3 730,3 745,3 775和3 800 cm-1处存在不同的羟基峰,分别对应H键,IIIa,IIIb,IIa,IIb,Ia和Ib。但是,由于环境和设备的限制,仅出现了一个大宽峰,没有办法对其进行分析。
2.2 焙烧时间对θ-Al2O3性质的影响
进一步考察焙烧时间对γ-Al2O3和θ-Al2O3性质的影响时发现:在一定的焙烧温度下,焙烧时间对γ-Al2O3性质的影响很小;θ-Al2O3在1 100 ℃焙烧时,焙烧时间对其性质有显著的影响。因此,在1 100 ℃下考察了焙烧时间对θ-Al2O3样品的晶型、织构性质、骨架振动和表面形貌的影响。
2.2.1 对θ-Al2O3晶型及骨架振动的影响
在1 100 ℃下经不同时间焙烧处理的θ-Al2O3的XRD和FT-IR图谱如图6所示。由图6(a)可知,当θ-Al2O3在1 100 ℃下焙烧1 h后,所得样品已转化为θ和α的混合晶相,且随着焙烧时间的延长,所得样品的混合晶相中α晶相的峰强度逐渐增大,即α晶相的相对含量逐渐增大。另外,随着焙烧时间延长,混合晶相中α晶相的增长速率变缓,且当焙烧时间延长至8 h时,仍有少量的θ晶相存在。
由图6(b)可知,θ-Al2O3在500~900 cm-1波数段出现了AlO4以及AlO6紧密结构中的Al-O振动峰,这与γ(γ-Al2O3)和θ(γ-Al2O3-1 000-4)晶相的骨架振动相似。将θ-Al2O3在1 100 ℃焙烧1 h时,即已出现了归属于α-Al2O3的Al-O振动峰(450和598 cm-1处),且峰型较尖锐,强度较大,进一步说明θ-Al2O3-1 100-1样品中含有α相Al2O3,与XRD的结果相一致。另外,在不同时间焙烧所得样品的FT-IR图谱中,归属于4配位Al(IV)-O和6配位Al(VI)-O的振动峰几乎看不到,这可能由于归属于α-Al2O3的FT-IR吸收较强,因此归属于θ-Al2O3的FT-IR吸收峰无法辨别出来。

图6 θ-Al2O3在1 100 ℃经过不同时间处理后的(a) XRD和(b) FT-IR图谱Fig.6 (a) X-ray diffraction patterns and (b) FT-IR spectra of θ-Al2O3 calcined at 1 100 ℃ with different time
2.2.2 对θ-Al2O3比表面积和孔结构的影响
利用N2物理吸附仪对经不同时间焙烧处理的θ-Al2O3进行了表征,N2吸附-脱附等温线如图7(a)所示。θ-Al2O3的 N2吸附-脱附等温线同γ-Al2O3的相似,根据IUPAC对滞后环的分类,其滞后环也属于H2型,孔型为墨水瓶孔。将θ-Al2O3在1 100 ℃焙烧1或2 h时,所得样品θ-Al2O3-1 100-1和θ-Al2O3-1 100-2的滞后环由θ-Al2O3的H2型转变为H3型,孔型由墨水瓶孔转变为狭缝状孔,且为非均匀的孔。当焙烧时间延长至4 h及以上时,氮气的吸附量较低,无滞后环存在,说明θ-Al2O3-1 100-4和θ-Al2O3-1 100-8样品的孔结构基本坍塌。
θ-Al2O3在1 100 ℃焙烧不同时间所得样品的比表面积和总孔容如图7(b)所示。该样品在1 100 ℃焙烧1 h后,其比表面积和总孔容分别由103.1 m2/g和0.407 3 cm3/g降至40.6 m2/g和0.146 0 cm3/g,即比表面积和总孔容分别降低了60.6%和64.2%。随着焙烧时间的延长,θ-Al2O3经焙烧所得样品的比表面积和总孔容均降低,但降低速率变缓。

图7 θ-Al2O3在1 100 ℃焙烧不同时间所得样品的(a)N2吸附-脱附等温线、(b)比表面积和总孔容及(c)BJH孔分布曲线Fig.7 (a) N2 adsorption-desorption isotherms, (b) specific surface area and total pore volume and (c) pore size distributions from BJH model of θ-Al2O3 calcined at 1 100 ℃ with different time
θ-Al2O3在1 100 ℃下焙烧不同时间所得样品的BJH孔分布曲线如图7(c)所示,其焙烧前后的最可几孔径集中在17 nm左右,说明其孔径分布比较均匀。将θ-Al2O3焙烧1或2 h时,所得样品的最可几孔径由17 nm增加至22 nm;当焙烧时间延长至4或8 h时,该样品的孔结构基本坍塌。
2.3 Al2O3相变机理的讨论
已知 Al2O3有 8种以上的晶型(ρ,η,γ,χ,δ,θ,κ和α-Al2O3等),根据 O2-排列结构可以将Al2O3分成面心立方结构和密排六方结构两大类。根据Al3+亚点阵可以分别将这两大类分成不同的相,其中,γ-Al2O3属于立方晶系,θ-Al2O3为单斜晶系,α-Al2O3为三方晶系[12],如图 8(a)所示。由前面的表征结果可知,γ-Al2O3在900 ℃转变为单一的θ晶相,在1 200 ℃完全转化为稳定的α晶相;θ-Al2O3在1 100 ℃转化为θ和α混合晶相,在1 200 ℃完全转化为稳定的α晶相;也就是说,随着焙烧温度的升高,Al2O3的相变顺序为γ→θ→α,且这类相变是晶格重构的不可逆相变。

图8 γ-Al2O3和θ-Al2O3的(a)晶相转变示意及(b)TG-DSC曲线Fig.8 (a) Schematic of crystal phase transition and (b) TG-DSC curves of γ-Al2O3 and θ-Al2O3
Al2O3由γ相转变为θ相归属于过渡晶型之间的相转变,在该过程中O2-的排列方式不变,均为面心立方结构,但是 Al2O3中处于 O2-四面体和八面体间隙的 Al3+亚点阵的有序度逐渐提高,该相变为拓扑转变,样品的比表面积略微降低。由于该过程中只涉及Al3+的局部迁移,不涉及O2-骨架的变化,因此可以在900 ℃以下完成。Al2O3由θ相转变为α相的过程中会发生结构重整,相变过程中O2-的排列由面心立方转变为密排六方结构。由于涉及到O2-的迁移,需要的能量较多,因此在1 200 ℃才能完成α相变[13,14]。上述的结论可从图8(b)中γ-Al2O3和θ-Al2O3的TG-DSC分析中得到证实,Al2O3由γ相转变为θ相时,热效应不明显,因此其在900 ℃即可完成;而Al2O3由θ相转变为α相的过程热效应较大,因此需要在较高的温度下完成。
3 结 论
研究了热处理温度和时间对γ-Al2O3和θ-Al2O3的晶型、比表面积和孔结构的影响规律。γ-Al2O3和θ-Al2O3在低于相变温度下处理时,具有一定的稳定性,其比表面积和总孔容会随焙烧温度的升高有所减少,但经长时间热处理仍保持较高的比表面积(约100 m2/g)和总孔容(约0.4 cm3/g)。γ-Al2O3在900 ℃转变为θ相,在1 200 ℃转变为单一的α相。θ-Al2O3在1 100 ℃缓慢向α相转变,且随着焙烧时间的延长,α相的含量逐渐增加;在1 200 ℃迅速转化为单一的α相。两种Al2O3在高温处理向α相转变时,孔结构会完全坍塌导致比表面积和孔容会急剧下降,最后形成致密结构的α-Al2O3。
γ-Al2O3和θ-Al2O3相变过程中织构性质的变化与相变的机理密切关联:由γ相转变为θ相的过程中只涉及Al3+的局部迁移,因而相变温度相对低,且相变过程中比表面积和孔径变化不是很明显;由θ相转变为α相时,O2-会发生重排而产生结构重整,因此相变的温度高,同时过程中比表面积和孔径的变化非常明显。
[1]张立忠, 柴永明, 张 潮, 等. 焙烧温度对氧化铝载体物化性能的影响[J]. 当代化工, 2015, 44(10): 2317-2320.Zhang Lizhong, Chai Yongming, Zhang Chao, et al. Effect of calcination temperature on the physical-chemical properties of alumina carrier[J]. Contemporary Chemical Industry, 2015, 44(10): 2317-2320.
[2]李广慈, 赵会吉, 赵瑞玉, 等. 不同扩孔方法对催化剂载体氧化铝孔结构的影响[J]. 石油炼制与化工, 2010, (1): 49-54.Li Guangci, Zhao Huiji, Zhao Ruiyu, et al. Effect of different reaming methods on the pore structure of catalyst carrier[J]. China Petroleum Processing Petrochemical Technology, 2010, (1): 49-54.
[3]Zhang D, Xue L, Xu Y, et al. Adsorption of 4,6-dimethyldibenzothiophene and collidine over MoO3/γ-Al2O3catalysts with different pore structures[J]. Journal of Colloid Interface Science, 2017, 493: 218-227.
[4]Ozawa M. Thermal stabilization of catalytic compositions for automobile exhaust treatment through rare earth modification of alumina nanoparticle support[J]. Journal of Alloys and Compounds, 2006; 408/412: 1090-1095.
[5]蒋 军, 李金兵, 黄景春. 氧化铝载体的物性调控及其对银催化剂性能的影响[J]. 石油化工, 2016, (2): 169-173.Jiang Jun, Li Jinbing, Huang Jingchun. The physical regulation of alumina carrier and its influence on the properties of silver catalysts[J]. Petrochemical Technology, 2016(2): 169-173.
[6]Masuda K, Sano T, Mizukami F, et al. Effect of the type of support preparation on the thermostability and the oxidation activity of CeOx/BaO/Al2O3-supported Pd catalysts[J]. Applied Catalysis A: General, 1995, 133(1): 59-65.
[7]Ozawa M, Nishio Y. Thermal stabilization ofγ-alumina with modification of lanthanum through homogeneous precipitation[J]. Journal of Alloys and Compounds, 2004, 374(1/2): 397-400.
[8]Wang J, Wang Y, Wen J, et al. Effect of phosphorus introduction strategy on the surface texture and structure of modified alumina[J].Microporous and Mesoporous Materials, 2009, 121(1/3): 208-218.
[9]Gu W, Shen M, Chang X, et al. Gelification process to prepare phosphate modified alumina: study on structure and surface properties[J].Journal of Alloys and Compounds, 2007, 441(1/2): 311-316.
[10]Paul P, Bhanja P, Salam N, et al. Silver nanoparticles supported over mesoporous alumina as an efficient nanocatalyst forN-alkylation of hetero(aromatic) amines and aromatic amines using alcohols as alkylating agent[J]. Journal of Colloid Interface Science, 2017, 493:206-217.
[11]Knözinger H, Ratnasamy P. Catalytic aluminas: surface models and characterization of surface sites[J]. Catalysis Reviews, 1978, 17(1):31-70.
[12]Levin I, Brandon D. Metastable alumina polymorphs: crystal structures and transition sequences[J]. Journal of the American Ceramic Society, 1998, 81(8): 1995-2012.
[13]Kumagai M, Messing G L. Controlled transformation and sintering of a boehmite sol-gel byα-alumina seeding[J]. Journal of the American Ceramic Society, 1985, 68(9): 500-505.
[14]Kao H C, Wei W C. Kinetics and microstructural evolution of heterogeneous transformation ofθ-alumina toα-alumina[J]. Journal of the American Ceramic Society, 2000, 83(2): 362-368.
