酯化反应合成苯甲酸甲酯动力学
2018-01-25李柏春韩俏飞邓会宁薛西西
李柏春,韩俏飞,邓会宁,薛西西
河北工业大学化工学院,天津 300130
苯甲酸甲酯是重要的化工原料,被广泛用作有机合成中间体,还可用于纤维素酯、纤维素醚、树脂和橡胶等的溶剂,另外,因其具有浓郁的香气被用作香料和食用香精[1]。苯甲酸甲酯存在于天然的丁香油、依兰油和月下香油中,可从精油中精馏提取。工业上多采用以浓硫酸为催化剂,苯甲酸和甲醇在间歇反应釜中酯化得到苯甲酸甲酯[2]。研究者[3-9]对苯甲酸甲酯的合成进行了大量研究,但研究主要集中在催化剂的改进上,忽略了对产品后续分离的研究。传统的硫酸催化体系都采用间歇的生产工艺生产苯甲酸甲酯,如进行连续化技术改造和过程优化,需要动力学参数进行分析,如采用反应精馏技术[10-12]进行连续化生产就需要有动力学数据的支持。因此,本工作以浓硫酸作催化剂,采用甲醇和苯甲酸在四口烧瓶中反应获取反应数据,通过反应数据回归,计算得到该酯化反应的动力学方程,为连续化反应精馏工艺研究或新反应器设计以及生产工艺优化提供动力学数据支持。
1 实验部分
1.1 实验步骤
酯化反应制备苯甲酸甲酯的动力学实验是在带有搅拌的四口烧瓶中进行的,实验装置见图1。将苯甲酸和甲醇同时加入四口烧瓶中,恒温水浴加热,待实际温度达到设定温度时,迅速加入浓硫酸并开始搅拌,同时反应开始计时,间隔一定时间进行取样分析。实验过程中,根据反应进行的程度调整取样间隔,待各组分浓度基本不变时认为反应平衡,停止实验。
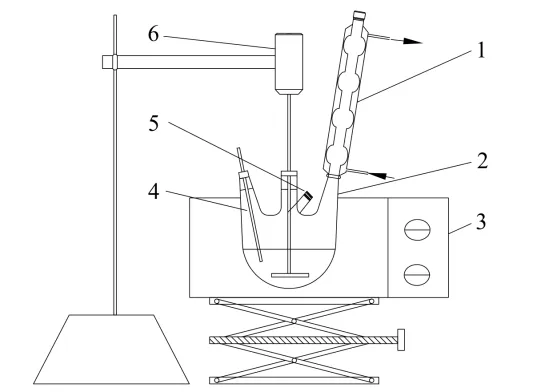
图1 反应动力学实验装置Fig.1 Reaction kinetics experimental apparatus
1.2 分析方法
采用SP-3420A型气相色谱仪对反应产物的组成进行分析。分析条件:色谱柱为KB-5,氢火焰检测器,载气N2,柱温160 ℃,进样温度250 ℃,检测器温度50 ℃,辅助箱温度250 ℃,进样0.2 μL。
利用内标法对实验数据进行校正,选择N,N-二甲基甲酰胺为内标物,绘制出标准曲线,并进行重复性实验,得到较精确的工作曲线。在取出的样品中加入定量的内标物,然后用气相色谱进行分析,通过先前得到的校正因子计算各物质的含量。苯甲酸转化率由下式进行计算:

式中:x为苯甲酸转化率,%;cA0为苯甲酸的初始浓度,mol/L;cA为苯甲酸瞬时浓度,mol/L。
2 结果与讨论
2.1 反应条件对酯化合成苯甲酸甲酯的影响
酯化反应制备苯甲酸甲酯过程中,苯甲酸转化率会受到多种因素的影响,甲醇与苯甲酸反应是在以浓硫酸为催化剂的均相条件下进行的,故消除了内外扩散对反应速率的影响。因此,主要考察搅拌速率、反应温度、催化剂用量和醇酸物质的量之比(醇酸比)对苯甲酸转化率的影响。
2.1.1 搅拌速率的影响
在醇酸比为2:1,反应温度为343.15 K,催化剂用量为苯甲酸质量的5%的条件下,考察搅拌速率对苯甲酸转化率的影响,结果如图2所示。由图可知,随着搅拌速率的增加,苯甲酸的转化率逐渐增加。当搅拌速率由700 r/min提高到800 r/min时,相同时间内,苯甲酸转化率增幅不明显。因此认为在搅拌速率大于700 r/min时,反应物与催化剂已混合充分。考虑到太高的搅拌速率对设备磨损较大,且加大能耗,因此,本动力学实验在700 r/min的搅拌速率下进行。
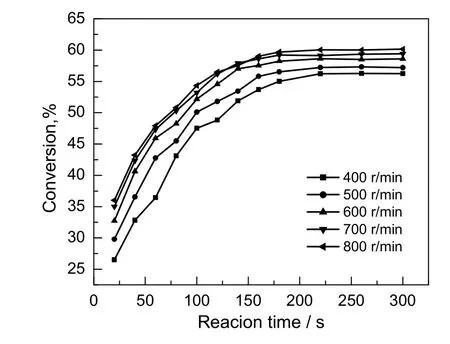
图2 搅拌速率对苯甲酸转化率的影响Fig.2 Effect of stirring rate on the conversion rate of benzoic acid
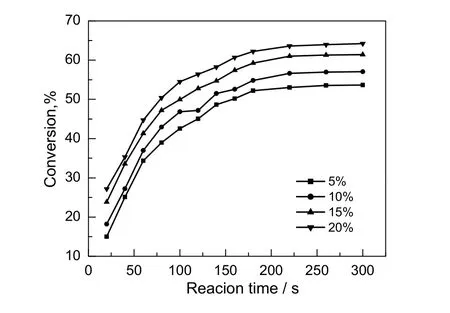
图3 催化剂用量对苯甲酸转化率的影响Fig.3 Effect of catalyst dosage on the conversion rate of benzoic acid
2.1.2 催化剂用量的影响
在反应温度为343.15 K,醇酸比为2:1,搅拌速率为700 r/min的条件下,考察不同催化剂用量对苯甲酸转化率的影响,结果如图3所示。由图可知,苯甲酸的转化率随着催化剂用量的增加而增大。在酯化反应中,醇作为亲核试剂对羧基的羰基进行亲核攻击,浓硫酸含量的增加,使得羰基碳更为缺电子而有利于醇与其发生亲核加成,但是浓硫酸对设备有腐蚀性,后期处理麻烦,故催化剂用量占苯甲酸总质量的15%较合适。
2.1.3 醇酸比的影响
在反应温度为343.15 K,催化剂用量占苯甲酸总质量15%,搅拌速率为700 r/min的条件下,考察不同醇酸比对苯甲酸转化率的影响,结果如图4所示。由图可知,随着醇酸比的增大,苯甲酸的转化率在逐渐增大,由于该反应属于可逆反应,根据勒夏特列原理[13],增加甲醇的物质的量会促进反应向正方向进行,从而增大另一反应物的转化率。当醇酸比增加到3:1时,转化率相较其他配比变化不大,且由于过多的醇使得后续分离更耗能,故醇酸比为3:1较合适。
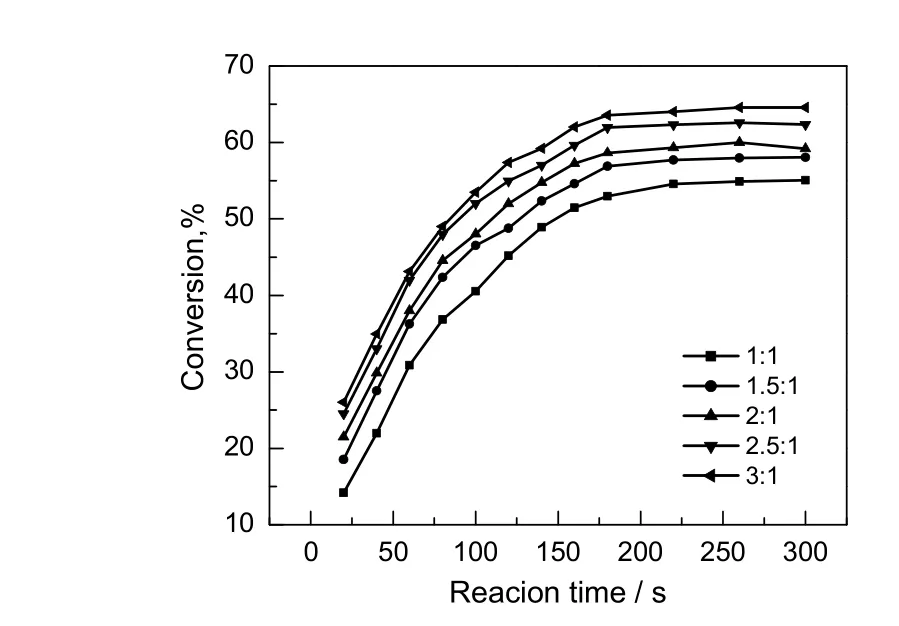
图4 醇酸比对苯甲酸转化率的影响Fig.4 Effect of initial molar ratio of alcohol to acid on the conversion rate of benzoic acid
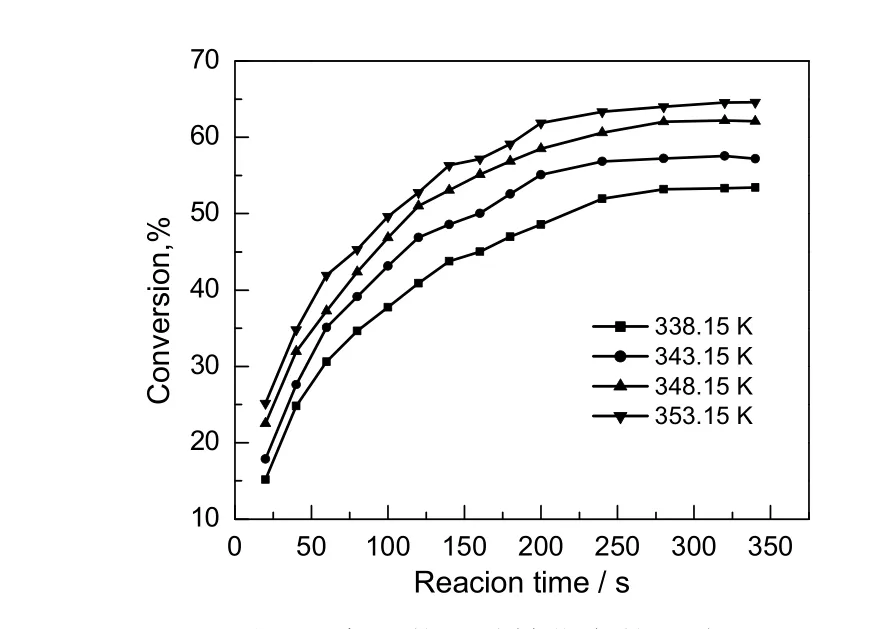
图5 温度对苯甲酸转化率的影响Fig.5 Effect of temperatures on the conversion rate of benzoic acid
2.1.4 反应温度的影响
在醇酸比为3:1,催化剂用量占苯甲酸总质量的15%,搅拌速率为700 r/min的条件下,考察反应温度对苯甲酸转化率的影响,结果如图5所示。由图可知,随着温度的升高,苯甲酸转化率在逐渐增大,在一定条件下,适当的提高温度对反应有利。由图5还可看出,在温度由348.15 K升高到353.15 K时,苯甲酸转化率变化幅度减小,综合考虑能耗与转化率,反应温度为353.15 K较合适。
2.2 动力学模型的建立
苯甲酸和甲醇的反应是二级可逆反应[14]。
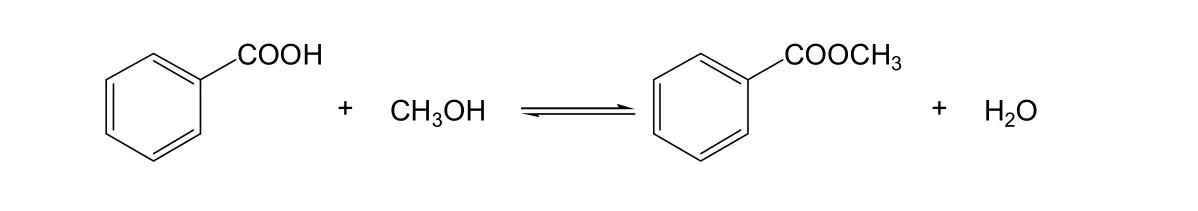
反应的化学平衡常数取决于反应温度,通过实验测定不同温度下各组分的平衡组成,得到各温度下的平衡常数。计算表达式如下:

式中:K为化学平衡常数;cC为苯甲酸甲酯的浓度,mol/L;cD为H2O的浓度,mol/L;cB为甲醇的浓度,mol/L;T为反应温度,K。
将各温度下的平衡组成带入公式(1),得到不同温度下的化学平衡常数,如表1所示:
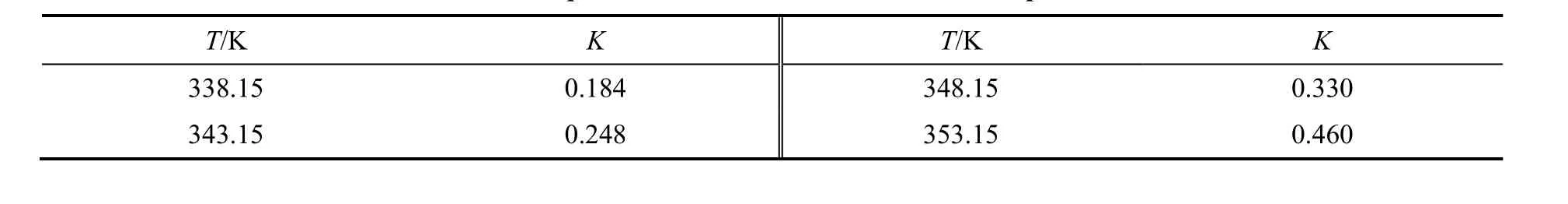
表1 不同温度下的平衡常数Table 1 Equilibrium constant at the different temperatures
2.2.1 参数拟合
根据范德霍夫方程:

式中,△H为反应焓变,kJ/mol。
将不同温度下的lnK对T-1作图,得到化学平衡常数和温度的关系,如图6所示。由图可知,lnK与T-1基本成线性关系,通过线性回归可得关系式如下:
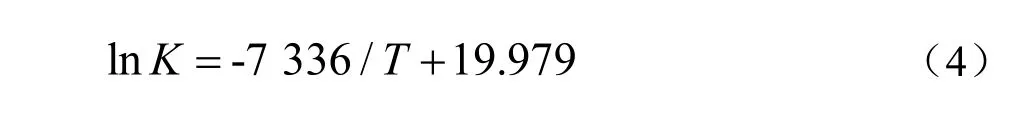

图6 反应温度对平衡常数的影响Fig.6 Effect of reaction temperature on the equilibrium constant
由式(3)计算可以得到△H为60.9 kJ/mol,说明酯化生成苯甲酸甲酯的反应为吸热反应。苯甲酸的转化率随着温度升高而增大,较高温度有利于反应进行。
2.2.2 数据拟合
苯甲酸和甲醇的反应在浓硫酸作用下是二级均相反应[15,16],则该反应速率方程为:

式中:k+和k-分别为正逆反应速率常数。简化上式得:

用转化率表示上式可得:
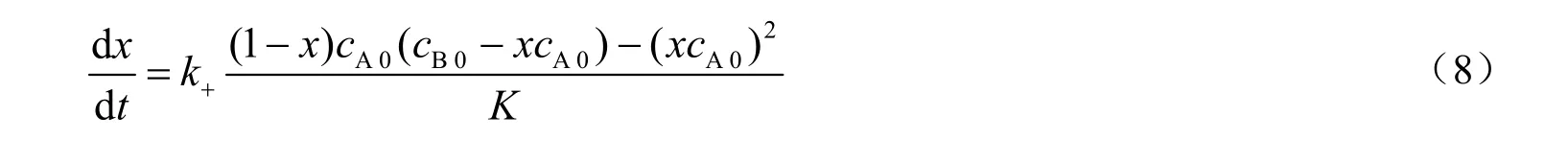
式中,cB0为甲醇的初始浓度,mol/L。
将式(8)积分得:
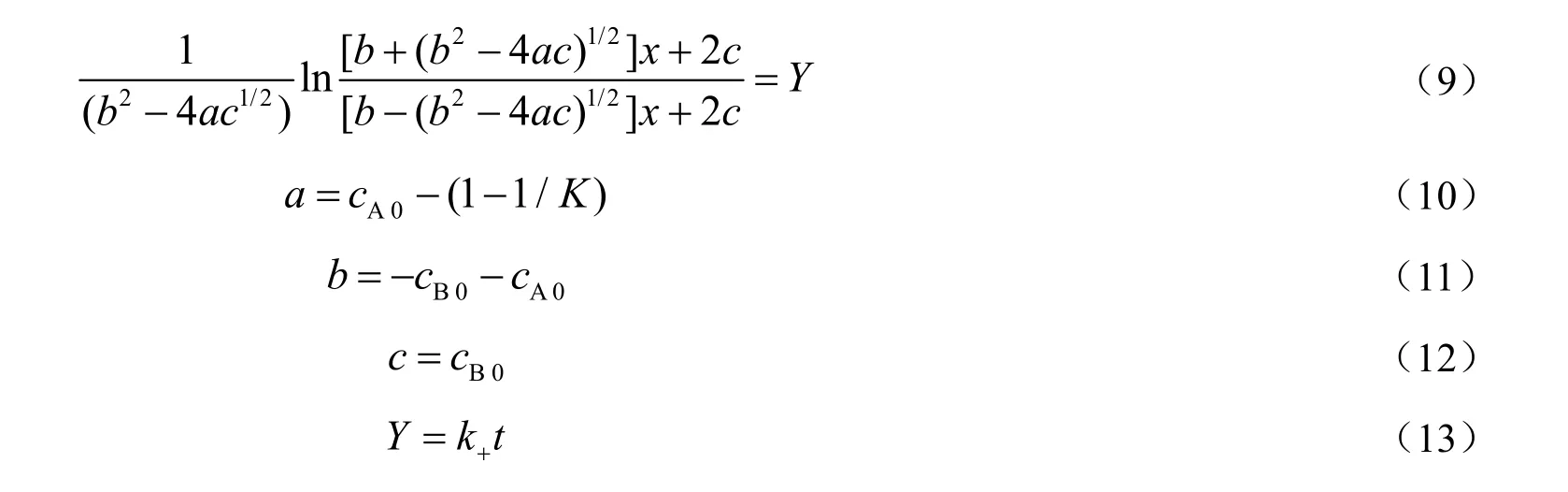
通过苯甲酸和甲醇的初始浓度可计算出a,b,c和Y,由实验测定的浓度和时间的关系数据,将Y对t作图,结果见图7。由图可知,不同温度下的Y值与时间t的线性关系显著,验证了反应机理和动力学方程的准确性[17],确定了苯甲酸和甲醇反应制备苯甲酸甲酯为二级可逆反应。由各个直线的斜率可得到不同温度下的反应速率常数,见表2。
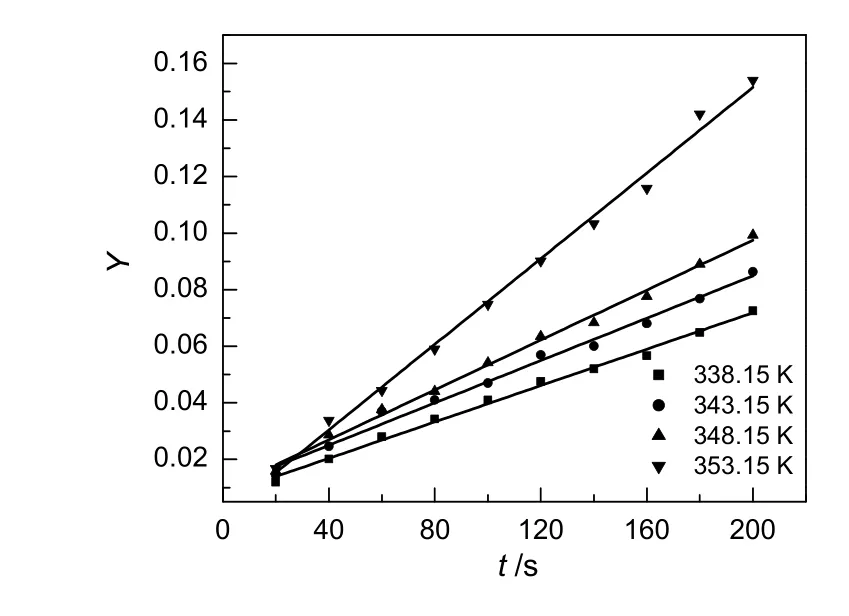
图7 不同反应温度下Y与时间的关系Fig.7 The relationship of Y and t at different temperature
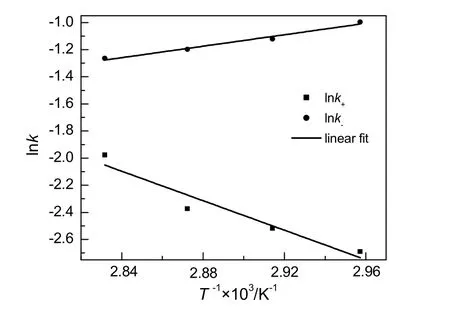
图8 反应速率常数与温度的关系Fig.8 The relationship between the reaction rate constant and temperature
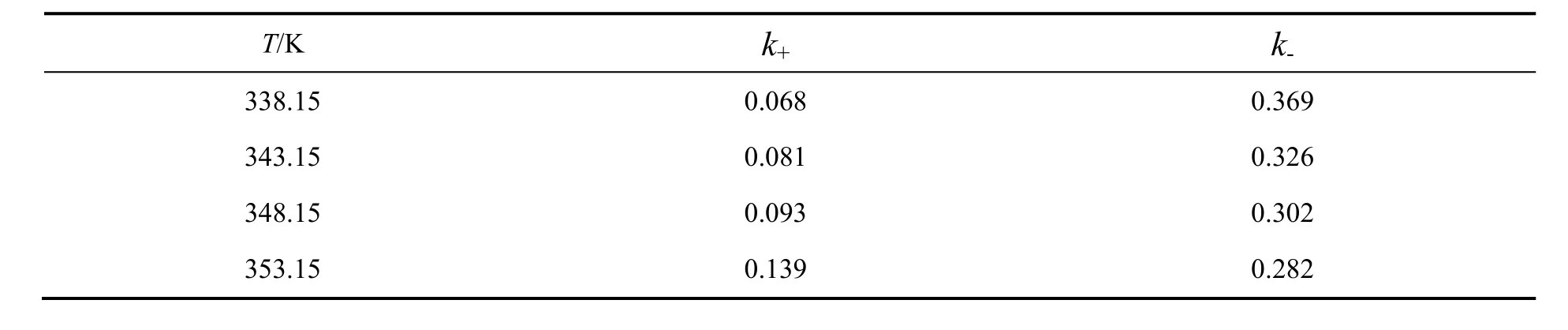
表2 不同温度下的反应速率常数Table 2 Reaction rate constant at different temperatures
根据Arrhenius方程可得:

式中:A为指前因子;Ea为反应活化能。
将lnk对T-1作图,结果见图8所示。由图可看出,lnk与T-1呈线性关系。通过斜率和截距求得活化能和指前因子,结果见表 3。综上,可以得到苯甲酸和甲醇酯化反应制备苯甲酸甲酯的动力学方程为:
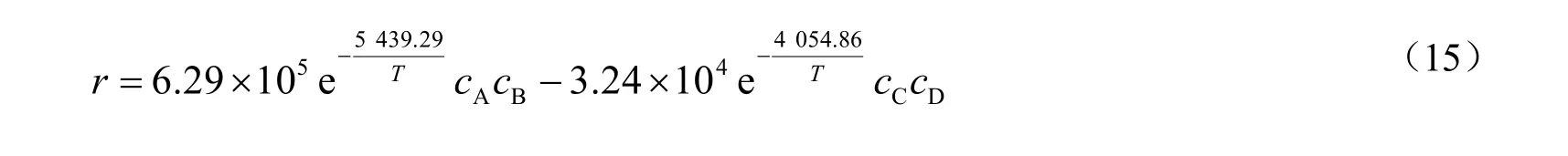
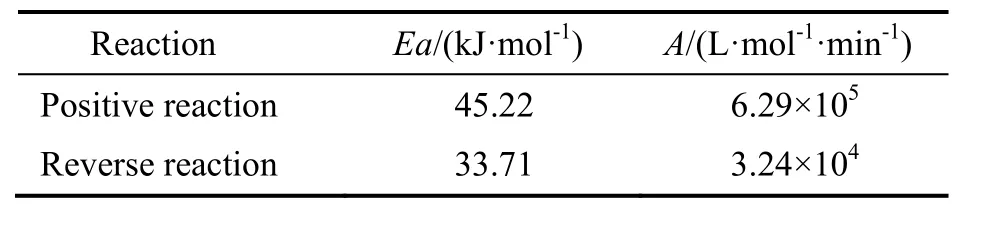
表3 反应的活化能与指前因子Table 3 Reaction activation energy and frequency factor
2.2.3 动力学模型参数验证
为了验证所得动力学模型的可靠性,在催化剂用量为苯甲酸质量的15%,醇酸比为3:1,转速为700 r/min,温度为350.15 K的条件下进行实验。将实验得到的苯甲酸转化率随时间的变化情况与动力学方程计算得到的计算值进行比较,结果如图 9所示。由图可知,动力学模型计算值与实验值较接近,经计算其相对误差小于 5%,说明所求得的动力学模型预测的结果与实验结果吻合良好。
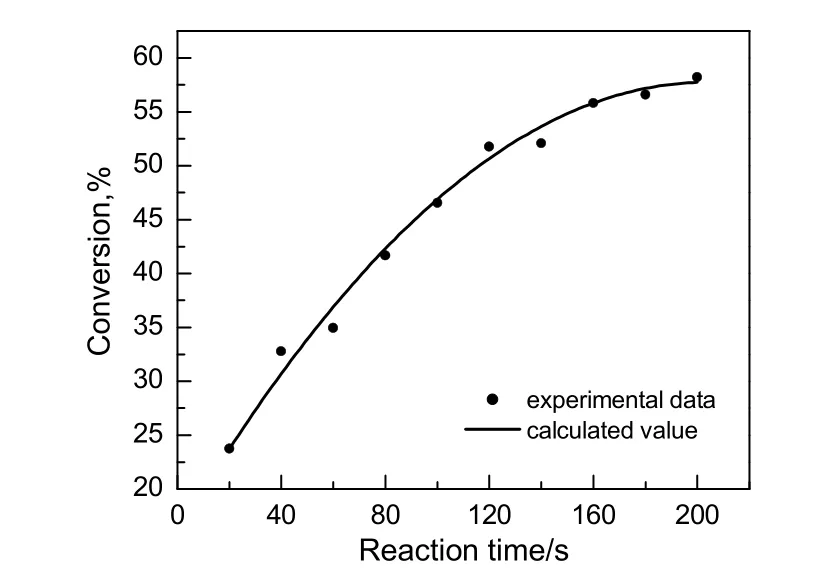
图9 实验结果与计算值比较Fig.9 Comparison of experimental data and the calculated value
3 结 论
在间歇反应釜中,以浓硫酸作催化剂进行苯甲酸与甲醇酯化合成苯甲酸甲酯反应,由各个因素对苯甲酸转化率的影响确定了最优的反应条件。通过对反应机理进行分析,将实验数据采用均相模型进行关联,得到了酯化反应合成苯甲酸甲酯的动力学方程。并对得到的模型进行验证,动力学模型计算值与实验值吻合良好,可为反应精馏合成苯甲酸甲酯提供基础数据。
[1]俞继华. 壳聚糖硫酸盐催化合成苯甲酸甲酯[J]. 化工科技, 2000, 8(6): 15-16.Yu Jihua. Synthesis of methyl benzoate using chitosan sulfate as catalyst[J]. Science & Technology in Chemical Industry, 2000, 8(6): 15-16.
[2]蔡 蕍, 陶建伟, 丁 蕙, 等. 苯甲酸甲酯微波合成研究[J]. 化学世界, 2006, 12(12): 746-748, 752,761.Cai Yu, Tao JianWei, Ding Hui, et al. Synthesis of methyl benzoate under microwave irradiation[J]. Chemical World, 2006, 12(12):746-748, 752, 761.
[3]李 兑, 黄先胜, 李 平, 等. 对甲苯磺酸催化合成苯甲酸甲酯的研究[J]. 安徽化工, 2013, 39(3): 25-26.Li Dui, Huang Xiansheng, Li Ping, et al. Synthesis of methyl benzoate catalyzed byp-toluenesulfonic acid[J]. Anhui Chemical Industry,2013, 39(3): 25-26.
[4]高晓丽, 薛 华. AlMCM-41介孔分子筛催化合成苯甲酸甲酯的研究[J]. 化学工程师, 2010, 12(12): 65-68.Gao Xiaoli, Xue Hua. Study on catalytic synthesis of methyl benzoate over AlMCM-41 zeolite[J]. Chemical Engineer, 2010, 12(12): 65-68.
[5]Wen R M, Lei C X, Ding L Z, et al. Synthesis of methyl benzoate catalyzed by NaHSO4·H2O[J]. Chinese Journal of Synthetic Chemistry,2003, 11(1): 89-92.
[6]崔 萍, 赵燕萍. 固体铁系超强酸催化合成苯甲酸甲酯[J]. 云南化工, 2005, 32(3): 26-27.Cui Ping, Zhao Yanping. Synthesis of methyl benzoate by the catalysis of solid iron super-strong acid[J]. Yunnan Chemical Technology,2005, 32(3): 26-27.
[7]胡思前, 陈快快. 固体Ti(SO4)2催化合成苯甲酸甲酯[J]. 精细与专用化学品, 2004, 12(17): 19-20, 24.Hu Siqian, Chen Kuaikuai. Synthesis of methyl benzoate using solid Ti(SO4)2as catalyst[J]. Fine and Specialty Chemicals, 2004, 12(17):19-20, 24.
[8]尚海燕, 王宏伟. 氯化铝催化合成苯甲酸甲酯[J]. 内蒙古石油化工, 2002, 27(1): 8-7.Shang Haiyan, Wang Hongwei. Synthesis of methyl benzoate using aluminium muriate[J]. Journal of Inner Mongolia Petrochemical Industry, 2002, 27(1): 8-7.
[9]殷树梅. 复合催化剂催化合成苯甲酸甲酯[J]. 精细石油化工进展, 2009, 10(7): 5-6, 10.Yin Shumei. Synthesis of methyl benzoate using composite catalysts[J]. Advances in Fine Petrochemicals, 2009, 10(7): 5-6, 10.
[10]Shao M, Wu Y, Zhang Z, et al. Catalytic reaction-rectification integrated process and specialized device thereof: US, 8721842[P].2008-11-20.
[11]郭进宝. 反应精馏技术的研究现状及应用[J]. 精细化工中间体, 2005, 35(1): 26-30.Guo Jinbao. Research actualities and application of reactive distillation technique[J]. Fine Chemical in Termediates, 2005, 35(1): 26-30.
[12]蒋 峰. 反应精馏在酯化反应中的应用研究[D]. 南京: 南京理工大学, 2004.
[13]顾翼东. 化学词典[M]. 上海: 上海辞书出版社, 1989: 760.
[14]羊衍秋, 宋 航, 付 超, 等. 用阳离子交换树脂—FeCl3络合催化合成丁酸异戊酯的动力学研究[J]. 四川大学学报(工程科学版),2000, 32(2): 36-39.Yang Yanqiu, Song Hang, Fu Chao, et al. Kinetics of the synthesis of isoamyl butyrate catalyzed by the complex of cation exchange resin with ferric chloride[J]. Journal of Sichuan University(Engineering Science Edition), 2000, 32(2): 36-39.
[15]陈海波, 吴 巍, 叶 岗, 等. 醋酸甲酯水解的反应动力学[J]. 工业催化, 2005, 13(9): 36-40.Chen Haibo, Wu Wei, Ye Gang, et al. The Kinetics for hydrolysis of methyl acetate over ammonium heteropoly acids[J]. Industrial Catalysis, 2005, 13(9): 36-40.
[16]王 勇, 张 云, 张志昆, 等. 醋酸甲酯合成的非均相反应动力学[J]. 石油化工, 2012, 41(6): 677-681.Wang Yong, Zhang Yun, Zhang Zhikun, et al. Kinetics of the heterogeneous synthesis of methyl acetate[J]. Petrochemical Technology,2012, 41(6): 677-681.
[17]李柏春, 巢 飞, 徐敬瑞. 甲缩醛催化精馏过程宏观动力学研究[J]. 化学工程, 2012, 40(6): 64-67.Li Baichun, Chao Fei, Xu Jingrui. Macrokinetics of methylal synthesis by catalytic distillation[J]. Chemical Engineering(China), 2012,40(6): 64-67.
