2,6-二甲基萘催化氧化制备2,6-萘二甲酸动力学
2018-01-25徐晓瑀王丽军
徐晓瑀,王丽军
浙江大学化学工程与生物工程学院,浙江 杭州 310058
2,6-萘二甲酸(2,6-NDA)及其衍生物是制备各种聚酯和聚氨酯材料的重要单体,特别是2,6-萘二甲酸与乙二醇反应得到的聚2,6-萘二甲酸乙二醇酯(PEN)是一种新型高性能工程塑料,其具有独特的物理机械性能、耐热性能、光学性能、气体阻隔性和化学稳定性[1,2]。近些年,2,6-NDA的制备技术越来越受到关注。
2,6-NDA的制备方法主要有亨克尔法、2-烷基-6-酰基萘氧化法和2,6-二烷基萘氧化法3种[3]。亨克尔法又分为歧化法和异构法,该方法使用高毒性镉盐作为催化剂,反应温度和压力较高,酸碱消耗大,工业上已不使用。陶帅江等[4]以2-甲基-6-丙酰基萘为原料,在200 ℃,1.9 MPa下,通过半连续装置反应2.5 h后,2,6-NDA的产率达91.44%,纯度99%以上。三菱公司建立了以2-甲基-6-乙酰基萘为原料制备2,6-萘二甲酸的生产装置,此方法不足之处为三废污染大[5]。2,6-二烷基萘氧化法是目前制备2,6-NDA的主要方法。Kamiya等[6]通过2,6-二乙基萘于160 ℃,在Co-Mn-Br催化剂作用下反应1 h,2,6-NDA的收率达到90%,最佳的反应物浓度为0.3 mol/L,反应物浓度过高会抑制反应的进行。Amoco公司建立了60 000 t/a 2,6-NDA的生产装置,反应原料为2,6-二甲基萘(2,6-DMN),氧化工艺条件为177~215 ℃,1~3 MPa,反应介质为醋酸,氧化剂为空气,催化剂为Co-Mn-Br三元催化剂,2,6-NDA的收率可达到95%[7,8]。张春荣等[9]在230 ℃和2.8 MPa下,以2,6-二甲基萘为原料,采用醋酸作为溶剂,以15:1的溶剂比,在Co-Mn-Br催化剂的作用下,通过液相高温氧化得到2,6-NDA的收率最高达90%。
关于2,6-DMN氧化制备2,6-NDA的动力学研究较少,Tian等[10]提出2-甲基-6-乙酰基萘的一级氧化动力学模型。然而,大量甲基芳烃氧化研究[11-13]表明,一级氧化动力学规律与实验结果差异较大。王丽军等[14]提出芳烃氧化的双曲动力学模型。Wang等[15]提出分数型动力学模型。张炳琦[16]用n级速率方程式拟合实验数据。本工作对2,6-DMN液相氧化制备2,6-NDA过程进行了系统的实验研究,建立了该反应的动力学模型,并通过实验数据回归模型参数,为氧化反应技术的开发奠定了基础。
1 动力学实验
以 2,6-DMN(通过结晶自制,纯度大于 99.5%。)为原料,空气作为氧化剂,Co-Mn-Br三元复合催化体系下,以醋酸(HAc)为溶剂,在分批式搅拌釜内进行氧化动力学的实验研究。
1.1 实验装置与方法
反应在图1所示的0.5 L的钛材高压反应釜中进行,反应釜配有取样器、冷却盘管、加热套、热电偶、压力探测器和尾气冷凝器等装置。另有精密背压阀和气体质量流量计控制和计量空气流速,氧气检测仪测定尾气氧含量,计算机控制与数据采集系统控制冷却导热油的泵入量和反应过程数据的采集。
反应前,将反应物、溶剂和催化剂(共300 g)一次性加入反应釜,用N2吹扫排尽釜内的空气后加压至1.6 MPa,加热套将釜内加热至指定温度后,打开进气阀,以16 L/min的进气速率通入空气,并通过背压阀调节釜内压力至2.15 MPa。计算机系统会根据釜内实时温度控制蠕动泵转速来调节导热油的泵入量,进而维持釜内温度在指定值。反应尾气通过冷凝器回流醋酸和 2,6-DMN后,依次通过背压阀,转子流量计,缓冲瓶,干燥瓶和磁氧分析仪,随后排入空气中。
在实验过程中,每隔1.0~1.5 min取一次液体样品,通过三阀取样,为防止取样管中有残留,每次取样完成后,用N2吹扫取样管。
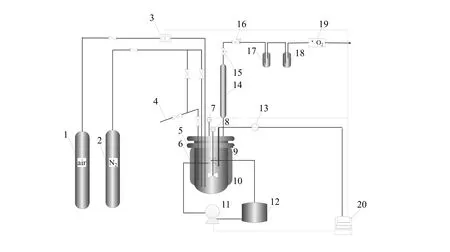
图1 实验装置Fig.1 Experimental setup
1.2 反应路径
反应过程中液相组分取样的液相色谱图如图2所示,主要组分在图中以峰1~5表示。其中,峰1和峰5通过与标准样品液相色谱图比对可以确定分别为2,6-NDA和2,6-DMN。峰2和峰3通过液质联用检测到分别为2-甲酰基-6-萘酸(2,6-FNA)和2-甲基-6-萘酸(2,6-MNA),结果如图3和4所示。峰4在质谱中无响应,所以无法通过液质联用检测。Kamiya等[6]提出2,6-二乙基萘的氧化路径并通过实验验证乙基氧化得到羧基主要是通过生成乙酰基来实现的。与2,6-DMN氧化过程具有相似性的其他甲基芳烃氧化过程如对二甲苯(PX)氧化,也已被验证甲基通过生成醛基进而生成羧基。通过比较峰4和对甲基苯甲醛的液相色谱最大吸收波长,也可以确定峰 4的特征基团为醛基。因此,确定峰 4为反应中间物 2-甲基-6-甲酰基萘(2,6-MFN)。综上所述,本工作提出了如图5所示的2,6-DNM液相催化氧化制备 2,6-NDA的路径。反应过程中,原料2,6-DMN依次氧化得到2,6-MFN,2,6-MNA,2,6-FNA和2,6-NDA。
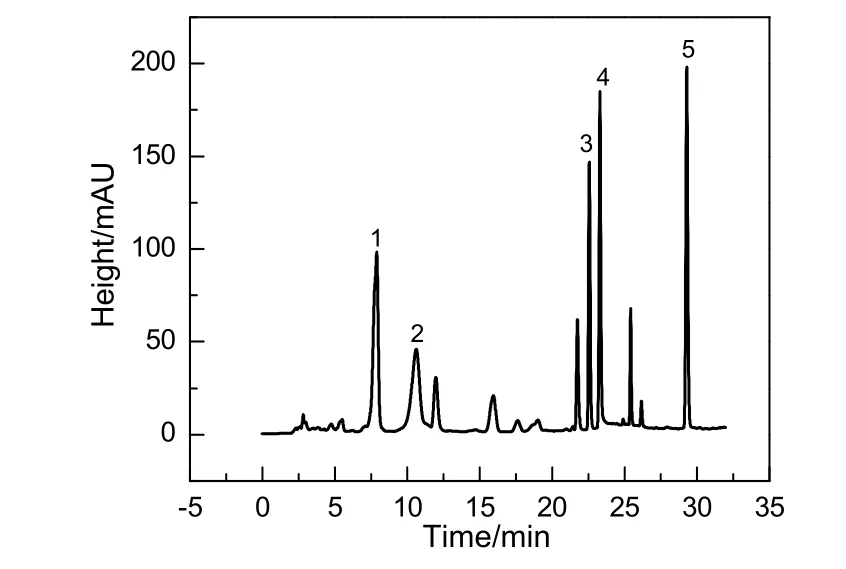
图2 反应各主要组分液相色谱Fig.2 Liquid chromatograms of the main reactant in typical sample

图3 液质联用检测到2,6-FNA结果Fig.3 2,6-FNA detected by liquid chromatograph mass spectrometer

图4 液质联用检测到2,6-MNA结果Fig.4 2,6-MNA detected by liquid chromatograph mass spectrometer

图5 2,6-二甲基萘的氧化路径Fig.5 Oxidation scheme of 2,6-dimethylnaphthalene
反应过程中5种主要组分的浓度变化如图6所示。由图可知,反应过程中各中间组分浓度均有最大值出现,符合串联反应过程组分浓度变化特征。
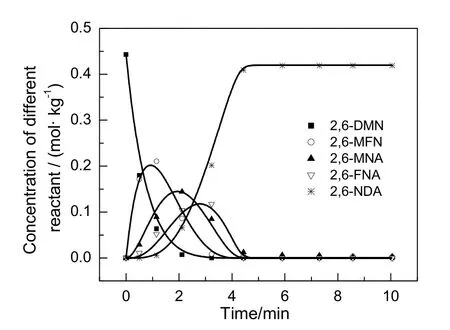
图6 各组分浓度随时间变化曲线Fig.6 Changes of concentration of different components with time
1.3 分析测试方法
液体样品中 2,6-DMN,2,6-MFN,2,6-MNA,2,6-FNA,2,6-NDA和各杂质的含量利用高效液相色谱(HPLC)分析[17,18],通过三元梯度洗脱分离各组分,其中2,6-DMN和2,6-NDA及各杂质采用外标法标定后得到具体数值。由于 2,6-MFN,2,6-MNA和 2,6-FNA无法获得标准样品,其响应因子是在质量守恒方程的约束下,通过多组实验数据回归得到,结合液相色谱数据进而计算得到液相中各组分含量。各组分响应因子见表1。

表1 各主要组分响应因子Table 1 The response factors of different components
高效液相色谱分析仪为Agilent 1100,分析条件为色谱柱Agilent ZORBAX SB-C18;检测器为DAD检测器;进样量20 µL;波长270 nm;柱温30 ℃;流速1 mL/min;分析时间32 min。梯度洗脱程序如表2所示。

表2 高效液相色谱洗脱梯度Table 2 Gradient elution of liquid chromatograph
2 反应动力学模型
2.1 反应动力学模型的确定
根据以上反应路径,对间歇反应过程中各组分的浓度变化分别采用以下方程来描述:

式中:C1,C2,C3,C4和C5分别代表2,6-DMN,2,6-MFN,2,6-MNA,2,6-FNA和2,6-NDA在液相组分中的浓度;r1,r2,r3和r4分别代表图5中每步反应的反应速率。
Cao等[19]认为,对于烃类液相氧化而言,反应对氧浓度为0级。所以本研究的主要任务是由实验数据确定反应速率ri和浓度C1,C2,C3,C4及C5的关系。关于2,6-DMN氧化的动力学模型,国内外都鲜有研究。由于PX氧化制备对苯二甲酸(TA)和2,6-DMN氧化制备2,6-NDA的反应条件和反应路径极其相似,有学者将已经提出的PX氧化动力学模型应用到2,6-DMN的氧化动力学中。Tian等[10]研究了2-甲基-6-乙酰基萘液相催化氧化制备2,6-NDA的动力学,并采用了PX氧化的一级动力学模型。而李静等[12]在研究PX氧化动力学时,曾比较过一级动力学模型,n级的反应动力学方程拟合和双曲动力学模型,发现一级动力学模型和n级反应动力学方程拟合效果都十分不理想,而双曲动力学模型则与数据能较好地吻合。经实验发现,双曲型模型拟合数据与本实验的实验数据也具有较好的一致性。因此,本工作采用双曲型动力学模型来进行实验数据回归和影响因素分析。
双曲动力学模型的形式为[20]:

式中:rj为各步反应速率,mol/(kg·s);kj为速率常数,s-1;Cj为各组分浓度,mol/kg;di,ε和βj是引入的经验参数。
2.2 参数拟合方法
本研究参数拟合的方法是,给出参数初值,采用四阶Runge-Kuttad[21,22]方法求解描述反应过程的间歇式反应器模型,将求得的浓度分布曲线与实验值进行比较。调整模型参数使二者一致即可。参数优化采用基于最小二乘法的单纯形优化方法。拟合过程的计算程序均由Matlab语言编程完成。
3 结果与讨论
3.1 反应物浓度影响
在反应温度为190 ℃,催化剂Co的浓度为200 mg/kg,Mn和Co物质的量之比为3:1,(Co+Mn)和Br物质的量之比为2:1,空气流速为16 L/min,压力为2.15 MPa下,分别在不同2,6-DMN和HAc的质量比下进行实验。为了便于比较,将反应中所有组分的浓度均除以 2,6-DMN的初始浓度后化为归一化浓度,液相中各主要组分浓度随时间的变化情况如图7所示。
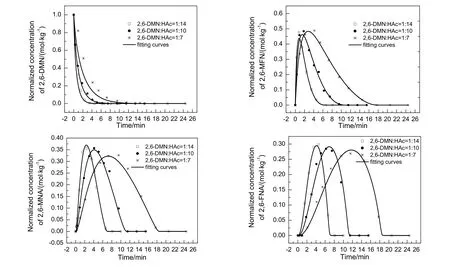
图7 不同2,6-DMN浓度下各组分浓度随时间的变化Fig.7 Changes of concentration of different components with time at different initial 2,6-DMN concentration
由图可知,2,6-DMN的初始浓度对反应速率影响较大,初始浓度越低,反应时间越短。由浓度曲线计算得出,反应物初始浓度提高1.4倍和2倍,2,6-NDA达到80%收率所用时间分别提高1.6倍和2.6倍,说明氧化反应速率与反应物浓度不成正比,氧化反应并非一级,呈现出分数型的特征。
采用双曲型动力学模型拟合各浓度曲线,可以看到模型与实验曲线的拟合程度较好,计算值与实验值的平均误差分别为7.8%,6.9%和7.8%。相关的动力学参数列于表3。

表3 动力学模型参数Table 3 Parameters of the kinetics model
3.2 反应温度影响
反应速率常数与温度的关系通常用Arrhenius方程来描述:

在2,6-DMN和HAc的质量比为1:14,Co的浓度为200 mg/kg,Co,Mn和Br物质的量之比为1:3:2,空气流速为16 L/min,压力为2.15 MPa的条件下,考察不同温度对反应物和中间产物各组分浓度的影响,结果见图8。

图8 不同温度条件下的反应物和中间产物浓度曲线Fig.8 Concentration of different reactants and intermediate products vs time at different reaction temperatures
由图8可知,各组分浓度曲线均随温度升高而变窄或前移,说明反应速率随温度升高而加快。计算值与实验值的平均误差分别为8.1%,6.6%,7.2%和6.3%。将各组数据带入双曲型动力学模型中,求得各温度下各步反应的动力学参数,再由Arrhenius方程可以求得各步反应的指前因子和活化能,结果列于表4。
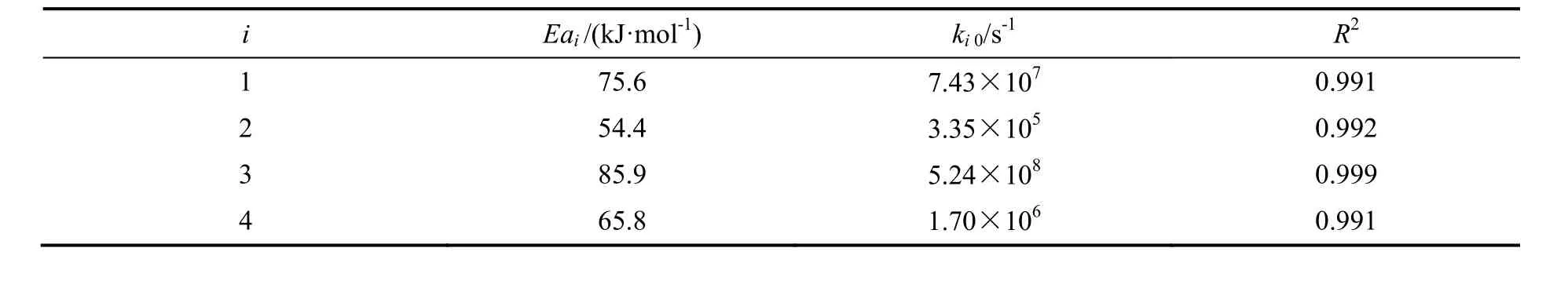
表4 Arrhenius方程参数值Table 4 Parameters of Arrhenius equation
活化能是反应温度敏感性的重要指标,活化能越大,反应对温度越敏感。从表4看出,2,6-MNA生成2,6-FNA的活化能最大,2,6-DMN生成2,6-MFN次之,说明2,6-DMN上两个甲基的氧化更容易受温度的影响。
3.3 催化剂总浓度影响
在2,6-DMN和HAc质量比为1:14,反应温度为190 ℃,Co,Mn和Br的物质的量之比为1:3:2,空气流速为16 L/min,压力为2.15 MPa的条件下,考察催化剂总浓度(以Co催化剂浓度计)对反应物和中间产物各组分浓度的影响,结果见图9。

图9 不同催化剂浓度条件下的反应物和中间产物浓度曲线Fig.9 Concentration of different reactants and intermediate products vs time at different catalyst concentrations
由图9可知,各组分浓度曲线均随Co催化剂浓度升高而变窄或前移,说明反应速率随着催化剂总浓度升高而加快。计算值与实验值的平均误差分别为5.9%,8.8%和7.4%。将各组数据带入双曲型动力学模型中求得各催化剂浓度下各步反应的动力学参数,并将各步速率常数与催化剂总浓度的关系总结于表5。由表可知,催化剂在高浓度时,对反应速率的加快效果更加明显,尤其是对第二步和第三步反应,即2,6-MFN和2,6-MNA的氧化,催化剂的影响相对于其余两步反应来说更加显著一些。

表5 速率常数ki与催化剂浓度的关系Table 5 Relation between ki and the catalyst concentrations
4 结 论
探究了2,6-DMN在Co-Mn-Br催化剂催化作用下,空气液相氧化制备2,6-NDA的反应机理和动力学,提出了 2,6-DMN的串联氧化路径。实验获得了在不同反应物浓度、温度和催化剂浓度条件下各组分浓度随时间的变化数据,用双曲型动力学模型拟合实验数据,通过Arrhenius方程得到各步反应的指前因子和活化能数据。反应的速率控制步骤为2,6-FNA生成2,6-NDA,2,6-MNA生成2,6-FNA的反应对温度最敏感,高浓度催化剂对2,6-MFN和2,6-MNA的氧化反应速率加快效果影响更加明显。
[1]Qing X, Peisheng M. Measurement and correlation for solubility of dimethyl-2,6-naphthalene dicarboxylate in organic solvents[J].Chinese Journal of Chemical Engineering, 2007, 15(2): 215-220.
[2]刘万治, 谢 刚. PEN及其中间体2,6-萘二甲酸简介[J]. 聚酯工业, 2006, 19(4): 7-10.Liu Wanzhi, Xie Gang. Introduction of PEN and its intermediate 2,6-NDA[J]. Polyester Industry, 2006, 19(4): 7-10.
[3]张春荣, 周 滨. 2,6-萘二甲酸的合成进展[J]. 化学与黏合, 2012, 34(6): 54-57.Zhang Chunrong, Zhou Bin. The progress in synthesis of 2,6-naphthelenedicarboxylic acid[J]. Chemisty and Adhesion, 2012, 34(6):54-57.
[4]陶帅江. 2-甲基-6-丙酰基萘液相催化氧化法制2,6-萘二甲酸研究[D]. 大连: 大连理工大学, 2014.
[5]吴红辉, 李玉琦. 2,6-萘二甲酸的合成探讨[J]. 上海化工, 1999, 24(6): 15-18.Wu Honghui, Li Yuqi. Synthesis of naphthalene dicarboxylic acid[J]. Shanghai Chemical Industry, 1999, 24(6): 15-18.
[6]Kamiya Y, Hama T, Kijima I. Formation of 2,6-naphthalenedicarboxylic acid by the Co-Mn-Br-catalyzed autoxidation of 2,6-diethylnaphthalene in acetic acid[J]. Bulletin of the Chemical Society of Japan, 1995, 68: 204-210.
[7]Sikkenga D L, Kuhlmann G E, Behrens P K, et al. Method for preparing aromatic carboxylic acids: US, 5292934[P]. 1994-03-08.
[8]Harper J J, Kuhlmann G E, Larson K D, et al. Process for preparing 2,6-naphthalene-dicarboxylic acid: US, 5183933[P]. 1993-02-02.
[9]张春荣, 马雪松, 经 韬. 2,6-二甲基萘空气液相氧化制备2,6-萘二甲酸的研究[J]. 化学与黏合, 2013, 35(2): 25-28.Zhang Chunrong, Ma Xuesong, Jing Tao. Preparation of 2,6-naphthalenedicarboxylic acid by air liquid phase oxidation of 2,6-dimethylnaphthalene[J]. Chemistry and Adhesion, 2013, 35(2): 25-28.
[10]Tian Wenyu, Xue Weilan, Zeng Zuoxiang, et al. Kinetics of 2-methyl-6-acetyl-naphthalene liquid phase catalytic oxidation[J]. Chinese Journal of Chemical Engineering, 2009, 17(1): 72-77.
[11]尚建平. 对二甲苯(PX)液相氧化过程强化与优化[D]. 上海: 华东理工大学, 2015.
[12]李 静. 对二甲苯液相空气氧化反应动力学的研究[D]. 天津: 天津大学, 2006.
[13]成有为. 烷基芳烃液相氧化过程的研究[D]. 杭州: 浙江大学, 2006.
[14]王丽军, 李 希, 谢 刚, 等. 对二甲苯液相催化氧化动力学(Ⅰ)反应机理和动力学模型[J]. 化工学报, 2003, 54(7): 946-952.Wang Lijun, Li Xi, Xie Gang, et al. Kinetics ofp-xylene liquid phase catalytic oxidation(I) reaction mechanism and kinetic model[J].Journal of Chemical Industry and Engineering(China), 2003, 54(7): 946-952.
[15]Wang Q, Zhang Y, Cheng Y, et al. Reaction mechanism and kinetics for the liquid-phase catalytic oxidation of meta-xylene to meta-phthalic acid[J]. AIChE Journal, 2008, 54(10): 2674-2688.
[16]张炳琦. 对甲基苯甲酸液相催化氧化反应动力学的研究[D]. 上海: 华东理工大学, 2002.
[17]吴志强, 郭志武, 靳海波, 等. 2,6-萘二甲酸的高效液相色谱分析[J]. 分析试验室, 2005, 24(1): 24-26.Wu Zhiqiang, Guo Zhiwu, Jin Haibo, et al. High-performance liquid chromatographic determination of 2,6-naphthalenedicarboxylic acid[J]. Chinese Journal of Analysis Laboratory, 2005, 24(1): 24-26.
[18]徐海波, 王勤波, 李 希. 对二甲苯氧化产物的色谱分析[J]. 聚酯工业, 2006, 19(1): 19-24.Xu Haibo, Wang Qinbo, Li Xi. Analysis ofp-xylene oxidation products by GC and HPLC[J]. Polyester Industry, 2006, 19(1): 19-24.
[19]Cao G, Servida A. Kinetics ofp-xylene liquid-phase catalytic oxidation[J]. AIChE Journal, 1994, 40(7): 1156-1166.
[20]成有为. MC工艺烃类液相催化氧化过程研究[D]. 杭州: 浙江大学, 2004.
[21]张志涌. 精通MATLAB R2011a[M]. 北京: 北京航空航天大学出版社, 2011: 586-587.
[22]王沫然. MATLAB与科学计算 [M]. 第3版. 北京: 电子工业出版社, 2012: 249-253.
