N,N-二烷基乙醇胺合成工艺开发
2018-01-25竺贝贝蒋红华陈新志
竺贝贝,蒋红华,钱 超,陈新志
1.浙江省化工高效制造技术重点实验室 浙江大学化学工程与生物工程学院,浙江 杭州 310027;2.杭州新德环保科技有限公司,浙江 建德 311604
N,N-二烷基乙醇胺包括N,N-二甲基乙醇胺(DMAE)、N,N-二乙基乙醇胺(DEAE)、N,N-二正丙基乙醇胺(DPAE)和N,N-二正丁基乙醇胺(DBAE)等,是一类具有重要商业用途的精细化工产品,可作为医药中间体、聚氨酯发泡催化剂、脱硫剂和二氧化碳捕获剂等[1]。其国内主要生产厂家为一些制药厂,国外主要有BASF和ICI公司等[2]。
目前此类化合物的合成路线可分为仲胺的羟乙基化法和乙醇胺的N-烷基化法两大类,主要有以下7条路线:1)以仲胺为原料,环氧乙烷(EO)为羟乙基化试剂[3]。该法具有合成步骤少、原子利用率高和产物易分离等优点,但传统生产工艺里环氧乙烷损耗大且不易控制,生成的产物会和环氧乙烷继续反应生成高阶羟乙基化合物;2)仲胺与卤乙醇发生亲核取代反应[4]。该工艺路线产生的卤化氢需用当量的碱作为缚酸剂除去,生成环境不友好的含盐废水;3)仲胺与乙二醇在金属催化剂和较高温度下反应[5]。该路线原料低廉,环境友好,但是对反应条件要求严苛;4)伯胺与醛在还原剂作用下发生还原胺化,缺点在于系统的产物选择性较差[6];5)卤代烷与氨或胺发生Hofmann烷基化[7]。该反应操作简便,但生成的产物会与卤代烃进一步连串反应,该方法同时会产生卤代酸(HX),需要加入当量碱中和,产生盐废水;6)脂肪醇与乙醇胺在催化剂催化下可发生亲核取代反应[8]。该工艺的反应原料脂肪醇价格便宜,副产物为水,绿色环保;7)乙醇胺与硫酸二甲酯、碳酸二甲酯也会发生N-烷基化,但是该方法原子经济性差[9]。
本工作对路线1)(图1)进行了改进:①以二正丁胺(DBA)和环氧乙烷为原料合成DBAE,只需微量水催化,便可得到63%的单次产品收率和92%的总收率;②以气相形式缓慢通入EO,控制体系的压力不超过1 MPa来调节通加速率,使得传统生产中EO损耗大的问题得以改进;③通过优化工艺条件(包括原料配比、EO的进料速率、催化剂水用量、反应压力与反应温度),提高目标产物选择性,减少EO消耗和副产物N,N-二正丁基二甘醇胺(DBAEE)的生成;④底物拓展实验证明路线1)适用于合成DMAE,DEAE和DPAE,为工业化生产提供参考。

图1 环氧乙烷法合成路线Fig.1 Process of epoxy ethane method
1 实验部分
1.1 合成与分离
往高压釜中加入一定量DBA和水,密封高压釜;氮气置换4~5次;升温至所需温度,恒温反应5 h左右,原料EO在反应过程中以气相形式缓慢通入反应体系中,控制体系压力不超过1 MPa。反应结束后,冷却泄压,取样减压精馏(压力0.004 MPa),分别获得30~70 ℃,70~120 ℃,120 ℃以及残留馏分。
1.2 表征与分析
产物的定性分析在美国安捷伦公司GC6890-MS5973型气相色谱-质谱联用(GC-MS)仪上进行,气相条件为氢气和载气氮气的柱前压为0.1 MPa,空气柱前压为0.03 MPa,进样器和检测器的温度为260 ℃,柱箱的起始温度为100 ℃,初始时间为2 min,升温速率为20 ℃/min。质谱检测条件为采用电子轰击离子化法(EI),载气为高纯He,加速电压1 800 kV,离子电流300 μA,离子源温度230 ℃,电子能量70 eV,质谱四级杆温度150 ℃,溶剂延迟2.5 min,扫描范围33~450 u,辅助加热器280 ℃。
2 结果与讨论
2.1 产品GC-MS结果
最终产品DBAE经GC-MS分析,结构正确,见图2。图2(a)为产品DBAE的气相色谱图,结合产品的质谱图(b)可以看出,保留时间为5.855 min的为DBAE峰,且产品的纯度很高。气相色谱图中保留时间为 5.855 min处的峰质谱图如图 2(b)所示,EI-MS(m/z):173(M+),155(M+-H2O),142(M+-CH2OH),130(M+-C3H7),100[C4H9(CH3)N+=CH2],88[HOC2H4(CH3)N+=CH2],74(CH2=N+C2H4OH),56(C4H8+),29(C2H5+),与文献[10]的报道一致。
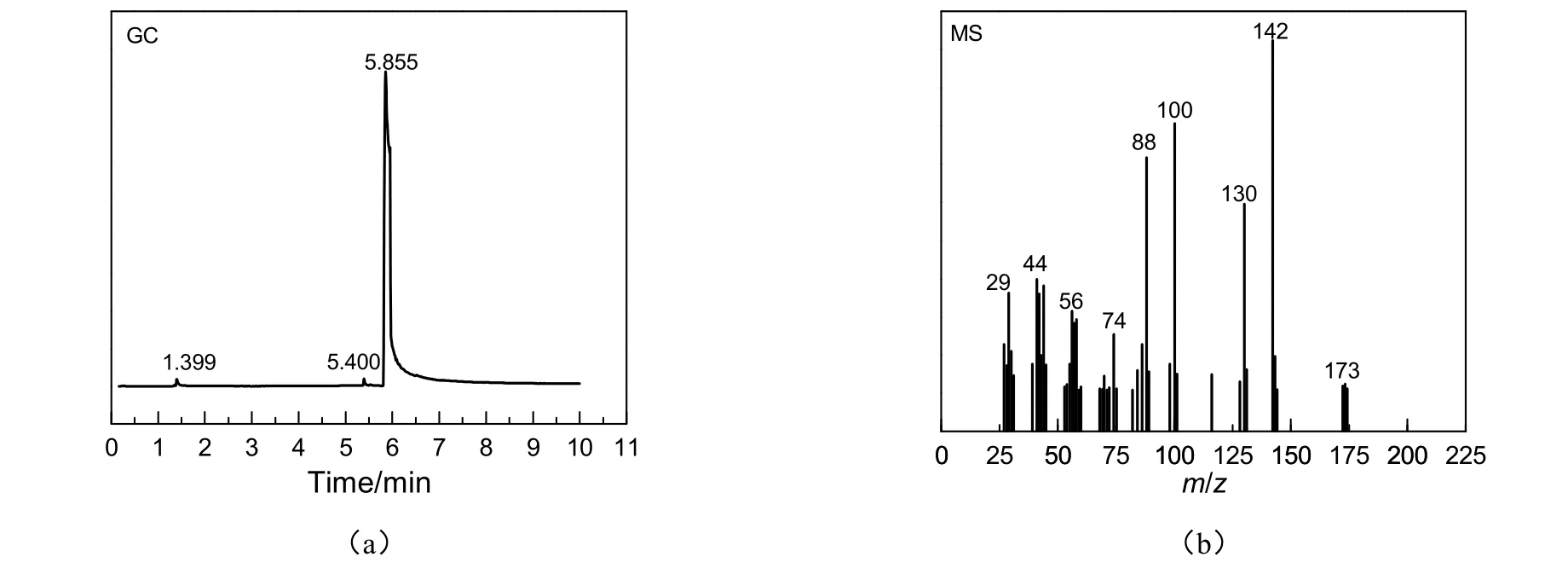
图2 N,N-二正丁基乙醇胺的GC-MS图谱Fig.2 GC-MS spectra of DBAE
2.2 原料配比的影响
原料配比(EO/DBA,物质的量之比)是影响产物分布的一个重要因素,调节原料配比可调节反应的选择性。在水量为5%(质量分数),温度80 ℃,控制EO通入速率缓慢且一定,反应5 h的条件下,探究EO通入量对反应的影响,结果如图3所示。
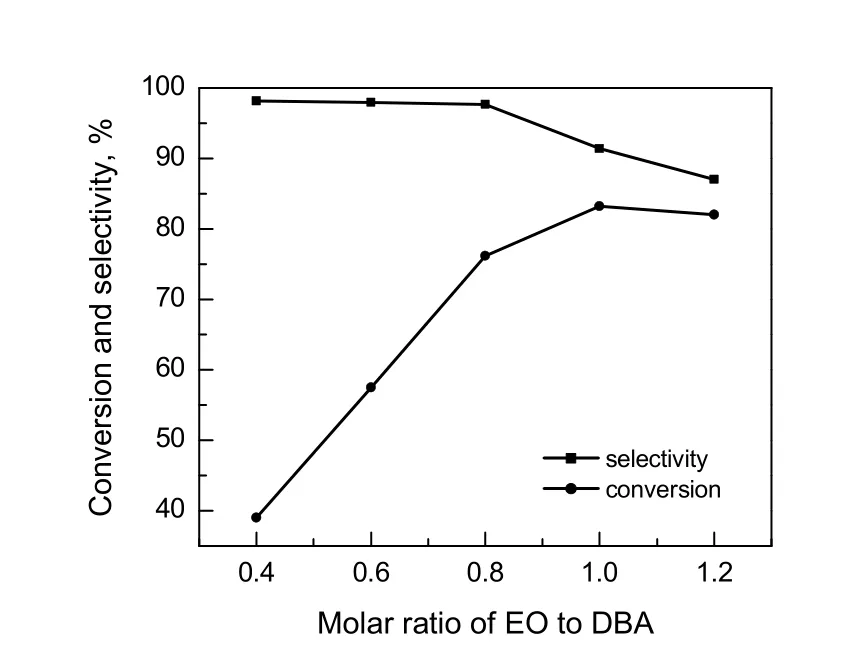
图3 原料转化率和产物选择性随EO/DBA变化曲线Fig.3 The conversion of DBA and the selectivity of DBAE varies with the molar ratio of EO to DBA
由图可知,在EO/DBA小于1时,随着EO/DBA的增加,原料DBA的转化率逐渐增加,产物DBAE选择性逐渐降低。说明EO的量会影响产物进一步羟乙基化生成DBAEE。当EO/DBA为0.8时,可使原料转化率在尽可能大的情况下,DBAE的选择性也较大,因此可控制EO/DBA为0.8为宜。
2.3 催化剂的影响
2.3.1 催化剂类型的影响
在高温高压下,EO可以进行碱性开环与胺类发生SN2反应,此过程可以在无水条件下反应。在普通条件下,EO和胺类在无水条件下是很难发生反应的,因为EO与胺类反应的活化能较高,提供活性氢原子是提高胺化活性的重要途径[11,12]。因此,可选用水或醇类作为催化剂。从反应机理来看,水和醇类物质可以诱导极化环氧乙烷,使得环氧乙烷的亚甲基带部分正电,易被DBA孤对电子进攻发生开环加成,催化机理如图4所示:

图4 活性质子对反应的催化机理Fig.4 Active proton catalytic mechanism of the reaction
在EO/DBA为1,控制EO通入速率缓慢且一定,反应温度65 ℃,反应5 h,分别在无催化剂和催化剂为乙醇或水的条件下,探究催化剂类型对反应的影响。此时催化剂乙醇或水的用量均为原料胺的5%(质量分数)。实验结果见表1。
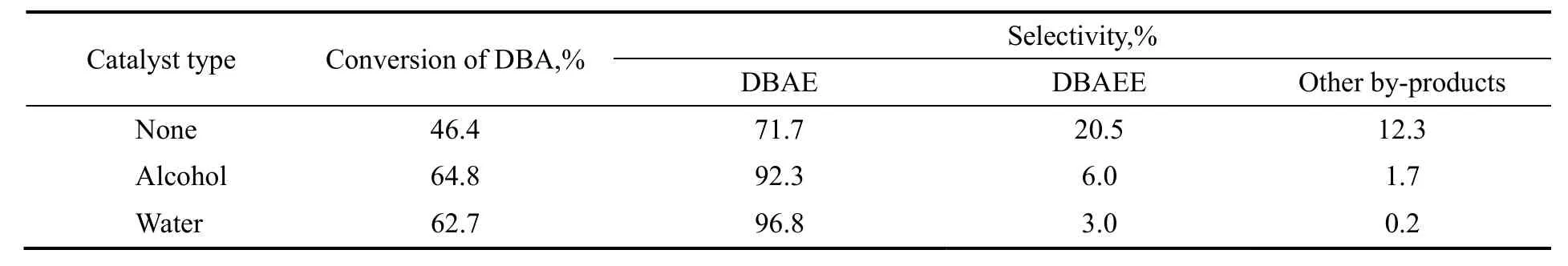
表1 不同催化剂对原料转化率和产物选择性的影响Table 1 Effects of different catalysts on the conversion of DBA and the selectivity of DBAE
由表可看出,水作催化剂可以明显加快DBA羟乙基化的反应速率,提高原料转化率,乙醇次之;以水为催化剂,产物DBAE的选择性较高,DBAEE控制在微量范围内。以上结果也说明了本反应需要活性质子催化,醇因为分子体积较大,其催化效果不如水。
2.3.2 催化剂用量的影响
在EO/DBA为0.8,控制EO通入速率缓慢且一定,以水为催化剂,反应温度65 ℃,反应5 h的条件下,探究催化剂用量对反应的影响,结果如图 5所示。由图可看出,随着水用量的增加,原料DBA的转化率先上升后逐渐下降,产物中DBAE选择性先上升后逐渐下降。当水用量控制在5%时,可有效控制副产物的量,提高产物DBAE的选择性,此时原料转化率最高。实验条件下,水用量应控制在5%为宜。

图5 原料转化率和产物选择性随催化剂水用量变化的曲线Fig.5 The conversion of DBA and the selectivity of DBAE varies with the water consumption
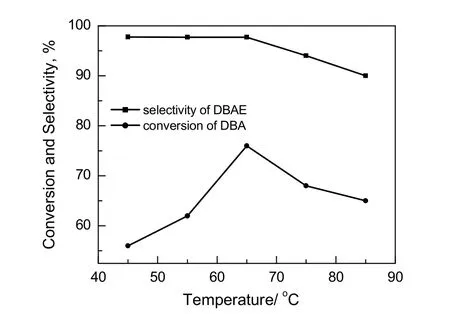
图6 原料转化率和产物选择性随温度变化的曲线Fig.6 The conversion of DBA and the selectivity of DBAE varies with the temperature
2.4 反应温度的影响
从反应动力学角度分析,温度越高反应速率越快,原料转化越高。但是并不是温度越高越好,随着温度的升高目标产物的选择性就会降低,生成更多的高阶副产物。在EO/DBA为0.8,水用量为5%,控制EO通入速率缓慢且一定,反应5 h的条件下,探究温度对反应的影响,结果如图6所示。由图可知,随着温度上升,DBAE选择性逐渐下降,且下降速率逐渐加快,DBA的转化率先升高后下降,此时最佳温度应为65 ℃。以上结果也说明了随着温度升高,反应速率和副反应速率均会加快,不能通过升高温度来大幅调节目标产物比例。因此,反应温度为65 ℃较适宜。
2.5 EO加料方式的影响
在EO/DBA为0.8,反应温度65 ℃,反应5 h,水用量为5%条件下,探究EO一次性加入和缓慢持续加入两种方式对实验结果的影响,结果如表2所示。由表可知,控制EO缓慢持续加入可以控制DBAE进一步被羟乙基化。这是由于EO和DBA合成DBAE反应主要是N-羟乙基化(主反应)与O-羟乙基化(副反应)的竞争反应,EO少量时,体系中的DBA优先与EO反应;EO过量时,体系中的产物DBAE会与EO进一步生成副产物DBAEE以及更高阶副产物,而控制EO的缓慢持续通入可以尽可能地使EO在体系里少量存在。
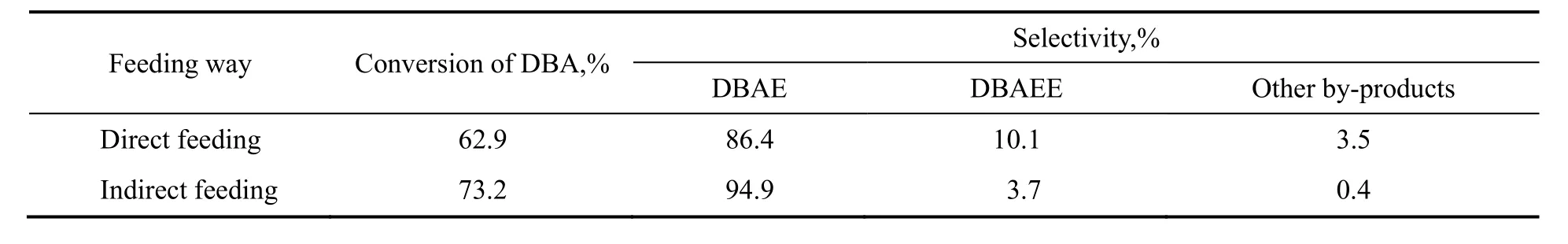
表2 EO投料方式对原料转化率和产物选择性的影响Table 2 Effects of feeding mode of EO on the conversion of DBA and the selectivity of DBAE
2.6 工艺流程设计
在后处理精馏阶段共得到水和DBA的混合馏分、DBA与DBAE的混合馏分、DBAE以及精馏余液4个部分。分离的原料DBA与水可投入到下一次产品生产中继续使用,而DBA与DBAE的混合馏分、精馏余液可随下一批产品精馏进一步纯化。工艺流程图如图7所示:
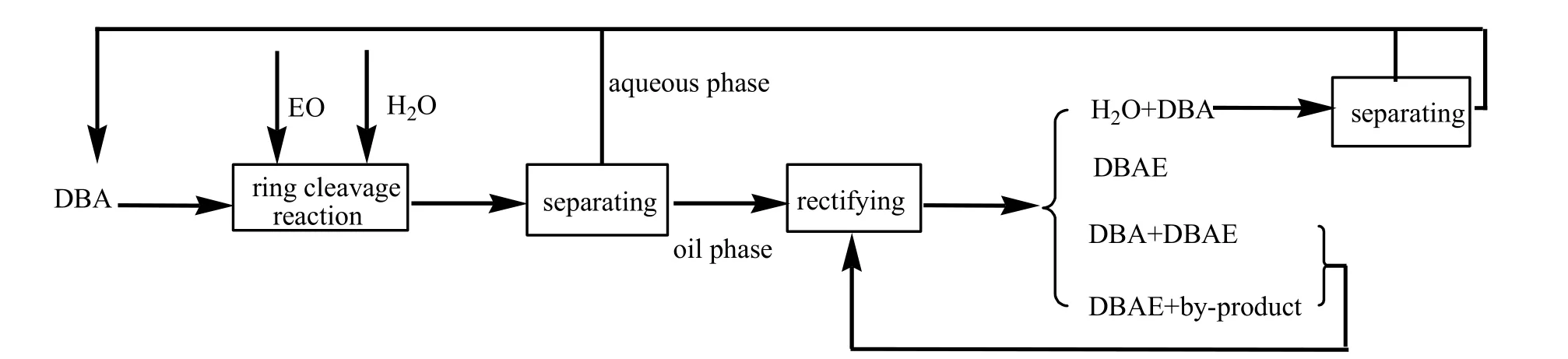
图7 工艺流程示意Fig.7 Production flow chart
考虑到精馏所得的原料和水可以继续使用,因此本工作在EO/DBA为0.8,水用量为5%,反应温度85 ℃,反应5 h,在EO缓慢通加的情况下,考察了溶剂水和未反应完全的原料循环套用对反应的影响,结果如表3所示。
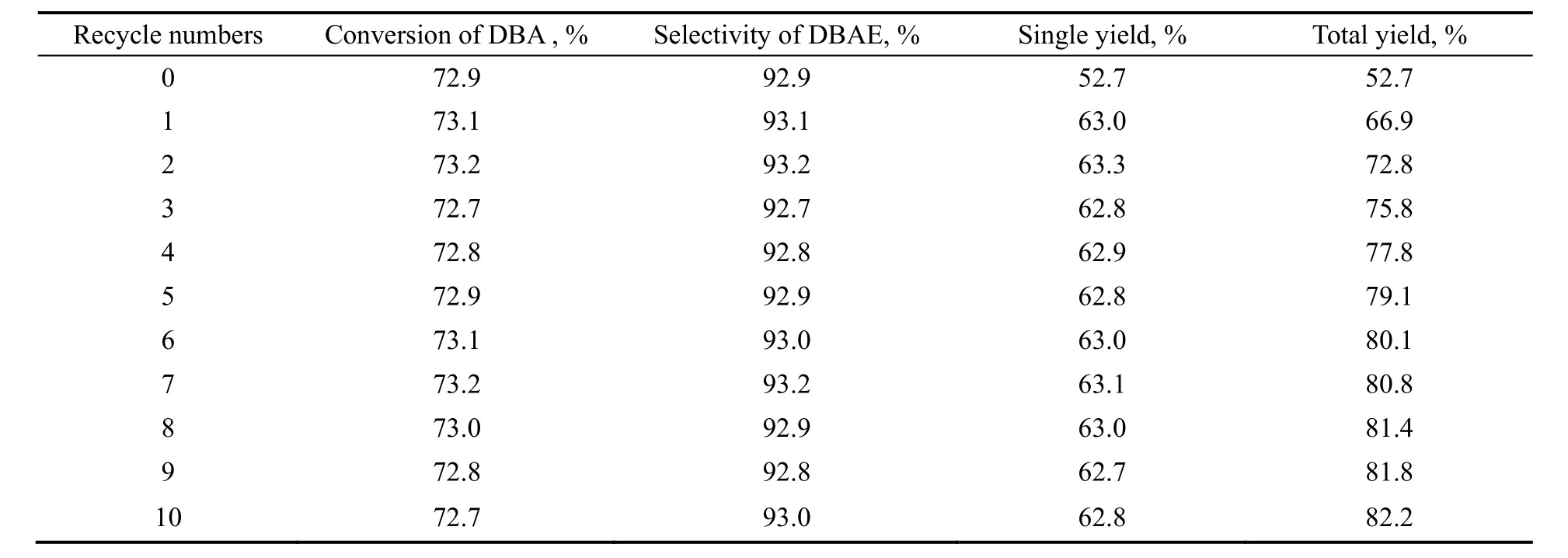
表3 循环次数对反应的影响Table 3 Selectivity of the product varies with the DBA recycle
在本实验中,由于投料比的限制,导致DBA的理论转化率最多为80%,同时这一因素也限制了产品的单程收率。由表3可以看出,循环次数不会对实验结果产生特别的影响,但随着实验次数的增加,总收率相应提高,循环10次后可达到82.2%。因此,本工艺流程对工业化生产具有指导意义。
2.7 底物拓展适用性
将上述工艺进行底物拓展。以二甲胺(DMA),二乙胺(DEA)和二丙胺(DPA)为原料,EO为羟乙基化试剂,在投料比为0.8,水用量为5%(DMA为市售33%水溶液),反应温度85 ℃,反应5 h条件下,合成DMAE,DEAE和DPAE。结果如表4所示。

表4 底物拓展结果Table 4 The substrate development results
由表4可知,本实验设计的由DBA和EO生产DBAE也同样适用于底物DMA,DEA和DPA。4个底物的单程收率略有不同,主要受底物仲胺的烷基侧链长度影响。本实验的主反应机理是仲胺上的N原子亲核进攻环氧乙烷上的C,若仲胺侧链较长,则会增加新键形成的难度,影响反应活性。其中底物DBA的N原子周围空间位阻是这4个底物中最大的,收率相对低。
3 结 论
a)合适的工艺条件:EO和DBA物质的量之比为0.8,水用量5%,温度65 ℃,反应5 h。此时,原料转化率可达73%(理论最大转化率为80%),产物选择性可达93%。EO/DBA是本反应原料转化率和产品选择性的主要影响因素。在EO/DBA小于0.8时,原料DBA转化率较低;大于0.8时,副产物DBAEE的含量升高。控制EO的加料方式与加料速率可以显著控制反应的选择性。本实验控制EO以气相形式缓慢通入到体系中,使得体系中的EO相对于原料DBA是极少量的,从而控制了副产物的生成,同时使原料DBA的转化率相对大。减压精馏回收所得的原料和水,以及未分离的混合馏分可循环利用到下一个产品生产中,循环10次后总收率可达82.2%。
b)进行了底物拓展性研究,包括DMA制DMAE、DEA制DEAE和DPA制DPAE。其结果可供工业化生产参考。
[1]赵玉英, 姚世杰, 田志红.N,N-二乙基乙醇胺的合成[C]//全国第二次生物化工、橡塑助剂及农药、医药、染料中间体技术经济与应用开发会议, 太原, 1998.
[2]杨玉峰.N,N-二甲基乙醇胺合成的研究[J]. 河南科学, 2004, 22(4): 458-460.Yang Yufeng. Study on systhesis of DMEA[J]. Henan Science, 2004, 22(4): 458-460.
[3]Chen A M, Wang H Y, Liu R, et al.N-Alkylation of alkylolamines with alcohols over mesoporous solid acid-base Cs-B-Zr catalyst[J].Catalysis Letters, 2016, 146(7): 1-12.
[4]Zhao Y, Duan S, Zeng X, et al. Prodrug strategy for PSMA-targeted delivery of TGX-221 to prostate cancer cells[J]. Molecular Pharmaceutics, 2012, 9(6): 1705-1716.
[5]Kayaki Y, Ikeda H, Tsurumaki J I, et al. Catalytic behavior of cationic hydridoruthenium(II) complex, [RuH(NH3)(PMe3)(4)](+), in H2-hydrogenation and transfer hydrogenation of imines[J]. Bulletin of the Chemical Society of Japan, 2008, 81(9): 1053-1061.
[6]Clerici A, Ghilardi A, Pastori N, et al. A new one-pot, four-component synthesis of 1,2-amino alcohols: TiCl3/t-BuOOH-mediated radical hydroxymethylation of imines[J]. Cheminform, 2008, 10(21): 5063-5066.
[7]Yin H Q, Jin M, Chen W, et al. Solvent-free copper-catalyzedN-arylation of amino alcohols and diamines with aryl halides[J].Tetrahedron Letters, 2012, 53(10): 1265-1270.
[8]Oku T, Arita Y, Tsuneki H, et al. Continuous chemoselective methylation of functionalized amines and diols with supercritical methanol over solid acid and acid−base bifunctional catalysts[J]. Journal of American Chemical Society, 2004, 126(23): 7368-7377.
[9]陈明元, 于洪艳, 王兴利.N-甲基二乙醇胺绿色合成研究[J]. 当代化工, 2007, 36(1): l-3.Chen Mingyuan, Yu Hongyan, Wang Xingli. Study on green synthesis ofN-Methylmorpholine[J]. Contemporary Chemical Industry,2007, 36(1): 1-3.
[10]Furutani H, Ogata Y, Shiina H, et al. National institute of advanced industrial science and technology (AIST)[J]. Journal of the Institute of Image Information & Television Engineers, 2010, 55(12): 1605-1608.
[11]冯汝明, 刘仲能, 顾 荣, 等. 环氧乙烷胺化制乙醇胺[J]. 化学进展, 2009, (Z2): 1636-1643.Feng Luming, Liu Zhongneng, Gu Rong, et al. Amination of ethylene oxide to ethanolamine[J]. Progress in Chemistry, 2009, (Z2):1636-1643.
[12]吴兆立, 谢荣锦, 蔡振云. 乙醇胺生产的无水管式反应方法: 中国, 96100557.2[P]. 1997-01-01.
