脐带间充质干细胞对CD4+和CD25+Treg细胞的调节作用
2018-01-24石琳琳马丽花庞荣清潘兴华
王 强,何 洁,赵 晶,石琳琳,马丽花,庞荣清,潘兴华
人脐带间充质干细胞(UCMSC)是从人脐带组织中分离获得的1种间充质干细胞,具有干细胞的所有生物学特性,包括归巢、分化、抑制淋巴细胞增殖反应等[1]。Treg细胞是一类具有主动免疫调节功能的T细胞群,具备免疫抑制性,对免疫反应具有抑制效应,是机体维持自身耐受的重要组成部分。本研究采用UCMSC和淋巴细胞共培养体系,探讨UCMSC对CD4+和CD25+Treg细胞及其功能因子IL-10的调节作用,从而验证UCMSC的免疫调节功能和机制,为UCMSC临床应用提供理论基础。
1 材料与方法
1.1 试剂及器材 DMEM/F12培养基(Invitrogen公司,美国),1640 培养基(Invitrogen 公司,美国),新生牛血清(Invitrogen公司,美国),IL-10检测试剂盒(联科生物技术有限公司),CD4/CD25、FITC/PE抗体(Santa Cruz,美国),酶标仪(Rayto,美国);倒置相差显微镜、(NIKON公司,日本),流式细胞仪(BD公司,美国)。
1.2 人UCMSCs及淋巴细胞的制备 人UCMSC制备方法:取健康足月胎儿脐带,PBS液冲洗后剪切为1 mm×1 mm×1 mm的小块,分散接种到培养瓶底,于37℃、5%CO2条件下培养3~5 d后换液,待贴壁细胞长满瓶底达80%以上融合时,用胰蛋白酶消化传代[2]。
人外周血淋巴细胞的制备方法:采集健康成年献血者的外周血300 ml,400 g离心9 min,取中间富含淋巴细胞的灰白色层,用10 ml生理盐水稀释后,加入到25 ml淋巴细胞分离液之上,200×g离心4 min,反复3次。用1640培养基悬浮,于37℃培养1 h后,收集不贴壁的细胞即为淋巴细胞。
1.3 淋巴细胞和UCMSC共培养实验 采用UCMSC分别与淋巴细胞接触和非接触两种培养模式进行,比例和细胞量一致。取第3代UCMSC与淋巴细胞数量的比例梯度依次为 1∶5、1∶10、1∶20 和 1∶40,人UCMSC数量为 3×105,淋巴细胞数量依次分别为 1.5×106、3×106、6×106、1.2×107。 另设对照组,只加淋巴细胞,数量依次分别为 1.5×106、3×106、6×106、1.2×107。各培养体系中均加入CD3和CD28抗体刺激淋巴细胞处于增殖活性状态,置于CO2培养箱中静置培养72 h。
1.4 CD4+和CD25+Treg细胞比例分析 采用流式细胞术。收集各组淋巴细胞,210×g离心6 min,加入PBS重悬,加入抗体后孵育30 min,流式细胞仪检测阳性率。
1.5 ELISA检测IL-10的含量测定 取共培养上清液,按照ELISA IL-10试剂盒说明书方法测定IL-10含量,用酶标仪检测样品光密度值。
1.6 统计学方法 应用SPSS13.0统计软件进行分析,计量资料以±s表示,两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 UCMSC培养结果 应用组织块反复贴壁培养法成功培养UCMSCs,为贴壁生长,细胞呈长梭形,出现漩涡状结构,具备成纤维细胞的典型特征(图 1)。
2.2 不同浓度UCMSC对CD4+、CD25+Treg细胞影响 各淋巴细胞与UCMSC培养组中CD4+、CD25+Treg细胞含量与对照组相比均有显著差异(P<0.05),当淋巴细胞与 UCMSC 的比例为 10∶1时,Treg细胞的比例最高(表1)。
2.3 各组共培养上清液IL-10含量 随着共培养体系中淋巴细胞数量的逐渐增加,共培养上清液中IL-10含量随之逐渐增加,且淋巴细胞与UCMSCs共培养各组的IL-10含量均高于对照组(P<0.01,表2)。
3 讨论
MSC对机体免疫系统具有双向调节作用的理论已得到公认,它在一定条件下可明显抑制T淋巴细胞的增殖[3]。MSC抑制T细胞增殖中的一个非常重要的机制是MSC可诱生功能性CD4+、CD25+Treg细胞,促进CD4+、CD25+Treg细胞功能。Treg细胞是一类具有主动免疫调节功能的T细胞群,在体内的主要作用是调节机体免疫平衡,防止免疫反应扩大及抑制自身免疫反应的发生[4]。目前发现的Treg亚群主要有:CD4+和 CD25+Treg、Tr1 型 CD4+Treg、Th3型 CD4+Treg、CD8+Treg、NK 细胞等。 CD4+和 CD25+Treg是目前研究最多的Treg细胞,占胸腺和外周血中CD4+T细胞的5%~10%,它可抑制自身机体的免疫反应,维持机体自身免疫的稳定,控制自身免疫性疾病发生。IL-10是Treg细胞发挥其免疫抑制功能的关键性细胞因子,Treg细胞通过分泌IL-10来抑制Th1介导的免疫反应、Th2介导的抗体产生和CD8+细胞毒性T细胞的活化[5]。

表1 淋巴细胞与UCMSC不同比例共培养后CD4和CD25Treg细胞的比例
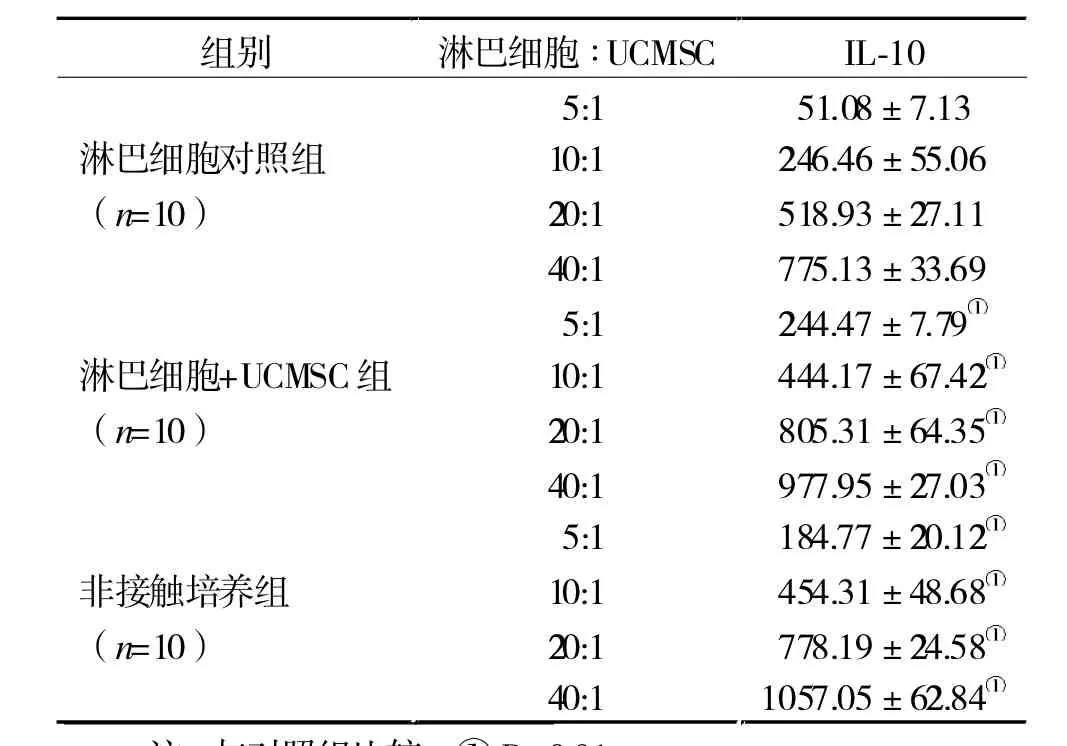
表2 各组共培养上清液IL-10含量(pg/L)
图1 UCMSC形态(×400)
本研究的结果表明,淋巴细胞单独培养时,细胞密度大于3×106个/ml时,Treg细胞的比例不会随淋巴细胞数量的增加而增加,这可能与细胞间的接触抑制有关。与对照组相比,淋巴细胞与UCMSC共培养后Treg细胞比例呈增加趋势,淋巴细胞与UCMSC比例在10∶1的条件下,Treg细胞比例最高,表明UCMSC对淋巴细胞向Treg分化有正向调控作用,且这种调控作用与UCMSC与淋巴细胞的相对比例有关。与对照组相比,UCMSC与淋巴细胞不同比例的各组共培养上清IL-10含量均逐渐增加。这充分表明UCMSC对IL-10起正向调节作用,不仅能使Treg细胞在数量上增加,可能还对Treg细胞在功能上起到促进作用[7]。
在UCMSC与淋巴细胞共培养体系中,淋巴细胞本身分泌许多细胞因子影响UCMSC和淋巴细胞的活性,而UCMSC也能分泌多种可溶性因子影响淋巴细胞。本研究中UCMSC与淋巴细胞非接触式共培养后Treg细胞比例明显改变,且变化模式与接触式培养一致,说明淋巴细胞和UCMSC分泌的细胞因子在Treg细胞的增殖活性与功能调节中发挥了关键作用。
[1] Chan CJ,Smyth MJ,Martinet L.Molecular mechanisms of natural killer cell activation in response to cellular stress[J].Cell Death Differ,2013,21(1):5-14.
[2] 庞荣清,何洁,李福兵,等.一种简单的人脐带间充质干细胞分离培养方法[J].中华细胞与干细胞杂志,2011,1(2):162-167.
[3] 庞荣清,王强,石琳琳,等.脐带间充质干细胞对体外外周血单核细胞的影响[J].西南国防医药,2015,25(8):820-822.
[4] Chao YH,Wu HP,Wu KH,et al.An increase in CD3+CD4+CD25+regulatory T cells after administration of umbilical cordderived mesenchymal stem cells during sepsis[J].PLoS One,2014,9(10):e110338.
[5] Frumento G,Piazza T,Di Carlo E,et al.Targeting tumor-related immunosuppression for cancer immunotherapy[J].Endocr Metab Immune Disord Drug Targets,2006,6(3):233-237.
