姜黄素通过上调PPARγ抑制糖基化终末产物诱导的软骨细胞凋亡及线粒体功能损伤
2018-01-24杨青山吴树金施松波毛新展郭士方陈志信台会平
杨青山,吴树金,施松波,毛新展, 郭士方,陈志信,台会平
(甘肃省人民医院1. 骨科、2. 药剂科,甘肃 兰州 730000;3. 中南大学湘雅二医院骨科,湖南 长沙 410011)
骨性关节炎(osteoarthritis, OA)是一种随年龄增长而发病率明显增加的慢性关节疾病, 病因及机制复杂,迄今仍未阐明。糖基化终末产物(advanced glycation end products,AGEs)是体内蛋白质及脂类与葡萄糖或其他还原单糖发生非酶糖化反应生成的稳定共价化合物,它在关节软骨内大量产生与积聚是导致OA病变的重要原因之一[1]。我们前期的研究发现,AGEs 能诱导软骨细胞过氧化物酶体增殖物激活受体-γ(peroxisome proliferators-activated receptor-γ,PPARγ)的表达下调,并在OA 病变中起重要作用[2]。PPARγ的重要作用之一为可以通过其辅助活化因子-1α(peroxisome proliferator activated receptor gamma coactivator-1 alpha,PGC-1α),调控线粒体功能[3],进而抑制细胞凋亡。
姜黄素(curcumin)是从姜科姜黄属植物姜黄中提取的一种黄色酸性酚类物质,是姜黄发挥药理作用的活性成分。姜黄素具有抗氧化、抗肿瘤、抗炎等多种药理作用[4-6],同时近年研究发现其可以有效上调PPARγ,被认为是PPARγ的天然配体[7]。姜黄素基于PPARγ的作用靶点是否对AGEs诱导的软骨细胞损伤具有保护作用尚不清楚。因此,本研究将直接使用外源性AGEs以排除其他因素的影响,在体外培养的家兔软骨细胞上,探讨AGEs诱导软骨细胞凋亡是否与PPARγ下调/线粒体功能损伤有关,同时观察姜黄素是否基于上调PPARγ而发挥保护作用。
1 材料与方法
1.1材料
1.1.1实验动物 普通级健康家兔(5周龄)由兰州大学动物实验中心提供。本研究中动物实验遵循的所有程序均符合国家及甘肃省人民医院制订的有关实验动物的规则和制度。
1.1.2试剂 环孢霉素A (cyclosporine A,CsA)、PPARγ抗体购自Calbiochem (La Jolla, CA, USA);姜黄素(批号C1386)、PPARγ特异性抑制剂GW9662(批号70785)、吡格列酮 (批号P4120),均购自Sigma公司;PPARγ活性检测试剂盒购自Santa Cruz Biotechnology公司;ATP检测试剂盒、TUNEL、Rhodamine-123、caspase-3活性检测试剂盒,均购自碧云天生物技术公司;其余试剂均为化学分析纯。
1.1.3仪器 LS-50B型荧光分光光度计(日本Shimadu公司);IX-70型荧光显微镜(日本Olympus公司);CO2细胞培养箱(美国SHEL-LAB公司);Model 3.9 EL酶标仪(Bio-Rad公司)。
1.2AGEs的体外制备配制0.2 mol·L-1磷酸盐缓冲液(PBS),然后将BSA(10 g·L-1)、D-羟乙醛(0.1 mol·L-1)、青链霉素(100 kU·L-1)分别溶于上述PBS中,充分摇匀,pH调至7.4,室温下放置24 h;用0.22 μm针头滤器过滤,灭菌、封口,置37℃恒温箱避光孵育7 d后取出,再转移至4 ℃冰箱无菌保存备用。使用前,将制备的AGEs装入透析袋,放入pH 7.4的无菌PBS透析液中,透析48 h,中途更换PBS液3~4次,除去未结合的D-羟乙醛,再次用0.22 μm针头滤器过滤。取制备的样品用荧光分光光度计鉴定,在激发波长370 nm,发射波长440 nm处释放荧光。
1.3兔软骨细胞体外培养将家兔麻醉后,在无菌条件下迅速取膝关节和髋关节处软骨,用无菌PBS冲洗2~3遍后,将其剪成1~3 mm3碎块,将所制软骨碎块转移至25 mL无菌培养瓶内,加10 mL 0.2%的胰蛋白酶后,置37℃ CO2培养箱孵育,每隔15 min振荡1次,45 min后取出,将胰蛋白酶弃去,加入10 mL 0.2% Ⅱ型胶原酶,置于37℃ CO2培养箱孵育,每隔15 min振荡1次,90 min后收集消化液,重复用0.2% Ⅱ型胶原酶直至所取软骨碎片全部消化,最后收集的消化液用200目纱网过滤去除杂质,1 000 r·min-1离心10 min, 将下层的细胞层用配制好的DMEM培基稀释后,按照2×105密度接种于培养瓶内,并加入15% 的FBS。3~5 d细胞贴壁后,更换培养基,继续培养至细胞80%融合后,开始鉴定并传代,仅采用1~4代细胞用于实验。
1.4细胞凋亡检测将细胞种植盖玻片后,置于6孔板内,细胞培养过夜;刺激细胞发生凋亡后,吸尽培养液,在样品中加100 μL TUNEL检测液,37℃避光孵育60 min后,PBS洗涤3次;用抗荧光淬灭封片液封片后荧光显微镜下观察,激发波长为450 nm,发射波长为550 nm。
1.5ATP生成检测细胞处理后吸除培养液,按6孔板每孔加200 μL比例加入裂解液,裂解后4℃ 12 000×g离心10 min,收集上清,BCA测定蛋白浓度。把ATP标准溶液用ATP检测裂解液稀释成适当的浓度梯度备用;按照96孔板每孔100 μL的体积配制适当量的ATP检测液,每孔加入100 μL的ATP检测液,室温放置5 min,消耗掉本底ATP;每孔加入50 μL的标准品,轻轻摇晃均匀,立即在酶标仪检测。
1.6线粒体跨膜电位(△Ψm)检测将处理后细胞PBS漂洗2次,150 μL PBS重悬细胞,20 μL Rhodamine 123避光染色,37℃避光孵育30 min,荧光分光光度计激发波长507 nm,散发波长529 nm检测。
1.7caspase-3活性检测吸取细胞培养液,用胰酶消化贴壁细胞,并收集至备用的细胞培养液中,600×g4℃离心5 min收集细胞,小心吸除上清,PBS洗涤1次,吸尽上清后,按照每2×106个细胞加入100 μL裂解液的比例加入裂解液,重悬沉淀,冰浴裂解15 min,4℃、20 000×g离心10~15 min后,放入试剂盒检测体系中检测。
1.8Real-timePCR采用TRIzol 法提取总RNA,取总RNA 5 μL,olig(dT)1 μL ,加DEPC水至12 μL,混匀,4 000 r·min-1离心5 s, 70℃孵育5 min后,于冰上冷却5 min,再加入5×Buffer 4 μL,10 mmol·L-1dNTP 2 μL, 40 U/μL RNase Inhibitor 1 μL, 加DEPC水处理到19 μL混匀,4 000 r·min-1离心5 s,37℃反应5 min,冰上骤冷5 min, 加入逆转录酶1 μL,总反应体系20 μL混匀,4 000 r·min-1离心5 s,之后于42℃反应60 min,72℃反应10 min,冰上骤冷结束反应。逆转录产物可以继续进行PCR扩增。取PCR产物5 μL,经1.5%琼脂糖凝胶电泳,EB染色后摄片,用Imagemaster VDS图像分析软件测定产物条带的积分光密度值。PPARγ 上游引物:5′-AGGAGCAGAGCAAAGAGGTGGC-3′,下游引物:5′-TGTGAGGACTCAGGGTGGTTCA-3′。 GAPDH上游引物:5′-TCGACAGTCAGCCGCATCTTCTTT-3′,下游引物:5′-ACCAAATCCGTTGACTCCGACCTT-3′。
1.9PPARγ活性检测采用基于ELISA 的DNA-binding 检测试剂盒检测PPARγ 活性。取10 μg核蛋白,加入事先包被有PPARγ特异性双链DNA结合位点的96孔板上,4℃孵育过夜。结合的PPARγ经特异的PPARγ标记显色后检测。
1.10Westernblot提取总蛋白,并用牛血清白蛋白标准曲线调整为一致浓度后,溶解在10 g·L-1十二烷基硫酸钠(SDS)中,每份样品取8 μL进行SDS聚丙烯酰胺凝胶电泳,并转移至PVDF膜上,5%的脱脂奶粉室温封闭1 h。倒掉封闭液,用5%的脱脂奶粉按比例稀释一抗,将膜置于一抗孵育液中,4℃摇动(20~30次/min)过夜,用TBST洗膜3次,每次5 min。用5%的脱脂奶粉按一定比例稀释二抗,将膜置于二抗孵育液中,室温孵育1 h(20~30次/min),用TBST洗膜4次,每次5 min。用ODYSSEY Fc imaging system显色,拍照。数据用样品与β-actin的比值表示。
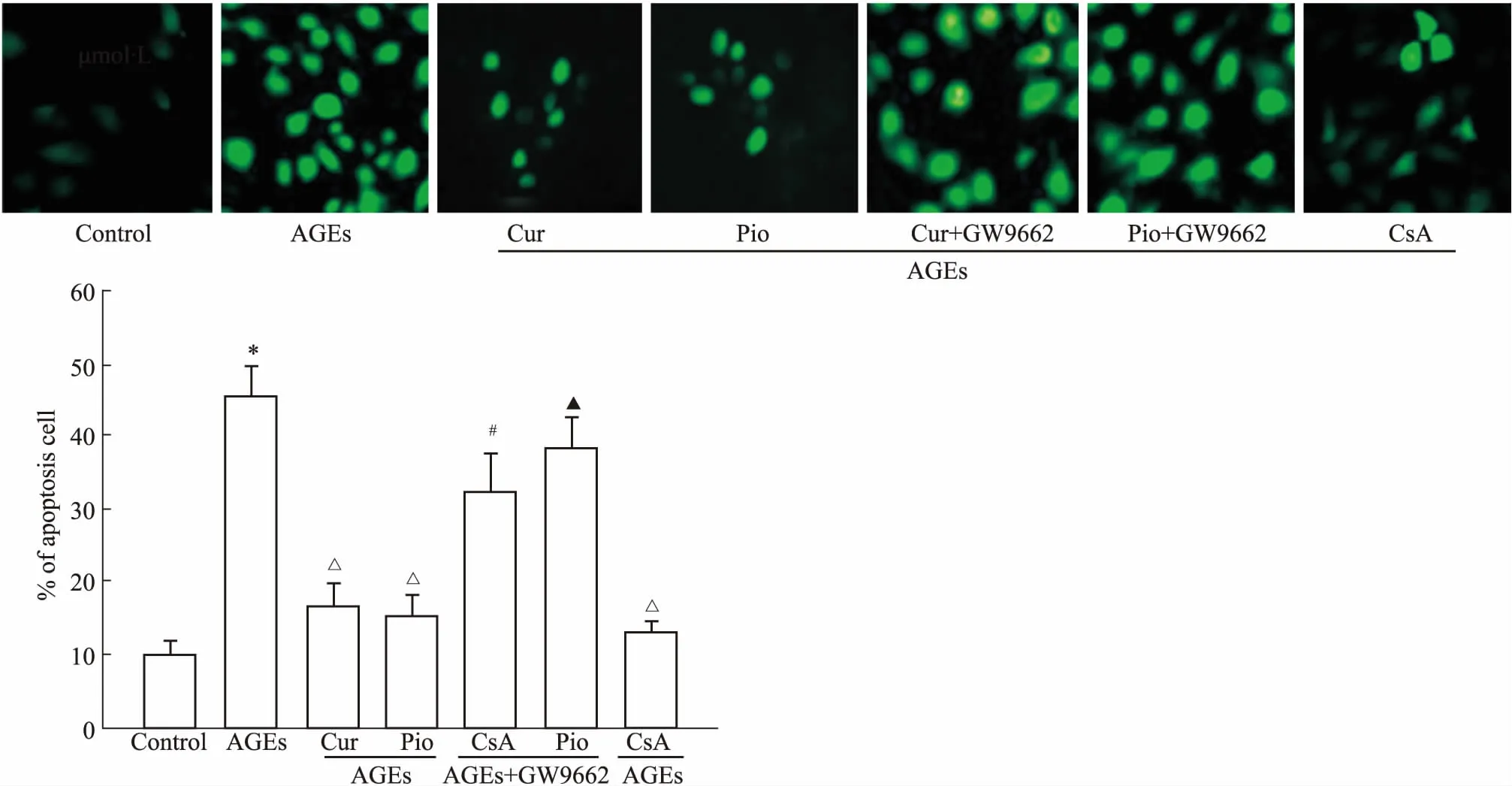
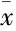
Cur: Curcumin; Pio: Pioglitazone; CsA: Cyclosporine A.*P<0.05vscontrol;ΔP<0.05vsAGEs;#P<0.05vsAGEs+Curcumin;▲P<0.05vsAGEs+ Pioglitazone

2 结果
2.1AGEs对家兔软骨细胞凋亡的影响及姜黄素的作用如Fig 1所示,AGEs (200 mg·L-1)孵育48 h后,可以明显诱导兔软骨细胞的凋亡;线粒体通透性转换孔的抑制剂CsA(100 nmol·L-1)同样可以明显抑制AGEs诱导的细胞凋亡(P<0.05)。同时,PPARγ特异性激动剂吡格列酮(50 μmol·L-1)及50 μmol·L-1姜黄素均可以明显抑制AGEs诱导的软骨细胞凋亡;50 μmol·L-1姜黄素单独处理组对软骨细胞未见明显代谢及功能影响[11],而给予PPARγ 特异性拮抗剂GW9662 10 μmol·L-1预处理后,可以明显拮抗姜黄素及吡格列酮对AGEs诱导软骨细胞凋亡的保护作用。
2.2AGEs对家兔软骨细胞线粒体功能的影响及姜黄素的作用如Fig 2所示,AGEs(200 mg·L-1)诱导软骨细胞线粒体△Ψm及ATP合成明显降低,姜黄素50 μmol·L-1及吡格列酮 50 μmol·L-1均可明显抑制AGEs的损伤作用。GW9662 10 μmol·L-1预处理后,可以明显拮抗姜黄素及吡格列酮对AGEs诱导的软骨细胞线粒体△Ψm及ATP合成下降的保护作用。
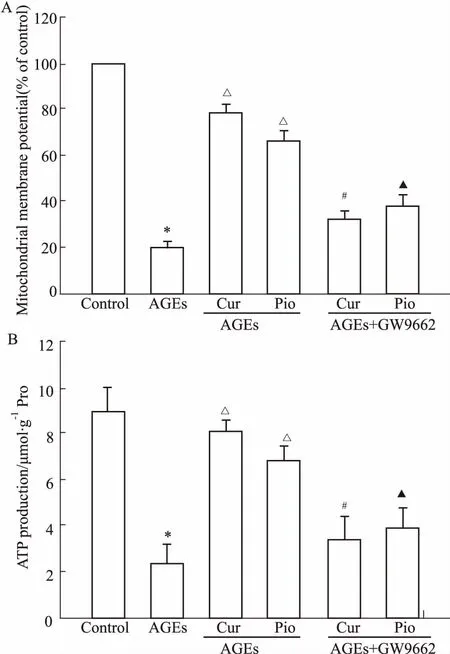
Fig 2 Effect of curcumin on AGEs-induced mitochondrialfunction of chondrocytes (±s, n=8)
A: Effect of curcumin on AGEs-induced mitochondrial membrane potential ( △Ψm); B: Effect of curcumin on AGEs-induced mitochondrial ATP production.*P<0.05vscontrol;△P<0.05vsAGEs;#P<0.05vsAGEs+Curcumin;▲P<0.05vsAGEs+Pioglitazone
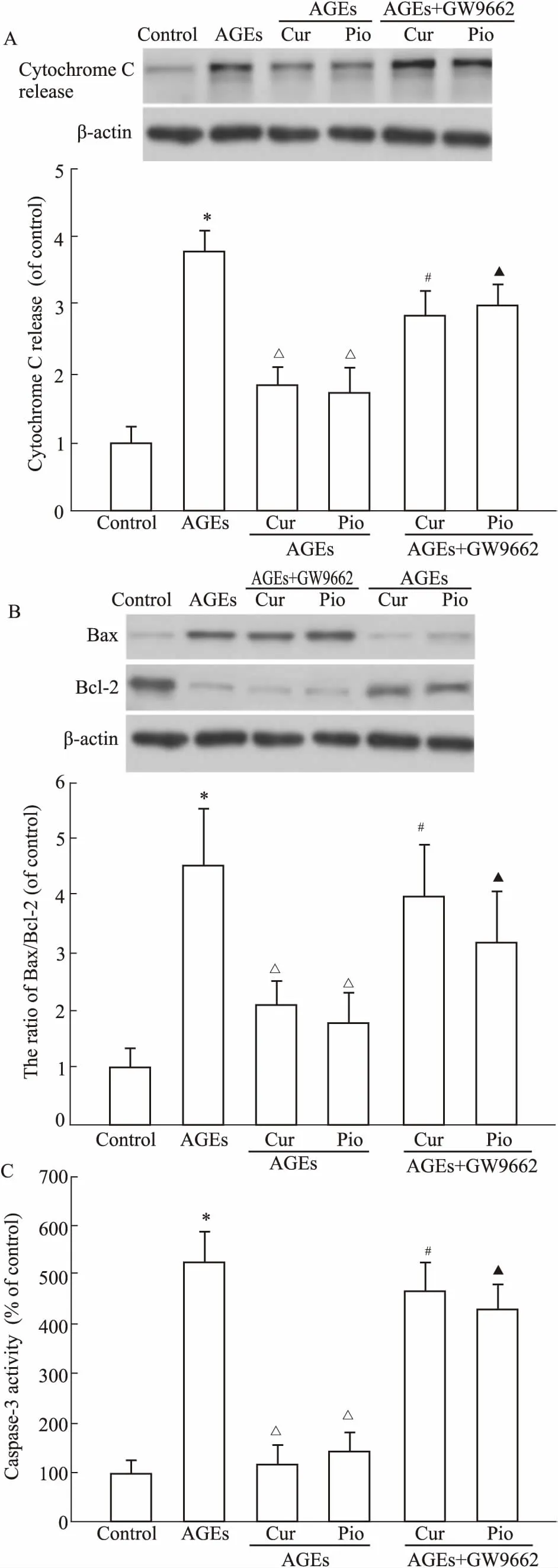
Fig 3 Effect of curcumin on AGEs-induced expression ofcytochrome C (A), Bax and Bcl-2 (B), caspase-3(C) (±s, n=8)
*P<0.05vscontrol;ΔP<0.05vsAGEs;#P<0.05vsAGEs+Curcumin;▲P<0.05vsAGEs+ Pioglitazone
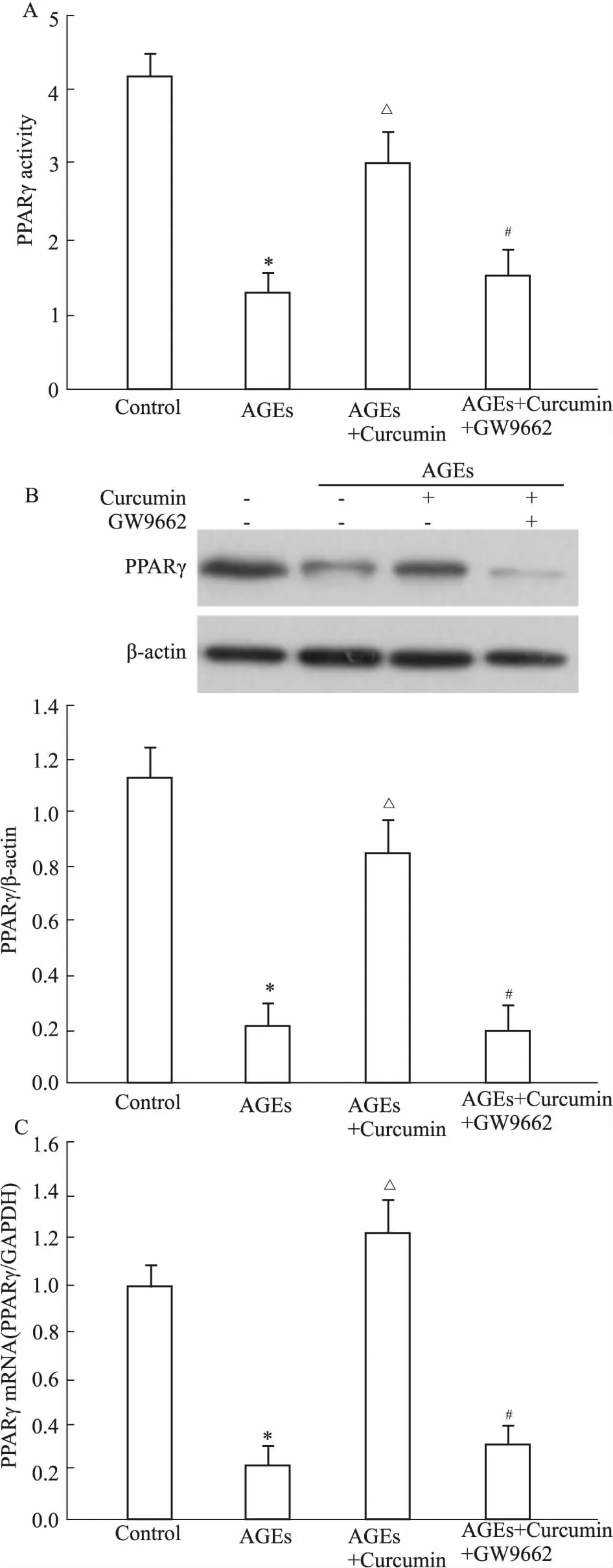
Fig 4 Effect of curcumin on AGEs-induced activity and
A: PPARγ activity;B: PPARγ protein level; C: PPARγ mRNA assayed by real-time PCR.*P<0.05vscontrol;ΔP<0.05vsAGEs;#P<0.05vsAGEs+Curcumin.
2.3AGEs对家兔软骨细胞细胞色素C、caspase-3、Bax、Bcl-2表达的影响如Fig 3所示,与正常对照相比,AGEs (200 mg·L-1)能够明显诱导细胞色素C、caspase-3、Bax/Bcl-2比值增加,而姜黄素50 μmol·L-1及吡格列酮 50 μmol·L-1均可明显抑制AGEs的上述作用;GW9662 10 μmol·L-1预处理后,可以明显拮抗姜黄素及吡格列酮对AGEs诱导的细胞色素C表达、caspase-3活性、Bax/Bcl-2增加的抑制作用。
2.4AGEs对家兔软骨细胞PPARγ表达的影响及姜黄素的作用如Fig 4所示,AGEs (200 mg·L-1)可以明显诱导软骨细胞PPARγ活性降低,同时伴随PPARγ的mRNA及蛋白表达降低;50 μmol·L-1的姜黄素可以明显上调PPARγ活性、mRNA及蛋白表达,同时,GW9662 10 μmol·L-1预处理1 h后,可以明显抑制姜黄素的作用。
3 讨论
本研究结果发现,姜黄素可以明显抑制AGEs诱导的软骨细胞凋亡及线粒体功能损伤,并明显上调AGEs诱导的PPARγ活性的降低,伴随PPARγ相应的mRNA及蛋白水平的升高,给予PPARγ 特异性拮抗剂GW9662预处理后,可以明显拮抗姜黄素的保护作用。该结果表明,基于上调PPARγ的作用靶点,姜黄素可明显抑制AGEs诱导的软骨细胞线粒体损伤,进而抑制AGEs诱导的软骨细胞凋亡。
在本研究中,为了探讨线粒体损伤在AGEs致OA病变中的作用,我们直接使用外源性AGEs以排除体内其他因素的影响,发现AGEs可以使得软骨细胞线粒体ATP生成减少,跨膜电位(△Ψm )降低,同时caspase-3活性增加,细胞色素C释放增加,Bax/Bcl-2的比值增加。这些结果提示AGEs可以诱导线粒体功能损伤,从而导致细胞色素C释放, Bax/Bcl-2的比值增加,激活caspase细胞凋亡途径, 诱导软骨细胞凋亡, 促进OA的发生发展。进一步的研究结果显示,PPARγ特异性激动剂吡格列酮可以明显抑制AGEs诱导的软骨细胞线粒体功能损伤,而预先给予PPARγ 特异性拮抗剂GW9662可以明显拮抗吡格列酮的作用。该结果提示,PPARγ的下调可能为AGEs诱导的线粒体功能损伤的重要机制之一。关于PPARγ对线粒体功能的调节作用的机制可能主要与PPARγ上调PGC-1α有关。PGC-1α与其下游的目标基因核呼吸因子-1(nuclear respiratory factor 1,NRF-1)结合后可以调控线粒体转录,呼吸基因的调节,另外,还可以通过诱导线粒体脂肪酸和亚铁血红素生物合成途径,提高线粒体的氧化功能[3, 8]。关于AGEs下调PPARγ 后,是否通过PGC-1α途径诱导线粒体功能损伤,尚需进一步实验证实。
为了进一步验证基于PPARγ靶点的保护药物是否对AGEs诱导的线粒体功能损伤具有保护作用,我们观察了姜黄素对AGEs诱导软骨细胞凋亡的作用。姜黄素已在多种细胞上被证实可以明显上调PPARγ。文献报道,在阿尔茨海默病大鼠模型中,姜黄素通过上调PPARγ明显抑制β-淀粉样蛋白诱导的神经炎症[9];Li等[10]研究表明,姜黄素通过提高PPARγ活性,抑制氧化应激,从而抑制血管紧张素II诱导的大鼠血管平滑肌细胞炎症和增殖。关于姜黄素对PPARγ的上调作用机制尚不十分清楚,姜黄素或为PPARγ的天然配体,与PPARγ直接结合后激活PPARγ,或通过与体内某些受体结合后间接激活PPARγ,尚需要进一步的研究证实[11-12]。关于姜黄素对OA病变的保护作用已在OA患者或动物实验中被证实,其可以有效缓解OA病变炎症反应及疼痛等相关临床症状[13-15],而姜黄素是否通过基于PPARγ靶点发挥保护OA病变作用,尚不清楚。本研究结果显示,姜黄素可以明显抑制AGEs诱导的软骨细胞凋亡及线粒体功能的损伤;而预先给予PPARγ 特异性拮抗剂GW9662处理后,可以有效拮抗姜黄素对AGEs诱导软骨细胞凋亡及线粒体功能损伤的保护作用;同时,本研究进一步发现姜黄素可以明显上调AGEs诱导的PPARγ活性的降低,伴随PPARγ相应的mRNA及蛋白表达水平的升高。该研究结果提示,姜黄素上调PPARγ的活性及表达可能为姜黄素保护AGEs诱导软骨细胞线粒体功能损伤的重要机制之一。
综上,本研究表明,AGEs通过下调PPARγ诱导软骨细胞线粒体功能损伤,从而激活caspase凋亡途径,最终导致软骨细胞凋亡,其中线粒体功能受损可能起了关键作用;同时,姜黄素基于PPARγ的作用靶点,有效保护AGEs诱导的软骨细胞线粒体损伤,抑制软骨细胞凋亡。另外,由于AGEs形式各异、分子量大、生成易分解难、体内不易清除等特点,使得PPARγ-线粒体损伤这一通路持续活化, 并且线粒体损伤后诱发大量ROS产生,又可反过来诱导AGEs特异性作用受体RAGE的表达,从而起到正反馈的作用,这或许可以解释为什么OA患者的病变呈持续、进行性地发展。姜黄素来源方便、经济,长期服用安全性高,多项临床研究已证实其可有效减轻OA患者的病理生理进展及缓解疼痛,本研究结果将为姜黄素保护AGEs所致OA病变的发生发展提供新的实验依据。
(致谢:本研究主要在甘肃省人民医院科研中心完成,感谢课题组成员在本研究过程中提供帮助与指导。)
[1] Shane Anderson A, Loeser R F. Why is osteoarthritis an age-related disease[J]?BestPractResClinRheumatol, 2010,24(1): 15-26.
[2] Yang Q, Chen C, Wu S, et al. Advanced glycation end products downregulates peroxisome proliferator-activated receptor γ expression in cultured rabbit chondrocyte through MAPK pathway [J].EurJPharmacol, 2010,649(1-3):108-14.
[3] Singh S P, Schragenheim J, Cao J, et al. PGC-1 alpha regulates HO-1 expression, mitochondrial dynamics and biogenesis: role of epoxyeicosatrienoic acid [J].ProstaglandinsOtherLipidMediat, 2016,125:8-18.
[4] 黄小华,孙 永,沈 能,等. 双亲姜黄素衍生物减轻大鼠肝纤维化与抗炎抗氧化作用的研究[J].中国药理学通报, 2015,31(4):470-5.
[4] Huang X H, Sun Y, Shen N, et al. The amphiphilic curcumin derivative attenuates liver fibrosis by anti-inflammatory and antioxidant effect [J].ChinPharmacolBull, 2015,31(4):470-5.
[5] 马如风,王丽丽,左加成, 等. 姜黄素通过调节组织蛋白酶K改善高脂诱导C57BL/6J小鼠骨结构和骨质量的实验研究[J]. 中国药理学通报, 2017,33(10):1446-51.
[5] Ma R F, Wang L L, Zuo J C, et al. An experimental study of effect of curcumin on improvement of bone microarchitecture and bone quality in high-fat-diet C57BL/6J mice and its association with cathepsin K[J].ChinPharmacolBull, 2017,33(10):1446-51.
[6] 吴 莺,吴丽贤,许建华. 姜黄素衍生物C085抑制K562/G01细胞及Bcr-Abl激酶的体外研究[J]. 中国药理学通报,2016,32(7):1004-11.
[6] Wu Y, Wu L X, Xu J H, et al. Curcumin derivative C085 inhibits proliferation of K562/G01 cells and activity of Bcr-Abl kinaseinvitro[J].ChinPharmacolBull, 2016,32(7):1004-11.
[7] Liu Z J, Liu H Q, Xiao C, et al. Curcumin protects neurons against oxygen-glucose deprivation/reoxygenation-induced injury through activation of peroxisome proliferator-activated receptor-γ function [J].JNeurosciRes, 2014,92(11): 1549-59.
[8] Wang S, Zhu X, Xiong L, et al. Ablation of Akt2 prevents paraquat-induced myocardial mitochondrial injury and contractile dysfunction: role of Nrf2 [J].ToxicolLett, 2017,269:1-14.
[9] Liu Z J, Li Z H, Liu L, et al. Curcumin attenuates beta-amyloid-induced neuroinflammation via activation of peroxisome proliferator-activated receptor-gamma function in a rat model of Alzheimer's disease [J].FrontPharmacol, 2016,7:261.
[10] Li H Y, Yang M, Li Z, et al. Curcumin inhibits angiotensin II-induced inflammation and proliferation of rat vascular smooth muscle cells by elevating PPAR-γ activity and reducing oxidative stress [J].IntJMolMed, 2017,39(5):1307-16.
[11] Mazidi M, Karimi E, Meydani M, et al. Potential effects of curcumin on peroxisome proliferator-activated receptor-γinvitroandinvivo[J].WorldJMethodol, 2016,6(1):112-7.
[12] Chen A, Xu J. Activation of PPARγ by curcumin inhibits Moser cell growth and mediates suppression of gene expression of cyclin D1 and EGFR [J].AmJPhysiolGastrointestLiverPhysiol, 2005,288(3):G447-56.
[13] Chin K Y. The spice for joint inflammation: anti-inflammatory role of curcumin in treating osteoarthritis[J].DrugDesDevelTher, 2016,10:3029-42.
[14] Sterzi S, Giordani L, Morrone M, et al. The efficacy and safety of a combination of glucosamine hydrochloride, chondroitin sulfate and bio-curcumin with exercise in the treatment of knee osteoarthritis: a randomized, double-blind, placebo-controlled study [J].EurJPhysRehabilMed, 2016,52(3):321-30.
[15] Zhang Z, Leong D J, Xu L, et al. Curcumin slows osteoarthritis progression and relieves osteoarthritis-associated pain symptoms in a post-traumatic osteoarthritis mouse model[J].ArthritisResTher, 2016,18(1):128.