海蓬子皂苷甲通过mTOR信号通路诱导MCF7细胞发生自噬
2018-01-24管福琴黄真真王奇志赵友谊
管福琴,单 宇,黄真真,王奇志,陈 雨,印 敏,刘 飞,徐 曙,王 鸣,赵友谊,冯 煦
(江苏省中国科学院植物研究所,江苏省植物资源研究与利用重点实验室,天然产物研究中心,江苏 南京 210014)
自噬是广泛存在于真核细胞内的一种溶酶体依赖性降解途径,是细胞进行自我保护的一种重要机制,在维持细胞存活、更新、物质再利用和内环境稳定中起着重要作用[1]。近年来的研究显示,自噬在肿瘤的治疗中有不可忽视的作用:一方面,自噬可以清除肿瘤细胞内折叠异常的蛋白和功能异常的细胞器, 防止基因组损伤,从而抑制肿瘤的发生;另一方面,肿瘤细胞可利用自噬作用使自身在营养缺乏和低氧的状况下得以存活[2]。海蓬子皂苷甲(Bigelovii A,BA)是本课题组从盐生植物海蓬子中分离得到的30-降齐墩果烷型五环三萜皂苷[3]。前期研究发现,BA能够诱导白血病细胞HL-60凋亡[4],同时可通过抑制NF-κB和p38 MAPK/ERK1/2,缓解LPS诱导的急性肺损伤[5]。故本研究在此基础上,以人乳腺癌细胞MCF7为研究对象,进一步观察BA作用后,细胞自噬的发生及其在肿瘤细胞生长中的作用,并初步探索发生自噬的作用机制,拟为肿瘤防治提供新的思路。
1 材料
1.1细胞MCF7细胞购自中国科学院典型培养物保藏委员会细胞库。
1.2试剂BA由本实验室从北美海蓬子干燥全草分离得到,纯度>98%;MEM培养基、胎牛血清、蛋白酶抑制剂,均购自Thermo Fisher Scientific公司;胰蛋白酶、青链霉素、二甲基亚砜(dimethylsul phoxide, DMSO)、四 甲 基 偶 氮 唑 盐 (MTT)、吖啶橙(acridine orange, AO)、RIPA裂解液、预染蛋白Marker等均购自厚百生物商城;丹酰戊二胺(monodansyl cadaverine, MDC)和3-甲基腺嘌呤(3-methyladenine, 3-MA)购自Sigma公司; 所有免疫印迹抗体、ECL发光液均购自美国Cell Signaling公司。
1.3仪器Thermo 6500 CO2培养箱、NapFLOW 1200生物安全柜(美国Thermo公司);Centrifuge 5804R高速离心机(德国Eppendorf公司);IX51型荧光倒置显微镜(日本Olympus公司);Infinite M200全波长荧光酶标仪(美国Tecan公司);Accuri C6流式细胞仪(美国BD公司);MS3 digital 定时微量振荡器(德国IKA公司);LiBROR AEL-200电子天平(日本Shimadzu公司)。
2 方法
2.1细胞培养人乳腺癌细胞株MCF7培养于含10%胎牛血清、100 kU·L-1青霉素、100 mg·L-1链霉素的MEM培养基中。培养条件为37℃、5% CO2。待细胞生长至80%融合后,倒掉培养瓶中的培养液,1 mL PBS清洗后,加入1 mL胰蛋白酶于细胞培养箱中消化,待贴壁细胞变圆后,吸掉胰酶,加入完全培养基吹打收集细胞,1 000 r·min-1离心5 min,倒掉上清,重悬于细胞培养液中,取一定量细胞接种培养板。
2.2AO染色检测细胞自噬将75%乙醇浸泡过夜、紫外消毒杀菌的盖玻片置于6孔板内,种入细胞(2×108·L-1)培养过夜。用不同浓度的BA(10、20、40 μmol·L-1)处理24 h。吸尽培养液,用PBS在摇床上洗2遍,每次3 min,吸尽液体。加入1 mL AO染色液(1 mg·L-1),摇床避光染色15 min。去染色液,加入1 mL PBS,洗2次,每次3 min,吸尽PBS。在载玻片上滴加抗荧光淬灭封片液,轻轻盖上贴有细胞的盖玻片,尽量避免产生气泡。在倒置荧光显微镜上观察,蓝光激发。
2.3MDC流式检测细胞自噬取对数生长期MCF7细胞(2×108·L-1)接种,每皿2 mL。次日用不同浓度的BA(10、20、40 μmol·L-1)处理24 h;收集细胞上清中漂浮细胞,500×g离心5 min;同时,PBS洗细胞,胰酶消化2 min;收集细胞,500×g离心5 min。加入1 mL PBS 吹散细胞,加入到相应漂浮细胞的管子中,500×g离心5 min;收集细胞,冷PBS洗1~2遍,尽量去干净上清。加入1 mL PBS重悬细胞,在细胞悬液中加入1 μL 0.05 mol·L-1MDC染色液,37 ℃避光染色1 h。500×g离心5 min,收集细胞;去上清,冷PBS洗1遍;流式细胞仪FL1通道检测,分析处理实验结果。
2.4Westernblot法检测自噬相关蛋白和mTOR信号通路蛋白的表达BA处理MCF7细胞24 h后,提取总蛋白,聚丙烯酰胺凝胶电泳,转移到PVDF膜上,5%脱脂奶粉封闭,一抗(1 ∶1 000)封闭过夜,二抗(1 ∶2 000)室温孵育1 h,最后用ECL发光液显色,暗盒中胶片曝光,显影、定影后扫描图像。
2.5细胞存活率测定将处于对数生长期的细胞接种于96孔培养板,细胞接种密度为2×108·L-1,每孔100 μL。贴壁细胞培养过夜,次日加入培养液、10 μmol·L-1BA、1×10-3mol·L-13-MA、10 μmol·L-1BA + 1×10-3mol·L-13-MA,每组设6个平行孔,置于细胞培养箱中培养24 h。然后每孔加入10 μL 5 g·L-1的MTT,37℃培养箱中继续培养4 h,吸尽上清,在96孔板中加入100 μL DMSO溶解甲臜,振摇10 min。在酶标仪上检测,测量波长为570 nm,参比波长为690 nm。按照下述公式计算细胞存活率:细胞存活率=(样品组OD值/空白对照组OD值)×100%。

3 结果
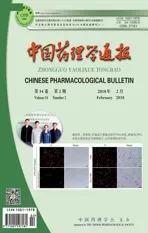
3.1BA诱导MCF7细胞发生自噬AO染色结果表明(Fig 1A),10、20、40 μmol·L-1BA作用MCF7细胞24 h后,橘红色荧光明显增多,且呈浓度依赖性,提示细胞内的酸性小囊泡增加。MDC可标记与酸性溶酶体结合的细胞自噬体结构,流式细胞仪结合MDC染色实验发现,随着BA浓度的增加,细胞荧光强度增强,且呈现很好的剂量依赖性(Fig 1B),提示BA诱导了细胞自噬。Western blot结果表明(Fig 1C),BA引起自噬标志性蛋白LC3-II增加,这进一步验证了BA诱导MCF7细胞自噬。
3.2BA通过Akt/ERK-mTOR信号通路诱导MCF7细胞自噬哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)信号通路是细胞自噬的负调节因子。如Fig 2所示,不同浓度的BA(10~40 μmol·L-1)处理细胞24 h后,p-mTOR蛋白表达降低,而总mTOR蛋白表达略微减少;细胞内p70S6K蛋白丝氨酸(Ser)、苏氨酸(Thr)的磷酸化水平和4EBP1的磷酸化水平降低,呈很好的剂量依赖性。当Akt或ERK1/2磷酸化结节性硬化症基因2(tuberous sclerosis complex 2, TSC2)后,TSC2与TSC1解离,引起mTOR的激活,自噬受到抑制[6]。Western blot结果显示,随着BA浓度升高,Akt 和p-ERK表达降低,呈很好的剂量依赖性(Fig 3)。
3.3自噬抑制剂3-MA可提高BA的细胞毒作用3-MA是一种广泛应用的细胞自噬抑制剂,可以抑制PI3K活性。为观察BA诱导的自噬对细胞活性的影响,我们用1 mmol·L-13-MA预处理MCF7细胞0.5 h,再加入10 μmol·L-1BA处理48 h,通过MTT检测细胞的活性。如Fig 4所示,当3-MA在1×10-3mol·L-1时,对MCF7细胞存活率没有影响,但在与10 μmol·L-1BA联合用药时,细胞存活率明显低于单独使用BA处理的细胞,即抑制细胞自噬导致细胞存活率下降。提示BA诱导的MCF7细胞自噬是细胞的一种自我保护机制。
4 讨论
乳腺癌是女性人群中发病率居首位的恶性肿瘤,全国肿瘤登记中心2015年年报显示,中国女性乳腺癌年发病人数约24.9万,近10年来发病一直呈上升趋势[7]。因此,寻找安全有效的抗乳腺癌药物具有十分重要的意义。本课题前期研究结果表明,BA能够抑制乳腺癌细胞和白血病细胞增殖,并通过线粒体通路介导细胞凋亡[4]。
Fig 1 BA induces autophagy in MCF7 cells, examined by AO staining (A), MDC staining (B) and Western blot (C)
**P<0.01vscontrol
细胞自噬是继凋亡之后,生命科学最热门的研究领域之一。目前已有研究报道,某些三萜皂苷可诱导肿瘤细胞发生自噬,但其引起的细胞自噬反而有助于细胞逃离损害,导致肿瘤细胞存活[8-10]。 但BA作用于人乳腺癌细胞MCF7后,是否产生自噬及其自噬对细胞的作用尚不明确。本研究结果表明,不同浓度BA处理细胞后,在荧光显微镜下观察到自噬溶酶体等典型的形态学变化。与此同时,流式细胞仪也检测到自噬溶酶体的出现。当自噬发生时,胞质内的LC3-I会转变为自噬体膜上的LC3-II。Western blot结果发现,随着BA剂量的提高,LC3-II表达逐渐增加。以上结果表明BA能够诱导MCF7细胞自噬。
Lim等[11]研究发现,乳腺癌的发生与mTOR通路过表达相关;同时,自噬的诱导与mTOR通路的抑制密切相关[12]。自噬的诱导通路较多,mTOR是其中经典的激活自噬的负调节通路[11]。当受到外界影响因子刺激,mTOR蛋白被抑制,从而抑制mTOR活性形式-磷酸化蛋白的形成,进而激活自噬效应。齐墩果酸能通过抑制Akt/mTOR通路,诱导前列腺癌细胞PC3自噬[9]。本研究中,BA抑制MCF7细胞内mTOR磷酸化表达,以及mTOR复合物两个最主要靶点p70S6K和4EBP1的磷酸化,说明在乳腺癌细胞MCF7中,BA能通过抑制该通路诱导自噬的产生。mTORC1 的上游通路主要有3条,包括PI3K/Akt/mTORC1 信号通路、Ras/MEK/ERK信号通路、AMPK-mTORC1信号通路[6]。我们检测了mTOR上游的Akt、p-ERK、ERK和p-AMPK的表达情况,发现BA可下调MCF7细胞中Akt和p-ERK蛋白表达,同时40 μmol·L-1BA可减少总ERK的表达,但是BA不能激活AMPK,Western blot没有检测到p-AMPK表达。

Fig 2 Effects of BA on expression of mTOR pathway*P<0.05, **P<0.01 vs control
肿瘤细胞发生自噬后可能会出现两种不同的结果:一种是使细胞内环境得到稳定,保护细胞逃离损害,维持细胞存活;另一种是启动Ⅱ型细胞程序性死亡,发生自噬性细胞死亡。有研究显示,化疗药顺铂及5-氟尿嘧啶作用于肿瘤细胞后,引起的自噬反而使肿瘤细胞得以存活,说明自噬的发生与化疗耐药有关[13-14]。 自噬抑制剂3-MA能通过阻止自噬体形成,抑制自噬的发生[15]。在本研究中,用3-MA与BA联合作用于MCF7细胞48 h后,诱导了更明显的肿瘤细胞增殖抑制。说明BA引起的自噬是保护性自噬,可部分拮抗BA诱导的乳腺癌细胞损伤。

Fig 3 Effects of BA on expression of Akt, p-ERK and ERK*P<0.05, **P<0.01 vs control
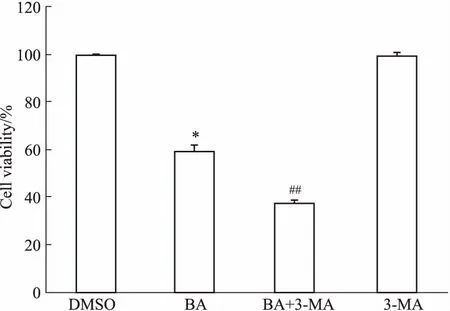
Fig 4 Effects of 3-MA on cytotoxicity induced by BA*P<0.05 vs DMSO; ##P<0.01 vs BA
综上所述,BA可通过抑制Akt和p-ERK蛋白表达,从而抑制mTOR激活,下调mTOR下游分子p70S6K和4EBP1的磷酸化水平,诱导细胞自噬水平的提高,最终促进了人乳腺癌细胞MCF7存活。该研究表明,BA和自噬抑制剂联合应用可更有效地抑制乳腺癌细胞的增殖,这将为乳腺癌的临床治疗提供新的思路。
(致谢:本研究是在江苏省中国科学院植物研究所完成,衷心感谢各位老师和同学在实验过程中的帮助与指导。)
[1] He C, Klionsky D J. Regulation mechanisms and signaling pathways of autophagy [J].AnnuRevGenet, 2009,43: 67-93.
[2] 张晓钰, 徐丽慧, 赵高翔, 等. 葫芦素E抑制Hela细胞mTORC1的活性并诱导细胞自噬[J]. 中国药理学通报,2014,6(30): 807-11.
[2] Zhang X Y, Xu L H, Zhao G X, et al. Cucurbitacin E induces autophagy in Hela cells by inhibiting mTORC1 activity [J].ChinPharmacolBull, 2014,6(30): 807-11.
[3] Wang Q Z, Liu X F, Shan Y, et al. Two new nortriterpenoid saponins from Salicornia bigelovii Torr. and their cytotoxic activity [J].Fitoterapia, 2012,83(4): 742-9.
[4] Guan F, Wang H, Shan Y, et al. Bigelovii A induces apoptosis of HL60 human acute promyelocytic leukaemia cells [J].MolMedRep, 2013,7(5): 1585-90.
[5] Yan C, Guan F, Shen Y, et al. Bigelovii A protects against lipopolysaccharide-induced acute lung injury by blocking NF-kappaB and CCAAT/enhancer-binding protein δ pathways [J].MediatorsInflamm, 2016,2016: 9201604.
[6] 陈兰芳, 肖 亮, 杨军平. 细胞自噬的分子机制及其功能 [J]. 实验与检验医学, 2014,32(2): 157-63.
[6] Chen L F, Xiao L, Yang J P. Molecular mechanism and functions of autophagy [J].ExpLabMed, 2014,32(2): 157-63.
[7] Chen W, Zheng R, Baade P D, et al. Cancer statistics in China, 2015 [J].CACancerJClin, 2016,66(2): 115-32.
[8] Sy L K, Yan S C, Lok C N, et al. Timosaponin A-III induces autophagy preceding mitochondria-mediated apoptosis in HeLa cancer cells [J].CancerRes, 2008,68(24): 10229-37.
[9] Shin S W, Kim S Y, Park J W. Autophagy inhibition enhances ursolic acid-induced apoptosis in PC3 cells [J].BiochimBiophysActa, 2012,1823(2): 451-7.
[10] Zhao C, Yin S, Dong Y, et al. Autophagy-dependent EIF2AK3 activation compromises ursolic acid-induced apoptosis through upregulation of MCL1 in MCF-7 human breast cancer cells [J].Autophagy, 2013,9(2): 196-207.
[11] Lim W, Jeong W, Song G. Delphinidin suppresses proliferation and migration of human ovarian clear cell carcinoma cells through blocking AKT and ERK1/2 MAPK signaling pathways [J].MolCellEndocrinol, 2016,422:172-81.
[12] Maycotte P, Thorburn A. Targeting autophagy in breast cancer [J].WorldJClinOncol, 2014,5(3): 224-40.
[13] Ren J H, He W S, Nong L, et al. Acquired cisplatin resistance in human lung adenocarcinoma cells is associated with enhanced autophagy [J].CancerBiotherRadiopharm, 2010,25(1): 75-80.
[14] 徐 玲, 曲秀娟, 刘云鹏, 等. 保护性自噬对5-FU诱导的胃癌细胞凋亡的抑制作用 [J]. 世界华人消化杂志, 2011,19(8): 777-81.
[14] Xu L, Qu X J, Liu Y P, et al. Protective autophagy inhibits 5-FU-induced apoptosis in human gastric cancer cell line MGC803 [J].WorldChinJDigest, 2011,19(8): 777-81.
[15] Brech A, Ahlquist T, Lothe R A, et al. Autophagy in tumour suppression and promotion [J].MolOncol, 2009,3(4): 366-75.