迷迭香酸衍生物RAD-9通过PI3K/Akt和p38 MAPK信号通路诱导胃癌MGC-803细胞凋亡
2018-01-24韦立群甘嘉亮李婉婷潘晓杭蒋伟哲唐双意
韦立群,李 清,甘嘉亮,李婉婷,潘晓杭,蒋伟哲,唐双意
(广西医科大学 1. 药学院、2. 第一附属医院药学部、3. 第一附属医院结直肠肛门外科,广西 南宁 530021)
胃癌是最为常见的癌症死亡原因之一,2017年美国估计新增胃癌病例约28 000例,新死亡病例约有10 960例[1]。胃癌发病率和死亡率极高,对公众的健康有重大影响,预计胃癌相关的死亡率将持续增加[2]。化疗是一种全身性治疗手段,对恶性肿瘤的原发灶、转移灶和亚临床转移灶均有治疗作用,但是化疗药物的选择性差,在产生治疗效果的同时,常出现不同程度的毒副作用[3]。因此,寻找具有低毒、高效的抗肿瘤药物成为广大科研人员的重要任务。面对现有化疗药物的特异性不足、疗效不强、毒副作用较大的缺点,中药给恶性肿瘤的临床治疗带来新的希望。利用现代生化方法深入研究中药的抗肿瘤作用机制,对发现新的抗肿瘤药物是很有意义的。迷迭香酸是一种天然来源的多酚羟基化合物,是迷迭香、紫苏、夏枯草、滇丹参等中药的有效成分,广泛应用于食品、医药品等领域,具有抗菌、抗氧化、抗炎、抗肿瘤等多种生物活性[4]。郭峰等[5]报道,迷迭香酸能拮抗H2O2诱导血管平滑肌细胞凋亡。还有研究报道,迷迭香酸可体外抑制人胃癌细胞MKN45的Warburg效应和生长[6]。为了优化迷迭香酸的抗肿瘤活性,本课题组前期合成了几种迷迭香酸衍生物,通过初筛发现迷迭香酸衍生物RAD-9具有明显的抗肿瘤活性,本研究进一步从细胞水平初步探讨其诱导MGC-803细胞凋亡可能机制,为后续开发利用奠定坚实的理论基础。
1 材料
1.1细胞与试剂人胃癌MGC-803细胞由广西医科大学第一附属医院胃肠外科肖强课题组赠予;RPMI 1640培养基购于美国Gibco公司;噻唑蓝(MTT) 购于中国索莱宝生物科技有限公司;荧光染料Hoechst 33258购于中国万类生物科技有限公司;Akt、p-Akt、p38、p-p38、GAPDH、Bax、Bcl-2、caspase-3兔抗人单克隆抗体,购自美国 Cell Signaling Technology 公司;0.25%胰蛋白酶、RIPA裂解液(强)、SDS-PAGE凝胶配制试剂盒、BCA蛋白定量试剂盒,均购自中国碧云天生物技术有限公司。
1.2仪器Series 8000 WJ 型 CO2培养箱(美国Thermo Fisher Scientific 公司),DMILLED DFC425C型倒置荧光显微镜(德国Leica公司),VersaMAXTM型多功能酶标仪 (美国 Molecular Dvices 公司),电泳仪及半干转印槽(美国Bio-Rad公司)。
2 方法
2.1细胞培养及药品储存液的配制人胃癌细胞MGC-803用含10%胎牛血清的RPMI 1640培养基,于37℃、5% CO2饱和湿度下常规培养,每2~3 d传代1次。迷迭香酸衍生物RAD-9(纯度大于90%)由本课题组合成,RAD-9溶于DMSO配制成100 mmol·L-1储存液,避光-20℃保存,实验时用含10%胎牛血清的RPMI 1640培养基稀释成相应浓度(DMSO终体积分数不超过0.1%)。
2.2MTT法检测细胞增殖将对数生长期的MGC-803细胞,以4 000个/孔接种于96孔板中,培养12 h待细胞贴壁后,弃去孔内培养基,加入用培养基配制好的终浓度为0、12.5、25、50、100、150 μmol·L-1的RAD-9药液,每孔200 μL,每个浓度设5个复孔,培养24、48、72 h。终止培养后,每孔加入20 μL 5 g·L-1的MTT,于培养箱中避光孵育4 h,弃掉孔里的液体,加入100 μL DMSO,于震荡器上避光震荡10 min使结晶充分溶解,在492 nm处用酶标仪测定各孔的吸光值(A值)。细胞存活抑制率=(正常对照组A492 nm-给药组A492 nm)/正常对照组A492 nm×100%。
2.3流式细胞术检测细胞的凋亡率将对数生长期的MGC-803细胞接种于6孔板中,待细胞长至80%汇合时,弃去培养基,加入含有不同浓度RAD-9(0、12.5、25、50 μmol·L-1)的培养基,置于37℃、5% CO2培养箱继续培养36 h,收集细胞上清液,用冰PBS洗3遍(收集PBS洗液),用不含EDTA的胰蛋白酶将细胞消化下来,收集所有细胞,用冰PBS洗3遍,弃掉PBS,加入100 μL Binding Buffer重悬细胞,再加入5 μL PI和5 μL Annexin V,避光室温孵育15 min,再加入400 μL Binding Buffer,于1 h内上机检测。
2.4Hoechst33258染色法观察细胞核的凋亡形态将对数期的MGC-803细胞接种到内嵌有经过无菌处理的盖玻片的6孔板中,待细胞长至80%汇合时,吸出孔内培养基,加入用培养基配好的含有不同浓度RAD-9(0、12.5、25、50 μmol·L-1)的药液,置于37℃、5% CO2培养箱中培养36 h,吸出孔内液体,用PBS轻轻漂洗3遍,加入4%多聚甲醛固定20 min,吸出4%多聚甲醛后,用PBS轻轻漂洗3遍,再用Hoechst 33258工作液室温避光染色20 min,吸出工作液,用 PBS轻轻漂洗3遍,再用抗荧光淬灭封片液(甘油 ∶PBS=1 ∶9)封片,于荧光显微镜下观察拍照。
2.5Westernblot检测相关蛋白表达将对数期的MGC-803细胞接种于25 cm2的培养瓶中,待细胞长至80%汇合时,吸出培养基,加入用培养基配好的含有不同浓度RAD-9(0、12.5、25、50 μmol·L-1)的药液,置于37℃、5% CO2培养箱中培养36 h,吸出并收集瓶内液体,用PBS轻轻漂洗3遍,再加入细胞裂解液冰上裂解30 min,12 000 r·min-1离心30 min,用BCA法检测蛋白浓度。加入适量上样蛋白缓存液,于沸水浴中高温变性8 min,取50 μg的蛋白,经10% SDS-PAGE电泳分离后,使蛋白转移至 PVDF膜上,用5% BSA室温封闭 40 min,再将PVDF膜置于配好的一抗中冰上孵育过夜,二抗室温孵育60 min,用TBST室温避光洗膜3遍,最后利用双色红外荧光扫描成像系统扫膜并采集图像。每组实验重复3次。

3 结果
3.1RAD-9对胃癌MGC-803细胞增殖的影响如Tab 1所示,与空白组比较,RAD-9干预胃癌MGC-803细胞24、48、72 h后,MGC-803细胞的存活率明显受到抑制(P<0.01)。抑制效果呈时间、浓度依赖,细胞的存活率随着药物浓度的升高而降低,说明RAD-9可以有效抑制胃癌MGC-803细胞的增殖。
Tab 1 Effect of different concentrations of RAD-9on viability of MGC-803 cells (±s,n=3)
*P<0.05,**P<0.01vscontrol(0 μmol·L-1)
3.2RAD-9对胃癌MGC-803细胞凋亡的影响如Fig 1所示,与空白组比较,12.5、25、50 μmol·L-1的RAD-9干预胃癌MGC-803细胞36 h后,MGC-803细胞出现明显凋亡(P<0.01),活细胞数随着药物浓度的升高而下降,晚期凋亡细胞随着药物浓度升高而增多,说明RAD-9可以促进胃癌MGC-803细胞的凋亡。
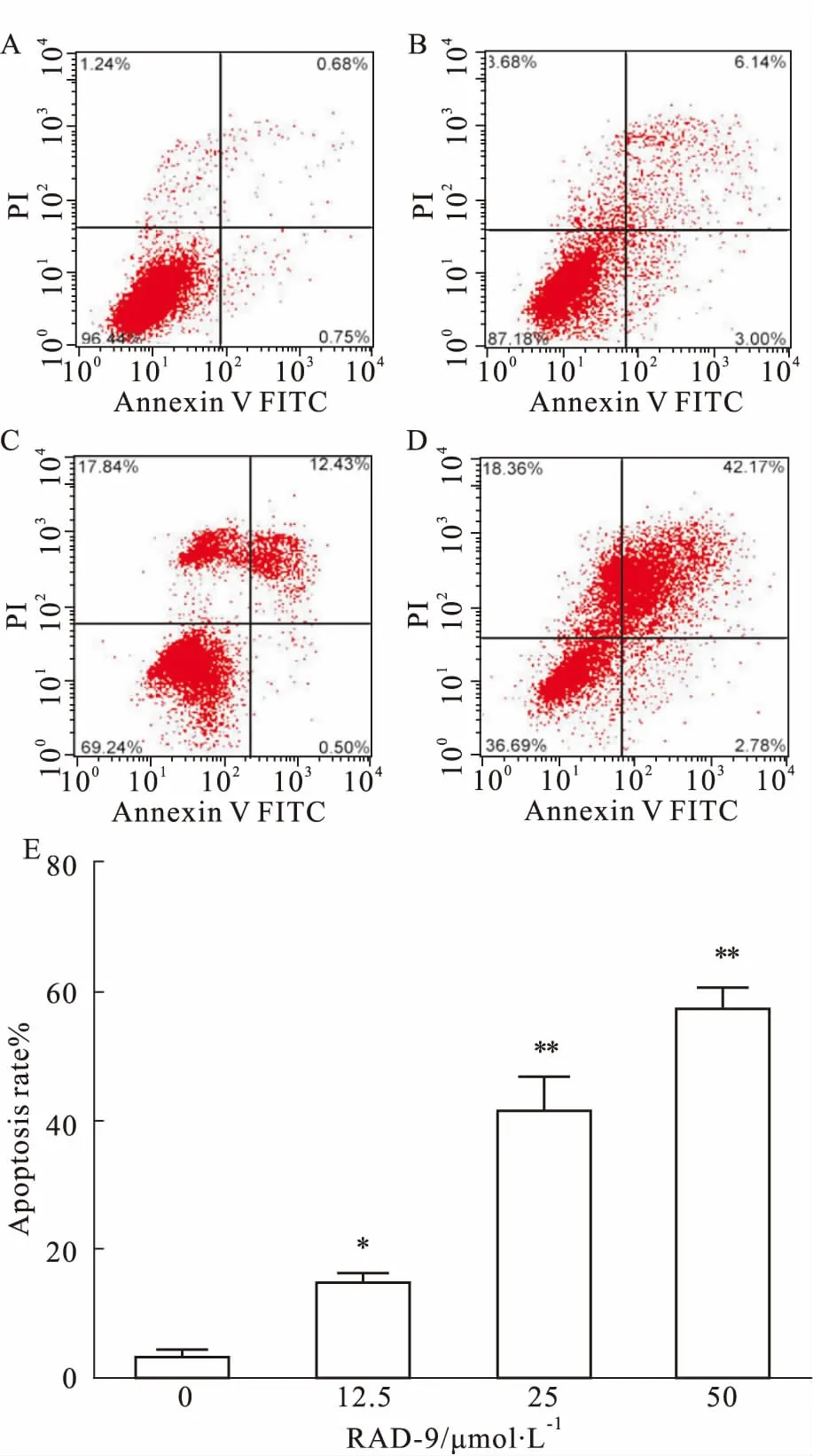
Fig 1 Effect of different concentrations of RAD-9 on apoptosis
A: Control group; B: 12.5 μmol·L-1RAD-9; C: 25 μmol·L-1RAD-9; D:50 μmol·L-1RAD-9; E: Bar graph of apoptosis rate.*P<0.05,**P<0.01vscontrol (0 μmol·L-1)
3.3RAD-9对胃癌MGC-803细胞核凋亡形态学的影响Fig 2的Hoechst 33258染色结果显示,与空白组比较,12.5、25、50 μmol·L-1的RAD-9干预胃癌MGC-803细胞36 h后,空白组中的细胞核形态呈圆形,淡蓝色;而经RAD-9处理后的细胞,细胞出现明显的凋亡特征,可见凋亡的细胞由于细胞核固缩,细胞核染色质凝聚、固缩呈明亮的月牙状、不规则圆形、椭圆形亮蓝白色亮光。表明 RAD-9对MGC-803细胞有一定的促凋亡作用。
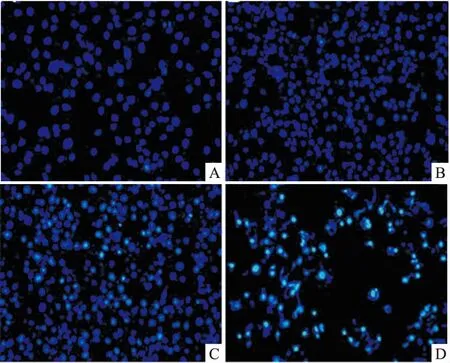
Fig 2 Effect of RAD-9 on morphology of MGC-803 cells(×200)
A:Control group; B:12.5 μmol·L-1RAD-9; C: 25 μmol·L-1RAD-9; D:50 μmol·L-1RAD-9
3.4RAD-9对人胃癌MGC-803细胞凋亡相关蛋白表达的影响如Fig 3所示,与空白组相比,RAD-9作用36 h后,给药组Bcl-2蛋白表达明显下调(P<0.01),Bax、caspase-3蛋白表达明显上调(P<0.01),提示RAD-9对促凋亡蛋白具有明显的诱导作用。
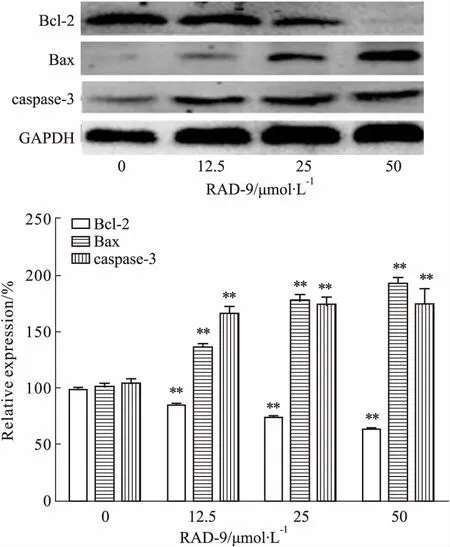
Fig 3 Effect of RAD-9 on expression of apoptosis-relatedproteins in MGC-803 cells (±s, n=3)
**P<0.01vscontrol (0 μmol·L-1)
3.5RAD-9对人胃癌MGC-803细胞Akt、p38信号通路蛋白的影响如Fig 4所示,与空白组相比,RAD-9作用36 h后,Akt、p-Akt蛋白表达下调(P<0.01),p38 MAPK通路蛋白p38、p-p38上调(P<0.01)。提示RAD-9可能是通过抑制PI3K/Akt、激活p38 MAPK信号通路,诱导胃癌MGC-803凋亡。

Fig 4 Effect of RAD-9 on expression of Akt, p-Akt, p38, p-p38proteins in MGC-803 cells(±s, n=3)
**P<0.01vscontrol (0 μmol·L-1)
4 讨论
最新统计数据显示,2015年中国有67.9万例新发胃癌患者,有49.8万人死于胃癌[7]。可见,胃癌仍然是临床上威胁国人健康最常见的消化系统恶性肿瘤之一。尽管有外科手术和化疗等有效的治疗手段,但我国胃癌总体预后仍不太乐观[8]。中药在胃癌等肿瘤治疗中具有一定优势[9],因此,如何挖掘和开发更多疗效好、毒性低的抗肿瘤中药,对改善胃癌预后具有很重要的现实意义。
细胞凋亡是组织稳态的关键调节因子,受通路激活和抑制相互作用的调控,细胞凋亡的调控异常与神经退行性疾病、慢性炎症性疾病、自身免疫性疾病等明显相关[10],这种主动诱导细胞死亡是中药抗肿瘤治疗的重要机制之一[9]。本研究结果显示,RAD-9能明显抑制人胃癌MGC-803 细胞的增殖,并随着浓度的递增,出现更多核固缩等凋亡形态学特征的肿瘤细胞,流式细胞术定量检测结果也显示,凋亡细胞数随着药物浓度增大而增多。进一步的Western blot检测结果显示,抑制凋亡的Bcl-2蛋白表达明显减少,而促进凋亡的Bax蛋白水平明显提高,凋亡启动标志蛋白caspase-3表达明显增强。这些结果提示RAD-9具有明显的凋亡诱导作用。
PI3K/Akt信号通路是细胞的重要调节通路,参与调节细胞生长、代谢、凋亡、转移、化疗耐药等,在大多数人类肿瘤中存在表达失调,越来越多的研究表明,PI3K/Akt与许多类型癌症(包括胃癌)的发生发展密切相关[11]。PI3K/Akt可以调控凋亡相关蛋白Bcl-2家族成员,Akt的激活能使Bcl-2从聚合体中释放出来,从而发挥抗凋亡作用[12],因此,抑制PI3K/Akt通路可以抑制肿瘤的生长或发展。在本研究中,迷迭香酸衍生物RAD-9可以明显抑制Akt、p-Akt蛋白表达水平,提示RAD-9可以明显抑制PI3K/Akt通路的信号传导。
丝裂原活化蛋白激酶(MAPK)包括 JNK、p38和ERK,其中p38受紫外线、渗透压、热休克和多种细胞因子等刺激而产生相应效应,参与调节细胞的增殖、分化、迁移、侵袭和死亡等,其功能异常与肿瘤的发生、进展和患者的生存期明显相关[13]。活化的p38可诱导Bax转位,介导caspases家族蛋白的活化[14]。p38 MAPK信号转导通路主要与促进肿瘤细胞凋亡密切相关,p-p38对肿瘤的形成有负向调控作用,能抑制恶性肿瘤的形成和肿瘤细胞的增殖。p38 MAPK促进细胞凋亡的机制主要有:增强c-myc基因表达,促进p53、c-jun磷酸化,参与介导Fas/FasL凋亡途径,使Bax转位以诱导线粒体凋亡途径等,最终诱导细胞凋亡[15]。我们的研究显示,RAD-9干预MGC-803细胞后,p38、p-p38明显上调,提示RAD-9可能通过激活p38 MAPK通路,诱导细胞凋亡。
综上所述,迷迭香酸衍生物RAD-9可以抑制胃癌MGC-803细胞增殖,并能诱导其凋亡,其机制可能与抑制PI3K/Akt、激活p38 MAPK信号通路有关,本研究为开发和改造迷迭香酸衍生物提供了理论参考。
(致谢:本实验于广西医科大学医学科学实验中心完成,感谢实验室老师和同学的指导和帮助!)
[1] Siegel R L, Miller K D, Jemal A.Cancer statistics, 2017[J].CACancerJClin,2017,67(1):7-30.
[2] Yuan L W, Yamashita H, Seto Y. Glucose metabolism in gastric cancer: the cutting-edge[J].WorldJGastroenterol,2016,22(6):2046-59.
[3] Hu Q, Sun W, Wang C, et al. Recent advances of cocktail chemotherapy by combination drug delivery systems[J].AdvDrugDelivRev,2016,98:19.
[4] 牟宜双, 邓文龙, 周黎明.迷迭香酸抗肿瘤作用研究进展[J].中药药理与临床, 2015,31(1):266-9.
[4] Mou Y S, Deng W L, Zhou L M. Research progress of antitumor effect of rosmarinic acid[J].PharmacolClinChinMaterMed, 2015,31(1):266-9.
[5] 郭 峰, 朱炳阳, 迟秀玲, 等.迷迭香酸抗过氧化氢诱导血管平滑肌细胞凋亡作用的研究[J].中国药理学通报, 2007,23(3):365-70.
[5] Guo F, Zhu B Y, Chi X L,et al. Inhibition of rosmarinic acid on the apoptosis of vascular smooth muscle cells induced by hydrogen peroxide[J].ChinPharmacolBull, 2007,23(3):365-70.
[6] Zhou L, Zhang P, Zhai C, et al. Anti-Warburg effect of rosmarinic acid via miR-155 in gastric cancer cells[J].DrugDesDevelTher, 2015,9:2695-703.
[7] Chen W, Zheng R, Baade P D, et al. Cancer statistics in China, 2015[J].CACancerJClin,2016,66(2):115.
[8] 陈 凛,张珂诚. 转移性胃癌的外科治疗[J]. 中华胃肠外科杂志, 2017,20(7):731-4.
[8] Chen L, Zhang K C. Surgical treatment for metastatic gastric cancer[J].ChinJGastrointestSurg, 2017,20(7):731-4.
[9] Gao L, Hao J, Niu Y Y, et al. Network pharmacology dissection of multiscale mechanisms of herbal medicines in stage IV gastric adenocarcinoma treatment[J].Medicine,2016,95(35):e4389.
[10] Peng Y T, Chen P, Ouyang R Y, et al. Multifaceted role of prohibitin in cell survival and apoptosis[J].Apoptosis, 2015,20(9):1135-49.
[11] Li B, Li J, Xu W W, et al. Suppression of esophageal tumor growth and chemoresistance by directly targeting the PI3K/AKT pathway[J].Oncotarget, 2014,5(22):11576-87.
[12] Siddiqui W A, Ahad A, Ahsan H. The mystery of BCL2 family: Bcl-2 proteins and apoptosis: an update[J].ArchToxicol, 2015,89(3):289-317.
[13] 陈前昭, 曾于桦, 邵 英, 等.白藜芦醇抑制人结肠癌细胞增殖与p38 MAPK的关系研究[J].中国药理学通报,2016,32(8):1110-4.
[13] Chen Q Z, Zeng Y Y, Shao Y, et al. Anti-proliferation effect of resveratrol and p38 MAPK in human colon cancer cells[J].ChinPharmacolBull, 2016,32(8):1110-4.
[14] Ghatan S, Larner S, Kinoshita Y, et al. p38 MAP kinase mediates Bax translocation in nitric oxide-induced apoptosis in neurons[J].JCellBiol,2000,150(2):335-47.
[15] 梁先敏, 杨克敌.Caspase和JNK/SAPK、p38 MAPK与细胞凋亡[J]. 国外医学卫生学分册, 2008,35(1):5-10.
[15] Liang X M, Yang K D.Caspase and JNK/SAPK, p38 MAPK and apoptosis[J].ForeignMedSci(SectHyg), 2008,35(1):5-10.