双歧杆菌联合乌司他丁对脓毒症模型大鼠免疫功能的影响①
2018-01-24王丽辉申亚晖郭艳青孙治霞邵焕璋
王丽辉 申亚晖 郭艳青 孙治霞 邵焕璋
(河南省中医院重症医学科,郑州 450002)
脓毒症是由于病原微生物所致的全身炎性反应综合征,涉及体内多个器官和系统,发病机制复杂,若早期得不到有效治疗,会发展为脓毒性休克、多器官功能障碍综合征(Multiple organ dysfunction syndrome,MODS),病死率高达70%[1]。研究表明,免疫功能紊乱、肠屏障损伤导致的肠源性感染是MODS发生的重要原因之一,在脓毒症发病机制中起重要作用[2- 4]。乌司他丁通过稳定溶酶体膜、抑制水解酶活性,发挥抗炎、抗休克作用,临床上常用于缓解脓毒症患者器官功能衰竭,增强免疫功能[5]。另有研究表明,乌司他丁能通过保护组织器官和内皮细胞,抑制多形核白细胞弹性蛋白酶、肿瘤坏死因子(TNF- α)、促炎细胞因子和白细胞介素(IL- 1、IL- 6、IL- 8)水平,减轻脓毒症损伤[6,7]。双歧杆菌为专性厌氧菌,是肠道内的优势菌群,可在肠道内产生乳酸、醋酸等有机酸及细菌素等抑菌物质,有助于提高机体的免疫能力[8- 10]。研究表明,双歧杆菌能够减轻脓毒症引起的肺损伤和炎症反应[11]。长双歧杆菌是双歧杆菌的一种,可以直接补充肠道有益菌,调整肠道菌群失调。本研究通过建立脓毒症大鼠模型,观察腹腔注射双歧杆菌联合乌司他丁后动物模型生存率、TNF- α、IL- 6含量、肠道菌群、血浆内毒素和T淋巴细胞亚群的变化,以探索双歧杆菌联合和乌司他丁对脓毒症的治疗效果,为临床上对脓毒症的治疗提供参考。
1 材料与方法
1.1材料
1.1.1动物 洁净级成年SD大鼠100只,雄性,体重200~250 g,购自南方医科大学实验动物中心,实验前适应性喂养7 d。
1.1.2试剂 长双歧杆菌B.adolescentis(由中科院微生物研究所提供);乌司他丁(广东天普生化医药股份有限公司);TNF- α、IL- 6 ELISA试剂盒(Biolegend公司);鲎试剂(TAL,厦门市鲎试剂实验厂有限公司);氯胺酮(广东嘉博制药有限公司);乙二胺四乙酸(EDTA,石家庄杰克化工有限公司);水为超纯水。
1.2方法
1.2.1脓毒症动物模型的建立 采用盲肠结扎穿孔术(Cecal ligation and puncture,CLP)[12],大鼠禁食12 h后,腹腔注射氯胺酮(100 mg/kg)麻醉,放置于操作台上,于腹正中作约1.5 cm切口,分离盲肠组织,用手术缝线从根部结扎末端1/2盲肠,用针头于盲肠上穿通2次形成盲肠漏,留置一条7号丝线防止针孔闭合,1号丝线关闭腹腔,术后立即皮下注射生理盐水(10 ml/kg)抗休克。
1.2.2动物分组与给药 把100只雄性SD大鼠,按随机数字表法分为假手术组、模型组、双歧杆菌治疗组、乌司他丁治疗组、联合治疗组,每组20只。假手术组开腹找到盲肠后立即关腹,不结扎,不穿孔盲肠;模型组按照“1.2.1”中方法处理,使大鼠发生腹腔感染继而出现脓毒症;双歧杆菌治疗组在模型组的基础上,每12 h腹腔注射双歧杆菌(250 mg/kg);乌司他丁治疗组在模型组的基础上,每12 h腹腔注射乌司他丁(1 000 U/100 g);联合治疗组在模型组的基础上,每12 h腹腔注射双歧杆菌后给予乌司他丁治疗。
1.2.3观察记录生存数 观察各组大鼠的生存情况,记录小鼠生存数量。
1.2.4检测肠道菌群 造模48 h后无菌收集大鼠粪便约0.1 g,加0.9 ml稀释液于无菌青霉素瓶中混匀,稀释后分别接种于各个培养基中,经张秀荣[13]菌落特征、革兰氏染色、镜检等初步鉴定后计数,计算出每克粪便中大肠杆菌、乳酸菌、双歧杆菌的数量。
1.2.5血样的采集与检测 于术后48 h收集血液,加入EDTA抗凝血管中,静置15 min,置于4℃下3 000 r/min离心机离心15 min,取上清液于-80℃冰箱保存。采用ELISA法测定TNF- α、IL- 6水平,操作方法严格按照试剂盒所附说明书进行。鲎试剂法测定血浆内毒素水平。用流式细胞术检测血浆T细胞亚群。

2 结果
2.1生存率的计算 模型组的生存率显著低于假手术组,差异具有统计学意义(P<0.05)。与模型组比较,双歧杆菌治疗组、乌司他丁治疗组、联合治疗组大鼠的生存率显著升高(P<0.05),联合治疗组大鼠的生存率显著优于双歧杆菌治疗组、乌司他丁治疗组 (P<0.05)。见表1。
2.2肠道菌群 模型组中大肠杆菌的含量显著高于假手术组,双歧杆菌和乳酸杆菌的数量显著低于假手术组,差异具有统计学意义(P<0.05)。与模型组比较,双歧杆菌治疗组、乌司他丁治疗组、联合治疗组的大肠杆菌的含量显著降低(P<0.05),联合治疗组的疗效显著优于双歧杆菌治疗组;与模型组比较,双歧杆菌和乳酸杆菌的含量显著增高(P<0.05),联合治疗组的疗效显著优于乌司他丁治疗组(P<0.05)。见表2。
表1各组大鼠48h生存率比较
Tab.1Comparisonof48hsurvivalrateinratsofvariousgroups

GroupsnnsurvivalSurvivalrate(%)Shamoperatedgroup2020 100Modelgroup206 301)Bifidobacteriumtreatmentgroup2010 502)3)Ulinastatintreatmentgroup2011 552)3)Combiningtreatmentgroup2015 752)
Note:Compared with sham operated group,1)P<0.05; compared with model group,2)P<0.05; compared with combining treatment group,3)P<0.05.
2.3TNF- α、IL- 6水平 模型组大鼠TNF- α、IL- 6水平显著高于假手术组,差异具有统计学意义(P<0.05)。与模型组比较,双歧杆菌治疗组、乌司他丁治疗组、联合治疗组的TNF- α、IL- 6水平显著降低(P<0.05),联合治疗组的疗效显著优于双歧杆菌治疗组和乌司他丁治疗组(P<0.05)。见表3。
2.4血浆内毒素水平 模型组大鼠内毒素水平显著升高,与假手术组比较差异具有统计学意义(P<0.05)。与模型组比较,双歧杆菌治疗组、乌司他丁治疗组、联合治疗组的血浆内毒素水平显著降低(P<0.05),联合治疗组的疗效显著优于双歧杆菌治疗组和乌司他丁治疗组(P<0.05)。见表4。
2.5T淋巴细胞亚群 模型组大鼠CD3+、CD4+T细胞、CD4+/CD8+T细胞比值显著下降,CD8+T显著上升,与假手术组相比差异具有统计学意义(P<0.05)。与模型组比较,双歧杆菌治疗组、乌司他丁治疗组、联合治疗组的CD3+、CD4+T细胞、CD4+/CD8+T细胞比值显著升高,CD8+T显著下降(P<0.05)。联合治疗组的疗效显著优于双歧杆菌治疗组和乌司他丁治疗组(P<0.05)。见表5。
表2各组大鼠肠道菌群数量比较
Tab.2Comparisonofintestinalflorasinratsofvariousgroups

GroupsnEscherichiaColi(IgN/g)Lactobacillus(IgN/g)Bifidobacterium(IgN/g)Shamoperatedgroup206.56±0.448.7±0.6510.01±0.41Modelgroup613.54±0.391)1.32±0.211)2.52±0.281)Bifidobacteriumtreatmentgroup107.48±0.292)5.45±0.312)3)8.61±0.462)Ulinastatintreatmentgroup119.61±0.892)3)4.80±0.392)3)6.34±0.292)3)Combiningtreatmentgroup157.31±0.422)7.71±0.602)9.27±0.432)
Note:Compared with sham operated group,1)P<0.05; compared with model group,2)P<0.05; compared with combining treatment group,3)P<0.05.
表3CLP大鼠TNF-α、IL-6含量比较
Tab.3ComparisonofTNF-αandIL-6inratsofvariousgroups

GroupsnTNF-α(ng/ml)IL-6(pg/ml)Shamoperatedgroup208.26±0.7614.09±1.41Modelgroup635.70±2.011)41.10±2.151)Bifidobacteriumtreatmentgroup1017.72±1.502)24.17±1.912)3)Ulinastatintreatmentgroup1113.76±1.632)20.28±0.982)3)Combiningtreatmentgroup159.94±1.212)16.99±1.422)
Note:Compared with sham operated group,1)P<0.05; compared with model group,2)P<0.05; compared with combining treatment group,3)P<0.05.
表4各组大鼠血浆内毒素水平比较
Tab.4Comparisonofserumendotoxininratsofvariousgroups

GroupsnPlasmaendotoxinlevel(EU/ml)Shamoperatedgroup200.169±0.068Modelgroup60.287±0.0191)Bifidobacteriumtreatmentgroup100.239±0.0152)3)Ulinastatintreatmentgroup110.211±0.0262)3)Combiningtreatmentgroup150.185±0.0212)
Note:Compared with sham operated group,1)P<0.05; compared with model group,2)P<0.05; compared with combining treatment group,3)P<0.05.
表5CLP大鼠T淋巴细胞亚群变化比较
Tab.5ComparisonofT-lymphocytesubsetsinratsofvariousgroups
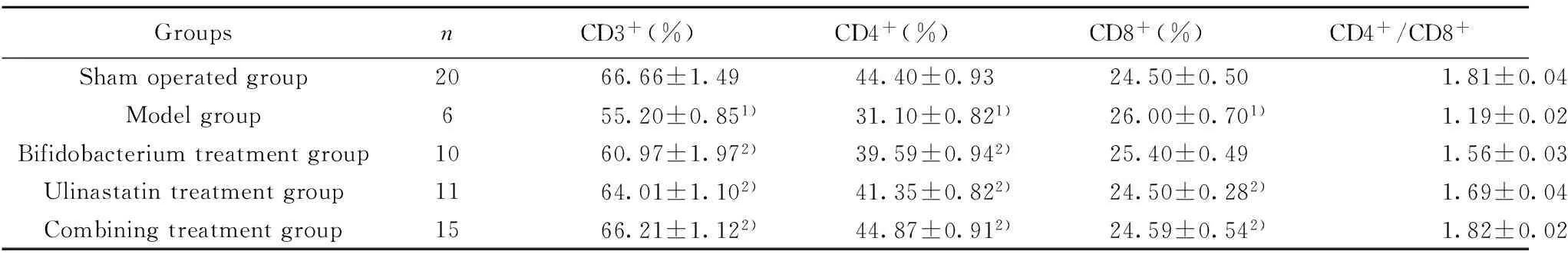
GroupsnCD3+(%)CD4+(%)CD8+(%)CD4+/CD8+Shamoperatedgroup2066.66±1.4944.40±0.9324.50±0.501.81±0.04Modelgroup655.20±0.851)31.10±0.821)26.00±0.701)1.19±0.021)Bifidobacteriumtreatmentgroup1060.97±1.972)39.59±0.942)25.40±0.491.56±0.032)3)Ulinastatintreatmentgroup1164.01±1.102)41.35±0.822)24.50±0.282)1.69±0.042)3)Combiningtreatmentgroup1566.21±1.122)44.87±0.912)24.59±0.542)1.82±0.022)
Note:Compared with sham operated group,1)P<0.05; compared with model group,2)P<0.05; compared with combining treatment group,3)P<0.05.
3 讨论
脓毒症的免疫调节机制十分复杂,目前临床上采用乌司他丁等药物提高机体的免疫能力是脓毒症治疗的主要治疗手段。正常情况下,大鼠肠道菌群之间保持着平衡的比例关系,且厌氧菌(乳酸杆菌、双歧杆菌)数量高于需氧菌(大肠杆菌)数量。本研究利用双歧杆菌对肠道菌群的调节提高免疫的作用,联合乌司他丁探究其对脓毒症动物模型免疫功能的影响。结果表明,脓毒症大鼠模型中厌氧菌双歧杆菌及乳酸杆菌数量明显减少,需氧菌大肠杆菌数量增加,肠道菌群发生紊乱,肠道菌群的数量和比例菌发生了改变。治疗组中,双歧杆菌治疗对肠道菌群的调节能力明显高于乌司他丁组,说明双歧杆菌能够调节肠道菌群平衡,防止肠道菌群紊乱,促进构成肠黏膜的微生物屏障,阻止致病菌的入侵,与文献报道结果相符[14]。
TNF- α、IL- 6是早期促炎细胞因子,参与早期脓毒症并发多器官损伤,能通过促进自由基、缓激肽、组胺等物质的产生,激活补体等,加重组织损伤[15]。肠道益生菌可诱导淋巴细胞因子表达,下调炎性因子,促进上皮细胞肌动蛋白和咬合蛋白磷酸化,加强上皮间的紧密连接,从而抑制病原对黏膜的损害,保持黏膜的完整性[16]。模型组中TNF- α、IL- 6水平大幅度增加,说明脓毒症引起了机体的炎症反应,此反应能通过双歧杆菌、乌司他丁治疗有效缓解,乌司他丁比双歧杆菌抗炎作用更明显,二者联合使用可以更好地提高疗效。
T淋巴细胞亚群可以反映出机体的免疫功能,模型组中CD3+、CD4+T细胞显著减少,说明脓毒症对机体产生了免疫抑制作用,治疗组中CD3+、CD4+T细胞显著升高,说明双歧杆菌与乌司他丁对脓毒症模型大鼠的免疫功能起促进作用。本研究通过建立脓毒症动物模型,确定了双歧杆菌联合乌司他丁较单用乌司他丁可更有效地降低脓毒症大鼠的死亡率,抑制脓毒症大鼠的炎症因子,调节肠道菌群,降低血浆内毒素,提高机体免疫能力。双歧杆菌通过调节肠道菌群平衡,对乌司他丁的疗效起促进作用。
[1] Cawcutt KA,Peters SG.Severe sepsis and septic shock:clinical overview and update on management[J].Mayo Clin Proc,2014,89(11):1572- 1578.
[2] 李成荣.脓毒症免疫功能紊乱机制研究概况[J].中国实用儿科杂志,2011,26(12):885- 887.
Li CR.An overview of the mechanism of immune dysfunction of sepsis[J].Chin J Pract Pediatr,2011,26(12):885- 887.
[3] Jiang L,Yang L,Zhang M,etal.Beneficial effects of ulinastatin on gut barrier function in sepsis[J].Indian J Med Res,2013,138(6):904.
[4] 史振伟,许 焱,李晓璐,等.银耳多糖改善脓毒症小鼠调节性T细胞的免疫活性[J].中国免疫学杂志,2016,32(3):313- 317.
Shi ZW,Xu Y,Li XL,etal.The effect of tremella polysaccharide on the immune activity of regulatory T cells in mice[J].Chin J Immunol,2016,32(3):313- 317.
[5] 毛 刚,吴清安,刘 磊.乌司他丁的药理作用机制及临床应用进展[J].山东医药,2015,55(30):94- 96.
Mao G,Wu QA,Liu L.The pharmacological mechanism and clinical application of Ustatin[J].Shandong Med J,2015,55(30):94- 96.
[6] Atal SS,Atal S.Ulinastatin- a newer potential therapeutic option for multiple organ dysfunction syndrome[J].J Basic Clin Physiol Pharmacol,2016,27(2):91- 99.
[7] 施 荣,熊旭东,李淑芳.乌司他丁调控脓毒症大鼠TNF- α与IL- 6及IL- 10水平的研究[J].抗感染药学,2009,6(1):16- 19.
Shi R,Xiong XD,Li SF.Study of Ulinastatin on level of TNF- α,IL- 6 and IL- 10 in rats with sepsis[J].Anti- Infection Pharmacy,2009,6(1):16- 19.
[8] 吕锡斌,何腊平,张汝娇,等.双歧杆菌生理功能研究进展[J].食品工业科技,2013,34(16):353- 358.
Lv XB,He LP,Zhang RJ,etal.Research progress in physiological functions of Bifidobacterium[J].Sci Technol Food Indust,2013,34(16):353- 358.
[9] 范金波,侯 宇,周素珍,等.双歧杆菌增强小鼠机体的免疫功能[J].微生物学报,2015,55(4):484- 491.
Fan JB,Hou Y,Zhou SZ,etal.Effect of Bifidobacterium on the immunity in BALB/c mice[J].Wei Sheng Wu Xue Bao,2015,55(4):484- 491.
[10] 黄 煌,郑鹏远,罗 予.双歧杆菌对免疫功能低下小鼠肠道屏障功能的影响[J].临床医学,2012,32(5):1- 3.
Huang H,Zheng PY,Luo Y.Effect of bifidobacterium on gut barrier function of mice with hypoimmunity[J].Clin Med,2012,32(5):1- 3.
[11] Khailova L,Petrie B,Baird CH,etal.Lactobacillus rhamnosus GG and Bifidobacterium longum attenuate lung injury and inflammatory response in experimental sepsis[J].PLoS One,2014,9(5):e97861.
[12] Wichterman KA,Baue AE,Chaudry IH,etal.Sepsis and septic shock- a review of laboratory models and a proposal[J].J Surg Res,1980,29(2):189.
[13] 张秀荣.肠道菌群粪便涂片检查图谱[M].北京:人民军医出版社,2000:1- 15.
Zhang XR.Intestinal flora fecal smear map[M].Beijing:People's military medical publishing house,2000:1- 15.
[14] Aroniadis OC,Brandt LJ.Fecal microbiota transplantation:past,present and future[J].Curr Opin Gastroenterol,2013,29(1):79- 84.
[15] 张 青,李 琦,毛宝龄,等.内毒素致伤大鼠肺组织促炎与抗炎细胞因子 mRNA 表达的时相性研究[J].中国危重病急救医学,2004,16(10):585- 588.
Zhang Q,Li Q,Mao BL,etal.Study on the expression of mRNA of the lung tissue of rats with endotoxin and anti- inflammatory cytokines[J].Chin Critic Care Med,2004,16(10):585- 588.
[16] Pena JA,Versalovic J.Lactobacillus rhamnosus GG decreases TNF- α production in lipopolysaccharide- activated murine macrophages by a contact- independent mechanism[J].Cell Microbiol,2003,5(4):277- 285.
