IL- 17参与巨细胞病毒肝炎致病机制的研究①
2018-01-24刘玲玲刘兴楼舒赛男
刘玲玲 黄 媛 马 迪 廖 毅 刘兴楼 李 革 舒赛男 方 峰
(华中科技大学同济医学院附属同济医院儿科病毒实验室,武汉 430030)
人类巨细胞病毒(Human cytomegalovirus,HCMV)属于疱疹病毒β亚科,是一种dsDNA病毒,具有与其他疱疹病毒类似的潜伏- 活化及持续感染的特性。但其致病力较弱,是一种机会性致病原。主要对免疫力低下(如新生儿、婴幼儿)、免疫抑制(如器官移植患者等)和免疫缺陷(如艾滋病患者)的人群造成危害。肝脏是最易受累的器官,感染者约60%~80%出现肝脏损伤,表现为肝脾大、黄疸及肝功能受损[1- 3]。
肝脏是CMV感染的主要靶器官,不仅在全身播散性感染时容易受累,还是主要受累的单个器官之一。临床上,巨细胞病毒性肝炎可表现为黄疸型或无黄疸型肝炎,常有轻~中度肝肿大伴血清肝酶轻~中度升高,常伴脾大,可伴不同程度胆汁淤积。炎性因子IL- 17,是Th17细胞主要的效应分子,其过高表达与多种疾病密切相关,其中,肝脏疾病包括自身免疫性肝病、急性肝损伤、慢性病毒性肝病及肝细胞癌等。近年来的研究发现,慢性乙型肝炎患者外周血中Th17细胞的数量及其分泌IL- 17的量都显著上调,与ALT升高显著相关,并参与胆管的慢性炎症过程,介导肝纤维化的形成[4,5]。研究显示IL- 17在巨细胞病毒性肝炎中也发挥着重要的作用,基于此,我们将在整体水平上对促炎因子IL- 17对巨细胞病毒肝炎中的致病机制进一步研究。
1 材料与方法
1.1材料
1.1.1动物 4周龄雌性BALB/c小鼠,SPF级[合格证号:SCXK(鄂)2008- 0005],购于湖北省医学科学院实验动物中心,饲养在同济医院动物室洁净层柜内。实验前适应性饲养3 d。
1.1.2病毒 MCMV Smith株(美国德克萨斯大学健康卫生中心惠赠)在BALB/c小鼠唾液腺中传毒增殖,收获病毒用于本实验,经标准空斑试验测定收获病毒的平均感染性滴度为4.9×105PFU/ml。
1.1.3MCMV感染小鼠模型的建立及实验分组 参考文献[6,7]:①正常对照组:每只小鼠腹腔注射200 μl相同稀释的正常唾液腺组织匀浆;②MCMV感染对照组:每只小鼠腹腔接种200 μl含5×103PFU MCMV唾液腺组织匀浆;③同型抗体阻断对照组:每只小鼠腹腔注射200 μl含5×103PFU MCMV唾液腺组织匀浆,同时在感染后第3天、第5天腹腔注射同型抗体100 μg/只;④IL- 17抗体阻断组:每只小鼠腹腔注射200 μl含 5×103PFU MCMV唾液腺组织匀浆,同时在感染后第3天、第5天腹腔注射100 μg/只的抗小鼠IL- 17抗体。在病毒感染后第7天收获小鼠。
1.2方法
1.2.1用Western blot法检测肝脏组织中IL- 17蛋白表达水平 提取肝脏组织蛋白,经蛋白裂解液裂解后应用BCA蛋白测定试剂盒测定裂解液上清中的蛋白浓度。各样本取50 μg蛋白上样,经电泳分离蛋白并转至PVDF膜上。封闭液浸泡PVDF膜,室温摇床封闭2 h。兔抗鼠IL- 17(1∶1 000),β- actin(1∶500)稀释,将已封闭的PVDF膜浸泡于一抗孵育液中,排出气泡,4℃孵育过夜。羊抗兔结合HRP的特异IgG二抗(1∶5 000)孵育后,用化学发光凝胶成像系统采集图像,采用Quantity one 4.62软件测定各蛋白光密度值,以β- actin条带为内参进行蛋白上样量的校正,以此对目的蛋白表达水平进行半定量分析。
1.2.2ELISA法检测血清中IL- 17水平 采用双抗体夹心ELISA法检测试验过程中小鼠血清中IL- 17水平。
1.2.3用HE染色法评估肝脏组织的病理性损伤程度 石蜡包埋肝脏组织切片行苏木紫- 伊红染色,并对其组织损伤进行评估。肝脏组织损伤标准根据Knodell肝组织病变活动性积分(Histological activity index,HAI)进行评估[8,9]。应用Olympus BX41显微镜摄像系统进行观察,每个标本选择3张切片,每张切片随机选择5个高倍镜视野(200×)进行观察。
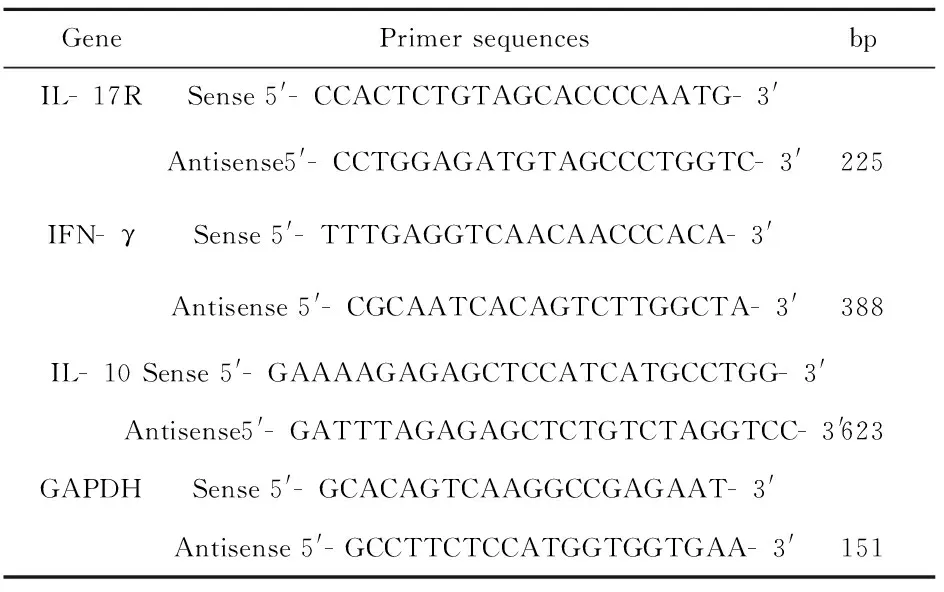
1.2.4RT- PCR法检测肝脏组织内IL- 17R、IFN- γ和IL- 10基因转录(mRNA)水平 用Trizol法提取肝脏组织总的RNA,检测RNA纯度 为1.959~2.089;反转录严格按试剂盒(Thermo提供)操作,cDNA合成模板RNA取5 μg;PCR试剂盒由Fermentas提供,每份样本同时检测目的基因和内参GAPDH基因。引物序列如表1[10- 12]: PCR反应体系:样本 cDNA 1 μl ,上、下游引物(pmol)各1 μl,共50 μl的反应体系。反应条件:IL- 17R与GAPDH:95℃预变性5 min;95℃,30 s;55℃,30 s;72℃,30 s,共36个循环。IFN- γ:95℃ 预变性5 min;95℃,30 s;57℃,30 s;72℃,30 s,共28个循环。IL- 10:95℃ 预变性5 min;95℃,30 s;58℃,30 s;72℃,30 s,共35个循环。PCR产物经琼脂糖凝胶电泳,凝胶成像系统扫描,Quantity One软件分析其IL- 17R、IFN- γ和IL- 10与GAPDH的Volume(CNTx mm2)比值,即用相对比值来表示IL- 17R、IFN- γ和IL- 10 mRNA的表达量。
表1引物序列
Tab.1Primersequences
GenePrimersequencesbpIL-17RSense5'-CCACTCTGTAGCACCCCAATG-3'Antisense5'-CCTGGAGATGTAGCCCTGGTC-3'225IFN-γSense5'-TTTGAGGTCAACAACCCACA-3'Antisense5'-CGCAATCACAGTCTTGGCTA-3'388IL-10Sense5'-GAAAAGAGAGCTCCATCATGCCTGG-3'Antisense5'-GATTTAGAGAGCTCTGTCTAGGTCC-3'623GAPDHSense5'-GCACAGTCAAGGCCGAGAAT-3'Antisense5'-GCCTTCTCCATGGTGGTGAA-3'151
1.2.5用罗氏生化分析仪检测血清ALT水平 血清ALT水平由 DPPI罗氏生化分析仪检测。

2 结果
2.1腹腔注射IL- 17抗体后组织内IL- 17表达 建立MCMV全身播散性感染模型后,通过腹腔注射IL- 17抗体中和其体内表达的IL- 17蛋白。采用Western blot检测其在肝脏组织中IL- 17表达情况。肝脏组织结果显示,IL- 17抗体阻断组IL- 17表达量与MCMV感染对照组及同型抗体对照组比较明显降低,差异具有统计学意义(图1,P<0.05),表明腹腔注射IL- 17抗体有效阻断了肝脏组织中IL- 17的表达。
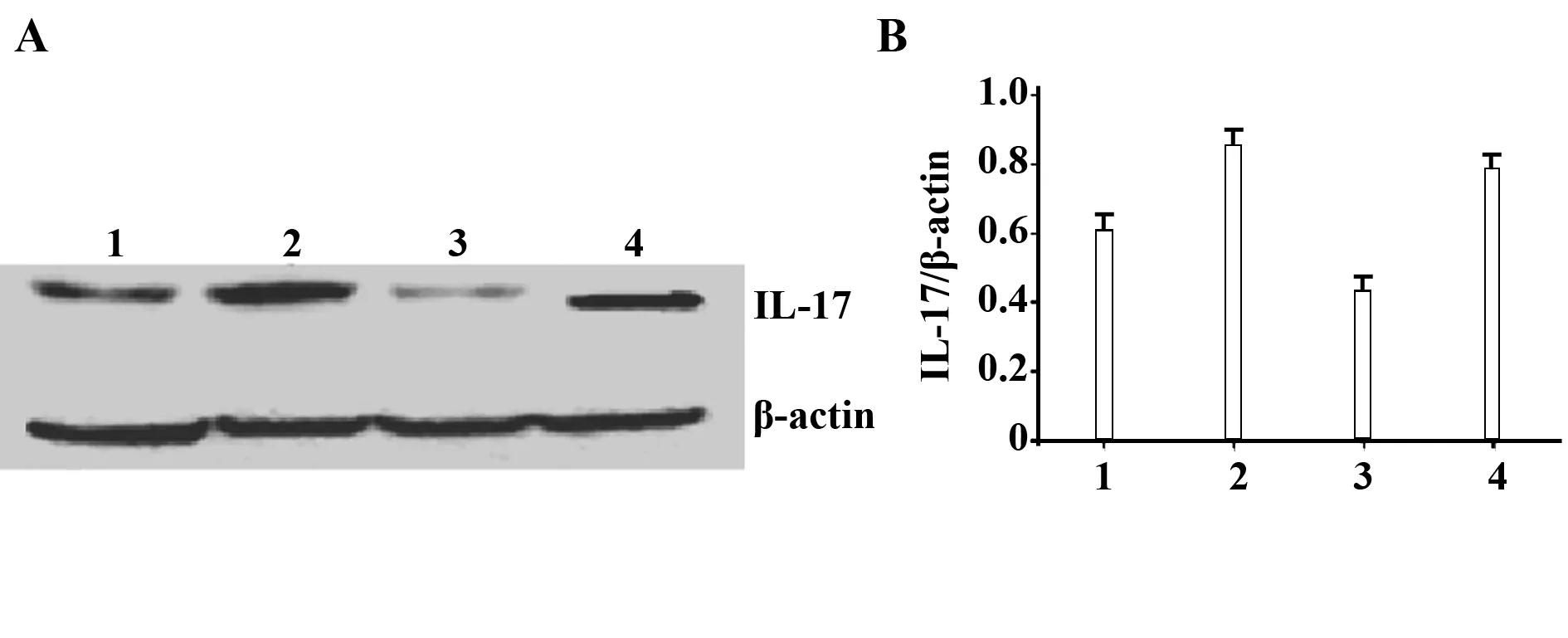
图1 IL- 17抗体阻断效应Fig.1 Blocked IL- 17 in vivoNote: 1.Control;2.MCMV infected mice;3.Anti- 17 mice;4.Isotype control.

图2 各实验组血清IL- 17水平测定Fig.2 Levels of IL- 17 in serumNote: *.P<0.05.
2.2血清中IL- 17水平 与同型抗体对照组及MCMV感染对照组相比,IL- 17抗体阻断组的IL- 17 明显减低(图2)。
2.3肝脏组织病理评估 IL- 17抗体阻断组在MCMV感染后第7天,体内中和IL- 17表达后,肝组织中炎性细胞浸润明显轻于MCMV感染组及同型抗体阻断对照组,肝脏病理评分为(4.5±0.5),而MCMV感染组和同型抗体阻断组的肝组织病理评分分别为(7.3±0.8)、(7.1±0.8)。说明降低IL- 17表达可以有效减轻肝组织的炎性细胞浸润,减轻肝损伤(图3)。
2.4血清ALT变化 IL- 17阻断组血清 ALT水平明显低于MCMV感染对照组小鼠及同型抗体阻断对照组小鼠(图4,P<0.05)。提示阻断体内IL- 17水平可以减轻巨细胞病毒感染所致肝损伤,促进肝功能的恢复。
2.5肝组织中IL- 17R、 IFN- γ及IL- 10mRNA的表达 在感染MCMV后阻断体内炎性因子IL- 17表达,见IL- 17抗体阻断组肝组织内IFN- γ表达量明显高于MCMV感染组及同型抗体阻断对照组(图5A、B,P<0.05)。而IL- 10在IL- 17被中和后也呈现表达量升高,明显高于MCMV感染组及同型抗体阻断对照组,差异有统计学意义(图5A、C,P<0.05)。在巨细胞病毒感染后,而IL- 17R的表达明显高于正常对照组(图5A、D,P<0.05)。但是,IL- 17抗体阻断组与MCMV感染组及同型抗体阻断对照组之间进行比较,差异无统计学意义(图5A、D,P>0.05),结果表明在体内中和IL- 17的表达,对IL- 17R mRNA的表达没有影响,而可以调节IFN- γ及IL- 10 mRNA的表达。
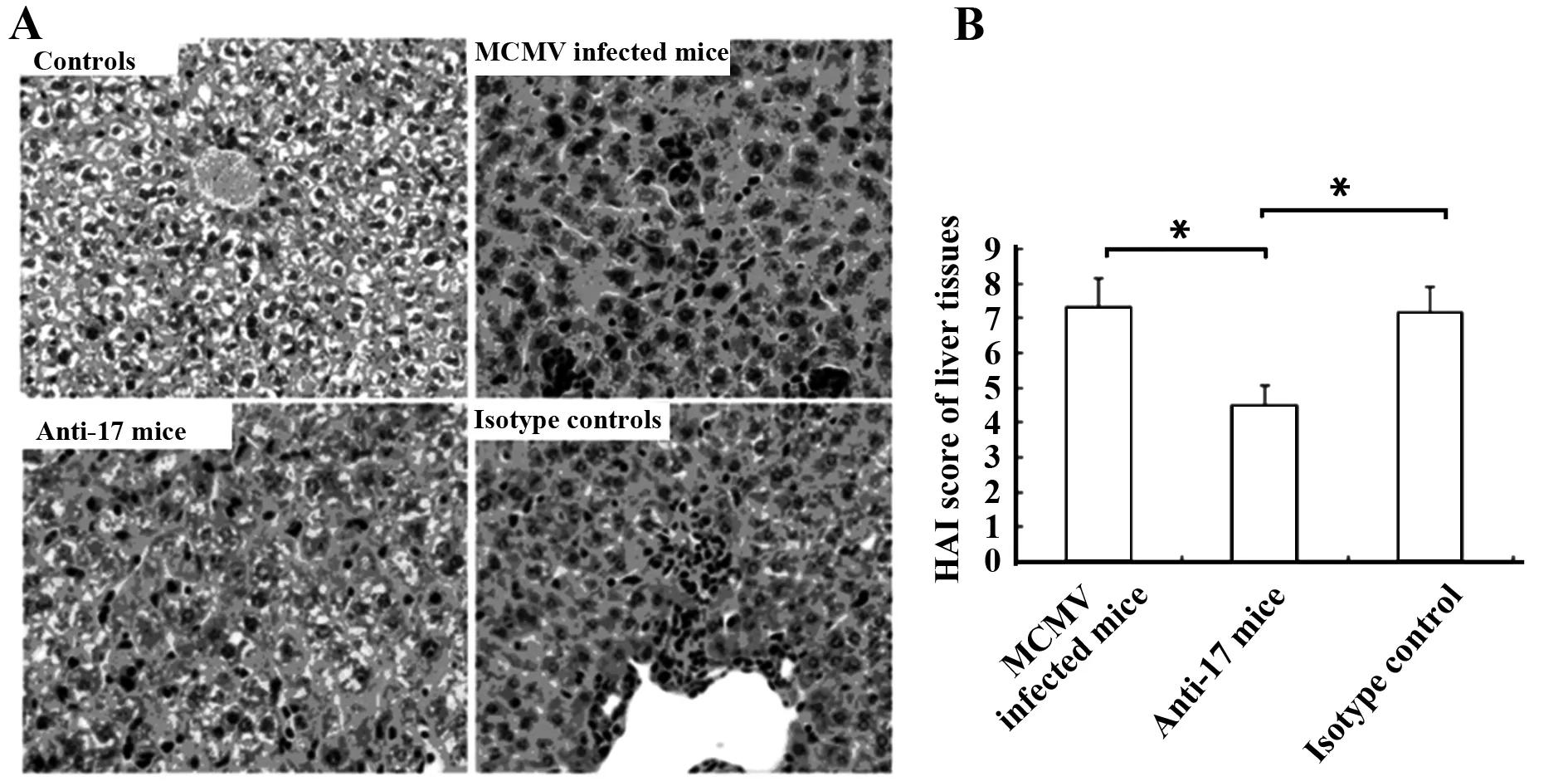
图3 IL- 17抗体阻断后各组肝组织病理性损伤评估(HAI评分)Fig.3 Blocking IL- 17 in vivo,pathological changes of liver in each group of mice(HAI scoring)Note: *.P<0.01.

图4 各实验组血清ALT水平测定Fig.4 Levels of ATL in serumNote: *.P<0.05.
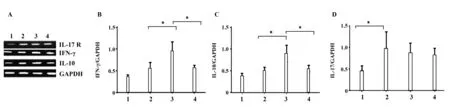
图5 阻断体内IL- 17后,肝脏组织中IL- 17R、IFN- γ及IL- 10的表达情况Fig.5 Blocked IL- 17 in vivo,expression of IL- 17 and IL- 17R mRNA in liver tissuesNote: *.P<0.05.1.Control;2.MCMV infected mice;3.Anti- 17 mice;4.Isotype control.
3 讨论
在人类肝脏疾病中,越来越多的证据间接显示IL- 17参与各种肝脏疾病的致病过程,包括酒精诱导的肝损伤、非酒精性脂肪性肝炎、肝细胞癌和原发性胆汁性肝硬化及肝移植术后的移植物排斥反应和自身免疫性肝炎[13,14],并在病毒性肝炎中发挥着关键作用[15]。IL- 17与受体结合后,作用于kupffer细胞、单核细胞、胆管上皮细胞及星形细胞,促进促炎因子及趋化因子分泌,诱导肝脏出现炎性细胞浸润[16,17]。我们在实验室前期研究中发现,在MCMV播散性感染小鼠,IL- 17表达明显增高,且肝内IL- 17高表达与肝脏病理损伤高峰期发生在同一时相,并呈明显相关,提示IL- 17参与MCMV感染所致肝组织免疫病理性损伤的过程。为了进一步验证IL- 17与MCMV肝损伤之间的关系,我们采用腹腔注射IL- 17抗体中和体内IL- 17进行干预。结果发现,IL- 17抗体阻断组肝组织内IL- 17表达明显减少,其肝组织损伤严重程度亦明显轻于MCMV感染组及同型抗体阻断组。表明IL- 17被中和以后,缓解了MCMV感染所致肝脏组织病理性损伤。同时我们实验显示病毒感染后IL- 17R水平升高,但中和体内的IL- 17后,其受体表达并未受到影响。有研究发现,在HSV- 1感染的角膜中,MIP- 2和MIP- 1α 是促进中性粒细胞募集最主要的炎性蛋白分子,在IL- 17R缺陷小鼠,由于中断了IL- 17信号通路,降低炎性蛋白分子的表达并减弱了其对中性粒细胞的募集功能[16,17]。在单纯疱疹病毒性角膜炎(Herpes simplex keratitis,HSK)患者,角膜中大量表达IL- 17,而且在培养的人类角膜基质纤维细胞(Human corneal stromal fibroblasts,HCF))中检测到IL- 17R mRNA[18]。这些实验说明IL- 17及其受体在病毒感染中发挥着重要的作用,但本实验结果也表明在阻断IL- 17表达后对其受体的表达并未受影响。Yoshimura[16]研究显示,在体内阻断IFN- γ与IL- 4表达后,体内IL- 17表达量明显增多,并引起实验性自身性免疫性葡萄膜炎(Murine experimental autoimmune uveoretinitis,EAU)的进一步恶化。Savarin等[19]研究发现,IFN- γ可在IL- 17介导的病毒性脑脊髓炎中发挥保护作用。我们实验结果显示阻断IL- 17表达后,IFN- γ的mRNA表达明显升高,我们推断IFN- γ可能在巨细胞病毒肝炎中同样发挥保护作用,Zhang等[20]研究也显示IL- 17的高表达可降低 IFN- γ 水平,与我们实验结果相仿,说明IL- 17与IFN- γ可以相互调节。 且多项研究显示,Treg细胞通过增强IL- 10的表达抑制Th17细胞所诱导的免疫病理性损伤,同时也能抑制Th17细胞所介导的免疫反应[18]。我们的实验结果显示,中和体内IL- 17后,肝脏组织内IL- 10 的表达量明显高于MCMV感染组及同型抗体阻断组(P<0.05),说明IL- 17与IL- 10之间也可以相互调节,由此通过阻断IL- 17的表达,从而增加体内IL- 10的表达量来降低组织的病理损伤。
MCMV感染的致病机制及感染结局与T细胞分泌细胞因子的功能及调节极为相关。IL- 17作为机体重要的炎性细胞因子在巨细胞病毒肝炎中发挥重要的作用,并且可以调节IFN- γ及IL- 10的表达,其在介导肝脏病理性损伤的同时,对巨细胞病毒肝炎也起到了免疫调节的作用。
[1] Landolfo S,Gariglio M,Gribaudo G,etal.The human cytomegalovirus[J].Pharmacol Ther,2003,98(3):269- 297.
[2] Fowler KB,Boppana SB.Congenital cytomegalovirus (CMV)infection and hearing deficit[J].J Clin Virol,2006,35(2):226- 231.
[3] Manicklal S,Emery VC,Lazzarotto T,etal.The "silent" global burden of congenital cytomegalovirus[J].Clin Microbiol Rev,2013,26(1): 86- 102.
[4] 马 雄,赵 丽.Th17细胞与肝脏疾病[J].国际消化杂志,2009,29(1):48- 51.
Zhao L,Ma X .Th17 cells and liver diseses[J].Int J Dig Dis,2009,29(1): 48- 51.
[5] 钟碧慧,晁 康,龚晓蓉,陈昱湖.细胞在肝脏疾病中的免疫病理作用[J].实用肝脏病杂志,2010,3(13):224- 227.
Yao k,Gong XR,Chen YH,etal.Immunopathogenesis of TH17 cells in liver diseases[J].J Clin Hepatol,2010,3(13): 224- 227.
[6] 徐 翼,方 峰,董永绥,等.小鼠巨细胞病毒全身播散型感染模型的建立[J].临床儿科杂志,2008,6(26):517- 520.
XU Y,Fang F,Dong YS,etal.Established murine cytomegalovirus disseminated infection model[J].J Clin Pediatr,2008,6(26): 517- 520.
[7] Xie Y,Chen R,Zhang X,etal.The role of Th17 cells and regulatory T cells in Coxsackievirus B3- induced myocarditis[J].Virology,2011,421(1):78- 84.
[8] Desmet VJ,Knodell RG,Ishak KG,etal.Formulation and application of a numerical scoring system for assessing histological activity in asymptomatic chronic active hepatitis [Hepatology 1981,1:431- 435][J].J Hepatol,2003,38(4):382- 386.
[9] Knodell RG,Ishak KG,Black WC,etal.Formulation and application of a numerical scoring system for assessing histological activity in asymptomatic chronic active hepatitis[J].Hepatology,1981,1(5):431- 435.
[10] Wang DD,Zhao YF,Wang GY,etal.IL- 17 potentiates neuronal injury induced by oxygen- glucose deprivation and affects neuronal IL- 17 receptor expression[J].J Neuroimmunol,2009,212(1- 2):17- 25.
[11] Zhang Q,Lei LS,Zhu ZG,etal.Ganoderma polysaccharides antagonize prostaglandin E2- induced suppression of murine splenocyte IFN- gamma and TNF- alpha mRNA expression[J].Nan Fang Yi Ke Da Xue Xue Bao,2006,26(6):780- 783.
[12] Zhou NM,Matthys P,Polacek C,etal.A competitive RT- PCR method for the quantitative analysis of cytokine mRNAs in mouse tissues[J].Cytokine,1997,9(3):212- 218.
[13] Molesworth- Kenyon SJ,Yin R,Oakes JE,etal.IL- 17 receptor signaling influences virus- induced corneal inflammation[J].J Leukoc Biol,2008,83(2):401- 408.
[14] Huang Z,van Velkinburgh JC,Ni B,etal.Pivotal roles of the interleukin- 23/T helper 17 cell axis in hepatitis B[J].Liver Int,2012,32(6):894- 901.
[15] Wang J,Liu Y,Xie L,etal.Association of IL- 17A and IL- 17F gene polymorphisms with chronic hepatitis Band hepatitis B virus- related liver cirrhosis in a Chinese population:A case- control study[J].Clin Res Hepatol Gastroenterol,2016,40(3):288- 296.
[16] Yoshimura T,Sonoda KH,Miyazaki Y,etal.Differential roles for IFN- gamma and IL- 17 in experimental autoimmune uveoretinitis[J].Int Immunol,2008,20(2):209- 214.
[17] Savarin C,Stohlman SA,Hinton DR,etal.IFN- gamma protects from lethal IL- 17 mediated viral encephalomyelitis independent of neutrophils[J].J Neuroinflammation,2012,9:104.
[18] Chaudhry A,Samstein RM,Treuting P,etal.Interleukin- 10 signaling in regulatory T cells is required for suppression of Th17 cell- mediated inflammation[J].Immunity,2011,34(4):566- 578.
[19] Savarin C,Stohlman SA,Hinton DR,etal.IFN- gamma protects from lethal IL- 17 mediated viral encephalomyelitis independent of neutrophils[J].J Neuroinflammation,2012,9:104.
[20] Zhang G,Zhou KF,Lu ZH.Interleukin- 17 enhances the removal of respiratory syncytial virus in mice by promotingneutrophil migration and reducing interferon- gamma expression[J].Genet Mol Res,2016,15(1):1- 8.