肺炎支原体荚膜多糖抑制树突状细胞吞噬和膜分子表达①
2018-01-24陈春艳刘紫玲陈列松曾燚华游晓星朱翠明
陈春艳 刘紫玲 余 斓 陈列松 曾燚华 游晓星 朱翠明
(南华大学病原生物学研究所,特殊病原体防控湖南省重点实验室,衡阳 421001)
肺炎支原体(Mycoplasma pneumoniae,Mp)是儿童呼吸道感染常见的病原体,主要引起支原体肺炎、气管炎、支气管炎等,并与哮喘的发病密切相关[1- 3]。Mp无细胞壁,其侵入机体后主要通过细胞膜上的脂质相关膜蛋白和菌体外的荚膜多糖(Capsular polysaccharides,CPS)与宿主细胞相互作用。目前国内外对Mp致病机制的研究主要集中在脂质相关膜蛋白[4- 6],对CPS的研究较少。在Mp感染致病的过程中,CPS除了抗吞噬和抵抗有害物质的损伤外,是否还有其他的功能?目前尚不清楚。
树突状细胞特异性细胞间黏附分子- 3- 结合非整合素分子(Dendritic cell- specific intercellular adhesion molecule- 3- grabbing nonintegrin,DC- SIGN)是一种模式识别受体和黏附受体,主要表达于树突状细胞(Dendritic cell,DC)表面。近年研究发现,许多病原菌,如肺炎链球菌、结核分枝杆菌、幽门螺杆菌、人类免疫缺陷病毒、利什曼原虫等均能与DC- SIGN结合,激活后续信号通路,使病原体逃避宿主的免疫防御,导致慢性持续性感染[7- 10]。
我们前期发现Mp 的CPS也是DC- SIGN的病原相关模式分子[11]。本实验拟初步研究CPS对DC吞噬功能和表达膜分子表达的影响。
1 材料与方法
1.1材料 Mp菌株(Strain M129,ATCC 29342)。CM403培养基(Oxoid);Phase Lock Gel Light购自天根生化科技有限公司;人淋巴细胞分离液购自天津TBD 公司;鼠抗DC- SIGN特异性抗体(Novus Biologicals);重组人GM- CSF和IL- 4(R&D)。APC- Mouse Anti- Human CD11c、PE Mouse Anti- Human CD80、PerCP- CyTM5.5 Mouse Anti- Human HLA- DR、APC Mouse Anti- Human CD83、FITC Mouse Anti- Human CD86均为BD公司产品。
1.2方法
1.2.1Mp CPS的提取 培养Mp M129菌株,4℃ 12 000 r/min离心20 min收集菌体。按文献[12]抽提CPS。方法如下:将1 L Mp离心后收集的沉淀用含10%葡萄糖的PBS洗涤2次后重悬于10 ml洗涤液中,加入等体积苯酚混匀,60℃孵育30 min,6 000 r/min离心30 min后移取水相和交界面,重复离心至液体澄清。将其透析过夜后在透析液中加入100 μg RNAase A和40 U DNAase Ⅰ、Ⅱ,37℃静置18 h。再加入5 g/L SDS和100 μl 蛋白酶K,45℃孵育 24 h。在透析液中加等体积的苯酚/氯仿混合物,混匀后移至含phase- lock gel的离心管离心,吸取水相,加入等体积氯仿后再次离心,取上清,用蒸馏水透析 4 d。在透析液中加入1/10体积的3 mol/L醋酸钠和4倍体积无水乙醇,离心弃上清,沉淀(即为抽提的CPS)用100 μl灭菌蒸馏水溶解,苯酚硫酸法定量,置-70℃保存备用。实验前用PBS稀释至相应浓度。
1.2.2外周血单核细胞来源的DC的培养 将20 ml 健康人静脉血用等量D- Hank′s液稀释。用密度梯度离心法分离人外周血单个核细胞,分离的细胞用RPMI1640完全培养基(含10%胎牛血清,2 mmol/L L- 谷氨酰胺,20 ng/ml重组人IL- 4,10 ng/ml 重组人GM- CSF)调整细胞数至1×106ml-1,将其加入皮氏培养皿,置CO2培养箱中37℃培养,隔天半量换液。培养至第6天后,将皮氏培养皿中细胞转移到细胞培养皿中培养过夜(以去除贴壁的巨噬细胞),收集培养7 d的细胞,调整细胞数至1×106ml-1,将其转至24孔板,每孔0.5 ml。细胞用吉姆萨染色后显微镜观察形态,并以APC mouse anti- Human CD11c抗体染色,FCM检测DC纯度。
1.2.3iDC吞噬功能检测 实验共分四组:①15 μg/ml CPS刺激培养7 d的DC;②15 μg/ml CPS 刺激DC- SIGN单抗(1∶100)预处理30 min后的DC;③DC- SIGN单抗(1∶100)刺激的DC;④PBS处理的DC。分组刺激DC 24 h,1 000 r/min离心10 min 收集细胞,PBS洗涤2次。用1 ml含5%胎牛血清的PBS重悬细胞,加入终浓度为1 mg/ml的FITC- 多聚糖,37℃孵育30 min。细胞用预冷的FACS缓冲液洗涤2次,FCM检测荧光强度。
1.2.4DC表面膜分子检测 实验分组和处理同1.2.3。24 h后收集细胞,用预冷的FACS缓冲液洗涤2次。分装,每管100 μl。用流式抗体APC- CD83、PerCR- cy5.5- HLA- DR、PE- CD80和FITC- CD86及其相对应的同型抗体染色,4℃孵育30 min。用预冷的FACS缓冲液1 200 r/min离心5 min洗涤细胞,重复2次。弃上清,每管加入300 μl FACS缓冲液,FCM检测DC表面膜分子的表达。

2 结果
2.1树突状细胞的培养及鉴定 DC细胞培养7 d后,大部分呈克隆集落状,可见树突状突起(图1)。FCM检测分离培养出的DC表面CD11c分子的阳性率为86.27%。
2.2CPS对DC吞噬功能的影响 用CPS刺激DC,FCM分析DC吞噬的FITC- 多聚糖平均荧光强度,检测DC的吞噬功能。结果显示CPS刺激组DC 较对照组DC吞噬的FITC- 多聚糖平均荧光强度显著增加(P<0.05)。若用DC- SIGN单抗预先封闭30 min,再用CPS刺激DC,细胞内FITC- 多聚糖平均荧光强度较DC- SIGN未封闭组DC显著降低(P<0.05),且与对照组DC差异无统计学意义(P>0.05),见图2、3。
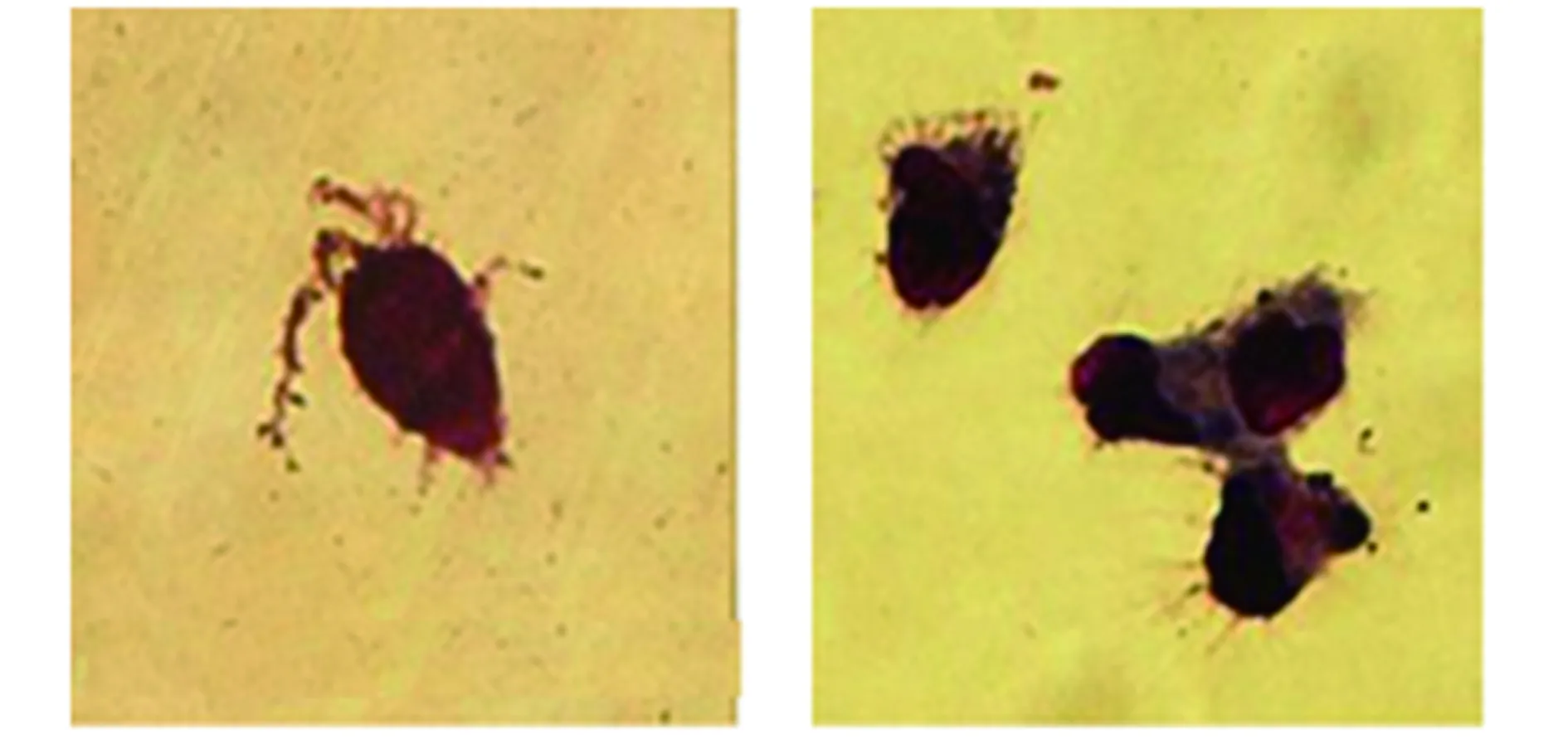
图1 人外周血PBMC来源的DC吉姆萨染色观察(×400)Fig.1 Dendritic cells derived from human peripheral blood mononuclear cells(Giemsa staining,×400)
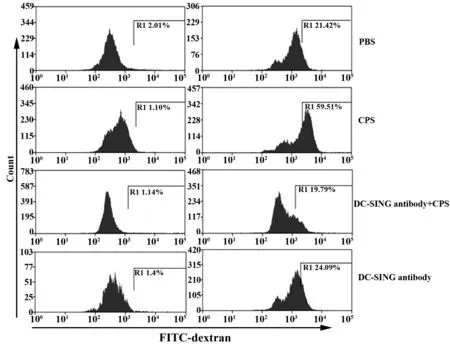
图2 不同处理组DC吞噬能力的流式检测结果Fig.2 FCM detect phagocytosis of DC under differ- ent treatments
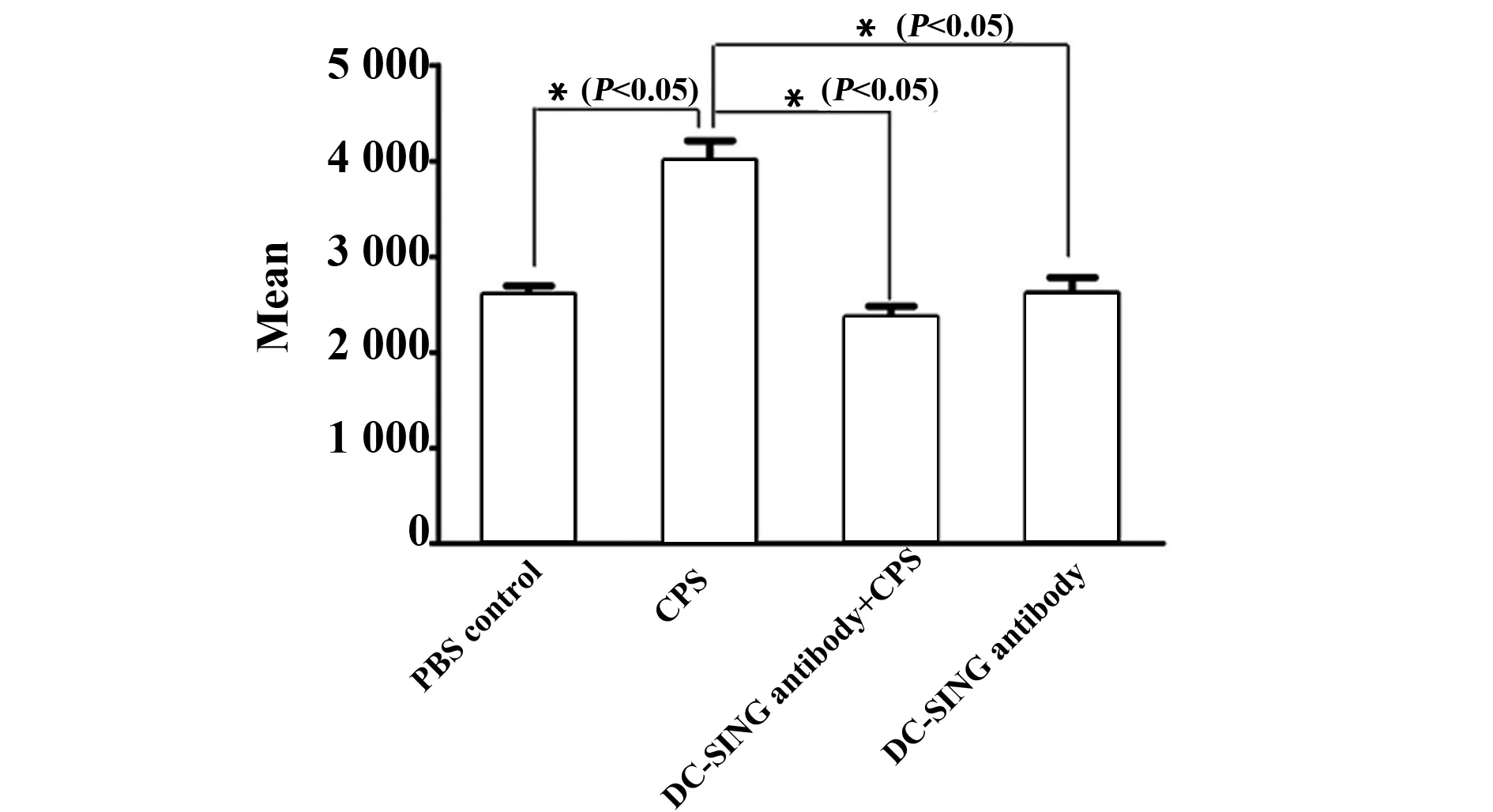
图3 不同处理组DC吞噬FITC- 多聚糖的荧光平均值(n=3)Fig.3 Fluorescence means of FITC- dextran uptake by DC with different treatments(n=3)
2.3CPS刺激对DC表面膜分子的影响 培养7 d的DC用CPS刺激,FCM检测DC表面膜分子CD83、HLA- DR、CD80和CD86表达水平变化,结果发现与对照理组DC相比,CPS刺激组DC表面四种膜分子阳性百分率均显著下降(P<0.05)。用DC- SIGN封闭抗体预先处理后,再用CPS刺激DC,其表面四种膜分子的表达较CPS处理组DC显著降低(P<0.05),与PBS处理组差异无统计学意义(P>0.05),见图4、5。

图4 FCM分析不同处理组DC 四种膜表面分子表达Fig.4 FCM analyzed expression of CD83,HLA- DR,CD80 and CD86 on different treated DC
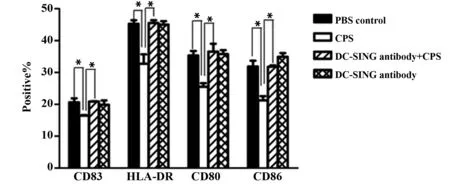
图5 不同处理组四种膜表面分子的表达(n=3)Fig.5 Expression of CD83,HLA- DR,CD80 and CD86 on different treated DC(n=3)Note: *.P<0.05.
3 讨论
DC 是功能最强的专职性抗原提呈细胞,表达多种膜分子,其中CD83是DC标志性分子,主要表达于成熟DC;HLA- DR属HLA- Ⅱ类分子,可辅助DC提呈抗原;CD80(B7- 1)和CD86(B7- 2)是DC细胞活化的协同刺激分子,作为第二信使激活初始T细胞。未成熟DC主要分布在机体器官及非淋巴组织的上皮中,其Fc和甘露糖受体表达水平高,而HLA- Ⅱ类分子和协同刺激分子表达水平低,故未成熟DC摄取抗原的能力强,提呈抗原的能力弱;受抗原等刺激后,DC逐渐分化成熟,成熟DC表面CD83、MHCⅡ类分子、协同刺激分子等的表达显著增高,而Fc受体等表达减少,故而成熟DC摄取抗原的能力降低,但提呈抗原的能力增强[13- 15]。
我们的实验发现用CPS刺激DC后,其吞噬功能显著增强,但CD83、HLA- DR、CD80和CD86的表达水平降低,这表明CPS可抑制体外培养DC的自然成熟。用单抗预先封闭DC- SIGN后再用CPS刺激DC,其吞噬功能和四种膜分子的表达水平与对照组相比无显著改变,这些结果说明,CPS抑制DC成熟是通过结合DC- SIGN发挥作用。
Mp是一种胞外寄生菌,其感染机体后,黏附在呼吸道上皮细胞表面生长繁殖,产生毒性代谢产物致病。但研究显示,Mp亦可通过其顶端结构侵入宿主细胞,在细胞内合成DNA并生长繁殖,并能在感染宿主细胞内长期存活,引起慢性持续性感染[16,17],其胞内兼性寄生机制目前尚不完全清楚。本实验发现CPS通过DC- SIGN可抑制DC成熟,从而抑制DC将Mp抗原提呈给初始T细胞,减弱特异性免疫应答。此外Mp的CPS与DC- SIGN结合可促进IL- 10的分泌,故CPS激活的DC- SIGN信号通路可能与Mp在机体内的持续性感染有关[11]。
有趣的是,我们发现Mp的脂质相关膜蛋白与DC表面的Toll样受体结合后,能促进其表达CD83、HLA- DR、CD80和CD86分子[18]。DC- SIGN和Toll样受体两条通路之间存在串话[19- 20],Mp CPS激活的DC- SIGN信号通路和脂质相关膜蛋白激活的Toll样受体通路之间是否也存在串话?还有待于进一步研究。
[1] Waites KB,Talkington DF.Mycoplasma pneumoniae and its role as a human pathogen [J].Clin Microbiol Rev,2004,17(4):697- 728.
[2] Parrott GL,Kinjo T,Fujita J.A compendium for mycoplasma pneumonia [J].Front Microbiol,2016,7(7):513- 528.
[3] Chaabane N,Coupez E,Buscot M,etal.Acute respiratory distress syndrome related to Mycoplasma pneumoniae infection [J].Respiratory Med Case Reports,2016,20(20):89- 91 .
[4] Shimizu T,Kida Y,Kuwano K.Mycoplasma pneumoniae- derived lipopeptides induce acute inflammatory responses in the lungs of mice [J].Infect Immun,2008,76(1):270- 277.
[5] Shimizu T,Kida Y,Kuwano K.A dipalmitoylated lipoprotein from Mycoplasma pneumoniae activates NF- kappa B through TLR1,TLR2,and TLR6 [J].J Immunol,2005,175(7):4641- 4646.
[6] Hu J,Chen C,Ou G,etal.Nrf2 regulates the inflammatory response,including heme oxygenase- 1 induction,by Mycoplasma pneumoniae lipid- associated membrane proteins in THP- 1 cells [J].Pathog Dis,2017,75(4):1- 7.
[7] Park JY,Choi HJ,Prabagar MG,etal.The C- type lectin CD209b is expressed on microglia and it mediates the uptake of capsular polysaccharides of Streptococcus pneumonia [J].Neurosci Lett,2009,450(3):246- 251.
[8] Srivastava V,Vashishta M,Gupta S,etal.Suppressors of cytokine signaling inhibit effector T cell responses during Mycobacterium tuberculosis infection [J].Immunol Cell Biol, 2011,89(7):786- 791.
[9] Di Gianvincenzo P,Chiodo F,Marradi M,etal.Gold manno- glyconanoparticles for intervening in HIV gp120 carbohydrate- mediated processes [J].Methods Enzymol,2012,509(509):21- 40.
[10] Gringhuis SI,den Dunnen J,Litjens M,etal.Carbohydrate- specific signaling through the DC- SIGN signalosome tailors immunity to Mycobacterium tuberculosis,HIV- 1 and Helicobacter pylori [J].Nat Immunol,2009,10(10):1081- 1088.
[11] 刘紫玲,游晓星,彭志平,等.肺炎支原体荚膜多糖与DC- SIGN结合并促进IL- 10的分泌 [J].细胞与分子免疫学杂志,2013,29(1):10- 13.
Liu ZL,You XX,Peng ZP,etal.Mycoplasma pneumoniae capsular polysaccharides bind to DC- SIGN and promotethe secretion of IL- 10[J].Chin J Cell Mol Immunol,2013,29(1):10- 13.
[12] Waite ER,March JB.Capsular polysaccharide conjugate vaccines against contagious bovine pleuropneumonia:Immune responses and protection in mice [J].J Comp Pathol,2002,126(2- 3):171- 182.
[13] 刘剑雯,曾志勇,陈君敏.人外周血耐受性树突状细胞的诱导培养及其DC- STAMP的表达研究[J].中国免疫学杂志,2013,29(5):474- 480.
Liu JW,Zeng ZY,Chen JM.Induction culture of tolerogenic dendritic cells from human peripheralblood and their DC- STAMP expression[J].Chin J Immunol,2013,29(5):474- 480.
[14] Park J,Babensee JE.Differential functional effects of biomaterials on dendritic cell maturation [J].Acta Biomater,2012,8(10):3606- 3617.
[15] Collin M,McGovern N,Haniffa M.Human dendritic cell subsets [J].Immunology,2013,140(1):22- 30.
[16] Hubo M,Trinschek B,Kryczanowsky F,etal.Costimulatory molecules on immunogenic versus tolerogenic human dendritic cells [J].Front Immunol,2013,4(4):82- 82.
[17] Yavlovich A,Tarshis M,Rottem S.Internalization and intracellular survival of Mycoplasma pneumoniae by non- phagocytic cells [J].FEMS Microbiol Lett,2004,233(2):241- 246.
[18] Dallo SF,Baseman JB.Intracellular DNA replication and long- term survival of pathogenic mycoplasmas [J].Microb Pathog,2000,29(5):301- 309.
[19] 欧广利,刘紫玲,谭田平,等.肺炎支原体脂质相关膜蛋白促进树突状细胞成熟 [J].细胞与分子免疫学杂志,2015,31(7):941- 944.
Ou GL,Liu ZL,Tan TP,etal.Lipid- associated membrane proteins of mycoplasma pneumoniae promotedendritic cells to mature[J].Chin J Cell Mol Immunol,2015,31(7):941- 944.
[20] Caparrós E,Serrano D,Puig- Kröger A,etal.Role of the C- type lectins DC- SIGN and L- SIGN in Leishmania interaction with host phagocytes [J].Immunobiology,2005,210(2- 4):185- 193.
[21] Keller CW,Freigang S,Lünemann JD.Reciprocal crosstalk between dendritic cells and natural killer T cells:mechanisms and therapeutic potential [J].Front Immunol,2017,8(8):570- 570.