抗原致敏的DC-CTL细胞对肝癌干细胞杀伤作用的实验研究
2018-01-23张颖宏王宏竹盛春华
贾 硕,孙 艳,张颖宏,王宏竹,盛春华*
(1.解放军第208医院细胞治疗中心,吉林 长春130062;2.中南大学湘雅二医院,湖南 长沙410011;3.吉林大学第二医院 肿瘤血液科,吉林 长春130000)
原发性肝癌是我国常见恶性肿瘤之一,发病率位居恶性肿瘤第四位,病死率居第二位,号称“癌中之王”,具有发病隐匿、易转移复发及预后差等特征[1]。研究证实,肿瘤的发生、发展、治疗耐药和容易复发转移的根本原因在于患者体内存在肿瘤干细胞(Cancer stem cells,CSCs)[2]。肿瘤干细胞虽然数量很少,但很难杀灭,常规放化疗只能去除肿瘤组织中大多数增殖细胞,不能去除肿瘤干细胞[3]。在杀灭大部分普通肿瘤细胞后(手术、放疗、化疗后),再予以肿瘤干细胞的靶向治疗,将可能是肿瘤治疗的新方案。肝癌手术后,残存在血液、淋巴循环及组织中的肝癌干细胞是复发和转移的根源[4]。CD133是目前比较明确的肝癌干细胞的表面标志[5],本研究筛选CD133+肝癌干细胞,以肝癌干细胞为靶点,体外诱导扩增DC和CTL细胞,研究肝癌干细胞抗原致敏的DC-CTL细胞对肝癌干细胞的杀伤作用,为肝癌干细胞的临床靶向治疗奠定实验基础。
1 材料与方法
1.1材料
GTT-551、DMEM细胞培养基、人AB血清(Gibco公司);细胞因子IL-2、IFN-γ、IL-1α、IL-4、GM-CSF、TNF-α(美国Peprotech公司);抗人CD3单克隆抗体、CD8单克隆抗体、小鼠抗人单克隆抗体CD133-PE(美国BD公司);ClinicMacs流式细胞仪(美国Beckman Coulter公司),酶标仪、全自动磁性细胞分选仪(德国Miltenyi公司)。
1.2肝癌干细胞的分选
明确诊断肝细胞性肝癌患者手术后取肝癌组织,用生理盐水加入庆大霉素(100 u/ml)清洗,剪切组织块,加入胰蛋白酶液置于37℃孵箱中消化,并间断用搅拌棒搅拌,消化4小时,用200目滤筛过滤,重新制备成单细胞悬液,加生理盐水离心800 rpm 10分钟,2次,应用高糖DMEM培养基加8%人AB血清接种于6孔板中,密度2×106/ml。严格应用磁珠分选系统说明书进行细胞分选操作。制备肝癌单细胞悬液,与CD133抗体磁珠进行交联后过分离柱进行分选,收集CD133+细胞,制备成肝癌干细胞单细胞悬液备用。
1.3流式细胞技术测定肝癌干细胞
取分选前的肝癌细胞悬液和分选后的CD133+细胞悬液,分别加入2 ml圆底离心管中,离心1 500 rpm,5 min,弃上清液。加入PBS 1 ml离心洗涤1次,弃上清。调整细胞浓度,加入Fc受体封闭剂,4℃避光反应10 min。离心,弃上清液。用PBS 1 ml洗涤1次,离心。分别加入CD133-PE抗体,将上述2份细胞放在冰盒里避光孵育30 min,用1 ml含体积分数10%胎牛血清PBS洗涤2次,应用流式细胞仪分析测定CD133+细胞。
1.4肝癌干细胞和肝癌细胞抗原的获得
分别收集肝癌干细胞和肝癌细胞,用PBS调整密度为5×106/ml,细胞被反复冻融(-196℃度至37℃),循环4次。细胞裂解物经12 000 rpm离心5分钟,取上清经滤器除菌后按Bradford蛋白浓度测定试剂盒说明书所示方法测量、计算抗原的蛋白浓度,分别分装后-70℃冻存备用。
1.5分别培养肝癌干细胞和肝癌细胞抗原致敏的DC-CTL细胞
1.5.1外周血单个核细胞分别诱导扩增DC和CIK细胞:肝癌患者(与上文获得肝癌干细胞为同一患者)手术1个月后,应用血液成分分离机进行单个核细胞单采,经Ficoll淋巴细胞分离液从单个核细胞分离淋巴细胞。用GTT-551培养基洗涤2次,用GTT-551培养基加入6%人AB血清混悬于培养瓶中,置37℃、5%CO2孵育箱中,2 h后将悬浮细胞移出进行CIK培养,贴壁细胞进行DC培养。
1.5.2肝癌干细胞和肝癌细胞抗原致敏的DC细胞培养:贴壁细胞加入IL-4(500 U/ml),GM-CSF(1 000 U/ml)培养,每隔2-3天换液1次,第6天分别加入肝癌干细胞和肝癌细胞抗原100 μg/ml,第7天加入TNF-α(500 U/ml)诱导DC成熟,第9天分别收获成熟DC细胞。
1.5.3CIK细胞培养:悬浮淋巴细胞加入重组人IFN-r(1 000 U/ml)和10%AB型人血清的GTT-551培养液,24 h后更换成含100 ng/ml小鼠抗人CD3单克隆抗体、IL-1α(1 000 U/ml)和 IL-2(500 U/ml)的完全培养液继续培养,2天后换含IL-2(500 U/ml)的完全培养液隔日换液维持培养9天。
1.5.4分选CTL细胞 参照ClincMacs使用说明,加入CD3、CD8抗体磁珠,应用CliniMacs流式细胞仪从诱导扩增的CIK细胞中分选出CD3+CD8+T淋巴细胞。
1.5.5抗原致敏后的DC与CTL细胞共培养,获得DC-CTL细胞:细胞培养第9天,分别取肝癌干细胞和肝癌细胞抗原致敏后的DC细胞,经活细胞计数后,按1∶5比例分别与CD3+CD8+T细胞混合培养,每2天加入IL-2(500 U/ml)半量换液,5天后收集,获得分别CTL细胞。细胞质量控制标准:细胞存活率≥95%,不含细菌、病毒和内毒素等微生物。
1.6MTT法检测不同抗原致敏的DC-CTL对肝癌干细胞的杀伤作用
取状态良好的肝癌干细胞,调整细胞密度分别为5 ×104/mL,接种于96 孔板,100 μL/孔,置于37℃、5% CO2孵育箱中培养过夜至靶细胞贴壁。分别取肝癌干细胞抗原致敏的DC-CTL细胞(实验组)、肝癌细胞抗原致敏的DC-CTL细胞(阳性对照组)和无抗原致敏的DC-CTL细胞(空白对照组),按照效靶比5∶1、10∶1 和20∶1 的细胞比例接种于铺有靶细胞的96 孔板,100 μL/孔,每组设10 个平行复孔,培养24 h。然后每孔加入MTT( 5 mg /mL) 10 μL,继续培养4 h,离心去上清,每孔加入200 μL DMSO,震荡10 min,用酶标仪在检测波长490 nm 测定吸光度( A) 值,每组取5 个平行复孔计算平均A值,按公式计算杀伤率。杀伤率= [1-(A实验组-A效应细胞对照组) /( A靶细胞对照组-A空白组) ]× 100%。

2 结果
2.1流式细胞技术测定肝癌干细胞
CD133表达达到98.4%,说明分选成功,得到的细胞基本为具有CD133+标志的肝癌干细胞,结果见图1。

注:左图显示分选前,CD133表达率为3.8%;右图显示分选后,CD133表达率为98.4%。
2.2抗原致敏DC细胞培养
DC细胞培养至第9天在显微镜下观察,DC细胞呈圆形,贴壁生长,表面有树突状突起。应用流式细胞技术测定DC细胞表面标志,说明为成熟DC,见图2。
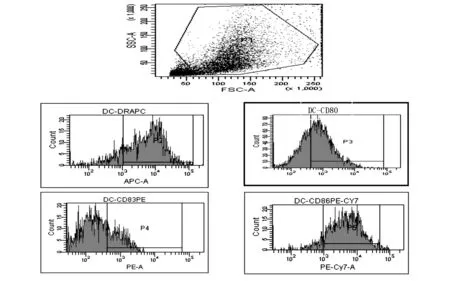
注:成熟DC细胞表面标志HLA-DR+表达率为85%,CD80+表达率为72%, CD83+表达率为45.2%,CD86+表达率为95.1%。
2.3CIK(cytokine-inducedkillercells)细胞培养
流式细胞术测定细胞诱导扩增前CD3+CD8+细胞含量约为48%,见图3;细胞诱导扩增9天,CIK细胞中CD3+CD8+含量约达90%,见图4。并且细胞总数量随诱导时间大幅扩增,第9天扩增100余倍,见表1。

注:辅助性T细胞(CD3+CD4+,Th)表达率为39%,杀伤性T细胞(CD3+CD8+,CTL)表达率为48%。

注:辅助性T细胞(CD3+CD4+,Th)表达率为7%,杀伤性T细胞(CD3+CD8+,CTL)表达率为90%,自然杀伤性T细胞(CD3+CD56+,NKT)表达率为30%。
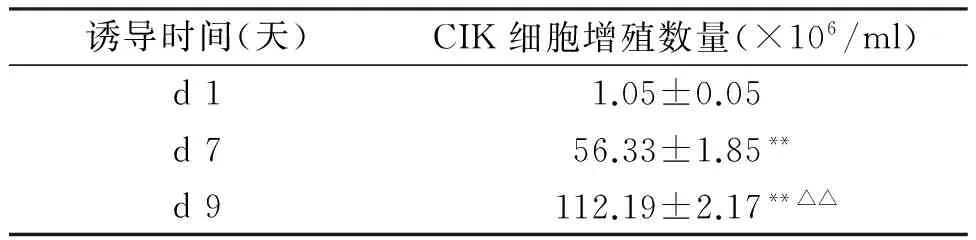
图4 细胞诱导扩增后
2.4MTT实验结果
实验组(肝癌干细胞抗原致敏组)与阳性对照组(肝癌细胞抗原致敏组)及空白对照组(无抗原致敏组)相比,效应细胞对肝癌干细胞的杀伤作用均具有极显著性差异;且随不同效靶比效应细胞的增加,其杀伤作用显著增强(见表2)。说明肝癌干细胞抗原致敏的DC-CTL细胞对肝癌干细胞具有极强的杀伤作用,且此杀伤作用随效应细胞数量的增加而增强。

表2 抗原致敏的DC-CTL杀伤肝癌干细胞作用效应
3 讨论
我国是肝癌高发区,肝癌患者生存期短,死亡率高,即使预后较好的小肝癌,术后也有超过70%的患者在2年内发生肿瘤复发或远处转移,而高达90%以上的肝癌术后死亡因素与转移复发有关。原发性肝癌术后复发转移是患者最终死亡的主要原因,而肝癌干细胞的残存和逃脱免疫系统监视清除是复发转移的根源。人体抗肿瘤免疫主要为细胞免疫,主要是T淋巴细胞介导的细胞免疫中CD3+CD8+T细胞即细胞毒性T细胞(CTL)发挥识别和杀伤肿瘤细胞的作用。而DC是人体内功能最强大的抗原呈递细胞,能有效激活初始T细胞,诱导出抗原特异性CTL,使机体产生抗肿瘤免疫反应。抗原致敏后DC细胞的增殖活性和对抗原的识别作用均增强[6],与CTL共培养后,细胞间的相互作用能促进二者的成熟和增殖,使CTL的抗瘤效应增强[7],增加DC和共刺激分子递呈抗原的特异性,促进DC分泌IL-2[8]。
本研究根据肝癌干细胞特异性表面标志CD133分子,从肝癌组织中筛选出肝癌干细胞,制备抗原。同时从病人外周血中分离单个核细胞,体外分别诱导、扩增人肝癌干细胞抗原致敏的树突状细胞(DC)和细胞因子诱导的杀伤细胞(CIK),并进一步从CIK细胞中分选出CTL细胞。CIK细胞是人体外周血单个核细胞在体外用多种细胞因子诱导而获得的一种多克隆性T细胞[9],增殖能力强,短期培养后即可达到抗肿瘤效应细胞的数量。CIK细胞对肿瘤细胞的毒性是非MHC限制的,并且对肿瘤干细胞也具有细胞毒性[10]。CIK细胞中富含大量的毒性T淋巴细胞(CTL)。本课题组通过临床应用级别的ClinicMacs流式细胞仪从CIK细胞中分选出CD3+CD8+的CTL细胞;将肝癌干细胞抗原致敏后的DC细胞与CTL细胞共培养,产生大量具有抗原特异性杀伤功能的CTL细胞。肝癌患者由于免疫耐受等原因,肿瘤免疫原性差,不能有效提呈给DC细胞,导致机体难以产生针对性的CD3+CD8+T细胞。本课题组采取体外诱导扩增DC和CTL的方式,流式细胞术测定结果显示细胞分类和增殖情况均可以满足实验和治疗需要。
本研究结果显示,肝癌干细胞抗原致敏后的DC-CTL细胞对肝癌干细胞具有很强的杀伤作用,且随效应细胞数量的增加杀伤作用亦增强,为进一步开展临床实验研究提供理论依据。
[1]马俊明,雷鹏,王琦.人肝癌组织中肝癌干细胞的分离培养与初步鉴定[J].宁夏医科大学学报,2015,37(8):917.
[2]张文锋,冯 凯.肿瘤异质性:肝癌干细胞有序的分化潜能[J].检验医学与临床,2014,11(21):3067.
[3]李广权,陈伟强.肝癌干细胞的研究现状[J].医学综述,2013,19(3):457.
[4]职晓松,訾晓渊,胡以平.基于肝癌干细胞的肝癌生物学研究进展[J].遵义医学院学报,2015,38(3):209.
[5]Suetsugu A,Nagaki M,Aoki H,et al.Characterization of CD133+hepatocellular carcinoma cells as cancer stem/progenitor cells[J].Biochem Biophys Res Commun,2006,351(4):820.
[6]刘 畅,王士勇,焦 雪,等.抗原致敏的DC-CIK对前列腺癌细胞DC145杀伤作用[J].解剖科学进展,2012,18(3):222.
[7]韩秀蕊,杨娣娣,赵 园,等.树突状细胞介导CIK细胞抗恶性肿瘤效应的实验研究[J].现代检验医学杂质,2014,29(3):44.
[8]王 凤,田复明,窦长武.DC-CIK细胞抗肿瘤的研究进展[J].内蒙古医学杂质,2013,45(4):435.
[9]祁秋干,纪 娜,王远东.CIK细胞连用树突状细胞治疗恶性肿瘤的进展[J].中国现代药物应用,2015,9(12):265.
[10]陈 娟,卢光琇.CIK细胞的生物特性和应用研究新进展[J].肿瘤药学,2014,4(3):166.
