CCR6、Th9细胞、Th17/Treg细胞失衡在大鼠肺纤维化中的表达及意义
2018-01-23李树民鲍文华赵艳景马雪梅杨晓东梁姗姗
李树民,鲍文华,赵艳景,马雪梅,杨晓东,梁姗姗
(佳木斯大学附属第一医院,黑龙江 佳木斯154002)
肺纤维化(pulmonary fibrosis,PF)是一种病因复杂,发病机制尚不十分明确的肺部间质性疾病,近年来发病率、死亡率均逐年增高。其主要病理改变呈现为弥漫性肺泡炎及肺成纤维细胞灶形成、细胞外基质过度沉积[1]。前期试验中针对CCR6-CCL20轴、Th9细胞相关因子与肺纤维化发生机制的关系已有所研究[2,3],而近年来有关Th17/Treg失衡的研究备受关注。相关文献[4]指出自身免疫性疾病发生的重要原因之一为Th17/Treg比例失衡,Th17 与Treg之间保持动态平衡对于机体内环境的维持意义重大。本研究拟通过建立大鼠肺纤维化模型,观察CCR6、Th9相关因子及Th17/Treg失衡在大鼠肺纤维化模型的肺组织中变化特点,探究CCR6、Th9相关因子和Th17/Treg比例失衡与肺纤维化发病机制的关系和意义,为临床治疗肺纤维化提供理论依据。
1 材料与方法
1.1实验动物与试剂63只SD大鼠(健康雄性清洁级),体重约( 220±30) g,购买于大连医科大学实验动物中心,清洁级标准饲养(合格证号:scxle(黑) 2013007);盐酸博来霉素(美国Invitrogen公司);地塞米松注射液(购置于辉瑞制药有限公司);10%水合氯醛、乙醇、蒸馏水等(天津化学试剂三厂生产);Anti-CCR6 antibody一抗、SP二抗(美国abcam公司);IL-9抗体(Abcam公司提供); PE-Cy5 anti-Rat CD4(大鼠抗小鼠 CD4单克隆流式抗体,美国BDP harmingen);PE anti-mouse IL-17及同型对照(大鼠抗小鼠 IL-17单克隆抗体,美国 BDPharmingen );PE anti-rat Foxp3(大鼠抗小鼠Foxp3 单克隆抗体)及同型对照(美国ebioscience);Cat15596-026(Invitrogen);Trizol溶液,DNA纯化试剂盒:引物(TaKaRa合成);逆转录试剂盒(Cat K1622 购自Fermentas公司);RT-PCR试剂盒、Trizol试剂、SYBR Green荧光定量 PCR试剂盒( Hai Gene);DAB显色试剂盒(中杉金桥)。
1.2动物分组按随机数字表将63只雄性SD大鼠分为三组:生理盐水对照组(N组)、肺纤维化模型组(F组)、地塞米松治疗组(D组),每组各21只。
1.3制作模型及标本采集以10%水合氯醛溶液(0.30 ml/100 g)腹腔注射麻醉,将大鼠以仰卧姿势固定在鼠板上后,颈部备皮消毒,沿正中线剪开颈部皮肤,分离组织充分暴露气管,F、D组快速推入BLM(0.50 mg/100 g)于大鼠气管分叉处,N组注入同体积等渗生理盐水。然后将大鼠直立,以及迅速顺逆时针旋转鼠板,皮肤缝合,清洁级饲养。从第2 d开始,D组大鼠每日给予腹腔内注射地塞米松( 0.3 mg/100 g),N、F组注入同体积生理盐水。分别在造模后第 7、14及28 d,采用随机方式从三组大鼠中各抽取7只,处死后留取肺组织。
1.4肺组织病理改变对留取的各组肺组织行HE染色,观察肺组织炎症程度及纤维化程度变化。
1.5检测肺组织CCR6、IL-9表达水平采用免疫组化法检测各组肺组织CCR6、IL-9表达水平,肺组织胞质中出现棕黄色颗粒提示切片阳性结果;胞质中无棕黄色反应物提示阴性结果(细胞核染色为蓝色)。据Hwang I等学者[5]研究标准,400倍显微镜下取景,使用image proplus系统( 细胞图像分析) 方法对阳性结果的平均灰度值行数值评分。
1.6检测PU.1mRNA离心BALF,留取沉淀,Trizol法提取RNA,逆转录为cDNA,荧光PCR法检测PU.1mRNA表达水平,引物序列:PU.1:(上游)5′-TGCTTCCCTTATCCACCCTTG-3′(下游) 5′-TCTTCTTGCTGCCTGTCTCC-3′;GAPDH:(上游)5′-AACTCCCATTCTTCCACCTTT-3 ′(下游)5 ′-CTCTTGCTCTCAGTATCCTTG -3′。
1.7肺组织Th17、Treg细胞表达检测采用流式细胞术方法检查分析肺组织Th17、Treg细胞表达情况。
2 结果
2.1显微镜下观察HE染色肺组织病理改变N 组大鼠呈现正常肺泡及肺间质结构,无炎症细胞及纤维蛋白沉积。F组、D组镜下病理改变基本相似,与N组对比,B组大鼠第7 d肺组织出现显著炎症细胞浸润,如中性粒细胞、单核巨噬细胞等,肺间质充血、水肿,成纤维细胞计数增多;第14 d、第21 d肺组织炎症逐渐吸收,成纤维细胞逐渐增多,胶原纤维逐渐增生、沉积,肺泡间隔逐渐增宽,肺泡逐渐萎缩、消失。但无论是肺组织炎症浸润程度,还是纤维蛋白沉积程度,同一时间点,D组较F组肺组织病变严重程度有所减轻。
2.2检测各组大鼠肺组织中CCR6、Th9相关因子、Th17及Treg细胞表达水平
与N组相比,F、D组各时间点检测指标CCR6、PU.1mRNA、IL-9蛋白质含量、Th17细胞百分率结果明显增高(P<0.05),具有统计学意义。检测结果于第 7 d时达到最高值,第14 d、第28 d呈现逐渐降低趋势,但总体上仍高于N组。D组、F 组两组变化趋势相似,但D组检测结果低于同时间点F组值、明显高于N组值,差异存在统计学意义(P<0.05)。F、D组各时间点Treg细胞百分比与N组相比结果降低(P<0.05),有统计学意义,并且结果呈现逐渐降低。见表1。
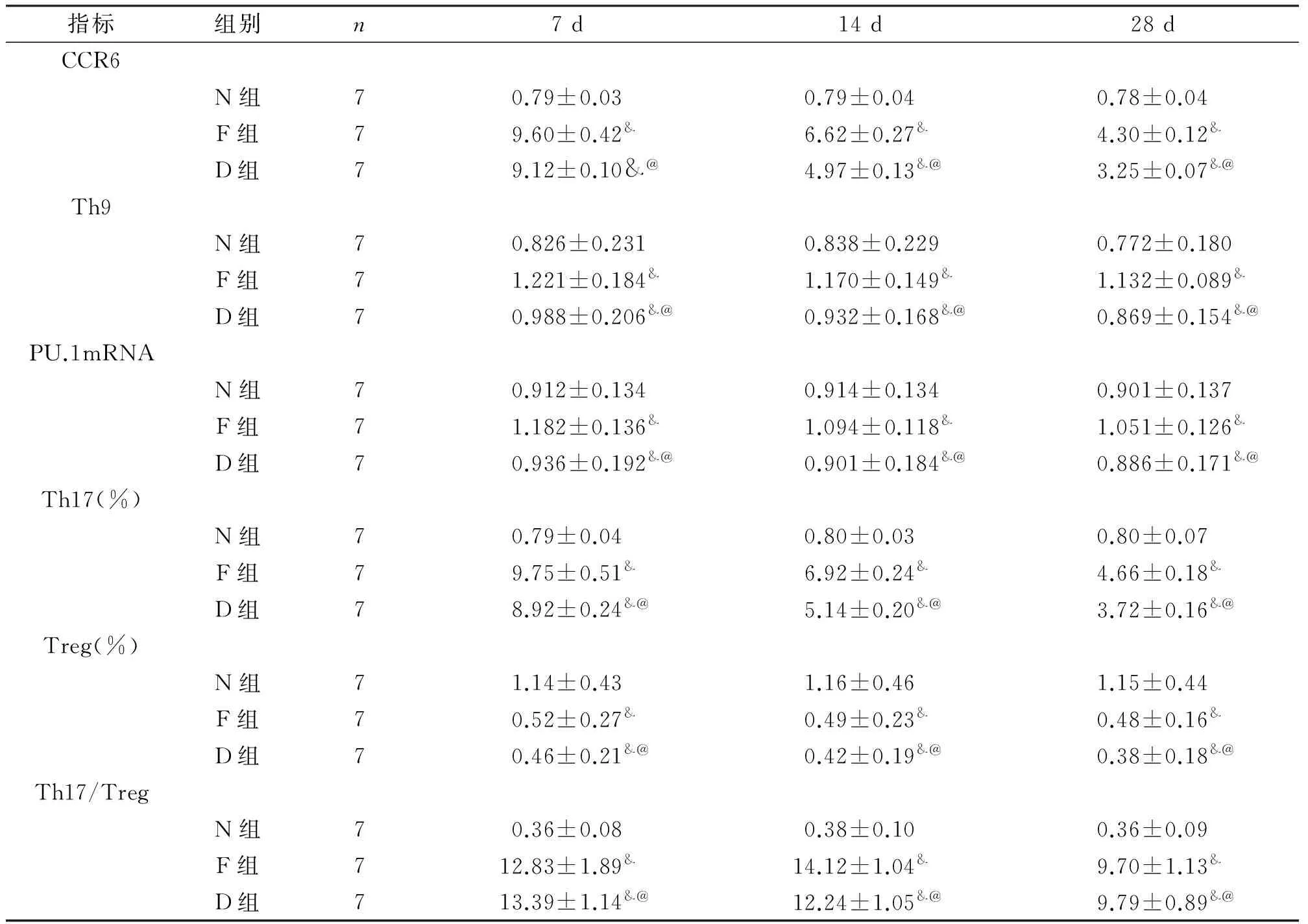
表1 不同时期三组大鼠肺组织各指标表达情况
注:与N组比较,&P<0.05;与F组比较,@P<0.05
2.3CCR6细胞表达量与IL-9、Th17、Treg细胞计数、Th17/Treg比例相关性的分析CCR6、Th9、PU.1mRNA表达水平与Th17有显著正相关性,与Treg有显著负相关(P均<0.01),见表2。
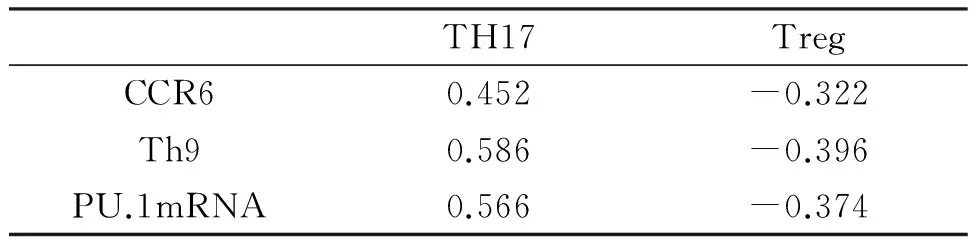
表2 相关r值
3 讨论
PF好发人群多为老年人,作为一种慢性呼吸道疾病间质性改变,早期以肺部炎症性改变,晚期以纤维蛋白沉积、肺组织纤维化病理表现为主,患者多以呼吸困难、干咳为主要症状,活动后加重,晚期严重乏氧,心肺功能降低,严重影响生活质量,被称为不死的癌症。目前发病机制尚未完全明确。本研究以Th17/Treg 失衡为切入点,分析前期研究中趋化因子受体CCR6、Th9相关因子与Th17/Treg 失衡在肺纤维化发病机制中的关系。
2005年,Harrington[6]等人提出Th17(CD4+-IL-17+辅助性T细胞)细胞是一种CD4+效应性T细胞亚群在介导炎症反应中起到重要的作用,在炎症状态下CCR6可趋化Thl7细胞至肺部、皮肤等其他组织[7];Th17细胞,由TGF-β和IL-6、IL-23介导下激活STAT3通路诱导高表达特异性转录因子RORγt,从而分泌IL-17,通过CCR6/CCL20趋化轴,被诱导至病变组织部位,激发炎症反应[8,9],本次研究中发现,与N组相比,F、D两组各时期CCR6、Th17指标结果明显增高,由于第7 d时大鼠肺纤维化模型炎症反应最明显,故检测结果在此时达到最高值,并且CCR6与Th17呈正相关,说明Th17可能通过与趋化因子受体CCR6相互作用参与肺纤维化发病过程。与鲍文华[10-11、2]等人关于Th17细胞对肺纤维化大鼠模型中的表达及意义研究一致。
CD4+CD25+Foxp3+调节性T细胞(Treg)是对炎症反应起拮抗作用的另一特殊类型T细胞,在维护免疫平衡及调节机体炎症反应中起到重要作用。Sayour EJ等[12,13]学者认为Treg与特发性肺纤维化以及化学因素诱导的肺纤维化密切相关。大量实验研究证实多种疾病例如自身免疫性疾病、肿瘤、炎症反应以及移植排斥等的发生发展与Th17、TH1/TH2及Treg细胞亚群之间相互作用有关。正常机体内存在着Th17/Treg动态平衡,Th17/Treg失衡可促进自身免疫性疾病炎症反应的发生[14]。而关于Th17/Treg 失衡与肺纤维化发病机制的研究甚少。赖小映,钟小宁[15]认为Th17/Treg失衡可能加重肺纤维化免疫炎症,促进肺部胶原纤维的沉积。CCR6主要由朗汉斯细胞,记忆性T细胞、B细胞、CD+25CD+4调节T细胞表达,CCR6与CCL20结合后,可募集未成熟树突状细胞(DCs)、专职的抗原提呈细胞(APCs)、成熟DCs至炎症反应部位[16]。本研究结果显示F、D两组相对于N组各时期Treg细胞百分比降低、Th17/Treg比值结果增高,并且CCR6与Treg相关性分析呈负相关、与Th17/Treg呈正相关,推断CCR6可能参与Th17/Treg细胞失衡致大鼠肺纤维化的形成过程。
TH9细胞是以分泌IL-9、IL-10细胞因子为主的新型 CD4+T 细胞亚群,VeldhoenM,、DardalhonV[17,18]等人证实了“Th9”细胞,为已有的包括辅助性T细胞1型(Thelpercell1,Th1)、2型(Th2)、Th17和Treg在内的Th细胞亚群添加新成员。PU.1作为Th9细胞特异的转录因子,通过IL-9 基因组蛋白乙酰化从而促进 Th9 细胞表达[19]。TH9细胞参与机体多种炎症反应性疾病,如支气管哮喘、过敏性鼻炎、溃疡性结肠炎、多发性硬化、系统性红斑狼疮等。本研究指出B、D两组相对于N组各时期IL-9、Th17/Treg比值结果明显增高,并且IL-9与Th17/Treg相关性分析呈正相关,提示TH9细胞可能参与肺纤维化Th17/Treg失衡理论的调节机制。Veldhoen M[20]等在研究Th9细胞的功能时发现,存在RAG-1缺陷小鼠,即便缺失Treg细胞,也可通过来源于Th9细胞的IL-9作用于Treg细胞,同时发挥促炎功能使组织炎性反应更加严重。与本实验研究结果相似。
总之,与对照组比较,CCR6、Th9相关因子、Th17、Th17/Treg在大鼠肺纤维化模型组中肺组织表达量显著增高,与肺部炎症、纤维化程度密切正相关,Treg细胞百分率降低;CCR6、Th9相关因子与Th17相关性分析为正相关,与Treg细胞相关性分析呈负相关;故如何通过抑制CCR6细胞、Th9相关因子分泌及有效调节Th17/Treg细胞平衡,从而控制炎症反应,调节机体的免疫状态,将为肺纤维化临床治疗提供新的研究方向。
[1]King TJ,Pardo A,Selman M.Idiopathic pulmonary fibrosis[J].Lancet,2011,378(9807):1949.
[2]李树民,鲍文华,王凤玲,等.CCR6-CCL20趋化轴在TH17细胞介导的肺纤维化大鼠肺组织中作用机制的研究[J].临床肺科杂志,2015,20(12):2177.
[3]鲍文华,王瑾,李树民,等.Th9细胞相关因子在肺纤维化大鼠中的作用[J].中国呼吸与危重监护杂志,2016,15(3):227.
[4] Eastaff-Leung N,Mabarrack N,Barbour A,et al.Foxp3+regula-tory T cells,Th17 effector cells,and cytokine environment in in-flammatory bowel disease[J].J Clin Immunol,2010,30 (1):80.
[5]Hwang I,An BS,Yang H,et al.Tissue-specific expression of oc-cludin,zona occludens-1,and junction adhesion molecule A inthe duodenum,ielum,colon,kidney,liver,lung,brain,andskeletal muscle of C57BL mice[J].J Physiol Pharmacol,2013,64(1):11.
[6]Harrington LE,Hatton RD,Mangan PR,et al.Interleukin 17-producing CD4+ effector T c- ells develop via a lineage distinct from the T helper type 1 and 2 lineages[J].Nat Immuno,l 2005,6(11):1123.
[7]Singh SP,Zhang HH,Foley JF,et al.Human T cells that are able to produce IL-17 express the chemokine receptor CCR6[J].J Immunol,2008,180(1):214.
[8]Stockinger B,Veldhoen M,Martin B.Thl7 T cells:Linking innate and adaptive immunity[J].Semin Immunol,2007,19(6):353.
[9]Hirota K,Yoshitomi H,Hashimoto M.Preferential recruitment of CCR6-expressing Thl7 cells to inflamed joints via CCL20 in rheumatoid arthritis and its animal model[J].J Exp Med,2007,204(12):2803.
[10]于永江,李树民,鲍文华,等.TH17细胞、IL-21因子在鼠肺纤维化中的表达及意义[J].中国实验诊断学,2013,17(7):1176.
[11]李树民,鲍文华,穆晓春,等.TH17细胞在肺纤维化大鼠模型中的表达[J].重庆医科大学学报,2013,38(7):780.
[12]Sayour EJ,Mc Lendon P,Mc Lendon R,et al.Increased proportion of Fox P3+ regulatory T cells in tumor infiltrating lymphocytes is associated with tumor recurrence and reduced survival in patients with glioblastoma[J].Cancer Immunol Immunother, 2015,64(4):419.
[13] Lo Re S,Lison D,Huaux F.CD4+ T lymphocytes in lung fibrosis:diverse subsets,diverse functions[J].J Leukoc Biol,2013,93(4):499.
[14]Afzali B,Lombardi G,Lechler RI,et al.The role of T helper 17(Th17) and regulatory T cells(Treg) in human organ transplanta-tion and autoimmune disease[J].Clinical Exp Immunol,2007,148(1):32.
[15]赖小映,钟小宁.Th17、Treg 在肺纤维化小鼠外周血、肺组织中的表达及意义[J].山东医药,2013,53(19):1.
[16]Rumbo M,Sierro F,Debard N,et al.Lymphotoxin beta receptor sig-naling inducers the chemokine CCL20 in intestinal epitheliu [J].Gastroenterology,2004,127(1):213.
[17]VeldhoenM,UyttenhoveC,SnickVJ,et al.Transforminggrowthfac-tor-beta`reprograms' thedifferentiationofThelper 2cellsandpro-motesaninterleukin 9-producingsubset[J].Natimmunol,2008,9(12):1341.
[18]DardalhonV,AwasthiA,KwonH,et al.IL-4inhibitsTGF-beta-in-ducedFoxp3+ Tcellsand,togetherwithTGF-beta,generatesIL-9+IL-10+ Foxp3(-)effectorT cells[J].NatImmunol,2008,9(12):1347.
[19]Goswami R,Kaplan MH.Gcn5 is required for PU.1-dependentIL-9 induction in Th9 cells[J].J Immunol,2012,189:3026.
[20] Veldhoen M,Uyttenhove C,van Snick J,et al.Transforminggrowth factor-beta reprograms the differentiation of T helper 2cells and promotes an interleukin 9-producing subset[J].Nat Im-munol,2008,9(12):1341.
