柠檬桉树皮单宁的提取纯化及抗氧化活性
2018-01-22,,,,,
,, ,, ,
(广西大学化学化工学院,广西南宁 530004)
柠檬桉(Eucalyptuscitriodora),良好的速生用材树种和很好的芳香油树种[1],是人造板和制浆造纸的优良原料[2-3]。其化学成分研究集中于枝叶,其挥发油的主要化学成分是香茅醛、香茅醇、异胡薄荷醇和乙酸香茅酯[4-8]。
单宁(Tannins),多酚的中、高化合物,富有许多独特的生理活性,如抗菌、抗氧化和抗过敏作用。在单宁抗菌性方面,黄增[9]等研究发现巨尾桉叶单宁对金黄色葡萄球菌、酵母菌、沙门氏菌等均有较强的抑制作用;在抗氧化方面,Katsubet[10]、顾海峰[11]、石锦芹[12]、马希汉[13]等研究发现柿子单宁具有较强的抗LDL氧化能力、清除自由基能力和抗油脂氧化能力;在抗过敏方面,杨文锟等[14]研究发现柿子单宁有很强的抗过敏活性。大量研究证明了单宁在医疗和保健上的实用价值,而对于柠檬按树皮的单宁的相关研究尚未进行,本文以柠檬桉树皮为原料进行单宁的提取和抗氧化活性的研究,期望以可靠的实验数据验证柠檬桉树皮的价值。
本实验采用溶剂浸提法对柠檬桉树皮单宁进行提取,以颜色反应,沉淀反应,紫外扫描等对单宁作定性分析,利用单宁酸以福林酚法绘制标准曲线作定量分析,在提取方面,在单因素的条件下采用四因素三水平正交得出其最优的提取工艺;在抗氧化研究方面,采用大孔吸附树脂纯化法分离纯化柠檬桉树皮粗提物,考察不同纯度单宁的总抗氧化性和清除二苯代苦味肼基自由基(DPPH·)和羟基自由基(·OH)的能力,评价其抗氧化性能,为柠檬桉树皮的开发利用提供参考。
1 材料与方法
1.1材料与仪器
柠檬桉树皮 2016年5月采自于广西机电职业技术学院校园;二苯代苦味肼(DPPH·) Sigma公司;DM130、ADS-17、NKA、AB-8、S-8、X-5、D101、HPD826、HPD400、HPD800 南开大学化工厂;单宁酸标品 天津市光复精细化工研究所;抗坏血酸 分析纯,上海试四赫维化工有限公司;无水乙醇,无水碳酸钠,七水合硫酸亚铁,水杨酸,30%过氧化氢,磷酸钠,钼酸铵 分析纯,广东光华科技股份有限公司。
KQ-600DB型数控超声清洗器 云南昆山超声仪器有限公司,Agilent-8453E型紫外可见分光光度计 美国安捷伦公司,HL-2恒流泵 上海青浦沪西仪器厂。
1.2实验方法
1.2.1 柠檬桉树皮单宁的提取 参考文献[15-16],取新鲜的柠檬桉树皮在恒温干燥箱中60 ℃烘干,将其粉碎过60目筛,得到干燥的柠檬桉树皮粉末原料。称取100.0 g干燥柠檬桉树皮粉末按1∶4料液比加入石油醚在70 ℃油浴条件下对原料进行回流脱脂,干燥密封保存。取5.0 g脱脂后柠檬桉树皮粉末,料液比1∶20 g·mL-1,加入60%的乙醇水溶液,超声功率800 W,提取温度60 ℃条件下提取时间30 min,离心过滤得到粗提液;
另取5.0 g脱脂后柠檬桉树皮粉末,以料液比1∶20 g·mL-1,加入60%的乙醇水溶液,提取温度60 ℃条件下用溶剂法提取30 min,比较两者的单宁得率。
1.2.2 单宁的定性和定量分析
1.2.2.1 粗提液的定性分析 粗提液和单宁酸标液分别滴加1%的明胶溶液,观察溶液中是否有白色絮状物产生。粗提液和单宁酸标液分别滴加0.3% FeCl3溶液,观察溶液颜色的变化。37%~40%的甲醛1 mL和浓盐酸2 mL加入粗提液中,沸水浴30 min,观察是否出现沉淀。
1.2.2.2 粗提液的定量分析
1.2.2.2.1 标准曲线的绘制 根据文献[15]的方法,以单宁酸做标品,蒸馏水为溶剂,分别配制0.05,0.10,0.15,0.20,0.25,0.30 mg/mL单宁酸溶液,取1 mL单宁酸溶液到6个25 mL容量瓶,采用福林酚法显色,紫外可见分光光度计在500~900 nm范围扫描最大吸收波长,再在最大吸收波长处测定系列标液吸光度。以单宁酸标准溶液的浓度x(mg/mL)为横坐标、吸光度y为纵坐标,绘制标准曲线。
1.2.2.2.2 样品中单宁含量的测定 量取一定体积提取液,用福林酚法显色后,测定其在工作波长处的吸光值,根据线性方程及公式(1)计算柠檬桉果实中单宁的得率。
式(1)
式中:V为容量瓶的体积(25 mL);W为柠檬桉树皮中单宁得率(%);x为从标准曲线查得的提取液中所含单宁的含量(mg·mL-1);V1为提取液的总体积(mL);V2为测定时所取提取液的体积(mL);M为柠檬桉树皮的质量(g)。
1.2.3 单因素实验设计
1.2.3.1 提取时间对单宁提取率的影响 准确称取7份5 g原料分别置于250 mL锥形瓶中,按料液比为1∶20 g·mL-1分别加体积分数为60%乙醇水溶液提取液,采用溶剂法提取,设定提取温度为60 ℃,提取时间分别为30、60、90、120、150、180、210 min,测定单宁提取率。
1.2.3.2 乙醇体积分数对单宁提取率的影响 准确称取11份5 g原料分别置于250 mL锥形瓶中,按料液比为1∶20 g·mL-1分别加入0,10%,20%,30%,40%,50%,60%,70%,80%,90%,100%乙醇水溶液提取液,采用溶剂法提取,提取时间为150 min,提取温度为60 ℃,测定单宁提取率。
1.2.3.3 提取温度对单宁提取率的影响 准确称取5份5 g预处理后的柠檬桉树皮粉分别置于250 mL锥形瓶中,按料液比为1∶20 g·mL-1分别加体积分数为60%乙醇水溶液提取液,采用溶剂法提取,提取时间为150 min,提取温度为40,50,60,70,80 ℃,测定单宁提取率。
1.2.3.4 料液比对单宁提取率的影响 准确称取6份5 g原料置于锥形瓶中,按料液比分别1∶10、1∶20、1∶30、1∶40、1∶50、1∶60 g·mL-1,分别加入体积分数为40%的乙醇水溶液提取液,摇匀静置。并将其至于50 ℃恒水浴中加热150 min,测定单宁提取率。
1.2.4 正交实验 由于需要考虑的单因素实验次数太多,采用正交设计可以有效的选择一些具有代表性的水平组合进行实验,单宁的提取实验考察了4个单因素,因此采用正交表对柠檬桉树皮进行提取,实验参数范围由单因素条件得出,正交实验设计见表1。
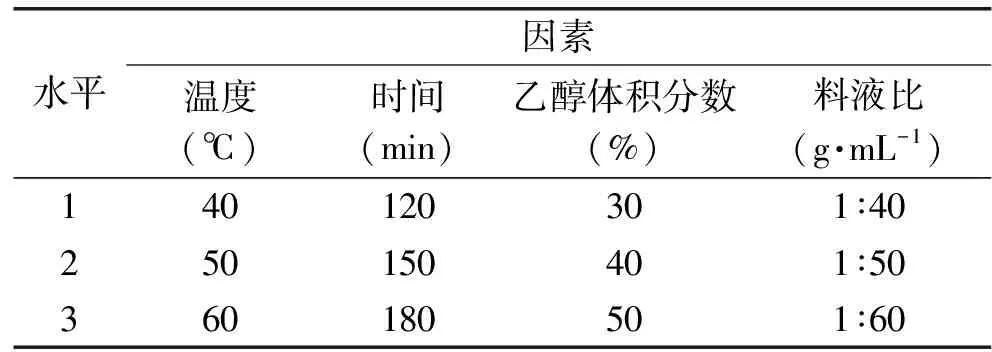
表1 溶剂法正交实验的因素及水平 Table 1 Factors and levels of the orthogonal test for solvents extraction
1.2.5 柠檬桉果实单宁样品的分离与纯化
1.2.5.1 乙酸乙酯萃取 100 mL粗提液,采用旋转蒸发仪蒸出溶剂后40 ℃干燥。干燥后的粗提物用适量50%乙醇溶解后,在缓缓加入无水乙醇,边加边搅拌使得最终乙醇水体积比为9∶1,充分搅拌后,在室温下静置24 h后,离心(4200 r·min-1,10 min),40 ℃下回收乙醇。用等体积的石油醚萃取3次,收集水相,水相用等体积氯仿萃取3次,收集水相,在用等体积的乙酸乙酯萃取6次,合并6次萃取的乙酸乙酯相,收集乙酸乙酯相和乙酸乙酯萃余相,分别在40 ℃下回收乙酸乙酯,40 ℃恒温烘干得到柠檬桉果实单宁的乙酸乙酯萃取相和乙酸乙酯萃余相纯化样品[15]。将乙酸乙酯萃取和萃余相溶解通过大孔树脂纯化后,得到萃取经大孔树脂纯化物和萃余经大孔树脂纯化物。
1.2.5.2 大孔树脂的静态筛选 称取已预处理的X-5、HPD826、HPD800、DM130、D-101、NKA、ADS-17、S-8、HPD400和AB-8型树脂各2 g,分别装入250 mL锥形瓶中,然后加入55 mL质量浓度为13.67 mg/mL的单宁粗提液,置于摇床中,温度为30 ℃,振荡速率为110 r·min-1,振荡24 h后过滤,然后用体积分数为60%的乙醇55 mL洗脱树脂,分别测定滤液及洗脱液中单宁的含量,计算树脂的吸附率和解吸率,选出最佳大孔吸附树脂。
称取6份2 g已预处理的HPD826大孔吸附树脂,分别装入250 mL锥形瓶中,然后加入55 mL已知质量浓度的单宁粗提液,置于摇床中,温度为30 ℃,振荡速率为110 r·min-1,振荡24 h后过滤,然后改变洗脱剂乙醇的体积分数(40%、50%、60%、70%、80%、90%),测定树脂的解析率,确定最佳洗脱剂体积分数。

式(2)

式(3)
1.2.5.3 HPD826脂对柠檬桉果实单宁的分离工艺考察 称取10 g已预处理的 HPD826大孔吸附树脂,湿法装柱。每次量取100 mL样品溶液上柱,收集流出液。参考其他文献并且结合柠檬桉树皮粗提液的含量,上样浓度为1.332 mg/mL,通过改变上样液流速(0.5、1.0、1.5、2.0、2.5 mL/min),通过吸附率的选择,确定最佳上样流速;上样流速为1.0 mL/min,改变上样液质量浓度(0.2、0.4、0.6、0.8、1.0 mg/mL),通过吸附率和吸附量的选择,确定最佳上样质量浓度;以1.332 mg/mL上样质量浓度和1.0 mL/min上样浓度上样,吸附完成后,通过改变洗脱流速(0.5、1.0、1.5、2.0、2.5 mL/min),通过解吸率选择,确定最适洗脱流速。
1.2.3.4 各纯化样品的纯度测定 通过不同的纯化方法得到不同的纯化样品,采用福林酚法测定其中单宁的含量,取一定体积的各纯化物样品于事先称重的培养皿中,烘干至恒重,计算单宁占纯化样品总质量的比例,即为单宁的纯度。
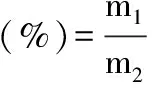
式(4)
式中:m1为一定体积纯化样品中单宁的含量(mg);式中m2为一定体积纯化样品的总质量(mg)。
1.2.6 柠檬桉树皮单宁的抗氧化性的测定
1.2.6.1 总抗氧化性的测定 依次取10 mL的刻度试管分别编号,各加入不同浓度的样品溶液2.0 mL,再分别加入0.6 mol/L浓硫酸、28 mmol/L钼酸铵、4 mmol/L磷酸钠各2.0 mL,混匀后于95 ℃温度下,水浴90 min,在695 nm处测定其吸光度,每个浓度平行测定3次,取平均值。以单宁酸作为对照,以蒸馏水作参比液,吸光度越大,总抗氧化能力越强[17-18]。
1.2.6.2 DPPH·的清除作用 配制浓度为4×10-3mol/L DPPH·无水乙醇溶液。取样品溶液2 mL和2 mL DPPH·溶液摇匀后,放置30 min,以蒸馏水和乙醇1∶1比例做空白,在517 nm处测定吸光度记为A1,2 mL蒸馏水加DPPH·溶液,摇匀,在517 nm测定吸光度A0,2 mL样品溶液加2 mL蒸馏水,摇匀,在517 nm测定吸光度A2。每个浓度平行测定3次,取平均值。以单宁酸作为对照[19-22],依照上述方法测定,根据公式(5)分别计算样液和单宁酸对DPPH·的清除率:

式(5)
式中,A2为样品自身对吸光度的贡献;A0为DPPH·本身吸收数值;A1为样品对DPPH·作用后的吸光度数值。清除率越大,说明样品对DPPH·的清除效果越好。
1.2.6.3 ·OH的清除作用 根据文献[16]中的方法,用蒸馏水分别配制9 mmol/L的FeSO4溶液和9 mmol/L的过氧化氢溶液;用无水乙醇配制9 mmol/L的水杨酸溶液[15-16,20]。测定各样液对·OH的清除作用。清除率越大,说明样品对·OH的清除效果越好。清除自由基活力SA(Scavenging Activity)可用公式(6)表示:

式(6)
式中,Aj为仅加入待测液的吸光度;Ac为不加待测液时的吸光度;Ai为加入待测液和FeSO4溶液、过氧化氢溶液、水杨酸溶液的吸光度。
1.3数据处理
实验数据按照对应公式进行计算,平行测定三次,并作图,结果以平均值±标准差表示
2 结果与分析
2.1单宁的定性与定量分析
2.1.1 单宁的定性分析 滴加1%明胶溶液后,柠檬桉树皮粗提液和单宁酸中均产生白色絮状物;滴加0.3%三氯化铁溶液后,粗提液和单宁酸均变为墨绿色,两者均为单宁的特征反应现象,证明柠檬桉树皮粗提物中含有单宁类化合物滴加甲醛溶液和浓盐酸溶液后,沸水浴后,溶液产生砖红色沉淀,证明柠檬桉提物中所含单宁为缩合单宁。
2.1.2 单宁的定量分析 经福林酚法显色后,单宁酸标品在758 nm处有最大吸收,以吸光值y和单宁酸标准溶液的体积x得到回归方程:y=93.781x+0.0584(线性范围0.002~0.012 mg/mL,R2=0.9995),y为吸光度,x(mg/mL)为单宁质量浓度。标准曲线如图1所示。
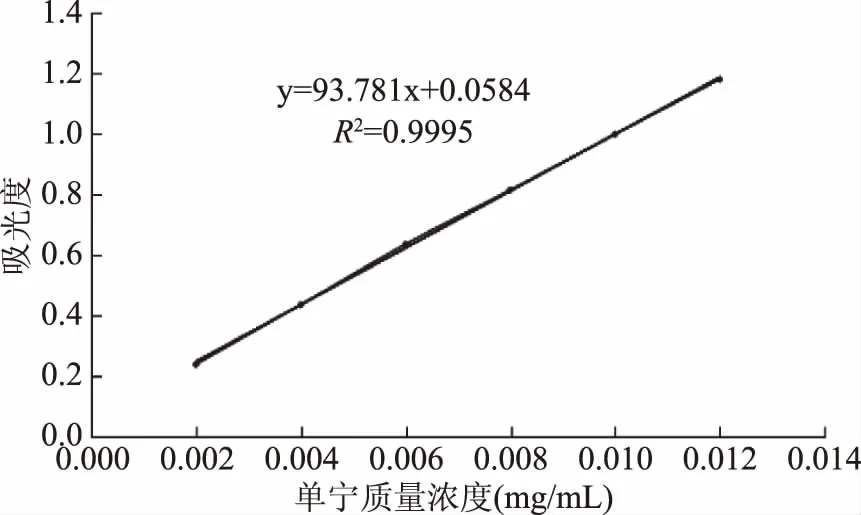
图1 单宁标准曲线Fig.1 Standard curvr of Tannins
2.2柠檬桉树皮单宁的提取-单因素实验
2.2.1 提取方法对柠檬桉树皮单宁得率的影响 本文主要采用溶剂法提取,以水和乙醇按比例混合作为溶剂。同时本文考察了超声波辅助法对柠檬桉树皮中单宁的提取。两种方法单宁的得率分别为9.39%和10.26%。提取结果说明在相同的提取条件下,超声波辅助法相比于溶剂法提取,单宁得率提高了0.87%,但超声波辅助法提存在振荡过程中噪声较大的缺点,而且从经济方面考虑,能量消耗较大,成本相对较高。而采用溶剂法在保证单宁得率的同时,对提取设备要求不高,操作简单,能耗小、成本低。综合考虑,本文采用溶剂法提取。
2.2.2 提取时间对柠檬桉树皮单宁得率的影响 提取时间对柠檬桉树皮单宁得率的影响结果如图2所示。随着溶剂提取时间的延长,单宁得率增加,在150 min附近单宁得率最大,此后时间延长,单宁得率逐渐降低。这可能是由于到150 min时,单宁已经充分溶出,超过150 min时,杂质成分溶出较多,单宁类物质的氧化分解量也增多,从而导致单宁得率在后半段下降。综合考虑,溶剂法提取柠檬桉单宁提取时间选择150 min。
由相关分析可知,提取时间与单宁得率的相关系数为0.66344(p=0.004829<0.01),达到极显著水平,说明提取时间对单宁得率有极显著性影响。
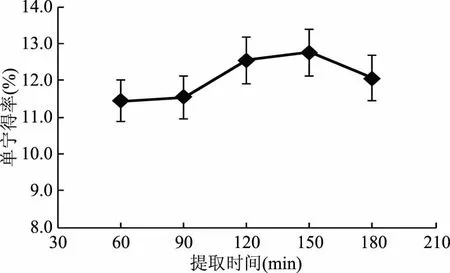
图2 提取时间对单宁得率的影响Fig.2 Effect of extraction time on yield of tannin
2.2.3 乙醇体积分数对柠檬桉树皮单宁得率的影响 乙醇体积分数对柠檬桉树皮单宁得率的影响结果如图3所示。溶剂法提取柠檬桉树皮单宁的得率先随着乙醇体积分数的增大而增大,在乙醇体积分数40%时达到最大,随后开始显著降低。这可能是由于乙醇是有机溶剂,根据相似相溶理论[23],随着乙醇体积分数的增加,其他杂质成分溶出增多,或者是40%的乙醇体积分数的溶剂极性最适宜单宁的大量溶出,导致40%后单宁得率降低。综合考虑,溶剂法提取柠檬桉树皮单宁乙醇体积分数选择40%。
由相关分析可知,乙醇体积分数与单宁得率的相关系数为-0.4815(p=0.000196<0.01),达到极显著水平,说明乙醇体积分数对单宁得率有极显著性影响。

图3 乙醇体积分数对单宁得率得影响Fig.3 Effect of the ethanol concertration on yield of tannin
2.2.4 提取温度对柠檬桉树皮单宁得率的影响 提取温度对柠檬桉树皮单宁得率的影响结果如图4所示。在温度达到50 ℃之前,提高溶剂提取温度有利于柠檬桉树皮单宁的提取,50 ℃后提取温度过高反而导致单宁得率下降,这可能是由于温度升高,溶剂挥发,不利于单宁的溶出,而且为其他杂质成分的溶出提供了有利条件,综合考虑,溶剂法提取柠檬桉树皮单宁提取温度选择50 ℃。
由相关分析可知,提取温度与单宁得率的相关系数为-0.30617(p=0.002342<0.01),达到极显著水平,说明提取温度对单宁得率有极显著性影响。

图4 提取温度对单宁得率的影响Fig.4 Effect of extraction temperature on yield of tannin
2.2.5 料液比对柠檬桉树皮单宁得率的影响 料液比对柠檬桉树皮单宁得率的影响结果如图5。柠檬桉树皮单宁得率先随溶剂料液比的减小呈上升趋势,料液比达到1∶50 g·mL-1时,单宁得率达到最大值,随后料液比再减小,单宁得率呈下降趋势。这是由于大的料液比不利于单宁的溶出,小的料液比稀释了提取液的质量浓度,导致单宁得率降低。而且溶剂量过大后续会增加提取液浓缩、分离纯化等工作的压力和时间。综合考虑,溶剂法提取柠檬桉树皮单宁的最佳料液比选择1∶50 g·mL-1。
由相关分析可知,料液比与单宁得率的相关系数为0.88122(p=0.00064<0.01),达到极显著水平,说明料液比对单宁得率有极显著性影响。
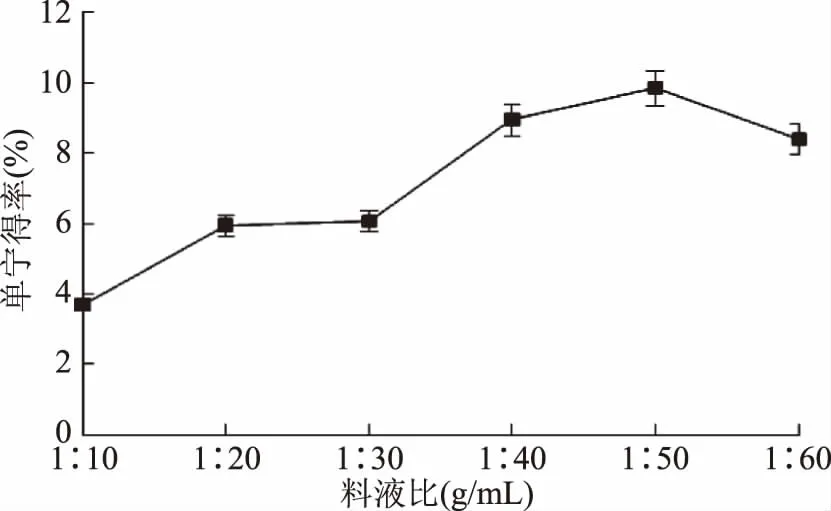
图5 料液比对单宁得率的影响Fig.5 Effect of feed liquid ratio on yield of tannin
2.3溶剂法提取柠檬桉树皮单宁的正交实验结果
溶剂法提取柠檬桉树皮单宁的L9(34)正交实验结果见表2。

表2 溶剂法正交实验设计及结果分析Table 2 Orthogonal experimental design and result analysis of solvents extraction
从表中极差分析可以看出,各因素对单宁得率的影响主要顺序是C>D>A>B,即乙醇体积分数>料液比>提取温度>提取时间。溶剂法提取最佳组合条件为A3B2C2D2即提取温度60 ℃,提取时间150 min、乙醇体积分数40%、料液比1∶50 g·mL-1。该组合不在正交表中。为此对最佳组合进行了验证实验。
2.4验证实验
按照溶剂法的优化条件,进行3次提取平行实验,结果如表3所示。经计算:溶剂法提取柠檬桉树皮单宁得率分别为:13.19%、13.53%、14.30%,平均得率为13.67%,比正交实验最高得率13.07%,提高幅度4.59%,SD=0.46,RSD%=4.16%(n=3)。实验结果说明,优化后的工艺提取条件单宁得率高,稳定性好,正交实验结果准确可靠。

表3 溶剂法优化条件验证实验结果Table 3 Test result of optimal conditions of solvents extraction
2.5纯化方法对单宁纯度的影响
实验选择吸附树脂类型,结果如表4所示,实验条件下,HPD826型树脂对柠檬桉树皮单宁的吸附率和解析率均高于其他树脂,达到90.10%、92.05%,选择HPD826型树脂进行动态吸附实验;上样流速对HPD826型大孔树脂吸附单宁的影响由图6可看出,上样流速越大,吸附率反而越低,虽然在0.5 mL/min 的流速下,吸附效果最好,但工作效率低,综合考虑选择1.0 mL/min的流速上样。
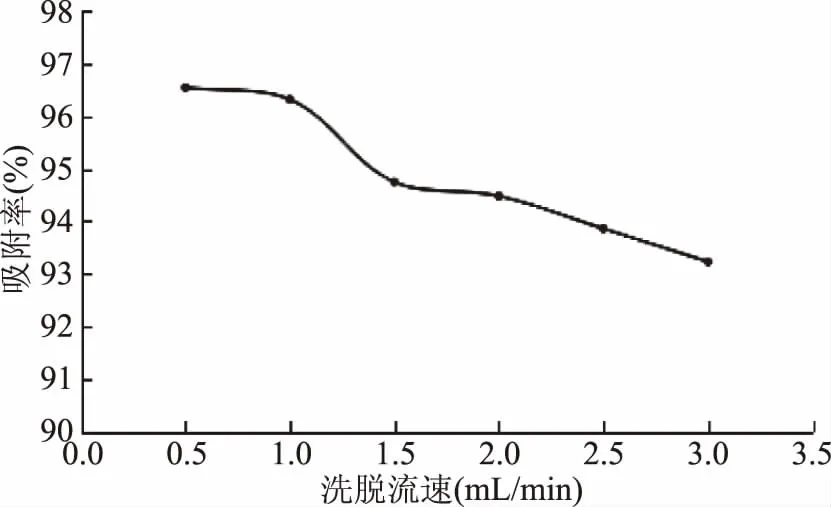
图6 不同上样流速对柠檬桉果实单宁的吸附效果的影响Fig.6 The effect of feed elution rate on adsorption effect of tannin
上样质量浓度对HPD826型大孔树脂吸附单宁的影响如图7所示,随着样液浓度的上升,吸附率先上升,在样液浓度为1.33 mg/mL时最大,吸附率达到98.52%,随后下降,所以选择1.33 mg/mL为单宁的上样质量浓度;洗脱流速对HPD826型大孔树脂吸附单宁的影响由图8可看出,洗脱流速越大,解析率反而越低,虽然在0.5 mL/min的流速下,解析效果最好,但工作效率低,综合考虑选择1.0 mL/min的流速解析;乙醇的体积分数对解吸率的影响,结果见图9,体积分数低的乙醇溶液只能洗脱少部分的单宁,解析率随着乙醇浓度的上升,在50%时达到最大,随后下降,故选择50%的乙醇为最适宜洗脱剂浓度。

表4 10种大孔树脂对样品中单宁的静态吸附和解吸结果Table 4 Results of adsorption and desorption for tannin ten types resin

表5 样品纯度分析结果Table 5 Purity of the crude extract and purified samples
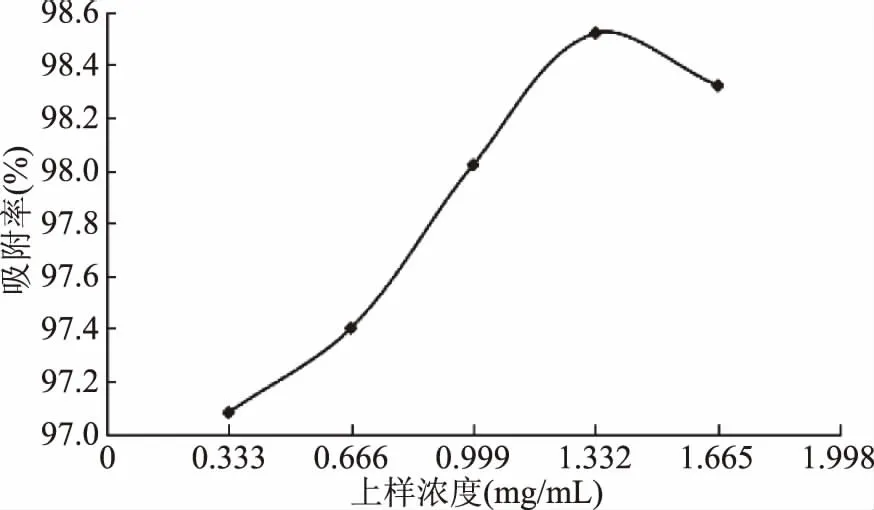
图7 样液浓度对柠檬桉果实单宁吸附效果的影响Fig.7 The effect of feed concentration on adsorption effect of tannin
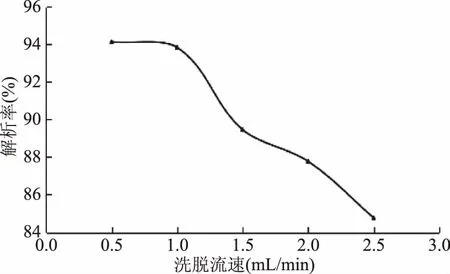
图8 不同洗脱流速对柠檬桉果实单宁解吸的影响Fig.8 The effect of elution rate on desorption efficiency
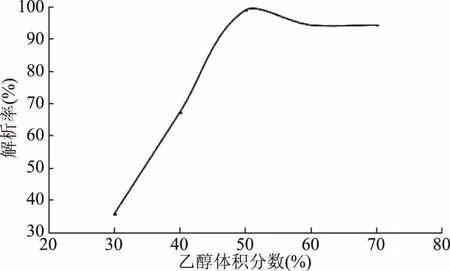
图9 不同乙醇体积分数对柠檬桉果实单宁静态解吸的影响Fig.9 The effect of ethanol concentration on static desorption efficiency
因此,大孔吸附树脂纯化的最佳工艺参数为:以HPD826树脂为吸附树脂,上样流速1.0 mL/min,上样浓度1.33 mg/mL,洗脱流速1.0 mL/min,乙醇洗脱剂体积分数50%。
在最优的分离纯化工艺条件下,采用不同的纯化方法纯化样液,结果如表5所示。由图可知,不同纯化方法得到的样品纯度各不相同。粗提物经乙酸乙酯萃取后纯度约为粗提物的3.0倍,经大孔树脂纯化后纯度约为粗提物的3.5倍,萃取和大孔树脂纯化联用得到的乙酸乙酯萃取经大孔树脂纯化的样品纯度约为粗提物的5.5倍,乙酸乙酯萃余经大孔树脂纯化的样品纯度约为粗提物的5.3倍。结果说明采用溶剂萃取与大孔树脂联用方法能有效提高柠檬桉树皮单宁提取物的纯度,效果较好。
2.6柠檬桉树皮单宁的抗氧化性研究
2.6.1 单宁的总抗氧化性 以单宁酸作为对照品,考察不同纯度的单宁质量浓度在0.01~0.10 mg/mL时的总抗氧化性,结果如图所示。以吸光度的大小可以直接得出样品和磷钼试剂反应的强弱,从而得到样品的总抗氧化性大小。由图10可知浓度范围内,总抗氧化性随着样液浓度增加而呈现上升趋势,总抗氧化性呈现明显的剂量依赖性。样品基本在样液浓度为0.1 mg/mL时有最好的总抗氧化性。此时,各物质的总抗氧化性大小为:乙酸乙酯萃取物>乙酸乙酯萃取过大孔树脂纯化物>大孔树脂纯化物>粗提物>单宁酸>乙酸乙酯萃余过大孔树脂纯化物>抗坏血酸。
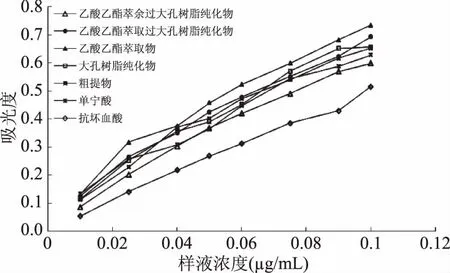
图10 不同质量浓度试样的总抗氧化性Fig.10 The total oxidation resistance of different concentration samples

表6 不同纯度单宁的抗氧化活性 Table 6 Antioxidant capacity from different purification tannin
样液浓度为0.1 mg/mL时的总抗氧坏性均强于抗坏血酸,此时乙酸乙酯萃取物、乙酸乙酯萃取过大孔树脂纯化物、大孔树脂纯化物、粗提物、乙酸乙酯萃余过大孔树脂纯化物的总抗氧化性分别是是抗坏血酸的142.38%、134.38%、127.38%、126.53%、116.05%,乙酸乙酯萃取物的总抗氧化性是单宁酸的116.88%,乙酸乙酯萃取过大孔树脂纯化物的总抗氧化性是单宁酸的110.32%,大孔树脂纯化物、粗提物和乙酸乙酯萃余过大孔树脂纯化物的总抗氧化性与单宁酸基本相等,其总抗氧化性分别为单宁酸的104.57%、103.79%、95.27%。总体来说,柠檬桉树皮不同纯度的单宁样品的总抗氧化性比较好。
2.6.2 单宁对DPPH·的清除效果 结果如图11所示。在实验浓度范围内,样品对DPPH·的清除率随着浓度的增加而上升,清除率呈现明显的剂量依赖性,在10 μg/mL时达到最大,最大清除率见表6,单宁酸的清除率高于各样品。
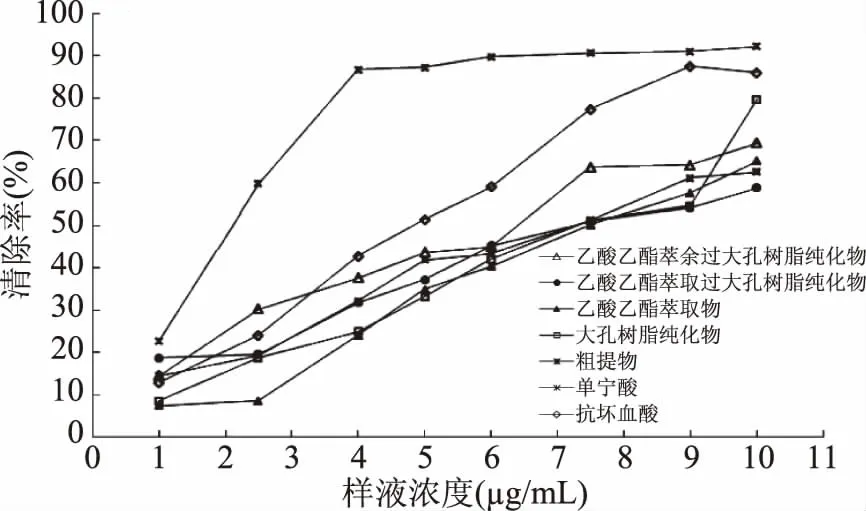
图11 不同质量浓度试样对DPPH·的清除曲线Fig.11 Scavenging rates of different samples:DPPH·free radical
根据表6的IC50值,各样品对DPPH·自由基的清除率依次为单宁酸>抗坏血酸>乙酸乙酯萃余过大孔树脂纯化物>大孔树脂纯化物>粗提物>乙酸乙酯萃取物>乙酸乙酯萃取过大孔树脂纯化物,根据图7的结果,对DPPH·自由基的清除率依次为单宁酸>抗坏血酸>大孔树脂纯化物>乙酸乙酯萃余过大孔树脂纯化物>乙酸乙酯萃取物>粗提物>乙酸乙酯萃取过大孔树脂纯化物,二者结果并不一致,说明随着浓度的增加,其对各样品清除DPPH·自由基能力的影响程度的差异也越来越明显。其中,大孔树脂纯化物对DPPH·自由基的最大清除率为79.63%,达到单宁酸的86.43%,抗坏血酸的92.66%,乙酸乙酯萃余经大孔树脂纯化物、乙酸乙酯萃取物、粗提物的清除率分别为单宁酸的75.30%、70.67%、67.87%,为抗坏血酸的80.97%、75.76%、72.76%。说明各样品对DPPH·自由基具有一定的清除效果但不明显。
2.6.3 单宁对·OH的清除效果 实验结果如图12。由图可知,在实验浓度范围内,各样液对·OH自由基的清除率随着浓度的增大而增大,清除率呈现明显的剂量依赖性。在样品浓度1.0 mg/mL时,清除率达到最大。各样液对·OH自由基的最大清除率排列顺序为:抗坏血酸>粗提物>单宁酸>大孔树脂纯化物>乙酸乙酯萃取过大孔树脂纯化物>乙酸乙酯萃取物>乙酸乙酯萃余过大孔树脂纯化物。大孔树脂纯化物、乙酸乙酯萃取过大孔树脂纯化物与单宁酸对·OH自由基的最大清除率几乎相等,都达到77%以上,粗提物对·OH自由基的最大清除率为83.08%,其清除效果是单宁酸的104.18%,是抗坏血酸的88.48%。粗提物的单宁纯度较低但对·OH自由基的清除率高,乙酸乙酯萃余过大孔树脂纯化物的单宁纯度较高而清除率相对较低,说明杂质中可能存在具有·OH自由基清除能力的物质。

图12 不同质量浓度试样对·OH的清除曲线Fig.12 Scavenging tares of different samples:·OH free radical
综上可知,不同纯度的单宁对DPPH·和·OH自由基的清除能力的差异较大,原因可能是两者的反应机理和条件不同,也不排除杂质中含有清除DPPH·和·OH自由基能力的物质的可能。不同纯度的单宁对DPPH·的清除能力与单宁酸、抗坏血酸相比相对较弱,对·OH自由基的清除效果较好。单宁对·OH自由基的清除效果说明,样液单宁纯度与其清除能力不呈正相关性,说明杂质中可能存在大量的具有清除OH·自由基能力的物质。
3 结论
3.1采用颜色反应、沉淀反应对柠檬桉树皮单宁进行了定性分析,结果表明,柠檬桉树皮粉提取物中含有单宁类化合物,单宁种类为缩合单宁。
3.2进行了溶剂法提取柠檬桉树皮单宁工艺研究,可得出提取温度、提取时间、乙醇体积分数、料液比等因素均对单宁得率有极显著性影响。优化条件最佳提取工艺为是:提取温度60 ℃,提取时间150 min、乙醇体积分数40%、料液比1∶50 g·mL-1,单宁得率是13.67%。
3.3采用溶剂萃取法、大孔吸附法、溶剂萃取和大孔吸附联用法对柠檬桉树皮单宁粗提取进行分离纯化。分离纯化所得各样品中单宁得率分别为13.67%、39.91%、47.97%、72.43%、76.90%。
3.4考察单宁的纯化方法和抗氧化活性,结果表明,不同纯化方法得到的柠檬桉树皮单宁的纯度差异较大。各单宁样品的总抗氧化性、对DPPH·和·OH自由基的清除能力均随样品浓度的增大而增大。乙酸乙酯萃取物和乙酸乙酯萃取过大孔树脂纯化物的总抗氧化性分别是抗坏血酸的142.38%、134.38%,是单宁酸的116.88%、110.32%,各种纯化物对DPPH·自由基具有一定的清除能力,粗提物对·OH自由基的最大清除率为单宁酸的104.18%。总体上看,柠檬桉树皮不同纯度的单宁的抗氧化活性较好。乙酸乙酯萃取物、乙酸乙酯萃取过大孔树脂纯化物、大孔树脂纯化物和粗提物的抗氧化能力较强,乙酸乙酯萃余过大孔树脂纯化物的抗氧化能力较弱。
[1]贺近恪,李启基. 林产化学工业全书(第三卷)[M]. 北京:中国林业出版社,2001,1965.
[2]余德新,范(毛小)仔,方玉林. 柠檬桉利用的研究[J]. 桉树科技,1990(Z1):123-130.
[3]欧文王,永亮,何正洪. 不同树龄柠檬桉木材对制浆造纸适宜性的研究[J]. 广西林业科技资料,1981(01):47-49.
[4]田玉红,刘雄民,周永红,等. 柠檬桉叶挥发性成分的提取及成分分析[J]. 色谱,2005,23(6):651-654.
[5]黎贵卿,陆顺忠,曾辉,等. 柠檬桉枝叶挥发性成分的研究[J]. 广西林业科学,2012,41(4):352-355.
[6]Li H,Madden J L,Potts B M. Variation in volatile leaf oils of the Tasmanian Eucalyptus SpeciesⅡ. Subgenus Symphyomyrtus[J]. Biochemical Systematics and Ecology,1996(24):547-569.
[7]Tian Y H,Liu X M,Zhou Y H. Chemical Compositions of Essential Oil of Eucalyptus umbellate Growing in Guangxi[J]. Food Science,2007,28(1):36-38.
[8]Vilela G R,Almeida G S de,D’Arce M A B R,et al. Activity of essential oil and its major compound,1,8-cineole,from Eucalyptus globulus Labill.,against the storage fungi Aspergillus flavus Link and Aspergillus parasiticus Speare[J]. Journal of Stored Products Research,2009(45):108.
[9]黄增. 巨尾桉有效成分的提取分离及其生物活性研究[D].广西大学,2012.
[10]Katsubet T,Tabatah H,Ohta Y,et al. Screening for antioxidant activity in edible plant products:comparison of low-density lipoprotein oxidation assay,DPPH radical scavenging assay,and Folin-Ciocalteu assay[J]. Journal of Agricultural and Food Chemistry,2004,52(8):2391-2396.
[11]顾海峰,李春美,徐玉娟等. 柿子单宁的制备及其抗氧化活性研究[J]. 农业工程学报,2007,23(5):241-245.
[12]石锦芹,黄绍华,谌乐礼,等. 柿叶乙醇提取物在猪油中的抗氧化性研究[J]. 食品工业科技,1999,20(5):22-33.
[13]马希汉,尉芹. 柿叶抗氧化作用的研究[J]. 西北林学院学报,2000,15(2):41-43.
[14]杨文锟,郁建平,蔡立,等. 柿子单宁纯化工艺及其抗过敏活性研究[J]. 山地农业生物学报,2010,29(1):48-51.
[15]黄增,刘雄民,库咏峰,等. 巨尾桉单宁的提取分离及其抗菌抗氧化性能[J]. 精细化工,2012,29(6):565-566.
[16]杨琼琼,李东,屈恋,等. 柿木皮单宁的纯化及抗氧化活性[J]. 食品科学,2016,07(37):50-55.
[17]周方,赵宏飞,杨洋,等. 高丛蓝莓品种花青素含量与抗氧化能力比较[J]. 西南林业大学学报,2011,31(5):53-57.
[18]周洲,龙凤香,邓黎娟,等. 巨尾桉叶、皮、芯中单宁提取及其抗氧化性研究[J]. 食品工业科技,2015,36(16):129-132.
[19]屈恋,高璇,刘雄民,等. 柠檬桉果实单宁的提取纯化及抗氧化活性[J]. 食品工业科技,2017,38(8):256-.261.
[20]赵国建,李佳峰,董周永,等. 石榴籽中总酚的提取及其抗氧化作用研究[J]. 西北植物学报,2008,28(12):2532-2537.
[21]徐树英,谭蔚,张玉苍. 香蕉茎秆单宁酸提取纯化及其抗氧化性[J]. 热带作物学报,2016,37(8):1567-1574.
[22]Cao X,Wang C,Pei H,et al. Separation and identification of polyphenols in apple pomace by high-speed counter-current chromatography and high-performance liquid chromatography coupled with mass spectrometry[J]. Journal of Chromatography,2009(1216):4268-4274.
[23]李立琳,刘建英. 生物柴油在乙醇/柴油中溶解机理的研究[J]. 河南工程学院学报(自然科学版),2014,26(2):45-49.
