美极梅奇酵母抑制芒果炭疽菌的拮抗机理初探
2018-01-22,,,
,, ,
(海南大学食品学院,海南海口 570228)
芒果是五大热带水果之一,素有“热带果王”之称[1]。芒果营养丰富,含有维生素A、B1、B2、C、蛋白质和叶酸等物质[2]。芒果还具有止咳化痰,抗炎镇痛,抗病毒,抗肿瘤的作用[3]。芒果属于跃变型水果,采后需要后熟过程,会变软变黄。而随着芒果的后熟,一些病害也随之产生,最常见的是炭疽病和蒂腐病[4]。这两种采后病害在芒果八成熟时开始发病,并快速蔓延到整个果实,如果不采取防治措施,损失率将达到40%以上。炭疽病主要由胶孢炭疽菌引起,感染后,芒果表皮出现圆形或多边形褐色斑点[5]。蒂腐病主要由可可球二孢菌引起,在田间侵染芒果果实,在运输过程中发病,造成果实腐烂[6]。
胶孢炭疽菌(ColletotrichumgloeosporioidesPenz.)是导致绝大多数的水果和蔬菜的采后病害的致病菌[7]。控制这种病害通常使用传统的化学杀菌剂,如多菌灵·硫磺、甲基托布津、炭疽灵福锌等等。然而化学杀菌剂的滥用,造成环境的严重污染,对人体健康产生威胁[8]。科学家开始寻找可以替代的无害生物杀菌剂[9]。研究发现放线菌、真菌、细菌能够降低果蔬采后病害的发生[10]。由于绝大数酵母菌不会产生毒素,故成为最佳的生物拮抗剂,受到前所未有的关注[11]。美极梅奇酵母(Metschnikowiapulcherrim)已经被报道可以有效降低苹果、葡萄、葡萄柚、樱桃番茄等水果采后病害的发生[12-13]。拮抗机理的研究有助于更好地发现有效的拮抗菌和使用增效剂提高拮抗菌的效果。其中最重要的拮抗机理有营养空间竞争、抗生素的产生、直接寄生、酶的分泌[14-15]。胶孢炭疽菌的细胞壁主要有几丁质和葡聚糖组成,几丁质酶和β-1,3-葡聚糖酶可以降解病原菌细胞壁,起到杀死病原菌的作用[16]。生物膜是自养型与异养型微生物形成阴离子,分泌固定在细胞表面保护微生物[17]。铁元素对于真菌的生长和病害的发生十分重要,非致病菌的铁螯合作用可以作为一种新型的拮抗机理[18]。本实验研究了美极梅奇酵母对芒果炭疽病的抑菌效果,从胞外酶的分泌、生物膜的形成、铁螯合作用方面,对抑菌机理做了初步研究。
1 材料与方法
1.1材料与仪器
胶孢炭疽菌(ColletotrichumgloeosporioidesPenz.) 由中国热带农业科学院环境与植物保护研究所提供,28 ℃在PDA培养基上培养15 d,4 ℃保存,用接种环刮取菌丝,置于10 mL无菌蒸馏水中,用纱布过滤,获得孢子悬浮液,血球计数器将其浓度调节至1×105spores/mL;美极梅奇酵母(Metschnikowiapulcherrima) 是前期实验室从芒果园中分离得到,发酵液在4 ℃下12000×g离心20 min,弃上清液后用蒸馏水重悬,得到酵母菌悬液,血球计数器调节浓度至1×108cells/mL;芒果果实 (台农)采摘于海南省昌江县芒果园内,采摘生理成熟期,没有机械或微生物损伤的芒果果实,1.5%次氯酸钠表面消毒2 min,自来水洗涤,在室温(28 ℃)下干燥,置于塑料容器中;酵母浸出粉胨葡萄糖培养基(YPD) 酵母浸提物10 g,细菌学蛋白胨20 g,葡萄糖20 g,1000 mL的蒸馏水;酵母膏胨葡萄糖琼脂培养基(YPDA) 琼脂20 g,酵母浸提物10 g,细菌学蛋白胨20 g,葡萄糖20 g,1000 mL的蒸馏水;马铃薯葡萄糖琼脂培养基(PDA) 马铃薯200 g,葡萄糖20 g,琼脂20 g,1000 mL的蒸馏水。
ZEAL-WAYGR60DA高压灭菌器 厦门致微仪器有限公司;FYL-YS-280L型恒温箱 北京福意电器有限公司;Shimadzu spectrophotometer UV-1800 岛津企业管理(中国)有限公司;TG16KR台式高速冷冻离心机 长沙东旺实验仪器有限公司;NRY-211恒温培养摇床 上海南荣实验室设备有限公司;HITACHIS-3000N扫描电子显微镜 苏州瑞测精密仪器有限公司;HCP-2临界点干燥仪 苏州瑞测精密仪器有限公司;BioTek Synergy H1酶标仪 美国伯腾仪器有限公司。
1.2实验方法
1.2.1 YPD中酵母菌对芒果炭疽抑菌效果测定 将200 mL YPD培养基分装在500 mL的三角瓶中,121 ℃灭菌15 min,接种1 mL酵母菌悬液和1 mL炭疽菌孢子悬浮液。以只接种1 mL炭疽菌孢子悬浮液的培养基作为对照。每隔24 h用8层纱布过滤,并用无菌水冲洗3次,测菌丝湿重;将菌丝放在纱布(放菌丝前称重)上置于80 ℃的恒温干燥箱中48 h,测其干重。实验重复3次,每个处理3个平行。
1.2.2 芒果果实上酵母菌对病原菌抑菌效果测定 用打孔器(8 mm)在每个芒果腰部刺两个1 mm深的伤口。每个处理50个果实,共4个处理:A:在伤口处接种50 μL的无菌水,作对照;B:接种25 μL炭疽孢子悬浮液和25 μL无菌水;C:接种25 μL酵母菌悬液和25 μL无菌水;D:在伤口处接种25 μL酵母菌悬液,1 h后接种25 μL炭疽孢子悬浮液。
处理后的芒果果实放在塑料容器中,每个处理设置两组,分别放在温度为25 ℃和15 ℃,相对湿度为90%以上的恒温培养箱中培养6 d。观察和测量病斑直径,根据Benbow和Sugar[19]的方法确定对疾病抑制率。计算拮抗酵母对病原菌生长的抑菌率的公式如下:
抑菌率(%)=(LDc-LDr)/LDc×100
式(1)
式(1)中:LDc-病斑直径(处理组B);LDr-病斑直径(处理组C、D)。
1.2.3 验证胞外裂解酶的存在 美极梅奇酵母分泌几丁质酶的能力参照Rojas-Avelizapa[20]等人的方法,葡聚糖酶的能力参照Lutz[21]等人的方法。
1.2.4 几丁质酶活性测定 在YPD培养基中分别加入20 g/L病原菌细胞壁(CWP)、20 g/L葡萄糖、5 g/L胶体几丁质、20 g/L CWP+5 g/L胶体几丁质、20 g/L CWP+20 g/L葡萄糖,灭菌,每个处理分别加入美极梅奇酵母悬浮液1 mL。在25 ℃,180 r/min培养,分别在0、24、48、72、96、120 h下取样,4 ℃,9600 r/min离心10 min,收集上清液。几丁质酶活性用Duraisamy等人[22]的方法测定。每个处理重复3次,实验重复2次。
1.2.5β-1,3-葡聚糖酶活性测定 将CWP、葡萄糖、昆布多糖、CWP+昆布多糖、CWP+葡萄糖等作为碳源加入到YPD培养基中,按1.2.4方法取样。β-1,3-葡聚糖酶活性用Somogyi[23]的方法测定。每个处理重复3次,实验重复2次。
1.2.6 拮抗酵母生物膜的检测 参照Parafati等[24]的方法研究拮抗酵母形成生物膜的能力。预处理好的芒果用酵母菌悬液浸泡后,参照潘洵操等[25]的方法,在扫描电镜下,观察酵母菌在芒果果皮上形成生物膜,以接种无菌水的芒果皮为对照。
1.2.7 铁对色素生成和拮抗作用的影响 参照Saravanakumar等[26]的方法。YPDA培养基中FeCl3的浓度为5、10、15、20 μg/mL,酵母菌培养4 d。观察和测量拮抗酵母形成的色素带的大小及抑菌圈的大小。
1.2.8 数据处理 所有实验数据使用Origin(8.5版)进行统计,使用SPSS Statistics 17进行差异性分析。
2 结果与分析
2.1拮抗酵母对芒果炭疽的抑菌效果
2.1.1 YPD培养基中抑菌效果 从图1可以看出,在接种了酵母菌的培养基中,炭疽菌丝的湿重和干重都明显的低于对照组。对照组中,菌丝的湿重和干重在第2 d后急剧上升;在接种酵母的培养基中炭疽菌丝湿重和干重在第3 d时,达到最大值,分别是1.1673 g和0.0082 g,第5 d时,对照组菌丝湿重是处理组的38.89倍,对照组菌丝干重是处理组的88.85倍。在第3 d以后,培养基中的环境较前期发生变化,已经不适合炭疽生长,加上培养基中的营养物质缺乏,拮抗酵母通过分解炭疽菌丝获得营养物质,所以第3 d后,炭疽菌丝干重、湿重开始下降。由此可见,拮抗酵母菌可以明显的抑制芒果炭疽菌丝的生长。

图1 美极梅奇酵母对炭疽菌丝湿重和干重的影响Fig.1 The effect of Metschnikowia pulcherrima on wet weight and dry weight of anthrax hyphae
2.1.2 芒果果实上的抑制效果 图2显示了不同处理后芒果果实上的病斑直径。15 ℃,接种12 d时,对照组A、处理组B、处理组C和处理组D的病斑直径大小分别是8.0,18.94,8.0和11.2 mm,其中处理组A、C与处理组B、D间差异显著(p<0.05)。与处理组B相比,处理组C和处理组D的病斑直径明显降低10.94和7.74 mm,其抑菌率达到了57.81%和40.87%。当芒果果实被贮藏在25 ℃下时,其病斑直径和抑菌率与15 ℃有着相同的趋势,这就表明美极梅奇酵母明显的降低了芒果伤口处由胶孢炭疽造成的伤害(所有处理测得的病斑直径都包括打孔直径8 mm)。

图2 芒果伤口病斑直径的变化Fig.2 The changes of lesion diameters in mango wound注:A-无菌水;B-胶孢炭疽;C-美极梅奇酵母;D-美极梅奇酵母和胶孢炭疽。
2.2拮抗酵母对芒果炭疽的抑菌机理
2.2.1 胞外裂解酶的产生 由图3可以看出美极梅奇酵母菌落周围均出现淡黄色透明圈,表明美极梅奇酵母可以水解胶体几丁质(几丁质酶活性)和昆布多糖(β-1,3-葡聚糖酶),美极梅奇酵母菌拥有产生分泌这两种胞外裂解酶的能力。

图3 美极梅奇酵母产生裂解酶的能力Fig.3 The ability of the yeast Meyerozyma pulcherrima to produce lyase
2.2.2 几丁质酶的活性 由图4可以看出,美极梅奇酵母菌在五种碳源的诱导下,均能分泌产生一定量的胞外几丁质酶,不同的碳源对酵母菌的诱导能力有所不同,酶活达到最大值的时间也不同,但整体呈现出先上升后下降的趋势。CWP+胶体几丁质诱导的几丁质酶活性最高,达到最大值的时间也最短,其OD值第2 d达到了0.3867 nm/min/mL;葡萄糖诱导的几丁质酶活性最低,第4 d时达到最大值,OD值为0.2333 nm/min/mL。CWP+胶体几丁质的OD值是葡萄糖得1.7倍。实验表明,CWP、胶体几丁质能够诱导美极梅奇酵母菌产生几丁质酶。
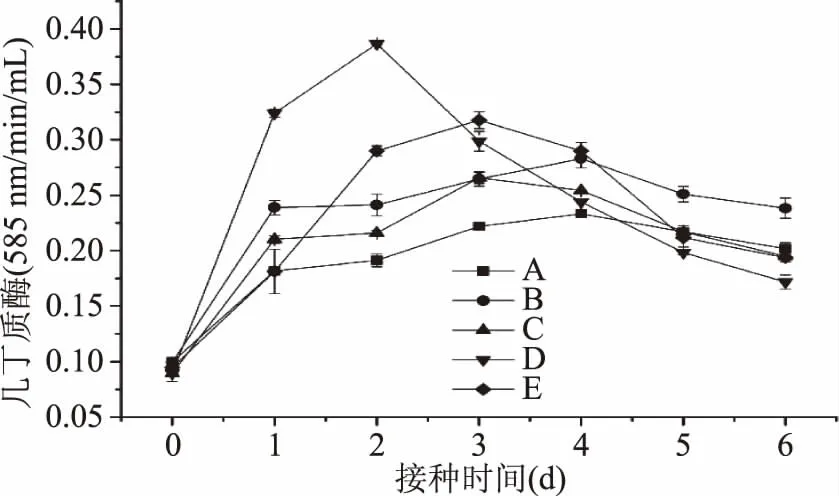
图4 不同处理对胞外裂解酶-几丁质酶活性的影响Fig.4 Effects of different treatments on the activity of extracellular lyase-chitinase注:A-葡萄糖;B-CWP;C-胶体几丁质;D-CWP+胶体几丁质;E-CWP+葡萄糖。
2.2.3β-1,3-葡聚糖酶的活性 由图5可以看出,美极梅奇酵母菌在加CWP、葡糖糖、昆布多糖的培养基中均有β-1,3-葡聚糖酶的产生,随着接种时间的增加,其活性也逐渐上升。其中添加CWP+葡萄糖的YPD培养基中,β-1,3-葡聚糖酶的活性明显地高于其他四中处理的,在第6 d时,其OD值高达0.3177 nm/min/mL。添加了葡萄糖和昆布多糖的培养基中,β-1,3-葡聚糖酶的活性都明显较低,两种处理也没明显差异,第6 d时OD值分别为0.1772、0.1827 nm/min/mL。说明,美极梅奇酵母菌在CWP、葡萄糖的诱导下能够分泌更多的β-1,3-葡聚糖酶。

图5 不同处理对胞外裂解酶-β-1,3-葡聚糖酶活性的影响Fig.5 Effects of different treatments on the activity of extracellular lyase-β-1,3-glucanase注:A-葡萄糖;B-CWP;C-昆布多糖;D-CWP+葡萄糖;E-CWP+昆布多糖。
2.2.4 生物膜 培养3 h后,经过反复冲洗,美极梅奇酵母仍能够附着在壁上(OD 1.478±0.12)。对照组的OD值为0.008。经过24 h后,OD值并未明显降低(OD 1.218±0.1)。72 h后OD值下降至0.481,酵母菌形成的生物膜随着时间会逐步降解。图6中B、C为不同倍数扫描电镜下美极梅奇酵母在芒果果皮上形成的生物膜。

表1 铁对色素生成和拮抗作用的影响Table 1 Effects of iron on pigment formation and antagonism
注:不同字母表示差异显著(p<0.05)。

图6 经处理后芒果果皮的扫苗电镜观察Fig.6 Observation of mango peel after treatment by SEM注:A-用无菌水处理芒果,作为对照;B-用美极梅奇酵母处理芒果,放大倍数1800×;C-用美极梅奇酵母处理芒果,放大倍数4700×。
2.2.5 产生色素的能力及拮抗效果的影响 由表1可以发现,在不同浓度的FeCl3培养基中,美极梅奇酵母菌周围的色素带由浅粉色变成深红色。随着FeCl3浓度的增加,颜色逐渐加深。在不加FeCl3或者FeCl3浓度为5 μg/mL时,色素带宽度分别为5.3、4.2 mm,明显高于浓度为10、15、20 μg/mL时。当不加FeCl3时,抑菌圈为6.4 mm,当FeCl3的浓度为20 μg/mL时,抑菌圈为2.1 mm,前者是后者的3倍。实验表明,美极梅奇酵母菌产生色素的能力越低,对胶孢炭疽菌的拮抗效果越好。
3 讨论与结论
芒果炭疽病是造成芒果腐烂,影响芒果品质的主要采后病害之一。该研究发现,美极梅奇酵母对芒果炭疽病有较明显的抑制作用,能抑制胶孢炭疽菌的生长。该实验在研究美极梅奇酵母的抑菌效果的基础上,对其抑菌机理做了初步研究。发现CWP、葡萄糖、胶体几丁质能够诱导美极梅奇酵母菌产生几丁质酶和β-1,3-葡聚糖酶,这两种裂解酶可以分解病原菌细胞壁,近而杀死病原菌,降低芒果炭疽病的发病率。美极梅奇酵母具有形成生物膜的能力,能够在芒果表面形成保护膜,防止病原菌的入侵。在含有Fe3+的培养基中,美极梅奇酵母能够产生红色色素带,表明酵母可以吸收周围环境中的Fe3+。当浓度增加时,美极梅奇酵母产生的色素带反而变窄,说明酵母菌只是微量吸收Fe3+,浓度过高反而会抑制酵母菌的活性。在培养基中,Fe3+浓度增加时,抑菌圈变窄,说明美极梅奇酵母在低铁环境中拮抗效果更好。
许多研究也表明,拮抗菌可以有效的降低芒果炭疽病的发生。李春玲等人[27]发现枯草芽孢杆菌发酵液的非挥发性代谢产物对芒果炭疽病菌丝生长的抑制率达到了99.86%,抑菌效果显著;高云慨等人[28]发现季也蒙毕赤酵母在活体接种实验中对芒果炭疽菌有显著的的生防效果,在接种第4 d时,抑菌率达到了80%。该实验发现的拮抗菌-美极梅奇酵母更加丰富了芒炭疽病的生防酵母菌库,为有效抑制炭疽病的发生做出贡献。虽然研究发现很多酵母菌可以减少采后病害的发生,但是目前商业化的酵母菌很少,主要原因是拮抗酵母菌的抑菌机理尚不清楚,对其生产应用造成了阻力。在胶孢炭疽菌细胞壁中,几丁质作为结构主链排列有序,而β-1,3-葡聚糖作为填充材料以无定型的方式排列。胶孢炭疽菌细胞壁的分解需要不同酶的参与,特别是β-1,3-葡聚糖酶和几丁质酶,还有蛋白酶。因此,几丁质酶、葡聚糖酶、蛋白酶可以直接或间接参与拮抗酵母抑制病原菌的拮抗机理中。Saravanakumar等人[29]发现Trichodermaasperellum能够分泌几丁质酶、蛋白酶、β-1,3-葡聚糖酶等,并筛选出Trichodermaasperellum最优培养温度和pH。拮抗菌若能够成功地在受伤的水果表面定殖、繁殖,就必须具备相应的附着、定殖能力。在大多数情况下,这种能力与生物膜的形成相关。Parafati等人[25]发现Wickerhamomycesanomalus能过在葡萄表面形成生物膜,对灰葡萄孢(Botrytiscinerea)有一定的拮抗作用。Bautista-Rosales等人[30]在扫描电镜下观察到Meyerozyma caribbica在芒果表面形成了生物膜。Fe3+对于微生物的生长和发病十分重要,Fe3+的竞争在采后病害的生物防治中扮演重要角色。拮抗酵母菌对氧气和Fe3+要求较低,通过与病原菌竞争Fe3+可以抑制病原菌菌丝的生长以及孢子的萌发。本实验结果与Sipiczki等人[31]的有相似之处,美极梅奇酵母和病原菌之间存在着铁元素的竞争。
综上所述,美极梅奇酵母对芒果炭疽菌有一定抑制作用,其抑菌效果是多种拮抗机理相互作用的结果,包括分泌保外裂解酶,形成生物膜,铁螯合等,该实验是一个初步探讨,对拮抗机理仍需要更深入的研究。
[1]李日旺,黄国弟,苏美花. 我国芒果产业现状与发展策略[J]. 南方农业学报,2013,44(5):875-878.
[2]孙晓东,谭书明,刘芳宏. 新鲜芒果采后贮藏保鲜综述[J].食品与发酵科技,2017,53(1):78-82.
[3]闫文昊,林贺,律广富. 芒果苷现代药理作用研究[J]. 吉林中医药,2017,37(3):288-290.
[4]赵超,胡美姣,李敏. 芒果采后病害拮抗菌的筛选、鉴定及其生防效果研究[J]. 西南农业学报,2016,29(2):385-389.
[5]柳凤,何红,詹儒林. 拮抗芒果炭疽病菌的红树内生细菌筛选及AiL3菌株抗菌物质研究[J]. 中国牛物防治,2010,26(3):293-299.
[6]王萌,陈小莉,赵磊. 海南芒果蒂腐病可可球二孢抗药性及遗传多样性分析[J]. 热带作物学报,2016,37(7):1363-1369.
[7]Bautista-rosales P U,Calderon-santoyo M,Servín-villegas R,et al. Action mechanisms of the yeast Meyerozyma caribbica for the control of the phytopathogen Colletotrichum gloeosporioides in mangoes[J]. Biological Control,2013,65:293-301.
[8]范青,田世平,刘海波. 两种拮抗菌卜1,-3葡聚糖酶和几丁酶的产生及其抑菌的可能机理[J].科学通报,2001,46(20):1713-1717.
[9]Ibarra J E,Del-rincón M C,Galindo E,et al. Los microorganismos en el control biológico de insectos y fitopatógenos[J]. Reviews Latinoam Microbiology,2006,48:113-120.
[10]Charlet L D,Olson D,Glogoza P A,et al. Biological control of insect and weed pests in North Dakota agriculture[D]. North Dakota:North Dakota State University 2002.
[11]韦莹莹,刘威,沙嫣. 拮抗酵母结合热空气处理对樱桃番茄采后病害防治及其品质的影响[J]. 农产品加工,2013,326(8):9-11.
[12]Schena L,Ippolito A,Zahavi T,et al. Molecular approaches to assist the screening and monitoring of postharvest biological yeasts[J]. European journal of plant pathology,2000,106:681-691.
[13]Spadaro D,Vola R,Piano S,et al. Mechanisms of action,efficacy and possibility of integration with chemicals of four isolates of the yeast Metschnikowia pulcherrima active against postharvest pathogens on apples[J]. Postharvest Biology Technology,2002,24:123-134.
[14]Li R P,Zhang H Y,Liu W M,et al. Biocontrol of postharvest gray and blue mold decay of apples with Rhodoturula mucilaginosa and possible mechanisms of action[J]. International Journal Food Microbiology,2011,146:151-156.
[15]Sharma R R,Singh D,Singh R. Biological control of postharvest diseases of fruits and vegetables by microbial antagonists:a review[J]. Biology Control,2009,50:205-221.
[16]曾凯芳. 套袋、SA和INA对芒果果实采后抗病性和品质的影响[D].北京:中国农业大学,2005.
[17]Chmielewski R A N,Frank J F. Biofilm formation and control in food processing facilities[J]. Comprehensive reviews in food science and food safety,2003,2:22-32.
[18]Calvente V,Benuzzi D,DE Tosetti M I S. Antagonistic action of siderophores from Rhodotorula glutinis upon the postharvest pathogen Penicillium expansum[J]. International Biodeterioration and Biodegradation,1999,43:167-172.
[19]Benbow J M,Sugar D. Fruit surface colonization and biological control of postharvest diseases of pear by preharvest yeast applications[J]. Plant Disease,1999,83:839-844.
[20]Rojas-avelizapa L I,Cruz-camarillo R,Guerrero M I,et al. Selection and characterization of a proteo-chitinolytic strain of Bacillus thuringiensis,able to grow in shrimp waste media[J]. World Journal of Microbiology and Biotechnology,1999,15:299-308.
[21]Lutz M C,Lopes C A,Rodriguez M E,et al. Efficacy and putative mode of action of native and commercial antagonistic yeasts against postharvest pathogens of pear[J]. International Food Microbiology,2013,164:166-172.
[22]Saravnakumar D,Spadaro D,Garibaldi A,et al. Detection of enzymatic activity and partial sequence of a chitinase in Metschnikowia pulcherrima strain MACH1 used as postharvest biocontrol agent[J]. European Journal of Plant Pathology,2009,123:183-193.
[23]Somogyi M. Notes on sugar determination[J]. Journal Biology Chemistry,1952,195(1):19-23.
[24]Parafati L,Vitale A,Restuccia C,et al. Biocontrol ability and action mechanism of food-isolated yeast strains against Botrytis cinerea causing post-harvest bunch rot of table grape[J]. Food Microbiology,2015,47:85-92.
[25]潘洵操,谢宝贵.荔枝果皮的扫描电镜观察[J]. 园艺学报,1996,23(3):227-230.
[26]Saravnakumar D,Ciavorella A,Spadaro D. Metschnikowia pulcherrima strain MACH1 outcompetes Botrytis cinerea,Alternaria alternata and Penicillium expansum in apples through iron depletion[J]. Postharvest Biology and Technology,2008,49:121-128.
[27]李春玲,王庆国,胥丽娜. 一株芒果炭疽病拮抗菌抑菌活性的研究及其鉴定[J]. 食品工业科技,2012,33(11):147-150.
[28]高云慨,张荣意,钟利文. 1株新分离拮抗酵母菌株对芒果炭疽病生防效果及其分类鉴定[J]. 热带生物学报,2015,6(1):48-52.
[29]Saravanakumar K,Yu C J,Dou K,et al. Synergistic effect of Trichoderma-derived antifungal metabolites and cell wall degrading enzymes on enhanced biocontrol of Fusarium oxysporum f. sp. Cucumerinum[J]. Biological Control,2016,94:37-46.
[30]Bautista-rosales P U,Calderon-santoyo M,Servin-villegas R. Action mechanisms of the yeast Meyerozyma caribbica for the control of the phytopathogen Colletotrichum gloeosporioides in mangoes[J]. Biological Control,2013,65(3):293-301.
[31]Sipiczki,M. Metschnikowia strains isolated from botrytized grapes antagonize fungal and bacterial growth by iron depletion[J]. Appl Environ Microbiol,2006,72:6716-6724.
