西藏灵菇中两株产胞外多糖单胞酿酒酵母菌发酵性能及其发酵乳的流变学特性
2018-01-22,,*,
, ,*,
(1.青海大学农林科学院,青海西宁 810016;2.青海省农林科学院,青海西宁 810016;3.青海省青藏高原农产品加工重点实验室,青海西宁 810016)
西藏灵菇是一种乳白色胶状的颗粒物,形酷似米粒[1-2],是一种天然的酸奶发酵剂,属于开菲尔的一个品系[3],有“西藏雪莲”之称[4]。其内部是由乳酸菌、酵母菌和醋酸菌共生而成的,在其生长过程中会产生胞外多糖[5],而胞外多糖产生菌发酵的酸奶具有明显改善酸奶的组织状态和稳定性的特点[6-7],因此,筛选和分离产胞外多糖乳酸菌成为现在发酵乳领域研究的热点。而在西藏灵菇上栖息的微生物由于益生菌的种类不同、培养基不同,其产生的胞外多糖会存在明显的差异[8-10]。目前研究大部分集中在西藏灵菇中产胞外多糖的乳酸菌,包括嗜热链球菌、马乳酒样乳杆菌和植物乳杆菌[11-14],而对西藏灵菇中酵母菌的分离和产胞外多糖特性的相关研究还未见报道。
本研究以前期实验分离得到的两株产胞外多糖的单胞酿酒酵母菌为研究对象,但由于其生长特性及发酵特性尚不明确,菌株有效合理的评价体系不完善,其应用价值也受到了限制。因此,本研究通过对分离菌株生长特性、产胞外多糖能力、发酵特性进行研究,同时研究其菌株发酵制备的发酵乳的流变学特性,对于评价不同菌株发酵乳的质地、黏弹性、稳定性方面具有重要作用[15],旨在为分离自西藏灵菇中产胞外多糖的两株单胞酿酒酵母菌发酵酸乳的品质评价提供理论依据,同时,通过本研究筛选出具有应用价值的菌株,为其后续开发与应用提供参考。
1 材料与方法
1.1材料与仪器
酵母菌J5、J7由青海省青藏高原农产品加工重点实验室分离得到,经鉴定均为单胞酿酒酵母菌;脱脂乳培养基 将新鲜牛乳离心(4000 r/min条件下10 min),灭菌(105 ℃,20 min);YEPD培养基 葡萄糖20 g、蛋白胨10 g、酵母提取物5 g、氯霉素 0.2 g、蒸馏水 1 L,105 ℃下灭菌20 min;葡萄糖标准品(100 mg) 合肥博美生物科技有限责任公司;鲜牛乳 采自青海省良种繁殖场;Sevage试剂 氯仿∶正丁醇=5∶1 (V/V);其他试剂 均为分析纯。
DHR流变仪 美国TA仪器;pHS-3C型精密酸度计 上海仪电科学仪器股份有限公司;LDZX-75KBS型立式压力蒸汽灭菌器 上海申安医疗器械厂;SW-CJ-2D型双人净化工作台 苏州净化设备有限公司;AL204型分析天平 梅特勒-托利多仪器(上海)有限公司;N4S紫外可见分光光度计 上海仪电分析仪器有限公司;LRH-150型生化培养箱 上海齐欣科学仪器有限公司;THZ-300C型恒温振荡器 上海一恒科学仪器有限公司;BCD-649WE型冰箱 青岛海尔股份有限公司;DL-5M型高速台式冷冻离心机 长沙湘仪离心机仪器有限公司;FD-1A-50型真空冷冻干燥机 北京博医康实验仪器有限公司。
1.2实验方法
1.2.1 菌种的活化 用接种环挑取保藏菌株两环,接种于100 mL液体YEPD培养基中,28 ℃培养48 h进行活化,活化2次。
1.2.2 两株单胞酿酒酵母菌生长特性研究 将两株活化后的菌种以4%的接种量接入液体YEPD培养基,28 ℃下培养,每3 h取样,测定其在600 nm波长处的吸光值(OD600值)及pH的变化[16]。
1.2.3 菌种胞外多糖的提取及多糖含量的测定
1.2.3.1 菌种胞外多糖的提取 胞外多糖的提取参照文献[17-18]并改进。两株菌株以5%的接种量接入脱脂乳培养基,在28 ℃下培养48 h,得到的发酵乳在沸水浴中加热15 min后,冷却离心(4000 r/min,20 min),将离心后上清液中加入80%(w/v)的三氯乙酸至终浓度4%(w/v),4 ℃下静置过夜后离心(8000 r/min,20 min);再向上清液中添加无水乙醇至终浓度75%(v/v),4 ℃静置22 h后离心(8000 r/min,20 min),取离心后沉淀物,加入Sevage试剂除蛋白(样品体积的1/5),浓缩液透析48 h后冷冻干燥得到胞外多糖粗品。
1.2.3.2 胞外多糖含量测定 胞外多糖含量的测定:采用苯酚-硫酸法[19]。以葡萄糖为标准品得到标准曲线,回归方程为:Y=0.0145X-0.0173,R2=0.9954。式中:Y为样品的吸光度A;X为样品中胞外多糖质量浓度(mg/L)。
1.2.4 两株单胞酿酒酵母菌发酵性能测定 发酵剂的制备[20]:取两环酵母菌的斜面菌种接种到装有5 mL灭菌牛乳(105 ℃下灭菌20 min)试管中,28 ℃培养至大量气泡产生时(高泡期),再以2%~3%的接种量移入100 mL灭菌牛乳中,28 ℃摇床振荡培养至菌数达到(6~7)×107个/mL时即为酒母。再以5%接种量接入灭菌牛乳中进行发酵,28 ℃培养30 h,4 ℃冷藏24 h得成品,测定2株菌发酵乳成品的发酵酸度、乙醇含量、pH及感官品质,同时探究两株单胞酿酒酵母菌发酵乳的流变特性,确定两株单胞酿酒酵母菌发酵性能优劣[21]。
1.2.4.1 发酵酸度的测定 采用0.1 mol/L NaOH滴定法测定发酵乳的酸度[22]。
1.2.4.2 乙醇含量测定 采用重铬酸钾氧化比色法[23]。
1.2.4.3 pH测定 采用pHS-3C型精密酸度计。
1.2.4.4 感官评定 根据2株菌制备的发酵乳的色泽、组织状态、滋味与气味给发酵乳评级打分(总分100分),评定标准见表1[24],品尝人员8名,取平均值,评价其菌株发酵性能差异。
1.2.5 发酵乳流变特性测定
1.2.5.1 两株单胞酿酒酵母菌发酵乳表观粘度随剪切速率变化的测定 参考文献[25-26]的方法并进行改进。椎板(40 mm,1°),4 ℃下线性剪切,剪切速率为0.1~100 s-1,测定时间为300 s,连续测定30个数据点,检测样品的表观黏度随剪切速率的变化情况。
1.2.5.2 两株单胞酿酒酵母菌发酵乳样的剪切应力随剪切速率变化的测定 参考文献[25-26]的方法并进行改进。椎板(40 mm,1°),4 ℃条件下线性剪切,检测样品剪切应力随剪切速率变化的情况:首先转子的剪切速率由 0 s-1升高到600 s-1,采集30个数据点,测试时间150 s;到达600 s-1后再降速到0 s-1,采集30个数据点,测试时间150 s。
1.2.5.3 两株单胞酿酒酵母菌发酵乳频率扫描测定 参考文献[25-26]的方法并进行改进。椎板(40 mm,1°),在4 ℃ 条件下,应变为0.5%,频率由0.1 Hz变化到10 Hz,对发酵乳样品进行频率扫描,采集30个数据点。
1.3数据处理
所有实验均重复3次。数据用DPS 6. 5进行方差分析和多重比较,以p<0. 05为显著性检验标准。
2 结果与分析
2.1两株单胞酿酒酵母菌生长特性研究
微生物OD600值是反映菌体生长状态的一个指标,通常用来指菌体细胞密度,是追踪液体培养物中微生物生长的标准方法。两株单胞酿酒酵母菌生长曲线见图1。由图1可见,这两株单胞酿酒酵母菌活菌数的变化符合细菌生长典型规律。两株单胞酿酒酵母菌的生长规律基本一致,初期两株单胞酿酒酵母菌在0~9 h生长较为缓慢,无明显生长延迟期;9~15 h菌数增加较快,两株酵母均在9 h后达到对数生长期,酵母菌J5在15 h后进入生长平稳期,而酵母菌J7相对延后,18 h后进入生长平稳期。在整个生长过程中,在0~12 h,J7的活菌数高于J5,J7生长速度较快;随着时间的延长且在18 h后,J5与J7生长趋势接近,都进入稳定期,但J5活菌数略高于J7。
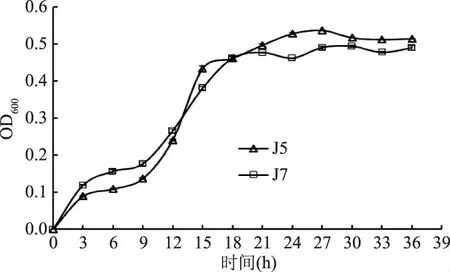
图1 两株单胞酿酒酵母菌生长曲线Fig.1 Growth curves of two Kazachstania unispora
2.2两株单胞酿酒酵母菌发酵过程中pH变化情况
两株酵母菌不同发酵时间的pH变化见图2。由图2可知,两株酵母菌均随发酵时间的延长,其pH一直呈下降趋势。在0~9 h期间两株酵母菌下降幅度基本一致,都较为缓慢,随着发酵时间的延长,酵母菌J7的pH在9 h后下降速度较快,产酸速度明显高于J5;J5菌株pH基本保持平稳下降趋势,下降幅度较小。由此可见,J7菌株发酵产酸能力明显高于J5,J7适宜用于酸乳发酵生产。

图2 两株单胞酿酒酵母菌发酵过程中pH变化曲线Fig.2 The pH change curves of two Kazachstania unispora in fermentation course
2.3两株单胞酿酒酵母菌发酵产胞外多糖产量
两株单胞酿酒酵母菌发酵产胞外多糖结果见图3。由图3可知,两株单胞酿酒酵母菌产胞外多糖存在显著差异(p<0. 05),其中酵母菌J5产胞外多糖产量较低为240.68 mg/L,酵母菌J7产胞外多糖较高,达到350.02 mg/L。与其他文献[27-28]报道西藏灵菇中优势菌产胞外多糖含量相比,本研究分离得到的两株单胞酿酒酵母菌具有更高的产胞外多糖的能力,且菌株J7多糖产量显著高于菌株J5。
2.4两株单胞酿酒酵母菌发酵性能的比较
两株单胞酿酒酵母菌发酵特性比较见表2。由表2可知,两株单胞酿酒酵母菌中,菌株J7发酵酸度较高,菌株J5稍弱,但二者产乙醇量无显著差异。而在组织状态和滋气味上,菌株J7制备得到的发酵乳其组织状态较好、滋气味较佳,菌株J5的发酵乳滋气味及组织状态均较差。综合考虑,菌株J7相对于菌株J5发酵性能优良。

表2 两株单胞酿酒酵母菌发酵性能比较结果Table 2 The comparison in fermentation performance of two Kazachstania unispora

图3 两株单胞酿酒酵母菌产胞外多糖产量Fig.3 The exopolysaccharide production of two Kazachstania unispora注:不同字母表示差异显著(p<0. 05)。
注:表中数据为3次重复的平均值,同列数据不同字母表示差异显著(p<0.05)。2.5两株单胞酿酒酵母菌发酵乳的流变学特性研究
2.5.1 两株单胞酿酒酵母菌发酵乳表观粘度随剪切速率的变化 在食品的制备过程中,黏弹性的测量如表观黏度的测量等提供了一种认识食品的流变学特性的方法,同时也有利于消费者对食品进行初步评价[29]。在0.01~100 s-1的剪切速率下,对两株单胞酿酒酵母菌发酵乳进行表观粘度测定,结果见图4。两种发酵乳的表观黏度都呈现随剪切速率的延长而降低的趋势,表现出剪切稀释的特征。0~20 s-1,随着剪切时间的延长酵母菌J5表观黏度下降较快,与J7相比下降幅度较大;在20 s-1之后,酵母菌J5、J7下降速度基本保持一致,但J5表观黏度较J7下降较多,发酵乳的黏度大小依次为:J7发酵乳>J5发酵乳,说明菌株J7具有较高的表观黏度,发酵性能较好。
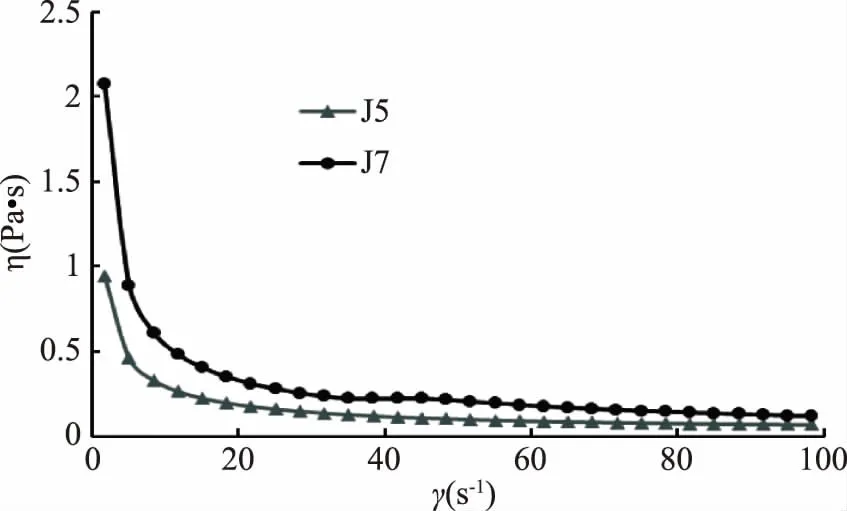
图4 两株单胞酿酒酵母菌发酵乳样品表观黏度随剪切速率变化曲线Fig.4 Curves of apparent viscosity with shear rate for fermented dairy products from two Kazachstania unispora
2.5.2 两株单胞酿酒酵母菌发酵乳样的剪切应力随剪切速率的变化 两株单胞酿酒酵母菌发酵乳的剪切应力随剪切速率的变化结果见图5。由图5可知,2 种发酵乳样品的剪切应力随剪切速率的变化曲线都出现类似环状曲线,形成触变环。在触变性实验中得到的触变环其面积的大小可以代表样品触变性的情况,面积越大说明此样品的结构恢复速度越慢,越小则恢复速度越快。J5发酵乳、J7发酵乳的触变环面积分别为377.63 Pa/s、346.96 Pa/s。从触变环面积可以看出J5发酵乳与J7发酵乳触变环面积相近,J7发酵乳触变环面积相对较小,说明菌株J7发酵出的乳结构恢复速度快,发酵性能好。

图5 两株单胞酿酒酵母菌发酵乳样品剪切应力随剪切速率变化曲线Fig.5 Curves of shear stress with shear rate for fermented dairy products from two Kazachstania unispora
2.5.3 两株单胞酿酒酵母菌发酵乳频率扫描 两株单胞酿酒酵母菌发酵乳样品的频率扫描结果见图6。由图6可知,在0.1~10 Hz的线性粘弹性范围内,随着扫描频率的增大,2个样品的G′和G″都呈现增加趋势,且每个样品的G′值都高于G″的值,体现出了类凝胶的特性。通过测定比较2种单胞酿酒酵母菌制备的发酵乳的粘弹性,结果发现J7发酵乳G′及G″值均高于J5发酵乳的G′及G″值,表明,菌株J7制备的发酵乳具有较高的粘弹性,且J7具有更好的发酵性能。
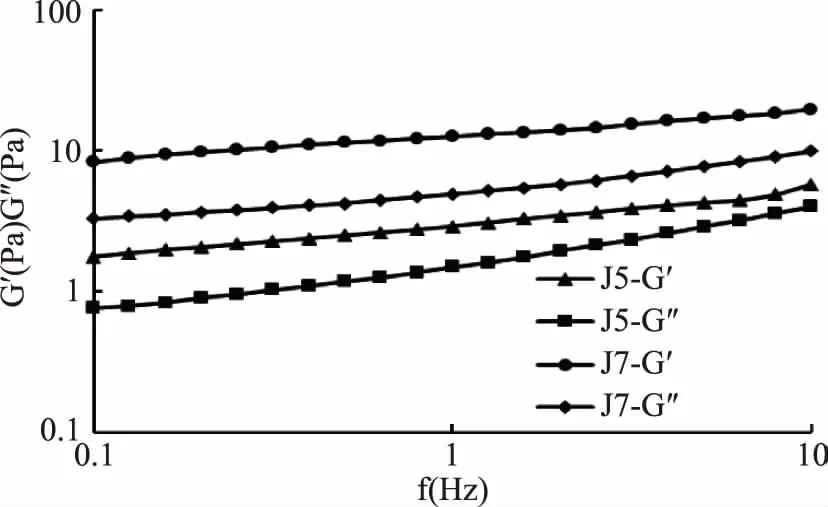
图6 两株单胞酿酒酵母菌发酵乳样品弹性模量G′和黏性模量G″随频率变化曲线Fig.6 Curves of elastic modulus and viscous modulus with frequency for fermented dairy products from two Kazachstania unispora
3 结论
从西藏灵菇中分离的两株单胞酿酒酵母均具有较高的产胞外多糖的能力,菌株J7胞外多糖产量高于菌株J5,菌株J7的发酵特性明显优于菌株J5,且 J7发酵乳具有较好的组织状态和滋气味,综合而言,菌株J7具有一定的应用潜力。
2株单胞酿酒酵母菌为正触变流体,其触变环面积菌株J7<菌株J5,即J7发酵乳结构恢复能力较强;菌株J7发酵乳较菌株J5具有较高的表观黏度;菌株J5及J7发酵乳的G′值都高于G″值,均表现类固体的特性,且菌株J7发酵乳表现出较高的黏性和弹性。
[1]刘慧,谭锋,董雨蒙,等.功能性开菲尔酸奶最佳发酵条件的研究[J].中国乳品工业,2003(1):26-27.
[2]GracielaL G,Analia G A,GracielaA L D. Chemical and microbiological characterization of kefir grains[J].Journal of Dairy Research,2001,68:639-652.
[3]杨希娟,师俊玲,樊明涛.西藏灵菇牛乳发酵液中的菌相与物质变化[J].中国食品学报,2007,7(4):42-46.
[4]蔚晓敏,程菲儿,张苗青,等.藏灵菇发酵乳中乳酸菌的分离鉴定及其应用研究[J].山西农业大学学报:自然科学版,2013(5):436-440.
[5]Zhou J Z,Liu X L,Jiang H H,et al. Analysis of the microflora in Tibetan kefir grains using denaturing gradient gel electrophoresis[J]. Food Microbiology,2009,26(8):770-775.
[6]Ruas M S,Hugenholtz J,Zoon P. An overview of the functionality of exopolysaccharides produced by lactic acid bacteria[J]. International Dairy Journal,2002,12(2/3):163-171.
[7]刘慧,熊利霞,易欣欣,等.藏灵菇中高产胞外多糖乳酸菌的筛选及其发酵性能的研究[J]. 食品科学,2007,28(5):211-215.
[8]马宇骥,李健,刘鲁蜀,等.藏灵菇研究现状及分析[J]. 食品工业,2016(12):201-204.
[9]王辑,田政,赵笑,等.藏灵菇发酵产胞外多糖的影响因素及其应用研究[J]. 食品工业科技,2015(18):203-208.
[10]董健,陈历俊,姜铁民,等.西藏灵菇颗粒中菌种的分离鉴定[J].食品科技,2015,40(1):6-9.
[11]Ahmed Z,Wang Y P,AnjumN,et al. Characterization of exopolysaccharide produced by Lactobacillus kefiranofaciens ZW3 isolated from Tibet kefir-Part II[J]. Food Hydrocolloids,2013,30(1):343-350.
[12]Jiang S J,Qlan F,Ren X H,et al. Studies on the preliminary characterization of a novel exopolysaccharide produced by streptococcus thermophilus strain from Tibetan kefir grain[J].Advanced Materials Research,2013,690/693:1374-1377.
[13]Qin Q Q,Xia B S,Xiong Y,et al. Structural characterization of the exopolysaccharide produced by Streptococcus thermophilus 05-34 and its in situ application in yogurt[J]. Journal of Food
Science,2011,76(9):C1226-C1230.
[14]Wang Y P,Li C,Liu P,et al. Physical characterization of exopoloysaccharide produced by Lactobacillus plantarum KF5 isolated from Tibet kefir[J]. Carbohydrate Polymers,2010,82(3):895-903.
[15]徐梦梦,孟岳成.热杀菌处理对搅拌型酸奶流变性质影响的研究[J].食品科技,2013,38(5):62-68.
[16]王刚,刘娟,陈光,等.产D-乳酸假肠膜明串珠菌生长特性分析[J].湖北农业科学,2015,55(5):1239-1241.
[17]Wang Y P,Ahmed Z,Wu F,et al. Physicochemical properties of exopolysaccharide produced by Lactobacillus kefiranofaciens ZW3 isolated from Tibet kefir[J]. International Journal of Biological Macromolecules,2008,43(3):283-288.
[18]吕晓鹏. 黑果枸杞多糖的分离纯化与结构表征研究[D].西安:西北大学,2012.
[19]梁雪.产胞外多糖酵母菌株的筛选鉴定及多糖结构初步分析[D].哈尔滨:东北林业大学,2010.
[20]邵东燕.西藏灵菇乳的发酵机制及其纯种复合发酵剂研究[D].杨凌:西北农林科技大学,2008.
[21]王玉华,郑明珠,关晓玲,等.2株滋味与气味乳酸菌的筛选及其生长特性的研究[J].中国乳品工业,2005,33(11):7-10.
[22]Guizel Z B,Seydim A C,Greene A K,et al. Determination of organic acids and volatile flavor substances in kefir during fermentation[J]. Journal of Food Composition and Analysis,2000(13):35-43.
[23]葛奉娟,王欲晓,周俊,等.重铬酸钾氧化比色法和气相色谱法定量分析发酵液中乙醇的比较研究[J].徐州工程学院学报(自然科学版),2011,26(2):64-68.
[24]吕晓鹏.黑果枸杞多糖的分离纯化与结构表征研究[D].西安:西北大学,2012.
[25]王松松,陈庆森. 3种发酵乳制品流变性质的比较与分析[J].食品科学,2011,32(19):7-11.
温研,张英华,赵新淮. 脱脂乳的氧化交联处理以及对凝固型酸奶流变学的影响[J].食品与发酵工业,2011,37(8):11-15.
[26]刘慧,李兰平,熊利霞,等.功能性开菲尔酸奶复合发酵剂的研制[J].食品科学,2005,26(12):139-143.
[27]曹永强,王辑,赵笑,等. 植物乳杆菌 YW11 生产胞外多糖的发酵条件研究[J].食品科学技术学报,2016,34(1):42-49.
[28]杨同香,仲玉备,吴孔阳. 高产胞外多糖乳酸菌的筛选及其在发酵乳中的应用[J].食品科技,2016,41(2):26-29.
[29]Marshall V M. Fermented milks and their future. I Micrological aspects[J]. J Dairy Sci,1987,54:559-574.
