海月水母(Aurelia aurita)精巢发育及精子的超微结构*
2018-01-22陈昭廷顾志峰刘春胜陈四清刘长琳
陈昭廷 周 洋 顾志峰 刘春胜① 陈四清① 刘长琳
(1. 海南大学南海海洋资源利用国家重点实验室 海口 570228; 2. 海南大学海洋学院 热带生物资源教育部重点实验室海口 570228; 3. 中国水产科学研究院黄海水产研究所 青岛 266071)
海月水母隶属刺胞动物门(Cnidarian)钵水母纲(Scyphozoa)旗口水母目(Semaeostomeae)海月水母属(Aurelia), 是世界广布性水母物种, 多分布于近岸半封闭海湾地区, 其暴发可堵塞电厂管道、破坏海洋生态系统和渔业资源结构, 从而造成巨大经济损失(Mills, 2001; Dong et al, 2010; 王建艳等, 2012; 王世伟等, 2012; 孙松, 2012; Liu et al, 2015)。在生物进化过程中, 海月水母所属的刺胞动物是最为原始的真后生动物, 是其他高等多细胞动物的起点(周春娅等,2013)。它们历经 6亿多年的进化历史和环境变迁而保持种群能长盛不衰, 与其特殊的繁殖方式密切相关, 因此开展海月水母生活史研究对解析其种群动态变化极为重要(孙松, 2012)。
海月水母的生活史分为两个阶段, 即浮游的水母体阶段和底栖的螅状体阶段(Hernroth et al, 1985;Miyake et al, 1997), 其中有性繁殖是海月水母螅状体种群补充的重要来源之一。目前, 针对该物种生活史研究主要集中在螅状体阶段, 而对于浮游阶段, 尤其是有性繁殖过程鲜有报道。我们前期利用显微观察方法对海月水母的精巢发育和排精过程进行了初步研究, 然而对其发育过程中的内部组织结构变化及精子超微结构相关工作尚未了解(陈昭廷等, 2015)。
基于此, 本文拟通过石蜡切片和苏木精-曙红染色(hematoxylin-eosin straining, HE)技术开展海月水母精巢发育过程研究, 并利用扫描电镜和透射电镜对海月水母精子超微结构进行观察, 其结果对于丰富海月水母繁殖生物学知识具有重要意义。
1 材料与方法
1.1 实验材料
实验所用海月水母螅状体由中国科学院海洋研究所提供。螅状体经暂养后, 放置于(13±1)°C条件下,低温诱导3周, 使其横裂产生碟状体。
选取不同规格的健康活泼的雄性海月水母作为实验对象, 所选个体的具体体型参数如表1所示。
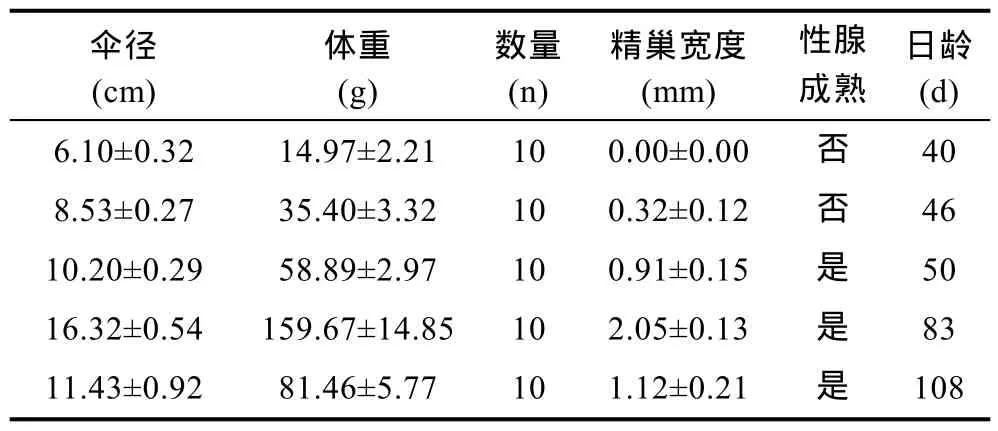
表1 海月水母形态参数Tab. 1 Medusae of Aurelia aurita used in this study
1.2 实验方法
1.2.1 海月水母的培育管理 碟状体至水母体变态前阶段: 初生碟状体养殖于 0.5m×0.5m×0.5m的塑料水槽中, 充气培养, 每日投喂足量卤虫无节幼体 2次(以碟状体胃中是否充满卤虫无节幼体为标准), 投喂2h后换水50%。
水母体阶段: 将变态完全的水母体从塑料水槽转到圆形亚克力水母缸(其中养殖室直径 77cm, 厚度30cm, 转速 2r/min)中进行培养, 每日投喂足量卤虫无节幼体2次(以每次水母体四个马蹄形胃中充满卤虫无节幼体为标准), 投喂 4h后换水 50%。每周清洗水母缸一次。
实验所用海水为经过二级砂滤的自然海水, 水温22°C 左右, 盐度 28—30, pH7.8—8.2, 溶解氧≥6mg/L。1.2.2 海月水母精巢组织学观察 取表 1所示各发育阶段海月水母生殖腺, 切成 0.5cm长的组织片,于Bouin’s液中固定24h; 梯度酒精脱水; 石蜡渗透,包埋; 常规组织切片 5μm; 爱氏苏木精曙红(雷根生物技术有限公司, 北京)染色。在 Olympus显微镜(Olympus AX, 日本)(目镜 10×)下观察每组海月水母的性腺发育状况。性腺发育过程描述方法参照Drummond等(2006)并加以改进。
1.2.3 海月水母精子的电镜观察 参照陈昭廷等(2015)的方法对性腺成熟的海月水母催熟排精, 取精子细丝备用。
扫描电镜精子样品制备与观察: 采集刚排出的精子细丝于 25mL样品管中, 加入海水进行稀释, 充分混匀后, 取1mL精子稀释液于5mL EP管中, 加入2.5%的戊二醛(0.2mol/L PBS配制, pH7.2, 4°C)固定样品, 磷酸缓冲盐溶液(phosphate buffer saline, PBS)漂洗。酒精梯度脱水后, 进行乙酸异戊脂置换。采用二氧化碳临界点干燥器(XD-1型, 美国Eiko公司)干燥,用离子镀金仪(IB-3型, Eiko公司, 美国)喷金镀膜,用扫描电镜(JSM-840, JEOL公司, 日本)观察。
透射电镜精子样品制备与观察: 采集刚排出的精子细丝于5mL样品管中, 加入海水进行稀释, 充分混匀后, 2000r/min离心5min, 弃上清液。PBS缓冲液冲洗, 1%锇酸4°C后固定4h。PBS缓冲液冲洗后, 乙醇系列梯度脱水, Epon812环氧树脂(中兴百瑞, 北京)包埋。Ultracut E超薄切片机(Ultracut EUItramicrotome,Reichert-Jung公司, 德国)半薄切片, 甲苯胺蓝染色,半薄定位。醋酸双氧铀硝酸铅染色。用透射电镜(JEM-1200EX, JEOL公司, 美国)观察。
2 结果与分析
2.1 海月水母精巢发育组织学分期
根据滤泡的形态变化及滤泡中生殖细胞的发育阶段, 将海月水母的精巢发育分为 4个时期: 增殖期、生长期、成熟期和排放期。
增殖期: 雄性生殖腺内滤泡逐渐出现, 滤泡壁不明显, 滤泡中逐渐形成精原细胞, 胞径约为 7.2—10.3μm。此期未见精子细胞及精子出现(图1a)。
生长期: 滤泡壁逐渐变得清晰, 滤泡中大部分为初级精母细胞, 也存在个别的精原细胞。初级精母细胞排列紧密, 逐渐形成次级精母细胞, 胞径约为 1.8—3.4μm(图 1b)。
成熟期: 滤泡与滤泡之间界限明显, 滤泡中存在次级精母细胞、精子细胞及成熟的精子, 且成熟的精子占有较大比例。精子细胞中细胞核占的比例较大,着色较深, 胞质不明显。精子头部着色较深, 体积最小。精小囊界限开始模糊, 成熟精子移动到滤泡中央区(图 1c, d)。
排放期: 滤泡壁增厚, 成熟精子几乎占满整个滤泡(图1e), 有的滤泡由于成熟精子的排放出现空腔(图1f)。
同一精巢不同部位的滤泡处于不同发育时期,如图1a中滤泡处于增殖前期和增殖期, 图1c中滤泡处于成熟期和排放期。此外, 通过观察发现, 雄性个体排精周期可达2周以上。
2.2 海月水母精子超微结构
2.2.1 扫描电镜观察 海月水母精子呈长尖辣椒状, 由头部、中段和尾部组成, 全长约为33.62μm(图2a)。头部长度约为 5.84μm, 表面凹凸不平, 具顶体,顶体细长呈锥形, 约为1.75μm(图2b)。尾部主要为细长的鞭毛, 长度约为27.78μm(图2a)。
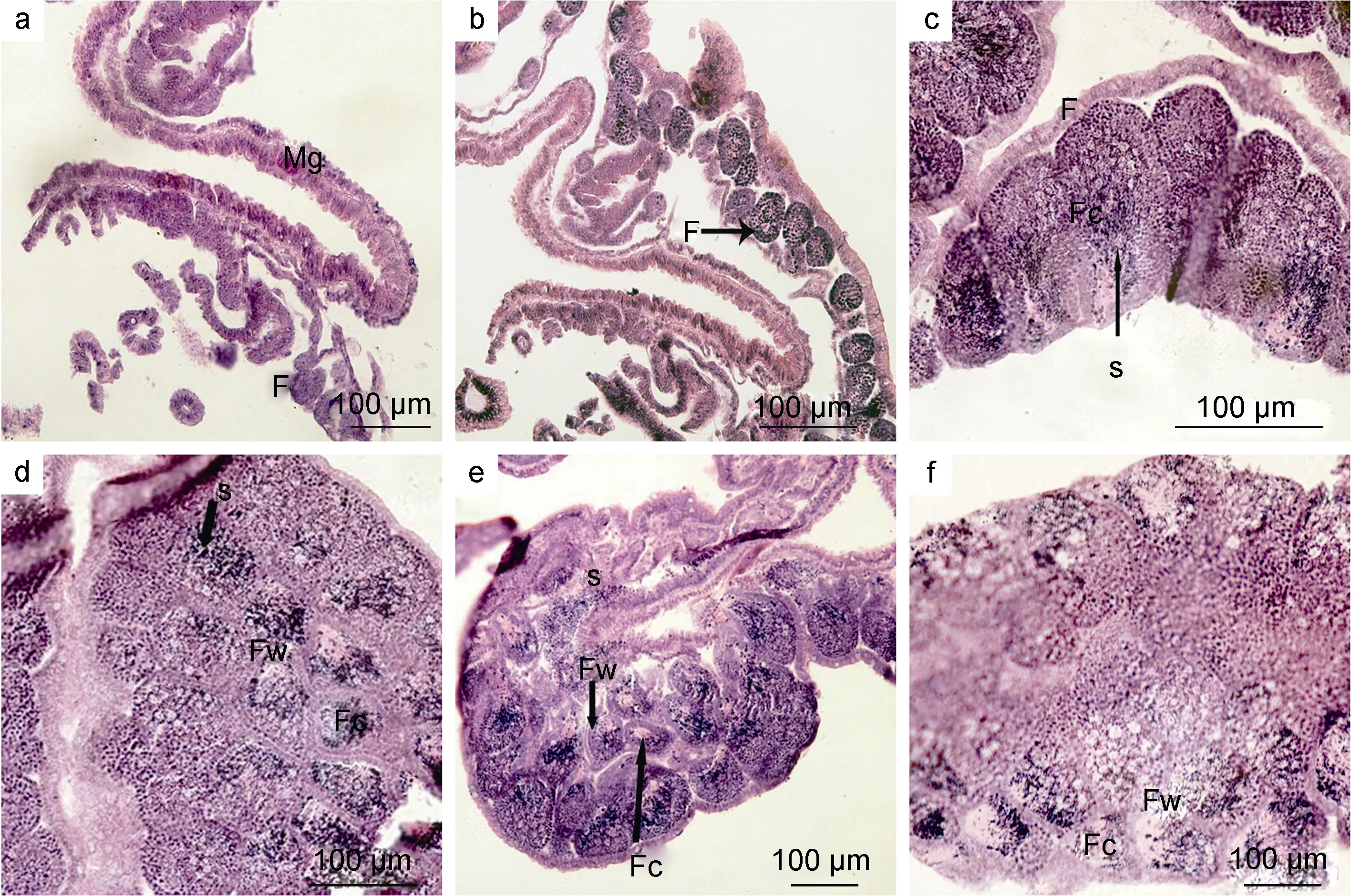
图1 海月水母精巢各发育阶段Fig. 1 The developmental stages of A. aurita testis注: a. 增殖期: 精巢逐渐开始发育, 出现滤泡(F); b. 生长期: 滤泡逐渐增大, 内部出现颗粒状精母细胞; c. 成熟期(纵切)和d. 成熟期(横切): 滤泡壁增厚(Fw), 滤泡腔(Fc)中出现大量成熟精子; e. 排放期: 大量成熟精子开始排放; f. 排放后期: 部分滤泡出现空洞, 开始萎缩。Mg. 生殖腺; F. 滤泡; Fc. 滤泡腔; Fw. 滤泡壁; s. 精子。
2.2.2 透射电镜观察
(1) 头部
由顶体和细胞核构成, 质膜与核膜明显。质膜表面不平整, 与核膜之间有较大空隙, 两者间具细胞质,电子密度较低。顶体电子密度不均匀, 前端电子密度高, 无亚顶体腔, 顶体后方为细胞核, 两者之间界限明显(图 2c)。细胞核为钝圆锥形, 稍微弯曲, 长度约为 4.15μm, 前端直径约为 0.31μm, 后端直径约为1.54μm(图2d)。核内染色质致密, 电子密度最高。核后端形成较浅的核后窝, 与近端中心粒相连。
(2) 中段
海月水母精子中段不发达, 由中心粒复合体和线粒体构成, 具袖套结构(图2e、f)。纵切面上可见1—2个线粒体在细胞核后端与细胞核紧密相连, 基体突出, 与轴丝相连, 形成鞭毛。中心粒复合体主要由近端中心粒和基体组成, 由横切片可知, 近端中心粒与基体呈“T”型排列, 基体由 9组三联微管组成, 无中央微管对(图2g中g′所示)。线粒体为 4—5个, 圆环状排列, 长径约为 1.03μm, 线粒体电子密度不均匀, 近心处电子密度高于离心处(图 2g), 线粒体脊明显可见。袖套较浅, 位于线粒体下方, 袖套内膜与鞭毛外膜部分融合, 袖套腔很小, 呈卵圆形, 长径约为267nm, 左右对称(图 2e)。
(3) 尾部
尾部为一条细长的鞭毛, 直径约为443nm, 由内部的轴丝和外部的质膜构成(图2h)。轴丝由基体向后延伸生成, 具有典型的“9+2”双联体微管结构(图 2i),质膜呈波浪状, 无侧鳍。
3 讨论
3.1 海月水母精巢发育分期
海月水母生活史复杂, 包括营附着生活的螅状体阶段和营浮游生活的水母体阶段。本研究对海月水母水母体进行室内养殖, 发现其寿命约为5个月, 这与已报道的自然海区的海月水母寿命相似(Miyake et al, 1997; Lucas, 2001)。实验结果表明, 对海月水母水母体而言, 其生命周期中仅有1次生殖腺发育, 待其排精后, 个体也随之自溶死亡。通过对各期的组织切片进行观察分析可知, 同一时期, 不同滤泡发育程度不同, 同一滤泡内不同部位发育程度也略有差异, 但同一精小囊内的生殖细胞发育同步, 由此认为海月水母雄性排精方式为多次连续型。
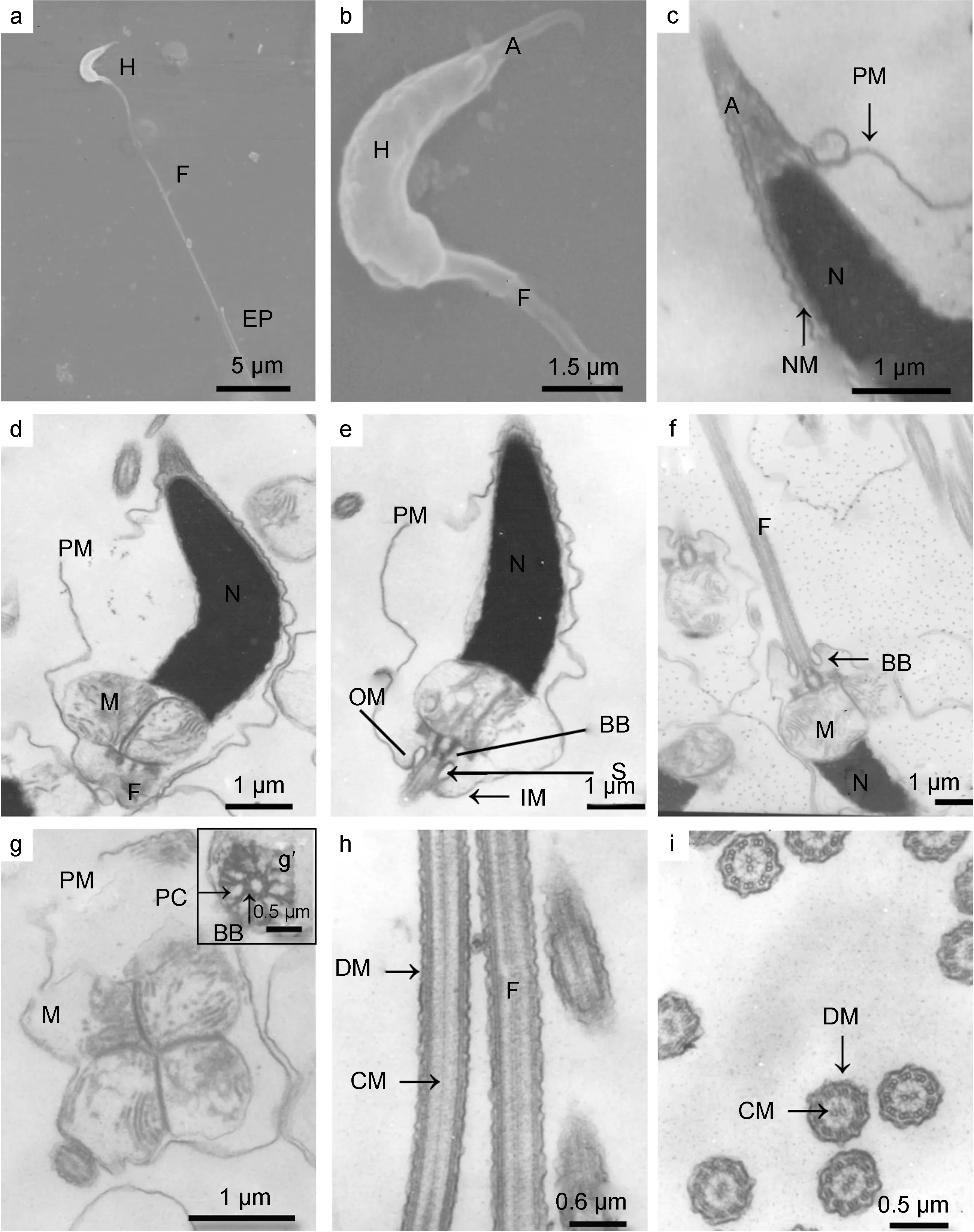
图2 海月水母精子超微结构Fig. 2 The ultrastructure of sperm of A. aurita注: a. 精子, 示头部(H)、鞭毛(F)、尾部末端(EP); b. 精子头部, 示顶体(A); c. 精子头部纵切, 示质膜(PM)、核膜(NM)及细胞核(N); d. 精子头部和中段纵切面, 示线粒体(M); e和f. 精子中段纵切面, 示基体(BB)、袖套(S)、袖套内膜(OM)及袖套内膜(IM); g(g′). 精子中段横切面, g示线粒体结构, g’示基体与近端中心粒(PC)呈“T”形排列; h.鞭毛纵切面, 示中心微管(CM)及双联体微管(DM); i. 鞭毛横切面, 示中心微管及双联体微管的“9+2”结构。
海月水母的精巢发育过程, 与某些贝类相似, 如中国蛤蜊(Mactra chinensis)、菲律宾蛤仔(Ruditapes philippinarum)等(Drummond et al, 2006; 杨林等,2010)。贝类在形成期前还有一个休止期, 无性腺, 难以辨别雌雄, 大部分为结缔组织。在形成期, 产生滤泡。随着发育的进行, 滤泡逐渐增大, 滤泡内的生殖细胞也发生相应的变化, 由最初的精原细胞逐渐发育为成熟的精子, 最终排出体外。排放期后, 滤泡萎缩, 进入耗尽期。据陈昭廷等(2015)对海月水母精巢成熟过程的报道, 海月水母的精巢发育起始于生殖上皮, 精小囊不断增多, 精巢开始发育。由于是形态学的观察结果, 其认为这种结构与小叶型的鱼类精巢发育类似。通过组织切片观察, 我们认为海月水母的这种精巢发育方式更类似于贝类滤泡的发育过程,但有所差异。海月水母的精巢发育分期并不如贝类明显, 其发育不同步, 即在生殖腺的不同部位, 有多个发育时期同时存在。这与贝类精巢发育过程显然不同,更类似于仿刺参(Apostichopus japonicus)和某些硬骨鱼类的精巢发育过程(庞震国, 2006; 温海深等,2007)。海月水母具有四个马蹄形生殖腺, 每个生殖腺发育程度并不同步, 这种模式更有利于保证排精的持续性, 对于种族的延续具有重要意义。
3.2 海月水母精子超微结构
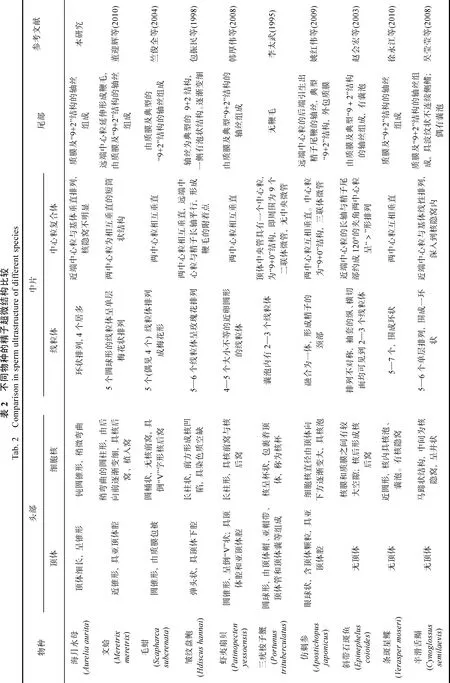
关于水母类精子超微结构的研究未见报道, 本文首次对海月水母的精子超微结构进行了研究。通过对比部分贝类、甲壳类、棘皮动物及硬骨鱼类的精子超微结构(表 2), 分析讨论了海月水母精子超微结构与其他物种的异同。
(1) 精子头部
海月水母精子头部包括顶体和细胞核两部分。顶体是精子头部的重要组成部分, 其结构的复杂程度往往能反应精卵结合的难易。体外受精的大多数双壳贝类均具有顶体结构, 这是由于双壳贝类大多为体外受精且卵膜结构复杂, 无受精孔, 精子入卵部位随机, 要发生复杂的顶体反应才能完成精子入卵(董迎辉等, 2010)。而大多数硬骨鱼, 如斜带石斑鱼(Epinephelus coioides)、条斑星鲽(Verasper moseri)、半滑舌鳎( Cynoglossus semilaevis)等, 其精子无顶体,这是由于其卵子具有受精孔结构, 精子入卵无需进行顶体反应(赵会宏等, 2003; 吴莹莹等, 2008; 徐永江等, 2010)。海月水母的顶体尖细, 呈锥形, 这与文蛤(Meretrix meretrix)、毛蚶(Scapharca subcrenata)、虾夷扇贝(Patinopecten yessoensis)的精子顶体相类似。由此可以推测, 海月水母精子入卵过程需要进行复杂的顶体反应(竺俊全等, 2004; 韩厚伟等, 2008;董迎辉等, 2010)。
海月水母精子的细胞核为稍微弯曲的钝圆锥形,电子密度很高, 无核泡, 形状类似于文蛤、仿刺参的细胞核形状(姚红伟等, 2009; 董迎辉等, 2010), 然而其细胞核无核前窝, 核后窝及植入窝亦不明显, 显然与硬骨鱼类有较大区别, 如半滑舌鳎(吴莹莹等,2008)。由此认为海月水母的细胞核在进化程度上较为原始。
在本研究中还发现, 海月水母的核膜和质膜之间具丰富的细胞质, 其与已报道的贝类、棘皮动物及硬骨鱼类显著不同。从生殖生物学角度, 精子主要为卵子受精提供遗传物质, 精子头部的关键物质即为染色质, 因此过多的细胞质是一种不完善的进化标志。此外,实验发现少数海月水母精子存在双核现象, 该现象或许是精子发育畸形造成, 其机制尚待进一步研究。
(2) 精子中段
海月水母精子中段包括线粒体、中心粒复合体和袖套结构。线粒体为4个, 形状不规则, 线粒体脊明显, 其个数与虾夷扇贝的类似, 而表2所列多数物种的线粒体数以 5个居多, 三疣梭子蟹(Portunus trituberculatus)线粒体为2—3个, 仿刺参的线粒体甚至融合为一体。线粒体数目的多少是区别种属的特征之一, 也是受精方式的适应和生殖进化的象征(叶素兰等, 2008)。
中心粒复合体由近端中心粒和基体组成, 两者的排列方式与文蛤、毛蚶、皱纹盘鲍(Hdiscus hannai)等多数物种相似(包振民等, 1998; 竺俊全等, 2004;董迎辉等, 2010), 呈“T”型, 不同于斜带石斑鱼的“>”型及半滑舌鳎等高等鱼类的线性排列方式(赵会宏等,2003; 吴莹莹等, 2008)。这种垂直排列的方式被认为是一种原始的排列方式(徐永江等, 2010)。
海月水母具有袖套结构, 这与半滑舌鳎及星突江鲽(Platichthys stellatus)的精子相类似(吴莹莹等,2008; 刘长琳等, 2009)。海月水母精子袖套腔封闭,袖套内膜与尾部质膜相互融合, 更类似于星突江鲽的精子(刘长琳等, 2009), 但与后者相比, 前者袖套较为发达, 可将线粒体完全包裹。袖套内除线粒体之外, 还存在一些由高尔基体退化形成的囊泡(管汀鹭,1990)。海月水母袖套相对发达实际上是其进化不完全的特征之一。
(3) 精子尾部
海月水母精子的尾部为鞭毛, 由轴丝和质膜组成, 轴丝为典型的“9+2”结构。这与表 2中的大多数物种精子尾部形似, 而不同于三疣梭子蟹(李太武,1995)。鞭毛的作用主要为游泳, 而三疣梭子蟹是以精荚的形式进行受精的, 故不存在鞭毛结构。本研究中还发现了少数精子中存在2条轴丝共质膜的现象, 这与韩厚伟等(2008)报道的虾夷扇贝及姚红伟等(2009)报道的仿刺参的鞭毛中存在 2条轴丝共质膜的现象相类似。韩厚伟等(2008)认为, 这是由于海水污染致畸造成的, 其机理究竟如何还未可知。海月水母的鞭毛无侧鳍, 也无囊泡存在, 这与一些硬骨鱼类的精子鞭毛有较大差异(吴莹莹等, 2008)。
4 结论
海月水母生殖系统较为原始, 其精巢是由两层外膜包裹的大量长圆形滤泡组成, 发育过程可分增殖期、生长期、成熟期和排放期四个阶段。海月水母精子全长约 33.62μm, 其头部呈长尖辣椒状, 具顶体,核膜与质膜空隙较大, 充满细胞质; 中部具有较发达的袖套结构, 袖套内膜与鞭毛质膜相互融合, 线粒体以 4个居多, 呈圆环状排列; 尾部细长, 由质膜和轴丝组成, 轴丝横切面为典型的“9+2”结构。综上所述,海月水母雄性生殖系统和精子结构均较为原始, 但其精子具有分批成熟排放的特性, 从而延长了雄性海月水母的有性生殖周期, 有利于种族的延续。
王世伟, 张光涛, 孙 松等, 2012. 2011年夏季胶州湾三种大型水母的种群动态研究. 海洋与湖沼, 43(3): 471—479
王建艳, 于志刚, 甄 毓等, 2012. 环境因子对海月水母生长发育影响的研究进展. 应用生态学报, 23(11): 3207—3217
叶素兰, 吴常文, 余治平, 2008. 曼氏无针乌贼(Sepiella maindroni)精子形成的超微结构. 海洋与湖沼, 39(3):269—275
包振民, 胡景杰, 姜 明等, 1998. 皱纹盘鲍(Haliotis discus hannai)精子的超微结构. 青岛海洋大学学报, 28(2): 283—287
刘长琳, 庄志猛, 陈四清等, 2009. 星突江鲽精子的超微结构.渔业科学进展, 30(4): 14—20
孙 松, 2012. 对黄、东海水母暴发机理的新认知. 海洋与湖沼, 43(3): 406—410
李太武, 1995. 三疣梭子蟹精子的发生及超微结构研究. 动物学报, 41(1): 41—47
杨 林, 李 琪, 闫红伟等, 2010. 山东沿海中国蛤蜊的繁殖生物学特性. 中国水产科学, 17(3): 514—520
吴莹莹, 柳学周, 王清印等, 2008. 半滑舌鳎精子的超微结构.海洋学报, 29(6): 167—171
陈昭廷, 李 琪, 陈四清等, 2015. 海月水母精巢发育及排精过程的观察. 动物学杂志, 50(1): 131—140
竺俊全, 杨万喜, 2004. 毛蚶与青蚶精子超微结构及其所反映的蚶科进化关系. 动物学研究, 25(1): 57—62
周春娅, 朱 玲, 潘滢等, 2013. 海蜇(Rhopilema esculentum)Wnt5基因: cDNA克隆、基因组结构与表达. 海洋与湖沼,44(4): 1115—1122
庞震国, 2006. 刺参的性腺发育及受精细胞学研究. 青岛: 中国海洋大学硕士学位论文, p32—39
赵会宏, 刘晓春, 林浩然等, 2003. 斜带石斑鱼精子超微结构及盐度、温度、pH对精子活力及寿命的影响. 中国水产科学, 10(4): 286—292
姚红伟, 宋冠男, 郭 晋等, 2009. 仿刺参精子形态与超微结构的研究. 大连海洋大学学报, 24(S): 73—76
徐永江, 柳学周, 刘新富等, 2010. 条斑星鲽精子超微结构研究. 渔业科学进展, 31(5): 8—14
董迎辉, 林志华, 柴雪良等, 2010. 文蛤(Meretrix meretrix)精子的超微结构及精子入卵过程的电镜观察. 海洋与湖沼,41(5): 726—732
韩厚伟, 高悦勉, 刘春凤等, 2008. 虾夷扇贝精子的超微结构.动物学杂志, 43(1): 75—81
温海深, 王连顺, 牟幸江等, 2007. 大泷六线鱼精巢发育的周年变化研究. 中国海洋大学学报, 37(4): 581—585
管汀鹭, 1990. 金鱼精子头部的液泡结构. 科学通报, 33(9):719—720
Dong Z J, Liu D Y, Keesing J K, 2010. Jellyfish blooms in China:dominant species, causes and consequences. Marine Pollution Bulletin, 60(7): 954—963
Drummond L, Mulcahy M, Culloty S, 2006. The reproductive biology of the Manila clam, Ruditapes philippinarum, from the North-West of Ireland. Aquaculture, 254(1—4):326—340
Hernroth L, Gröndahl F, 1985. On the biology of Aurelia aurita(L.): 2. Major factors regulating the occurrence of ephyrae and young medusae in the Gullmar Fjord, western Sweden.Bulletin of Marine Science, 37(2): 567—576
Liu C S, Zhuang Z M, Chen S Q et al, 2015. A large-scale breeding experiment and observations on development of Cyanea nozakii (Scyphozoa, Cyaneidae) from fertilized eggs to larval medusae. Hydrobiologia, 754(1): 113—123
Lucas C H, 2001. Reproduction and life history strategies of the common jellyfish, Aurelia aurita, in relation to its ambient environment. Hydrobiologia, 451(1—3): 229—246
Mills C E, 2001. Jellyfish blooms: are populations increasing globally in response to changing ocean conditions?Hydrobiologia, 451(1—3): 55—68
Miyake H, Iwao K, Kakinuma Y, 1997. Life history and environment of Aurelia aurita. South Pacific Study, 17(2):273—285
