夏秋季南海北部陆坡区氧化亚氮的分布、产生及海-气交换通量*
2018-01-22任妍妍郑文静叶旺旺张云燕张桂玲
任妍妍 郑文静 叶旺旺 张云燕 张桂玲
(中国海洋大学海洋化学理论与工程技术教育部重点实验室 青岛 266100)
氧化亚氮(N2O)的单分子对全球变暖影响潜力大约是CO2的300倍(IPCC, 2013), 虽然它在大气中的含量约为CO2的1/1000, 但N2O在大气辐射强度的占比仅次于 CO2和CH4。目前大气中N2O的体积浓度较工业革命之前增长了近 20%, 从 1750年的271×10–9增加到 2015 年的 328×10–9(http://www.esrl.noaa.gov/gmd), 并且在过去 30年里以(0.73±0.03)×10–9/a 的速度增长(Ravishankara et al, 2009)。这表明工业革命以来人类活动导致了大气中 N2O的源汇失衡。随着氟氯代物的禁止使用, N2O将成为21世纪大气臭氧层的最大威胁(Ravishankara et al, 2009), 对温室效应的贡献也会更加显著(IPCC, 2007)。
海洋是大气 N2O的第二大自然源, 每年由海洋向大气释放的 N2O约占大气总来源的 1/4(IPCC,2013)。海洋中的 N2O主要由两个过程产生, 即硝化和反硝化, 其中硝化是海洋中 N2O产生的主要过程,反硝化过程对海洋中 N2O的贡献只有 7%—35%(Bange et al, 1999; Freing et al, 2012)。虽然目前已开展了大量有关海洋 N2O的调查研究工作, 但是相对广袤的海洋, 至今所能获得的数据还十分有限, 且N2O的产生和消耗受不同的生物、化学因素和水文物理过程的影响, 因此开展更多不同海洋环境中 N2O的分布和海-气交换通量研究对准确估算海洋对大气N2O的贡献有重要意义。
南海是世界第三大陆架边缘海, 面积约为 3.5×106km2, 平均水深大于 1000m(苏纪兰, 2005), 注入南海的主要河流有珠江、红河和湄公河等(Morton et al, 2001)。河口、陆坡等近海区域受人类影响较大,虽然所占面积较小, 但对 N2O的产生与释放有较大贡献。目前, 国内已经开展了部分对南海 N2O的研究, 研究区域包括南海东北部台湾海峡及吕宋海峡附近海域(徐继荣等, 2006), 珠江口及其邻近海域(Chen et al, 2008), 南海北部海盆(郑立晓等, 2009)及海南东部沿岸(Han et al, 2013), 但这些研究均主要关注特定季节南海 N2O的分布与通量, 而忽略了季节变化的影响。本文在前人研究的基础上, 对南海北部典型陆坡区溶解 N2O的分布、产生及其影响因素进行了探讨, 并估算了不同季节南海北部陆坡区向大气释放的 N2O海-气交换通量以及其对全球海洋释放N2O的区域性贡献, 丰富了南海N2O数据库。
1 材料与方法
1.1 研究区域和样品采集
分别于2014年10月和2015年6月搭乘“南锋”号调查船对南海北部陆坡区进行了调查, 调查海区及采样站位如图1所示。各个层次的海水样品由12L Niskin采水器采集。采样前要先用海水涤荡采样瓶(56.5mL玻璃瓶), 然后用半透明硅胶管将海水缓慢平稳的注入样品瓶中, 注入过程避免产生气泡和漩涡, 当溢出的海水体积大约是玻璃瓶体积的 1.5—2倍时, 缓慢抽出硅胶管, 加入 0.5mL饱和氯化汞(HgCl2)溶液以抑制微生物活动, 然后用带聚四氟乙烯内衬的橡胶塞和铝盖将瓶口密封, 并将样品瓶上下颠倒几次, 使 HgCl2均匀分散开, 取双样, 最后将样品置于低温避光条件下保存, 并尽快带回陆地实验室进行测定。利用船载CTD在采样时同步获取现场水温、盐度等数据。
1.2 样品的处理和分析
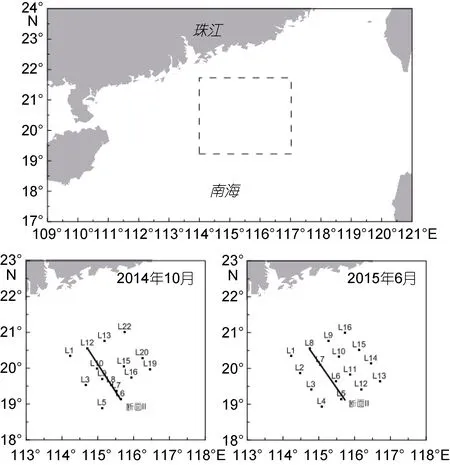
图1 2014年10月和2015年6月南海陆坡区采样站位图Fig.1 Sampling stations at the slope region of the South China Sea (SCS) in October, 2014 and June, 2015
海水中溶解N2O浓度采用静态顶空-气相色谱法测定(Zhang et al, 2010)。向样品瓶内注入5.0mL高纯氮气(>99.999%), 同时排出等体积的水样使瓶内产生顶空, 室温下将样品剧烈振荡 3min后静置 3h以上,当气、液两相达到平衡时, 抽取顶空气体注入气相色谱仪(Agilent HP6890, 配有ECD检测器)进行分离和测定。利用 3种不同浓度的标准气体(0.232×10–6,0.606×10–6和2.980×10–6N2O/N2, 国家标准物质中心)对检测器信号进行校正, 得峰面积与标准气体浓度的关系曲线。测定过程中记录实验室的温度和气压,利用 Weiss等(1980)提供的溶解度数据, 计算出样品中溶解N2O的浓度。该方法测定水样中N2O的检测限为1.0 nmol/L, 精密度约为2%。
1.3 饱和度及海-气交换通量的计算
海水中溶解 N2O 的饱和度(%)和海-气交换通量(μmol/(m2·d))分别由下列公式计算:

式中, Cobs为表层海水中溶解 N2O的实测浓度; Ceq是表层海水与大气达到平衡时溶解 N2O的浓度; kw为气体交换速率, 是风速与施密特数(Sc)的函数(Raymond et al, 2001)。文献中常用Liss、Merlivat 1986 公 式(Liss et al, 1986)(简 称 LM86)和Wanninkhof 1992公式(Wanninkhof, 1992)(简称W92)来估算 kw的较低值和较高值, 并估算海-气交换通量。最近Wanninkhof (2014)根据过去20年的研究进展更新了气体交换速率和风速之间的关系(W2014)。Nightingale等(2000)提出了 N2000气体交换模型来计算近岸海域的海-气交换通量, 并且其结果接近由大量方法和模型所得到结果的中位数。因此在本文中用这两种方法(W2014, N2000)分别计算海-气交换通量。
2 结果与讨论
2.1 南海陆坡 N2O浓度和饱和度的季节变化及海-
气交换通量
2014年10月和2015年6月南海北部陆坡表层水体温度、盐度、N2O浓度和饱和度如表1所示。秋、夏季表层海水中溶解 N2O的浓度范围分别为 6.82—9.95nmol/L和 6.85—9.07nmol/L, 平均值分别为(8.19±0.79)nmol/L 和(7.72±0.56)nmol/L(平均值±SD),饱和度分别为 132.5%±13.4%和 135.5%±9.7%, 受温度影响, 秋季表层海水中N2O浓度略高于夏季, 但饱和度相差不大。底层海水中溶解 N2O的浓度范围分别为 12.13—28.81nmol/L和 12.53—30.46nmol/L, 平均值分别为(20.3±5.87)nmol/L 和(21.62±4.94)nmol/L。

表1 南海北部陆坡表层水体温度、盐度、N2O浓度、饱和度和海-气交换通量Tab.1 Surface temperature, salinity, N2O concentrations, saturations and air-sea fluxes on continental slope of the SCS
结合文献中与本文相同调查区域的结果(表 1)可以看出, 南海北部陆坡区 N2O浓度和饱和度存在一定的季节变化, 表层 N2O浓度的高值出现在春末夏初(5月)(郑立晓等, 2009), 低值出现在夏季(6、8月)(Han et al, 2013), 而秋季略高于夏季。总的来说,南海北部陆坡区表层N2O浓度季节变化为春末>秋季>夏季。而造成季节差异的原因可能为5月西南季风开始盛行, 降雨量增加, 珠江径流量增大, 携带大量高浓度的 N2O进入南海北部陆坡, 并且此时由于表层水体温度较低且垂直混合均匀, 所以研究区域表层N2O出现较高浓度。6月, 西南季风导致的降雨减弱, 同时温度开始升高, 溶解度降低, 海水层化现象明显, 阻碍了底层较高浓度N2O向表层的扩散, 因此,表层 N2O浓度较低。秋季表层海水温度较夏季略有降低, N2O浓度相应升高。总的来说, 不同季节南海北部陆坡区表层 N2O分布受到水温、陆源输入、物理过程等多种因素的影响。
本文秋季调查海域表层海水 N2O饱和度范围为110.2%—162.6%(132.5%±13.4%), 夏季表层饱和度范围为120.6%—159.4%(135.5%±9.7%)。由表1可以看出, 南海北部陆坡区表层 N2O饱和度的季节变化特征为: 春末最高, 而夏、秋季饱和度值相差不大。各站位表层海水中溶解 N2O在不同季节均处于过饱和状态, 表明南海北部陆坡是大气N2O的净源。
表2列出了已报道的南海不同区域溶存N2O的浓度、饱和度和海-气交换通量, 为避免不同区域分布受到季节变化的影响, 只选取秋季不同研究海域进行讨论。
由表 2, 本文 10月份观测结果略高于 Chen等(2008)2003年9月在珠江口及其邻近海域观测的结果(6.9—8.1nmol/L), 与徐继荣等(2006)2004年9—10月在南海东北部观测的结果((8.11±0.54)nmol/L)基本一致, 本文结果明显高于Han等(2013)2008年8月在南海西北部陆架区(5.51—7.09nmol/L)和海南东部近海((6.28±0.47)nmol/L)台风过后观测的结果。本文测得的秋季南海北部陆坡区表层海水中 N2O的饱和度(132.5%±13.4%)高于已报道的东北部表层水体(119.1%±8.6%) (徐继荣等, 2006)和Han等(2013)报道的南海西北部陆架区(99%—123%)以及海南东部近海(110%±8%)的结果。总的来说, 除了 Han等(2013)在2008年台风过后观测到的不饱和之外, 南海不同区域表层海水N2O均处于过饱和状态, 且本文观测的北部陆坡区饱和度值明显高于已发表的南海其他区域,说明陆坡区的N2O释放量明显高于南海其他区域。

表2 已报道的南海不同海域溶存N2O的浓度、饱和度和海-气交换通量Tab.2 Available concentrations, saturations and air-sea fluxes of dissolved N2O in different parts of SCS
根据现场测得的温度、盐度以及卫星风速, 分别利用N2000公式和W2014公式计算得到各个站位海-气交换通量的范围及平均值如表 1所示。夏季海-气交换通量(单位: μmol/(m2·d))为 1.01—21.57(7.04±6.10)(N2000)和 0.75—22.69(6.94±6.49) (W2014), 秋季海-气交换通量为 1.81—23.81(11.11±6.52) (N2000)和1.73—24.38(11.30±6.81) (W2014)。本文用 N2000 和W2014估算的海-气交换通量结果相差不大, 夏季的海-气交换通量小于秋季, 主要受到风速的影响, 夏季调查期间风速为 2.53—11.85m/s, 平均值为(6.02±2.84)m/s, 秋季风速为 6.27—10.48m/s, 平均值为(8.63±1.43)m/s。本文结果远大于徐继荣等(2006)利用LM86公式估算的南海东北部的结果((0.72±0.36)μmol/(m2·d))和根据Han等(2013)采用W2014公式估算的南海西北部陆架区的结果((1.4±1.3)μmol/(m2·d)), 低于郑 立 晓 等 (2009)的 结 果 (25.56±14.93)(N2000)和(26.29±15.37)(W2014) μmol/(m2·d)。估算海-气交换通量公式的不同可能是导致结果差异较大的一个原因。另外, 风速和季节变化等因素也会导致同一海区 N2O的海-气交换通量存在较大的差异。但是, 结合文献数据和本文调查结果, 总体而言南海北部陆坡区的 N2O海-气交换通量春末高于秋季, 高于夏季, 而同一季节内, 北部陆坡区N2O海-气交换通量明显高于南海东北部和海南东部海域。南海北部陆坡(约23×104km2) (卓海腾等, 2014)占全球海洋面积的0.064%, 根据各季节N2O平均海-气交换通量初步估算出北部陆坡 N2O释放量约为 0.055Tg/a, 约占全球海洋总释放量(11—17Tg/a)(Bange et al, 1996)的0.39%, 说明南海北部陆坡区是N2O释放的活跃海域, 是大气N2O的重要净源。由于目前获得的数据多集中在夏季和秋季, 而且调查区域主要集中在北部陆坡区, 因此只能局部认识南海N2O的释放, 为了深入了解南海N2O的来源、分布、变化规律和产生机制, 今后仍应加强相关研究。
2.2 南海北部陆坡N2O的水平分布
南海北部陆坡不同航次表底层温度、盐度和N2O浓度的水平分布如图2所示。夏、秋季南海表层温度变化范围不大, 底层温度由于受到地形的影响, 随深度的增加而逐渐减小, 等值线与海岸线基本平行, 底层 N2O浓度分布与温度呈相反趋势, 由陆架向陆坡呈逐渐增加趋势。秋季调查海域表层 N2O浓度与盐度无明显相关, 盐度大都在 33.5以上(图 3), 表明该研究区域在秋季受陆源输入影响较小。夏季调查海域盐度低值可达31.5, N2O浓度随盐度升高呈降低趋势(图 3), 表明夏季该海域受到珠江冲淡水的影响。杨阳等(2014)和庞海龙等(2006)研究表明, 夏季西南季风有利于珠江冲淡水向东及向外海扩展, 因此夏季冲淡水对陆架区的影响最大, 其次是春季, 而冬季最弱。秋、冬季黑潮表层流存在3种类型: 北向型、西向型和流套-涡旋型, 后两种入侵南海(郭景松等,2013), 2014年10月调查海域东北部出现较低浓度的N2O可能是穿过吕宋海峡的黑潮分支表层水(王胄等,1997), 2015年6月该区域则表现不明显。
两个航次水体中 N2O浓度与海水温度呈显著相关([N2O]= -0.72t+27.72, n=225, R2=0.903, P<0.0001)(图4), 表明南海陆坡水体中N2O的分布受温度影响显著, 一方面, 温度可以影响N2O在水体中的溶解度,另一方面, 温度也可以影响N2O的生物产生速率, 从而影响整个水层中N2O的分布。

图2 2014年10月和2015年06月表、底层温度(°C)、盐度和N2O浓度(nmol/L)水平分布Fig.2 Distributions of temperature (°C), salinity and N2O (nmol/L) in the surface and bottom waters in October 2014 and June 2015
2.3 N2O的垂直分布
两个航次中断面II的温度、盐度、溶氧DO以及N2O浓度的垂直分布如图5所示。该断面横跨整个陆坡区域。两个航次中各参数层化现象明显, 1000m以浅变化尤为显著。温度随深度增加逐渐减小, 而盐度总体随着深度增加而增大, 除了位于陆架区较浅的(≤120m)站位, 陆坡上各站位在 120—200m 深度出现盐度较高(盐度>34.6)的高盐水团, 与前人的研究结果相符(仇德忠等, 1984; 郭忠信等, 1985; 马云龙等, 2014), 表明存在来自西太平洋的高盐次表层水。DO的浓度随着深度的增加而降低, 在断面最外侧深水区700—1000m水层中出现DO最小值(~82.81μmol/L)。N2O浓度随着深度的增加而增加, 层化现象非常明显。2014年10月在陆坡中部底层水体中出现高浓度N2O(其他断面也存在相同情况), 说明可能存在底部沉积物的释放或者底层水体中的现场生物生产过程。两个航次均在 700m处出现 N2O浓度高值, 对应着DO浓度的低值, 表明存在现场的生物生产过程。两航次中该断面在水深 1000m以下各参数相对稳定,没有明显季节变化。
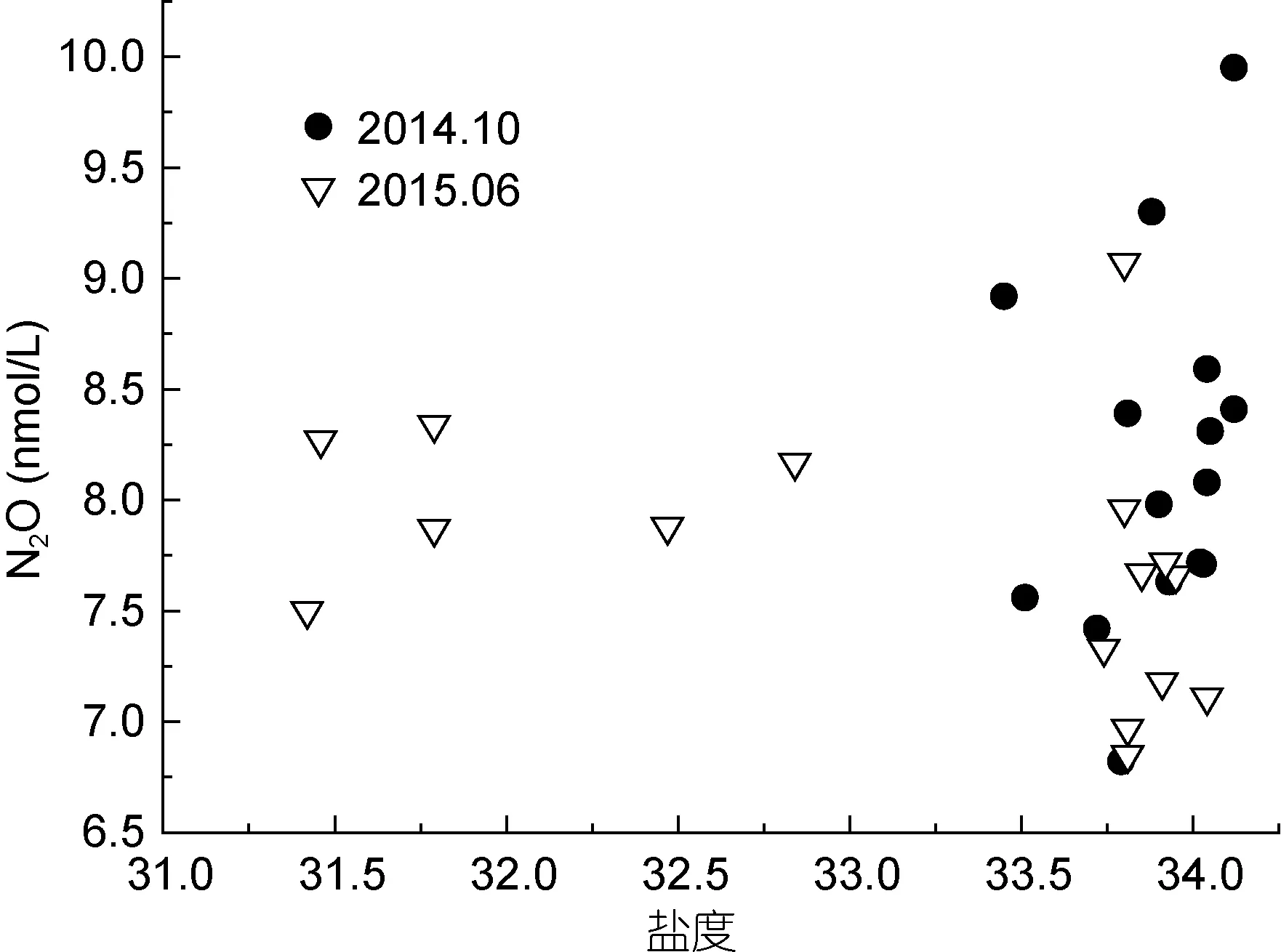
图3 表层N2O浓度与盐度的关系Fig.3 Relationship between N2O concentrations and salinity in surface water
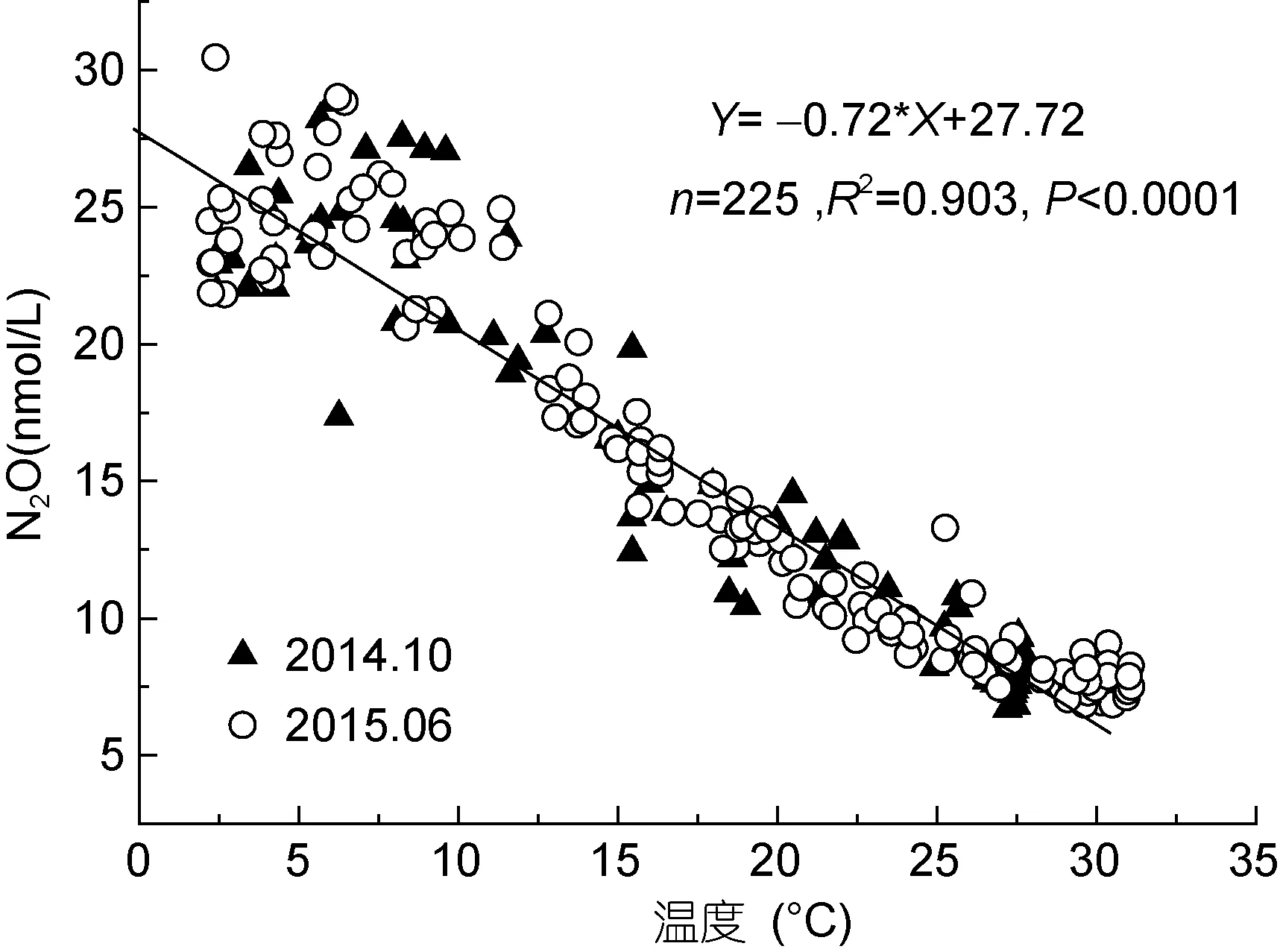
图4 水体中N2O浓度与温度的关系Fig.4 Relationship between N2O concentrations and temperature in the water column
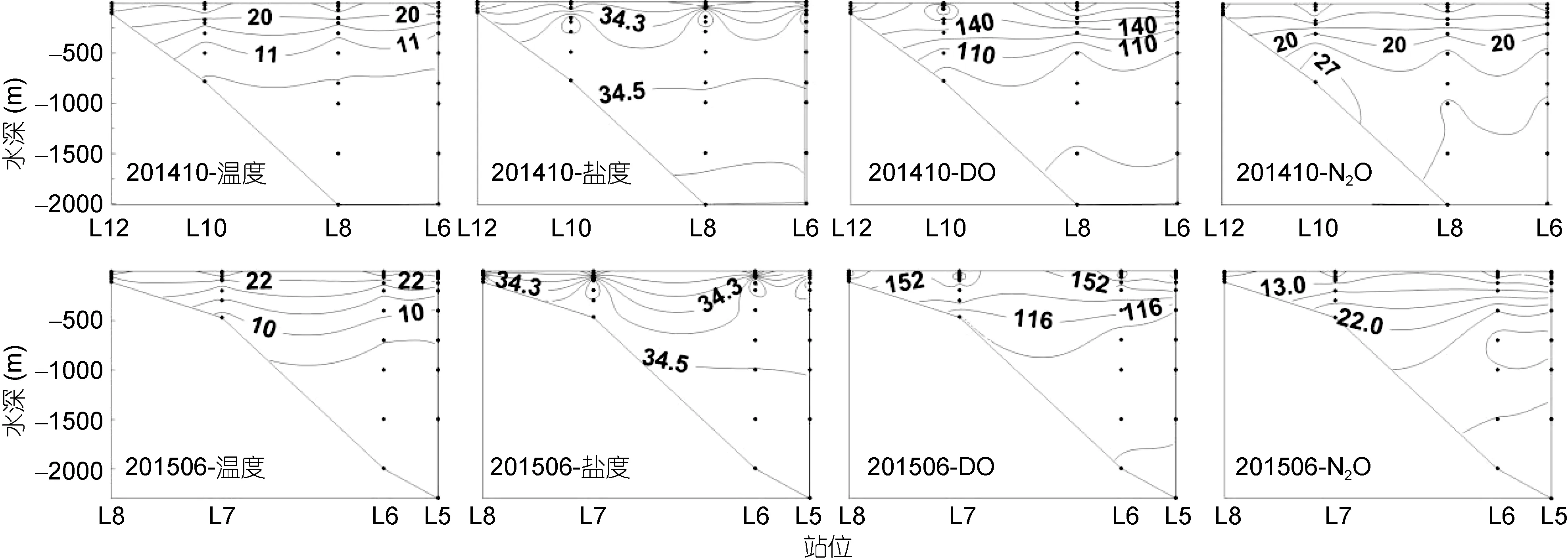
图5 2014年10月和2015年6月南海断面II温度(°C)、盐度、DO(μmol/L)和N2O浓度(nmol/L)的垂直分布Fig.5 Vertical profiles of temperature(°C), salinity, DO (μmol/L) and N2O (nmol/L) along transect II in October 2014 and June 2015
为进一步讨论水体中 N2O的垂直分布, 分别选取了位于陆架、陆坡的部分代表性站位做温度(°C)、盐度、DO(μmol/L)、N2O(nmol/L)以及 NO3¯(μmol/L)的垂直分布(如图6)。
位于南海陆架的L13站(2014年 10月)和L9站(2015年6月), 位置基本相同, 深度分别为 143m和180m。由图6-1可以看出, 秋季混合层可达45m, 混合层内各参数较稳定, 其中 NO3¯浓度较低(<0.03μmol/L)。混合层以下, NO3¯浓度先快速增加再缓慢增加至底部。DO的变化趋势与温度基本相同, 快速减小至60m, 再缓慢减小至底部。盐度由混合层的 34.04缓慢增加至底部最大值34.44。L13站表层N2O浓度约为 8.59nmol/L, 自表层向下略有下降, 至混合层底部出现最小值8.16nmol/L, 然后随着深度先快速增加后缓慢增加至底部。夏季 L9站混合层变薄, 由于珠江冲淡水的影响, 该站表层盐度较低(<32), 表层以下盐度迅速增加, 在120m达到最大值后略有降低直至底部。温度在20m以浅基本不变, 20m以下随深度的增加而降低, 且降低幅度明显大于秋季。DO的变化趋势与温度基本相同。由于珠江冲淡水携带了大量的营养物质, 因此夏季L9站上层水体中的NO3¯浓度明显高于秋季, 且自表层向下随着深度和盐度的增加而减小, 在~60m达到最小值后向底部快速增加。L9站表层N2O浓度约为8.34nmol/L, 自表层向下略有降低, 至 20m出现最低值 7.44nmol/L, 然后随深度增加逐渐增加, 其分布趋势与温度和 DO基本呈镜像对称。
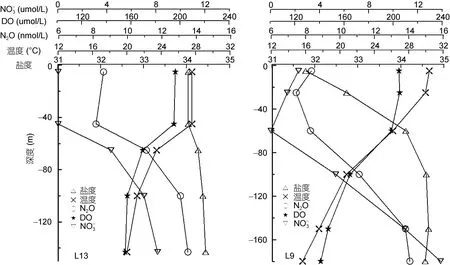
图6 -1 陆架区L13(2014.10)和L9(2015.06)站各参数垂直分布Fig.6-1 Vertical profiles of various parameters at stations L13 (2014.10) and L9 (2015.06) at the shelf
位于陆坡中部的L20站(2014年10月)和L14站(2015年6月), 深度分别为825m和965m, 混合层深度分别为50m和25m, 两航次中各参数分布较为相似(图 6-2)。在混合层内各参数变化不大, 混合层以下,盐度迅速增加, 在 120m 左右达到最大值(分别为34.72(L20)和 34.57(L14)), 之后盐度随深度增加而减小, L20站在500m达到最小值34.41, L14在400m左右达到最小值 34.36, 然后均向底部缓慢增加。L20站的DO变化趋势与温度基本相同, 混合层以下先快速降低再缓慢降低, L14站的 DO随着深度而降低,在~700m达到最低值, 然后向底部增加。N2O浓度在混合层以下随深度增加而增加, L14站在~700m达到N2O浓度的最大值(27.74nmol/L)后向底部降低。N2O浓度最大值与DO最低值相对应, 本文的结果同前人观测到的N2O浓度垂直分布特征基本一致(Ostrom et al, 2000; Popp et al, 2002; Toyoda et al, 2002;Yamagishi et al, 2005; Charpentier et al, 2007)。

图6 -2 陆坡L20(2014.10)和L14(2015.06)站各参数垂直分布Fig.6-2 Vertical profiles of various parameters at stations L20 (2014.10) and L14 (2015.06) on the slope
位于边缘的 L6(2014年 10月)和 L5(2015年 6月)站, 深度分别为 2000m 和 2300m。由图 6-3,1000m以浅各水文和化学参数的分布与中部站位(L20和L14)基本一致, 1000m以深各参数非常稳定,基本没有变化。N2O浓度由表层以下随深度增加而增加,L6站在~500m达到 N2O浓度的最大值(24.56nmol/L),然后随着深度的增加缓慢降低至底部, L5站在~700m达到 N2O浓度的最大值(28.83nmol/L), 然后随深度增加降低, 在~1500m 达到最小值(23.77nmol/L)后缓慢增加至底部。N2O浓度垂直分布趋势与 DO基本呈镜像对称, N2O浓度最大值与DO最小值相对应。

图6 -3 陆坡L6(2014.10)和L5(2015.06)站各参数垂直分布Fig.6-3 Vertical profiles of various parameters at stations L6 (2014.10) and L5 (2015.06) at the slope
2.4 南海海水中N2O的产生
综合上述两个航次不同深度站位各参数的垂直分布, 可以看到 N2O浓度在南海陆坡中层水体中快速增加, 而且N2O的垂直分布与DO以及温度的分布呈镜像对称, 而与水体中 NO3¯的分布规律类似, 说明N2O主要产生于中层水体中(Bange et al, 1999;Nevison et al, 2003; Freing et al, 2012), 而且其在水体中的分布受到温度的影响。
为了进一步了解N2O在该区域的生物产生过程,作混合层以下800m以浅N2O过剩量(ΔN2O=N2Oobs-N2Oeq)与表观耗氧量(apparent oxygen utilization,AOU) (AOU=O2eq-O2obs)以及 NO3¯浓度的相关关系(如图7), 结果显示两个航次ΔN2O与AOU呈显著相关([ΔN2O]=0.057[AOU]+1.46, n=135, R2=0.73,P<0.0001), 其相关曲线的斜率为0.057 ×10-3, 在世界已报道的大洋范围(0.01—0.3)×10-3内(Oudot et al,2002; Nevison et al, 2003; Forster et al, 2009)。两航次ΔN2O与NO3¯也显著相关, 但2014年10月其相关性([ΔN2O]=0.33[NO3¯]+2.77, n=47, R2=0.769, P<0.0001)不如2015年06月([ΔN2O]=0.35[NO3¯]+2.19, n=85, R2=0.918, P<0.0001)明显。ΔN2O与AOU以及NO3¯的显著相关关系表明硝化作用是该海域海水中溶解 N2O的重要来源。此外, 通过各站位的垂直分布(图 6)也可以看出, N2O浓度在达到最大值后, 虽然NO3¯浓度继续增加, 但 N2O浓度却有降低的趋势, 说明在深层水体中除了产生 N2O的过程之外, 还可能存在其他消耗 N2O的过程。另外 NO3¯与 AOU之间也有较好 的 相 关 性 ([NO3¯]=0.167[AOU]-1.99, n=135, R2=0.879, P<0.0001), 说明水体中的硝酸盐主要来自硝化作用(Yoshida et al, 1989), 因此可以根据ΔN2O与NO3¯关系曲线的斜率初步估算两个季节南海北部陆坡区硝化过程中的N2O产率(Grundle et al, 2012), 秋季和夏季分别为0.033%和0.035%。但是由于我们并没有消除预先形成的 N2O以及保守混合的影响, 因此本文的ΔN2O浓度和N2O产率只代表在水体中的整体水平, 而并非简单的原位生产(Nevison et al, 2003;Grundle et al, 2012)。本研究中获得的南海陆坡区硝化过程中 N2O 产率(0.033%—0.035%)明显低于已报道的南海陆架区(0.065%)(Han et al, 2013); 与已报道的大洋区域相比, 本文结果略高于 Yoshida等(1989)报道的北太平洋 N2O产率(0.004%—0.027%), 低于Walter等(2006)报道的热带大西洋 N2O 产率(0.06%—0.08%); 但是本文结果与远离北极的太平洋(0.028%—0.040%) (Grundle et al, 2012)以及亚热带大西洋(0.03%—0.04%) (Walter et al, 2006)的结果比较接近。
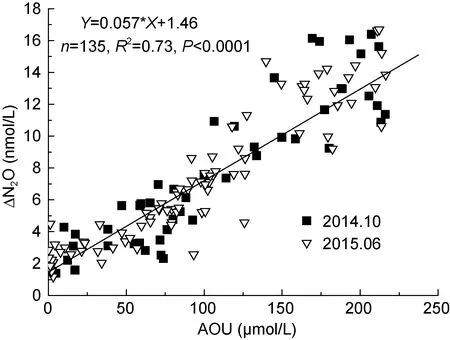
图7 -1 两个航次南海水体中ΔN2O与AOU的关系Fig.7-1 Water column ΔN2O versus AOU during two cruises in SCS
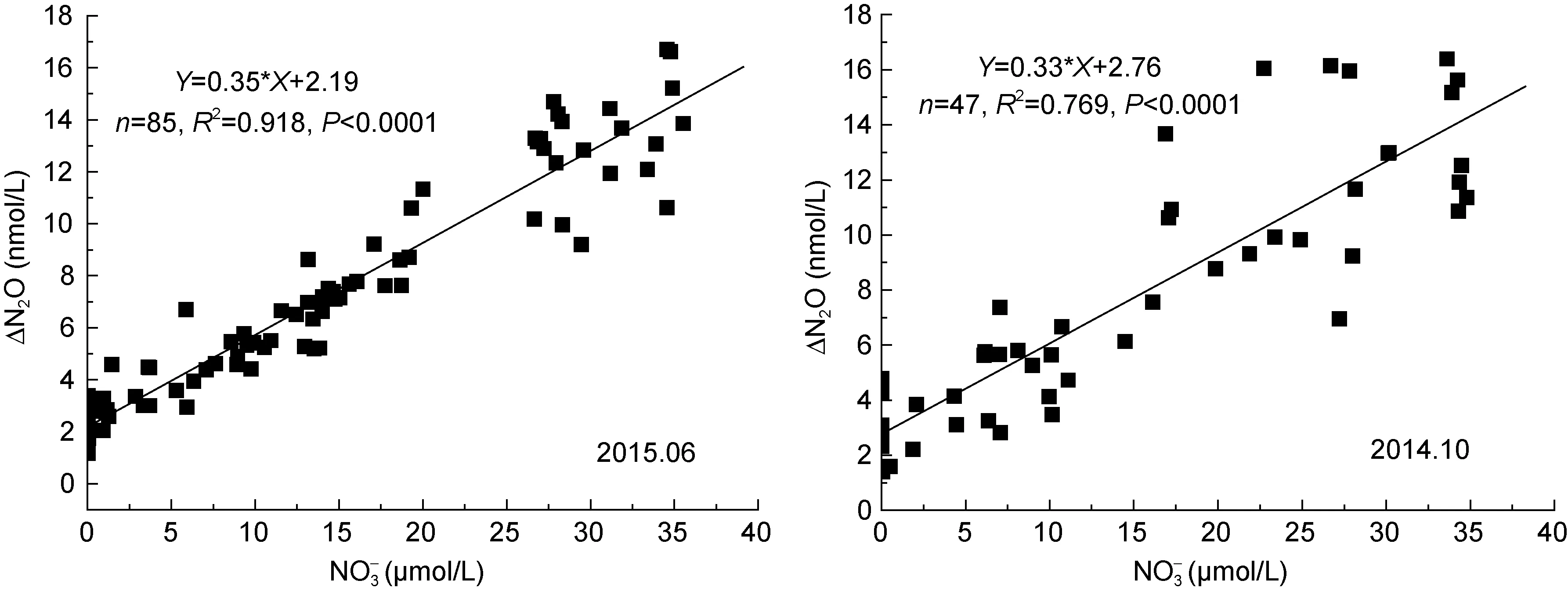
图7 -2 两个航次南海水体中ΔN2O与NO3¯的关系Fig.7-2 Relationship between ΔN2O and NO3¯ during two cruise in water column of the SCS
3 结论
(1) 南海北部陆坡区表层 N2O浓度随季节变化显著, 总体表现为春末>秋季>夏季。饱和度表现为春末最高, 夏秋季相当。同一季节, 北部陆坡区N2O浓度和饱和度明显高于其他区域, 说明北部陆坡区是南海N2O释放的活跃区域。
(2) 夏季和秋季南海陆坡区表、底层N2O浓度均相差不大, 表层N2O浓度处于过饱和状态。底层浓度明显高于表层, 是表层浓度的大约 2.5倍, 说明 N2O在深层水体中大量富集。
(3) 夏、秋季南海陆坡区水体中N2O层化现象明显, 垂直分布特征基本一致。N2O浓度在混合层内变化不大, 混合层以下随深度的增加逐渐增加, 在~700m达到最大值后缓慢降低至底部, 其分布趋势与温度和DO基本呈镜像对称, N2O浓度最大值对应DO最小值。
(4) 夏、秋季南海陆坡区水体中 ΔN2O与 AOU及 NO3¯均呈显著相关, 表明硝化过程是南海水体中N2O产生的重要来源, 初步估算出硝化过程中秋季和夏季N2O产率分别为0.033%和0.035%。
(5) 初步估算出南海北部陆坡 N2O释放量为0.055Tg/a, 约占全球海洋总释放量的 0.39%, 说明南海北部陆坡是N2O释放的活跃海域, 是大气N2O的重要净源。
马云龙, 朱小华, 张钟哲等, 2014. 2012年10月和12月南海北部海流的观测研究. 大连海洋大学学报, 29(3): 309—315
王 胄, 陈庆生, 1997. 南海东北部海域次表层水与中层水之流径. 热带海洋, 16(2): 24—41
仇德忠, 杨天鸿, 郭忠信, 1984. 夏季南海北部一支向西流动的海流. 热带海洋, 3(4): 65—73
苏纪兰, 2005. 南海环流动力机制研究综述. 海洋学报, 27(6):1—8
杨 阳, 李锐祥, 朱鹏利等, 2014. 珠江冲淡水季节变化及动力成因. 海洋通报, 33(1): 36—44
卓海腾, 王英民, 徐 强等, 2014. 南海北部陆坡分类及成因分析. 地质学报, 88(3): 327—336
庞海龙, 高会旺, 宋萍萍等, 2006. 夏季珠江冲淡水扩散路径分析. 海洋预报, 23(3): 58—63
郑立晓, 张桂玲, 许 洁等, 2009. 春季南海溶存N2O的分布特征和海气交换通量. 海洋环境科学, 28(3): 233—237
徐继荣, 王友绍, 张凤琴等, 2006. 南海东北部海水中N2O分布与产生机制的初步研究. 热带海洋学报, 25(4): 66—74
郭忠信, 杨天鸿, 仇德忠, 1985. 冬季南海暖流及其右侧的西南向海流. 热带海洋, 4(1): 1—9
郭景松, 冯 颖, 袁业立等, 2013. 入侵南海的黑潮流套及其脱落涡旋. 海洋与湖沼, 44(3): 537—544
Bange H W, Andreae M O, 1999. Nitrous oxide in the deep waters of the world’s oceans. Global Biogeochemical Cycles,13(4): 1127—1135
Bange H W, Rapsomanikis S, Andreae M O, 1996. Nitrous oxide in coastal waters. Global Biogeochemical Cycles, 10(1):197—207
Charpentier J, Farias L, Yoshida N et al, 2007. Nitrous oxide distribution and its origin in the central and eastern South Pacific Subtropical Gyre. Biogeosciences, 4(5): 729—741
Chen C T A, Wang S L, Lu X X et al, 2008. Hydrogeochemistry and greenhouse gases of the Pearl River, its estuary and beyond. Quaternary International, 186(1): 79—90
Forster G, Upstill-Goddard R C, Gist N et al, 2009. Nitrous oxide and methane in the Atlantic Ocean between 50°N and 52°S:latitudinal distribution and sea-to-air flux. Deep Sea Research Part II: Topical Studies in Oceanography, 56(15):964—976
Freing A, Wallace D W R, Bange H W, 2012. Global oceanic production of nitrous oxide. Philosophical Transactions of the Royal Society of London B: Biological Sciences,367(1593): 1245—1255
Grundle D S, Maranger R, Juniper S K, 2012. Upper water column nitrous oxide distributions in the northeast subarctic Pacific Ocean. Atmosphere-Ocean, 50(4): 475—486
Han Y, Zhang G L, Zhao Y C et al, 2013. Distributions and sea-to-air fluxes of nitrous oxide in the coastal and shelf waters of the northwestern South China Sea. Estuarine,Coastal and Shelf Science, 133: 32—44
IPCC, 2007. Climate Change 2007: The Physical Science Basis.New York: Cambridge University Press, 1—126
IPCC, 2013. Climate Change 2013: The Physical Science Basis.New York: Cambridge University Press, 1—1535
Liss P S, Merlivat L, 1986. Air-sea gas exchange rates:introduction and synthesis. In: Buat-Ménard P ed. The Role of Air-Sea Exchange in Geochemical Cycling. Netherlands:Springer, 113—127
Morton B, Blackmore G, 2001. South China sea. Marine Pollution Bulletin, 42(12): 1236—1263
Nevison C, Butler J H, Elkins J W, 2003. Global distribution of N2O and the ΔN2O-AOU yield in the subsurface ocean.Global Biogeochemical Cycles, 17(4), doi:10.1029/2003GB002068
Nightingale P D, Malin G, Law C S et al, 2000. In situ evaluation of air-sea gas exchange parameterizations using novel conservative and volatile tracers. Global Biogeochemical Cycles, 14(1): 373—387
Ostrom N E, Russ M E, Popp B et al, 2000. Mechanisms of nitrous oxide production in the subtropical North Pacific based on determinations of the isotopic abundances of nitrous oxide and di-oxygen. Chemosphere - Global Change Science, 2(3—4): 281—290
Oudot C, Jean-Baptiste P, Fourré E et al, 2002. Transatlantic equatorial distribution of nitrous oxide and methane. Deep Sea Research Part I: Oceanographic Research Papers, 49(7):1175—1193
Popp B N, Westley M B, Toyoda S et al, 2002. Nitrogen and oxygen isotopomeric constraints on the origins and sea-to-air flux of N2O in the oligotrophic subtropical North Pacific gyre.Global Biogeochemical Cycles, 16(4): 12-1—12-10
Ravishankara A R, Daniel J S, Portmann R W, 2009. Nitrous oxide (N2O): the dominant ozone-depleting substance emitted in the 21st century. Science, 326(5949): 123—125
Raymond P A, Cole J J, 2001. Gas exchange in rivers and estuaries: choosing a gas transfer velocity. Estuaries, 24(2):312—317
Toyoda S, Yoshida N, Miwa T et al, 2002. Production mechanism and global budget of N2O inferred from its isotopomers in the western North Pacific. Geophysical Research Letters,29(3): 7-1—7-4
Walter S, Bange H W, Breitenbach U et al, 2006. Nitrous oxide in the North Atlantic Ocean. Biogeosciences, 3(4): 607—619
Wanninkhof R, 1992. Relationship between wind speed and gas exchange over the ocean. Journal of Geophysical Research:Oceans, 97(C5): 7373—7382
Wanninkhof R, 2014. Relationship between wind speed and gas exchange over the ocean revisited. Limnology and Oceanography: Methods, 12(6): 351—362
Weiss R F, Price B A, 1980. Nitrous oxide solubility in water and seawater. Marine Chemistry, 8(4): 347—359
Yamagishi H, Yoshida N, Toyoda S et al, 2005. Contributions of denitrification and mixing on the distribution of nitrous oxide in the North Pacific. Geophysical Research Letters,32(4), doi: 10.1029/2004GL021458
Yoshida N, Morimoto H, Hirano M et al, 1989. Nitrification rates and15N abundances of N2O and NO3-in the western North Pacific. Nature, 342(6252): 895—897
Zhang G L, Zhang J, Liu S M et al, 2010. Nitrous oxide in the Changjiang (Yangtze River) Estuary and its adjacent marine area: riverine input, sediment release and atmospheric fluxes.Biogeosciences, 7(11): 3505—3516
