藿香内生细菌HX-2的鉴定、耐性及对宿主植物的促生作用
2018-01-19江绪文李贺勤谭勇
江绪文,李贺勤*,谭勇
(1.青岛农业大学农学院,山东 青岛266109;2.广西中医药大学药学院,广西 南宁530200)
当前,不断恶化的农业生产环境导致我国农业生产上农药、化肥的投入非常大,这不仅降低了农作物品质,破坏了土壤生境,加剧了环境污染,也提高了农业生产成本。如何减少农药、化肥的投入,降低污染,成为我国农业可持续发展亟待解决的一个问题[1]。微生物菌肥因可提高作物产量,改进作物品质,且具有肥效持久、不破坏土壤结构、无毒无污染、保护生态环境等优点,成为一条缓解当前这一问题的有效发展途径[2],其中利用高效植物生长促进菌研制新型微生物肥料已成为国内外生物菌肥研究的热点之一[3]。
植物内生细菌(endophytic bacteria),通常指在生活史的某一阶段或全部阶段生活在健康植物组织内又不对植物组织造成明显病害症状的一些细菌[4]。在目前研究过的所有植物中均发现有内生细菌,它们存在于植物的根、茎、叶、花、果实等部位,是一类巨大的微生物资源[5]。内生细菌在植物体内具有多种生物学功能,主要通过产生植物生长物质(如植物生长素、赤霉素、细胞激动素等)、自身的固氮、溶磷或通过增强植物对矿物质利用的有效性以及对不同植物病原菌的拮抗作用,从而间接地促进植物生长、提高植物对生物和非生物胁迫的抗性[6]。因此,将具有良好促生潜力的内生细菌应用于农业生产,可以在一定程度上替代化肥和农药。前人已从小麦(Triticumaestivum)、水稻(Oryzasativa)、马铃薯(Solanumtuberosum)等植物中分离出了超过120种54个属的内生细菌,其中比较常见的主要有芽孢杆菌(Baciullsspp.)、假单孢菌(Psuedomonasspp.)、土壤杆菌(Arrobacetriumspp.)、欧文氏菌(Erwiniaspp.)等[7],这些内生细菌多具有促生功能,在农业生产上应用前景巨大。
藿香(Agastacherugosa)为唇形科多年生草本植物,全株具芳香味,可作园林绿化植物,亦可作保健特色蔬菜食用,也是畜禽饲料添加剂的常用原料[8-9],其芳香挥发油还是制造多种中成药的原料,市场需求大。由于藿香野生植物资源有限,现多采用人工栽培。为应对不断恶化的农业生产环境,发展藿香生产,开发藿香丰产栽培技术尤为重要。内生菌不仅为植物生长提供所必需的营养物质,还能提高植物对不良环境的抗性,比如干旱、盐害、重金属等[10]。目前有关藿香内生细菌筛选及生物学特性的研究还未见报道。因此,本实验以从青岛崂山藿香叶片中分离的一株内生细菌HX-2为研究对象,测定其生物学特性,结合16S rDNA序列分析,鉴定其归属,并采用体外和体内实验研究了HX-2对藿香种子萌发和幼苗生长的促生效应,为该菌株开发成微生物菌肥提供理论依据,为藿香丰产栽培提供新方法。
1 材料与方法
1.1 实验材料
内生细菌HX-2由作物逆境栽培生理与调控课题组从青岛崂山藿香植株叶片中分离获得,现保存于青岛农业大学山东省旱作农业技术重点实验室。藿香种子采自青岛崂山,经青岛农业大学农学与植物保护学院谭勇教授鉴定。牛肉膏蛋白胨培养基、金氏B液体培养基、Salkowsk显色剂、革兰氏染色液试剂盒、芽孢染色液试剂盒、Kovacs氏靛基质试剂盒以及有机磷细菌培养基购于青岛海博生物技术有限公司;细菌基因组DNA快速抽提试剂盒购于生工生物工程(上海)股份有限公司,2×Taq PCR MasterMix购自北京博迈德生物技术有限公司,引物合成和PCR产物测序由北京三博远志生物技术有限责任公司完成,其他试剂为国产分析纯。实验于2015年10月至2016年4月期间进行。
1.2 菌株鉴定
将内生细菌HX-2在牛肉膏蛋白胨琼脂培养基上30 ℃纯化培养24 h,观察并描述菌落的形态、光泽、质地、边缘特征、表面特征、隆起形状及菌落颜色等特征。并按照革兰氏染色液试剂盒、芽孢染色液试剂盒说明书进行染色处理。将接种到牛肉膏蛋白胨液体培养基30 ℃恒温180 r·min-1摇培48 h的菌液收集,进行16S rDNA分子鉴定,重复3次。按照细菌基因组DNA快速抽提试剂盒说明书提取HX-2的基因组,以此基因组为模板进行PCR扩增,通用引物为27F (5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R (5′-GGTTACCTTGTTACGACTT-3′),总反应体系为20 μL,PCR扩增条件: 94 ℃ 2 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1.5 min,30个循环;72 ℃ 10 min后存于4 ℃。将 PCR 反应产物测序结果在GeneBank 上进行Blast 比对,获得与目标菌株相似性较高的序列,再用Clustalx比对,采用MEGA 5.1工具构建NJ系统发育树。
1.3 产激素吲哚乙酸和溶磷能力测定
将在金氏B液体培养基上30 ℃恒温180 r·min-1摇培48 h的菌液按照Kovacs氏靛基质试剂盒说明书进行操作,颜色变红表明内生细菌HX-2能产生吲哚乙酸,颜色越深,表明产生的吲哚乙酸越多,重复3次。以吲哚乙酸标准品制作标准曲线,将培养48 h的菌悬液和对照10000 r·min-1离心10 min后取上清,加入等体积的Salkowsk显色剂,室温下避光显色 20 min,测定其OD530 nm吸光值。根据标准曲线计算内生细菌分泌吲哚乙酸的含量[11]。将HX-2菌株点接于固体有机磷培养基上,30 ℃培养 7 d,观察有无溶磷圈,并测定溶磷圈直径(D)与菌落直径(d)的比值,比值为 1 表示无解磷能力[12],重复3次。
1.4 耐性测定
1.4.1耐酸碱性测定 将生长对数期的HX-2菌液0.2 mL加入20 mL pH为4,5,6,7,8,9,10的牛肉膏蛋白胨液体培养基中,30 ℃恒温摇床180 r·min-1培养48 h,测菌液OD600 nm的吸光值,以未接菌的牛肉膏蛋白胨液体培养基作对照,重复3次。
1.4.2耐盐性测定 将生长对数期的HX-2菌液0.2 mL加入20 mL NaCl含量为0.5%,2.0%,4.0%,6.0%,8.0%,10.0%的牛肉膏蛋白胨液体培养基中,30 ℃恒温摇床180 r·min-1培养48 h,测菌液OD600 nm的吸光值,以未接菌的牛肉膏蛋白胨液体培养基作对照,重复3次。
1.4.3耐重金属铜测定 将生长对数期的HX-2菌液0.2 mL加入20 mL Cu2+含量为0,0.5,1.0,2.0,4.0,6.0,8.0 mmol·L-1的牛肉膏蛋白胨液体培养基中,30 ℃恒温摇床180 r·min-1培养48 h,测菌液OD600 nm的吸光值,以未接菌的牛肉膏蛋白胨液体培养基作对照,重复3次。
1.5 促生实验
1.5.1种子萌发 将30 ℃恒温 180 r·min-1摇培48 h 的菌液,10000 r·min-1离心1 min留取上清液。挑选饱满健康、大小一致的藿香种子,0.5% NaClO溶液消毒10 min后,用无菌蒸馏水清洗3遍,然后用吸水纸吸去种子表面浮水,将消毒后的种子室温浸泡在上述上清液中12 h。采用纸床发芽,在发芽盒底部垫两层发芽纸,用无菌蒸馏水充分润湿后,将浸泡后的种子整齐排放在发芽纸上,之后盖上盒盖,置于智能人工气候箱中进行发芽,温度为30 ℃,光照为10 h,每处理3个重复,每重复30粒种子。以未浸泡的种子和未接种菌体HX-2的培养基浸泡的种子为对照,分别记作CK1和CK2。以后每天观察并统计发芽种子数,于第4天统计发芽势(germination energy, GE),第7天统计发芽率(germination rate, GR)[13]。
GE=4 d内发芽种子数/供试种子数×100%
GR=7 d内发芽种子数/供试种子数×100%
1.5.2幼苗生长 摇培48 h 后的菌液经4000 r·min-1离心5 min后,保留菌体,用无菌水调菌体浓度为 108cfu·mL-1。营养土与粗粒蛭石按1∶3的比例混匀,经高温灭菌后称取100 g置于一次性方形小花盆中,含水容积重量比为10%。将藿香种子播于其中,每盆3粒种子,出苗后只保留1株。出苗7 d后,采用灌根法接种菌HX-2,共设2个处理,以不接菌的处理为对照,每处理3次重复,每重复10株苗。30 d后进行破坏性取样,测藿香幼苗株高、根长、茎粗、叶面积、幼苗鲜重与干重、叶绿素含量和根系活力。幼苗株高、根长、茎粗采用游标卡尺测量,叶面积采用方格纸法测量[14],幼苗鲜重与干重采用万分之一天平测量,叶绿素含量采用日本美能达SPAD-502微型叶绿素仪测定,用SPAD值表示[15];根系活力采用氯化三苯基四氮唑(TTC)[16]法测定。
1.6 数据统计分析
采用SPSS 17.0统计软件进行单因素方差分析,Duncan法检验各参数不同处理间的差异显著性(P<0.05)。
2 结果与分析
2.1 菌株HX-2的鉴定
在牛肉膏蛋白胨固体培养基上30 ℃培养48 h,菌落圆形扁平,边缘整齐,表面干燥,灰白色,中间有一皱点;革兰氏染色和芽孢染色均呈阳性,杆状,芽孢呈椭圆形。在牛肉膏蛋白胨液体培养基上30 ℃培养48 h,高度混浊,表面无膜。以其基因组DNA为模板PCR扩增,产物测序得片段大小为1459 bp。登录NCBI进行Blast比对,选取10个相似度较高的菌株16S rDNA基因序列构建NJ系统发育树(图1),HX-2与巨大芽孢杆菌Bacillusmegaterium(KC189946.1)聚在一个分支,相似率达99.0%,说明HX-2与该菌株亲缘关系最近。结合形态特征和16S rDNA基因序列分析结果,判定HX-2为巨大芽孢杆菌,命名为Bacillusmegateriumstrain HX-2。

图1 菌株HX-2系统发育树Fig.1 Phylogenetic tree of strain HX-2
2.2 产吲哚乙酸和溶磷能力分析
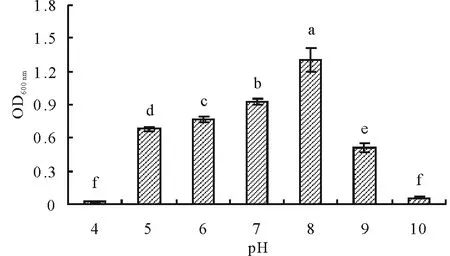
图2 pH对菌株HX-2生长的影响Fig.2 Effect of pH on strain HX-2不同小写字母表示差异显著(P<0.05)。下同。The different lowercase letters show significant difference at P<0.05 level. The same below.
在含100 mg·L-1色氨酸的金氏B液体培养基中,加入该菌培养后Kovacs氏靛基质试剂变红,说明内生菌HX-2具有产生吲哚乙酸的能力。Salkowsk显色后OD530 nm为0.732,由标准曲线方程y=0.021x+0.016 (R2=0.957,y代表吸光值,x代表浓度)计算得吲哚乙酸的含量为34.10 mg·L-1。在有机磷细菌培养基平板上产生透明圈,溶磷圈直径(D)与菌落直径(d)的比值为1.3,表明内生菌HX-2具有溶解有机磷的能力。
2.3 耐性分析
2.3.1耐酸碱性 含盐量0.5%的牛肉膏蛋白胨液体培养基,当pH为4时,内生细菌HX-2不生长,随pH值升高,OD600 nm值越来越大且差异显著,表明菌株逐渐生长旺盛;当pH为8时,OD600 nm值最大,表明菌株此时生长最旺盛;pH值继续升高,OD600 nm值显著下降,表明菌株生长下降;当pH为10时,菌株生长最慢(图2)。可知,菌株HX-2生长较旺盛的pH范围是5~9。
2.3.2耐盐性 pH为8的牛肉膏蛋白胨液体培养基,当NaCl含量为0.5%时,OD600 nm值最大(图3),表明此时内生细菌HX-2的生长最旺盛;随NaCl含量的增加,OD600 nm值呈下降趋势,表明菌株逐渐生长变慢;当NaCl浓度大于10.0%时,菌株HX-2生长更慢或停止生长,表明菌株HX-2具有一定的耐盐性,耐盐范围为0.5%~8.0%。
2.3.3重金属Cu2+耐性 pH为8的牛肉膏蛋白胨液体培养基,随Cu2+含量增加,OD600 nm值增大,当Cu2+含量为1.0 mmol·L-1时,OD600 nm值最大(图4),表明此时内生细菌HX-2的生长最旺盛;随Cu2+含量的增加,OD600 nm值呈下降趋势,表明菌株生长逐渐变慢;当Cu2+含量大于8.0 mmol·L-1时,菌株HX-2停止生长,表明菌株HX-2具有一定的耐重金属Cu2+能力,耐性范围为0~6.0 mmol·L-1。

图3 NaCl对菌株HX-2生长的影响Fig.3 Effect of NaCl on strain HX-2
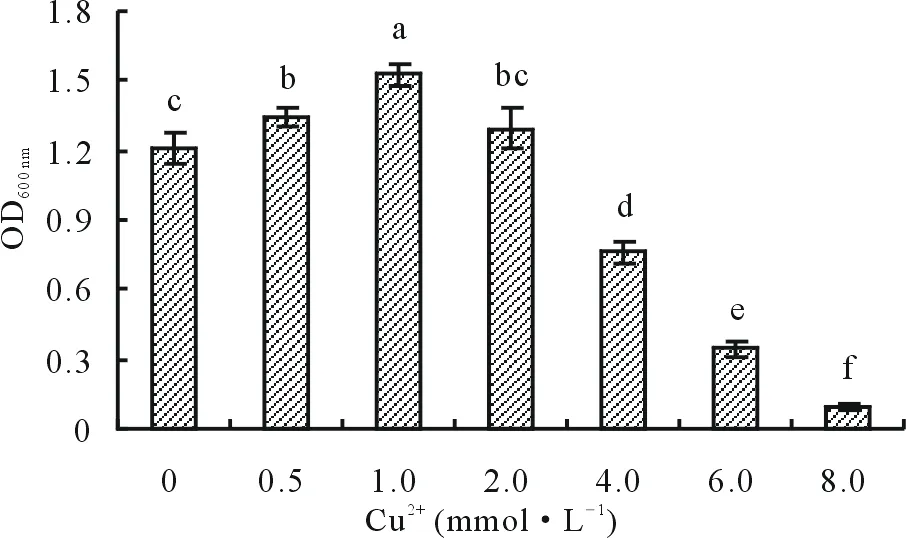
图4 Cu2+对菌株HX-2生长的影响Fig.4 Effect of Cu2+ on strain HX-2
2.4 促生实验
2.4.1菌株HX-2对种子萌发的影响 与未浸泡处理的种子(CK1)相比,培养基浸泡(CK2)和菌液浸泡(T)处理均能显著提高藿香种子的发芽势,分别提高了8.06%和22.59%,且培养基浸泡的种子和菌液浸泡的种子的发芽势存在显著差异(P<0.05)。同样,培养基浸泡(CK2)和菌液浸泡(T)处理也能显著提高藿香种子的发芽率,分别提高了6.18%和17.95%,且培养基浸泡的种子和菌液浸泡的种子发芽率也存在显著差异(表1)。由此可知,内生菌HX-2培养液浸种处理可以促进藿香种子萌发。

表1 菌株HX-2对藿香种子萌发的影响Table 1 Effects of HX-2 on seed germination of A. rugosa
注:同列不同字母表示差异显著(P<0.05)。下同。CK1:未浸泡处理的种子; CK2:培养基浸泡处理的种子; T:菌液浸泡处理的种子。
Note: Data in same column followed by different letters indicate significant difference atP<0.05. The same below. CK1:Control 1, seed unsoaked; CK2:Control 2, seed soaked with liquid medium; T:Treatment of strain HX-2.
2.4.2菌株HX-2对幼苗生长的影响 未接种HX-2处理下,藿香幼苗的株高、根长、茎粗、叶面积分别为8.14 cm、5.76 cm、0.48 cm和16.55 cm2;接种HX-2处理下,株高、根长、茎粗、叶面积分别为9.53 cm、6.81 cm、0.53 cm和18.98 cm2,分别提高了17.08%,18.23%,10.42%和14.68%,且除茎粗外均有显著性差异(P<0.05)。同样,未接种HX-2处理下,藿香幼苗的鲜重、干重为2.4254和0.2317 g·株-1,接种HX-2处理下,鲜重、干重为2.9781和0.2895 g·株-1,显著提高了22.79%和24.95%。接种HX-2后,叶绿素含量和根系活力分别由22.9(SPAD值)、9.01 μg·g-1FW·h-1提高至25.2(SPAD值)、10.74 μg·g-1FW·h-1,分别提高了10.04%和19.20%,且有显著性差异 (P<0.05) (表2)。可见,接种内生细菌HX-2可以促进藿香幼苗生长。

表2 菌株HX-2对藿香幼苗生长的影响Table 2 Effects of HX-2 on seedling growth of A. rugosa
CK:对照组Control;CK+HX-2:接种内生细菌HX-2处理Treatment of strain HX-2.
3 讨论
内生细菌在寄主植物体内生存空间稳定,易定殖,受外界环境影响小,长期的进化选择形成了植物体内的固定组分。通常情况下,植物内生和根围细菌可通过固氮、溶磷、分泌植物激素等方式直接影响植物的新陈代谢[17],进而影响植物生长发育。因此,作为一种新的微生物资源,植物内生细菌受到越来越多的关注。目前从很多植物上都分离出了具有促生作用的内生细菌,如雷公藤内生菌LJ10具有产生植物生长素和铁载体的能力,兼具溶磷特性,回接LJ10能够使雷公藤(Tripterygiumwilfordii)组培苗长势良好,根系发达,平均质量增加[12];短小杆菌属Curtobacterium能使马铃薯组培苗的鲜重和干重提高17.56%和24.46%[18];辣椒内生枯草芽孢杆菌Bacillussubtilisstrain BS-2可诱导辣椒(Capsicumannuum)体内吲哚乙酸等植物生长激素含量的提高,从而使辣椒鲜重和干重提高168.70%和181.25%[19];油菜内生细菌环状芽孢杆菌Bacilluscirculans的发酵液对油菜(Brassicanapus)种子萌发、胚根及胚轴生长具有促进作用[20];草莓内生细菌枯草芽孢杆菌BacillussubtilisNA-108可产生吲哚乙酸提高草莓(Fragaria×ananassa)的株高和植株干重[21];洽草(Koeleriacristata)内生细菌QS3、QG3和QS15可通过分泌吲哚乙酸显著提高苜蓿(Medicagosativa)、红三叶(Trifoliumpratense)、燕麦(Avenasativa)、黑麦草(Loliumperenne)种子的发芽势、发芽率、胚根长度等[6];人参内生细菌荧光假单胞菌Pseudomonasfluorescens具有较高1-氨基环丙烷-1-羧酸脱氨酶活性,且具有解磷、固氮和产生铁载体的能力,能明显促进人参(Panaxquinquefolius)种子及根部的生长[1]; 水稻内生细菌HerbaspirillumseropedicaeDX35具有固氮、溶磷、产铁和分泌生长激素的能力[22];苜蓿内生团泛菌Pantoeavagans和短小芽孢杆菌Bacilluspumilus均具有溶磷、嗜铁和产生植物生长激素吲哚乙酸的作用,从而促进苜蓿生长[23]。由此可知,很多植物内生细菌有促生作用,与能分泌植物激素吲哚乙酸关系密切,因吲哚乙酸生理活性较强,在浓度较低时就能刺激植物生理代谢、促进植物生长。本实验中,内生细菌HX-2也具有产生吲哚乙酸的能力,同时兼具溶磷能力,能提高藿香种子的发芽势、发芽率和幼苗的苗高、根长、茎粗、叶面积、鲜重以及干重,也能提高根系活力和叶绿素含量。可见,接种内生细菌HX-2不仅给藿香提供了生长素,还给植物增加了磷元素,提高了藿香的根系吸收能力和光合作用能力,从而促进藿香幼苗的生长。此外,实验结果还显示藿香内生细菌HX-2对盐碱和重金属铜有一定的耐性,前人也有类似的研究报道,如刘莉华等[24]发现内生巨大芽孢杆菌能促进龙葵(Solanumnigrum)生长且兼具铬耐性,韩坤等[25]发现海滨锦葵(Malvasylvestris)内生细菌巨大芽孢杆菌能提高小麦幼苗的耐盐性。耐性实验结果表明藿香内生细菌HX-2有应用于盐碱地改良和铜污染土壤修复的潜力,这对我国农业和生态的可持续发展意义重大。
已有的研究报道多采用体外实验研究内生细菌生物学特性,通过检测菌株能否产生植物激素类物质、是否具有1-氨基环丙烷-1-羧酸脱氨酶活性、是否具有分泌铁载体的能力等来评判它们的促生作用。这些方法能了解内生细菌的促生潜能,但是存在不能反映菌株在植物体内作用情况的局限性。因此,体外和体内实验相结合的研究结果,能更充分地反映内生细菌的生物学功能。本研究中,在体外检测到藿香内生细菌HX-2具有产生植物类激素吲哚乙酸的能力,培养液浸种具有提高藿香种子发芽势和发芽率的能力;通过室内盆栽回接菌株到植物体内,该菌能提高藿香幼苗的根长、苗高、茎粗、叶面积、鲜重、干重、叶绿素含量和根系活力。本研究比较全面地反映了内生细菌HX-2对藿香种子萌发和幼苗生长的促进作用,为进一步大田实验奠定了基础。
4 结论
综上所述,藿香内生细菌HX-2为巨大芽孢杆菌,能产生植物激素吲哚乙酸,能溶解有机磷,兼具一定的盐碱适应性和重金属铜耐性,对藿香种子萌发和幼苗生长有促生作用。本研究结果为藿香内生细菌HX-2开发成微生物菌肥用于农业生产提供理论依据。
References:
[1] Tian L, Jiang Y, Chen C Q,etal. Screening and identification of an endophytic bacterium with 1-aminocyclopropane-1-carboxylate deaminase activity fromPanaxginsengand its effect on host growth. Acta Microbiologica Sinica, 2014, 54(7): 760-769.
田磊, 姜云, 陈长卿, 等. 一株人参内生1-氨基环丙烷-1-羧酸(ACC)脱氨酶活性细菌的筛选、鉴定及其对宿主生长的影响. 微生物学报, 2014, 54(7): 760-769.
[2] Han W X, Yao T, Xi L Q,etal. PGPR bio-fertilizers producing and its effect onAvenasativagrowth and quality development. Acta Prataculturae Sinica, 2008, 17(2): 75-84.
韩文星, 姚拓, 席琳乔, 等. PGPR菌肥制作及其对燕麦生长和品质影响的研究. 草业学报, 2008, 17(2): 75-84.
[3] Hafeez F Y, Yasmin S, Ariani D,etal. Plant growth-promoting bacteria as biofertilizer. Agronomy for Sustainable Development, 2006, 26(2): 143-150.
[4] Kobayashi D Y, Palumbo J D. Bacterial Endophytes and Their Effects on Plants and Uses in Agriculture//Bacon C W, White J F. Microbial Endophytes. New York (NY): Marcel Dekker, 2000.
[5] Lodewyckx C, Vangronsveld J, Porteous F,etal. Endophytic bacteria and their potential applications. Critical Reviews in Plant Sciences, 2002, 21: 583-606.
[6] Wang C Y, Chen X R, Yang C D. Screening of IAA-producing endophytic bacteria fromKoeleriacristataand the effect on seed germination. Grassland & Turf, 2013, 33(1): 21-24.
王辰月, 陈秀蓉, 杨成德. 分泌吲哚乙酸洽草内生细菌的筛选及其对种子发芽的影响. 草原与草坪, 2013, 33(1): 21-24.
[7] Hu M. Recent advances on endophyte research. Journal of Shandong Agricultural University (Natural Science Edition), 2008, 39(1): 148-151.
胡萌. 植物内生细菌研究进展. 山东农业大学学报(自然科学版), 2008, 39(1): 148-151.
[8] Chen Y H. Feed additive for effectively regulating pig intestine: China, CN105876126A. 2016.
陈永红. 一种有效调理猪肠道的饲料添加剂: 中国, CN105876126A. 2016.
[9] Cuo M J. Application of special anti-diarrhea powder in prevention of piglet diarrhea. Chinese Abstracts of Animal Husbandry and Veterinary Medicine, 2015, 31(1): 204.
措毛加. 特效止痢散在仔猪腹泻预防中的应用. 中国畜牧兽医文摘, 2015, 31(1): 204.
[10] Mercadoblanco J, Ben J J L. Biotechnological applications of bacterial endophytes. Current Biotechnology, 2014, 3(1): 60-75.
[11] Glickmann E, Dessaux Y. A critical examination of the specificity of the salkowski reagent for indolic compounds produced by phytopathogenic bacteria. Applied & Environmental Microbiology, 1995, 61(2): 793-796.
[12] Xu J J, Song P, Feng L,etal. Growth-promoting effect and triptolide production regulation of endophytic bacteria fromTripterygiumwilfordii. Chinese Journal of Applied Ecology, 2014, 25(6): 1681-1687.
许进娇, 宋萍, 封磊, 等. 雷公藤内生细菌的促生作用及其对雷公藤甲素生成的影响. 应用生态学报, 2014, 25(6): 1681-1687.
[13] Jiang X W, Li H Q. Effects of exogenous salicylic acid on seed germination and seedling growth ofPogostemoncablinunder salt stress. Chinese Traditional and Herbal Drugs, 2015, 46(15): 2303-2308.
江绪文, 李贺勤. 外源水杨酸对盐胁迫下广藿香种子萌发和幼苗生长的影响. 中草药, 2015, 46(15): 2303-2308.
[14] Tie J, Ma J, Jin S,etal. Measurement and correlation analysis on leaf area in endangered plantTaxuschinensisvar.mairei. Journal of Shanxi University (Natural Science Edition), 2012, (3): 581-586.
铁军, 马婧, 金山, 等. 濒危植物南方红豆杉的叶面积测定及其相关分析. 山西大学学报(自然科学版), 2012, (3): 581-586.
[15] Xu Z L, Li T F. The use of the SPAD-502 chlorophyll meter during the flue-cured tobacco growth. Guizhou Agricultural Sciences, 2006, 34(4): 23-24.
徐照丽, 李天福. SPAD-502叶绿素仪在烤烟生产中的应用研究. 贵州农业科学, 2006, 34(4): 23-24.
[16] Zheng J, Chen Q X, Jin C,etal. The effects of different TTC method for the determination of root vigor of pine broadleaf tree seedling. Zhejiang Agricultural Sciences, 2008, (1): 39-42.
郑坚, 陈秋夏, 金川, 等. 不同TTC法测定枫香等阔叶树容器苗根系活力探讨. 浙江农业科学, 2008, (1): 39-42.
[17] Gaiero J R, Dunfield K E. Inside the root microbiome: Bacterial root endophytes and plant growth promotion. American Journal of Botany, 2013, 100(9): 1738-1750.
[18] Shen L Z, Liang F, Wang Z,etal. Identification of the endophytic bacteria StC01 and its plant-growth-promotion effect on potato. Jiangsu Agricultural Sciences, 2008, (1): 143-146.
沈丽珍, 梁峰, 王忠, 等. 马铃薯内生细菌StC01的鉴定与促生作用. 江苏农业科学, 2008, (1): 143-146.
[19] Cai X Q, He H, Hu F P. The effects of endophytic BS-2 (Bacillussubtilis) on growth and internal phytohormone of capsicum. Subtropical Agriculture Research, 2005, 1(4): 49-52.
蔡学清, 何红, 胡方平. 内生菌BS-2对辣椒苗的促生作用及对内源激素的影响. 亚热带农业研究, 2005, 1(4): 49-52.
[20] Xing K, Han J C, Liu H P,etal. Studies on the growth promotion of endopytic bacteria yc8 from rape. Acta Agriculturae Boreall-Sinica, 2007, 22(5): 180-183.
邢鲲, 韩巨才, 刘慧平, 等. 油菜内生细菌yc8促生作用及其机理研究. 华北农学报, 2007, 22(5): 180-183.
[21] Pereira G V D M, Magalhães K T, Lorenzetii E R,etal. A multiphasic approach for the identification of endophytic bacterial in strawberry fruit and their potential for plant growth promotion. Microbial Ecology, 2012, 63(2): 405-417.
[22] Wang X C, Cao Y H, Tang X,etal. Rice endogenous nitrogen fixing and growth promoting bacteriumHerbaspirillumseropedicaeDX35. Acta Microbiologica Sinica, 2014, 54(3): 292-298.
王秀呈, 曹艳花, 唐雪, 等. 水稻内生固氮菌HerbaspirillumseropedicaeDX35的筛选及其促生特性. 微生物学报, 2014, 54(3): 292-298.
[23] Kang H Y, Wang W, Liu J L,etal. Isolation and identification of two plant-growth promoting endophytes from alfalfa. Microbiology China, 2015, 42(2): 280-288.
康慧颖, 王伟, 刘佳莉, 等. 两株具促生作用的苜蓿内生菌的分离纯化与鉴定. 微生物学通报, 2015, 42(2): 280-288.
[24] Liu L H, Liu S J, Chen F M,etal. Effect of endophytic bacteria inoculation on cadmium uptake inSolanumnigrumL. Acta Scientiae Circumstantiae, 2013, 33(12): 3368-3375.
刘莉华, 刘淑杰, 陈福明, 等. 接种内生细菌对龙葵吸收积累镉的影响. 环境科学学报, 2013, 33(12): 3368-3375.
[25] Han K, Tian Z Y, Liu K,etal. Effect of endophytic bacteria with ACC deaminase activity inKosteletzkyapentacarposon wheat salt tolerance. Plant Physiology Journal, 2015, (2): 212-220.
韩坤, 田曾元, 刘珂, 等. 具有ACC脱氨酶活性的海滨锦葵(Kosteletzkyapentacarpos)内生细菌对小麦耐盐性的影响. 植物生理学报, 2015, (2): 212-220.
