甘农三号紫花苜蓿种带细菌的生物功能分析及鉴定
2018-01-19张振粉师尚礼
张振粉,师尚礼
(1.甘肃农业大学草业学院,甘肃 兰州 730070;2.草业生态系统教育部重点实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
内生细菌与宿主植物在长期共同进化过程中形成互惠互利关系,在自然界中广泛存在,现已从多种植物根、茎、叶、花、果实和种子中分离到[1-3]。植物内生细菌具有丰富的功能多样性,可分泌吲哚乙酸(indole-3-acetic acid, IAA)[4-6]、细胞分裂素(cytokinin, CTK)[7],这有助于植物种子更早和更好的萌发。大部分内生细菌被证明它们可以固氮(nitrate fixtion)[4,8-10],溶磷(phosphate solubilizing)[11-12],分解纤维素(cellulose dissolving)[13-14],帮助寄主植物更能适应贫瘠的土壤或生长环境;研究结果表明,内生细菌和寄主植物共生体提高了植物的抗寒、旱、盐和重金属的胁迫能力[15-16];共生体的这种耐贫瘠和抗逆境胁迫能力,使其种群在自然生态系统中具有更强的生存和竞争优势。内生细菌还可以防治植物病害并诱导植物抗病性,使寄主植物种群得到更好的保护和健康的繁衍[1]。植物内生细菌的生境特殊性决定了其既有理论研究的广度和深度,又有广泛的应用潜力,是潜力巨大且尚待开发的微生物新资源[4]。
毋庸置疑,种带内生菌同种带病原一样,可通过储存在时间上进行延续和通过商业、生产和科技交流等活动在空间上进行传播[17]。种带细菌可以在紫花苜蓿(Medicagosativa)种子存活达十年及以上,并具有活力[8,18]。大多数有花植物通过有性生殖和产生种子繁衍后代,植物种群的繁衍和生存与种子活力的保持和成功萌发成苗关系密切[19],并决定植物进入自然和农业生态系统的时间,直接影响作物的产量[20-21]。
甘农三号紫花苜蓿(Medicagosativacv. Gannong No.3)由甘肃农业大学育成,经1995 年全国牧草品种审定委员会评审通过、登记注册。它是通过引种国内外丰产品种,选择优良单株,扦插成无性系,经过多元杂交和配合力测验,由7个优良的无性繁殖系合成的综合品种[22]。该品种耐瘠薄、抗旱、耐寒。春季返青较早,生长速度较快,再生能力较强,秋季休眠早。抗倒伏能力一般。是当前我国甘肃、青海、宁夏、新疆灌区主要推广的品种。
本试验采用稀释平板法从表面消毒的甘农三号紫花苜蓿种子中分离种带细菌,采用稀释平板法从表面消毒的甘农三号紫花苜蓿种子中分离细菌,测定其产IAA、溶磷、固氮和分解纤维素生物学功能,并通过表型特征和16S rDNA基因序列分析鉴定其分类地位。本研究拟从甘农三号紫花苜蓿分离鉴定种带功能细菌,为进一步开发利用生防制剂奠定理论基础。
1 材料与方法
1.1 试验材料
供试的甘农三号紫花苜蓿品种种样于2014年7月从酒泉苜蓿种植区采集,并带回甘肃农业大学牧草种质资源实验室(兰州)常温保藏,于2015年9月开始种带细菌分离试验。
供试培养基:营养琼脂培养基(nutrient agar,NA)用于种带细菌的活化和保存,肉汁冻培养液(nutrient broth,NB)用于菌悬液的制备,金氏培养基B (King’s medium B,KB)用于菌株产IAA的测定[23]。Pikovaskaia培养基(PKO)用于菌株溶解无机磷的测定,蒙金娜培养基用于测定菌株溶解有机磷的能力,阿须贝无氮培养基用于固氮能力定性测定,纤维素刚果红培养基用于分解纤维素能力的测定[14]。
供试标准枯草芽孢杆菌(Bacillussubtilis,ACCC 10243)菌株购自中国农业微生物菌种保藏管理中心(ACCC: Agricultural Culture Collection of China)。
1.2 种带细菌的分离
将制备好的NA平板培养基,置培养箱中1~2 d后检查,确认没有污染方可使用。然后采用稀释法分离培养。即分别称取紫花苜蓿种样1 g (约450粒)备用,将种子先用75%的乙醇浸泡2 min,后转入1%的NaClO消毒5 min[24],用无菌水冲洗3~4次转至盛有10 mL无菌水和少量灭菌后的石英砂的研钵中研磨,静置10 min后取上清液梯度稀释到浓度为1~10-3,取4个稀释度的菌悬液各200 μL涂布于 NA平板上;无菌蒸馏水接种为对照组;试验重复3次。涂板后置于28 ℃恒温培养3~5 d,根据菌落和产色素等形态特征分类划线纯化,观察并描述菌落的形态、大小、光泽、质地、边缘特征、表面特征、隆起形状、透明度、菌落及培养基的颜色等特征[23],于背景布自然日光条件下拍照(Canon A720);将纯化后的菌种4 ℃短暂保存于NA斜面上。
1.3 种带细菌的生物功能测定
1.3.1产IAA 能力 标准曲线采用纯3-IAA制作。将经 KB培养液培养12 d的菌悬浮液和空白对照离心(4 ℃,10000 r·min-1,10 min), 取上清液4 mL加等量比色液,在黑暗中静置30 min,立即测定OD530 nm值,重复测3次,以加比色液的空白对照调0[25]。根据标准曲线计算出内生细菌分泌IAA的量。
1.3.2溶磷能力 将内生细菌接于PKO或蒙金娜培养基平板上,每皿接5点, 重复3次,置于28 ℃恒温培养箱培养,观察并测量菌株在培养基平板上形成的溶磷圈大小[26]。根据溶磷圈直径/菌落直径(D/d值)确定内生细菌的溶磷能力。
1.3.3固氮能力 经活化的供试菌株用无菌生理盐水配制菌悬液,以200 μL分别涂板接种于阿须贝无氮固体培养基和液体培养基内,3次重复,以接种无菌水为对照,28 ℃培养(150 r·min-1),在第3和7天目测其生长状况,平板上生长菌落和三角瓶内培养基变浑浊者为阳性[25]。
1.3.4分解纤维素能力 将活化培养48 h的菌株点接于纤维素刚果红培养基上,置于30 ℃恒温培养3 d。在菌株的观察过程中记录透明圈的直径大小(D)和菌落的直径大小(d),计算酶相对活性(A)=D/d[27]。
1.4 细菌鉴定
1.4.1生理生化特征 参照文献[28-30],进行部分菌株的革兰氏染色、产芽孢、需厌氧生长、硝酸盐还原、最大耐盐性和利用碳源产酸等生理生化特征测定。
1.4.216S rDNA基因序列分析鉴定 种带细菌16S rDNA基因序列扩增引物为通用引物27F/1492R,由武汉金开瑞生物工程有限公司合成;扩增和检测方法等具体参考文献[31],与GenBank数据库(http://www.ncbi.nlm.nih-gov/blast.cgi)中序列相似性比较,并用Clustal (1.8)软件进行多重序列比较和用Mega (4.0)软件邻接法构建系统发育树,确定其系统发育学地位。
2 结果与分析
2.1 种带细菌多样性
从表面消毒的甘农三号紫花苜蓿种子中分离得到8种细菌分离物(ZSR9~16),NA平板上48 h后的菌落形态特征详见图1。8种细菌分离物的菌落形态和产色素均有一定的差异,表明甘农三号紫花苜蓿种带可培养细菌具有多样性。

图1 甘农三号紫花苜蓿种带细菌分离物ZSR9~16的菌落形态Fig.1 The colony shape of seed-borne bacterial strains on NA medium of lucerne cultivar Gannong No.3
ZSR9:菌落乳头状凸起,近圆形,肉色,稍有光泽,表面褶皱,边缘不整齐,不透明,略有粘度,直径2~4 mm;ZSR10:菌落具有中凹的隆起,圆形或近圆形,乳白色,稍有光泽,边缘不整齐,半透明,略有粘度,直径2~3 mm;ZSR11:菌落稍凸起的,圆形或近圆形,白色,略显米黄,稍有光泽,边缘不整齐,不透明,略有粘度,直径2~6 mm;ZSR12:菌落凸起的,圆形或近圆形,肉色,有光泽,边缘整齐,半透明,有粘度,直径1~5 mm;ZSR13:菌落稍凸起的,圆形或近圆形,黄色,有光泽,边缘整齐,半透明,有粘度,直径1~4 mm;ZSR14:菌落凸起的,圆形或近圆形,奶白色,有光泽,边缘整齐,半透明,有粘度,直径2~4 mm;ZSR15:菌落凸起的,不规则形,表面有褶皱,灰褐色,有光泽,边缘不整齐,半透明,有粘度,直径2~4 mm;ZSR16:菌落平展,圆形或近圆形,白色,有光泽,边缘整齐,半透明,有粘度,直径2~4 mm。
2.2 种带细菌功能多样性
对种带细菌进行产IAA、溶磷、固氮和分解纤维素能力测定结果表明(表1),8个菌株均具有产IAA的能力,最强的是ZSR9,在添加色氨酸的培养基上分泌IAA的量达4.26 mg·L-1;有7个菌株具有分解纤维素的能力,占总株数的87.5%,ZSR9的能力最强;有7个菌株具有固氮能力,占总株数的87.5%;7个菌株具有同时溶解有机磷和无机磷的能力,占总株数的87.5%,且它们溶解无机磷均强于溶解有机磷的能力;其中ZSR9菌株对两种磷溶解能力最强。在已测得的8株种带细菌都具有生物功能,其中7株细菌:ZSR9~12、ZSR14~16同时具有分泌IAA、溶磷、固氮和分解纤维素的能力,ZSR9各个生物功能的能力显著(P<0.05)高于其他7种菌。
-:无功能Without biological function;+:有功能With biological function;同列不同小写字母表示差异显著(P<0.05) Different letters in the same column denote significant difference (P<0.05).
2.3 种带细菌的鉴定
2.3.1生理生化测定 部分甘农三号紫花苜蓿种带细菌分离物(ZSR9~12、ZSR14~15)和标准菌株ACCC 10243的主要细菌学特征见表2,根据标准菌株的生长形态特征以及部分生理生化指标开展对种带细菌分离物的表型鉴定。ZSR9与标准菌株ACCC 10243表型特征一致,结合形态特征初步确定其为枯草芽孢杆菌(Bacillussubtilis);ZSR11与标准菌株ACCC 10243非常接近,但是ZSR11能耐受50 ℃高温,区别于标准菌株,结合形态特征初步确定其为莫海威芽孢杆菌(B.mojavensis);ZSR10和ZSR14的表型特征比较接近,但在纤维醇、麦芽糖和松二糖中的产酸却表现不同,它们与标准菌株在明胶水解、硝酸盐还原、耐盐性和生长温度范围存在差异,结合形态特征初步确定ZSR10为沙福芽孢杆菌(B.safensis);ZSR14为短小芽孢杆菌(B.pumilus);ZSR12在厌氧生长、利用丙酸盐、生长温度范围、耐盐性和在松二糖中产酸区别于标准菌株,结合形态特征初步确定其为地衣芽孢杆菌(B.licheniformis);ZSR15在NA培养基上产生暗褐色色素、生长温度范围、耐盐性、在纤维醇和松二糖中的产酸特征与ACCC 10243存在差异,结合形态特征初步确定其为萎蔫芽孢杆菌(B.atrophaeus)。
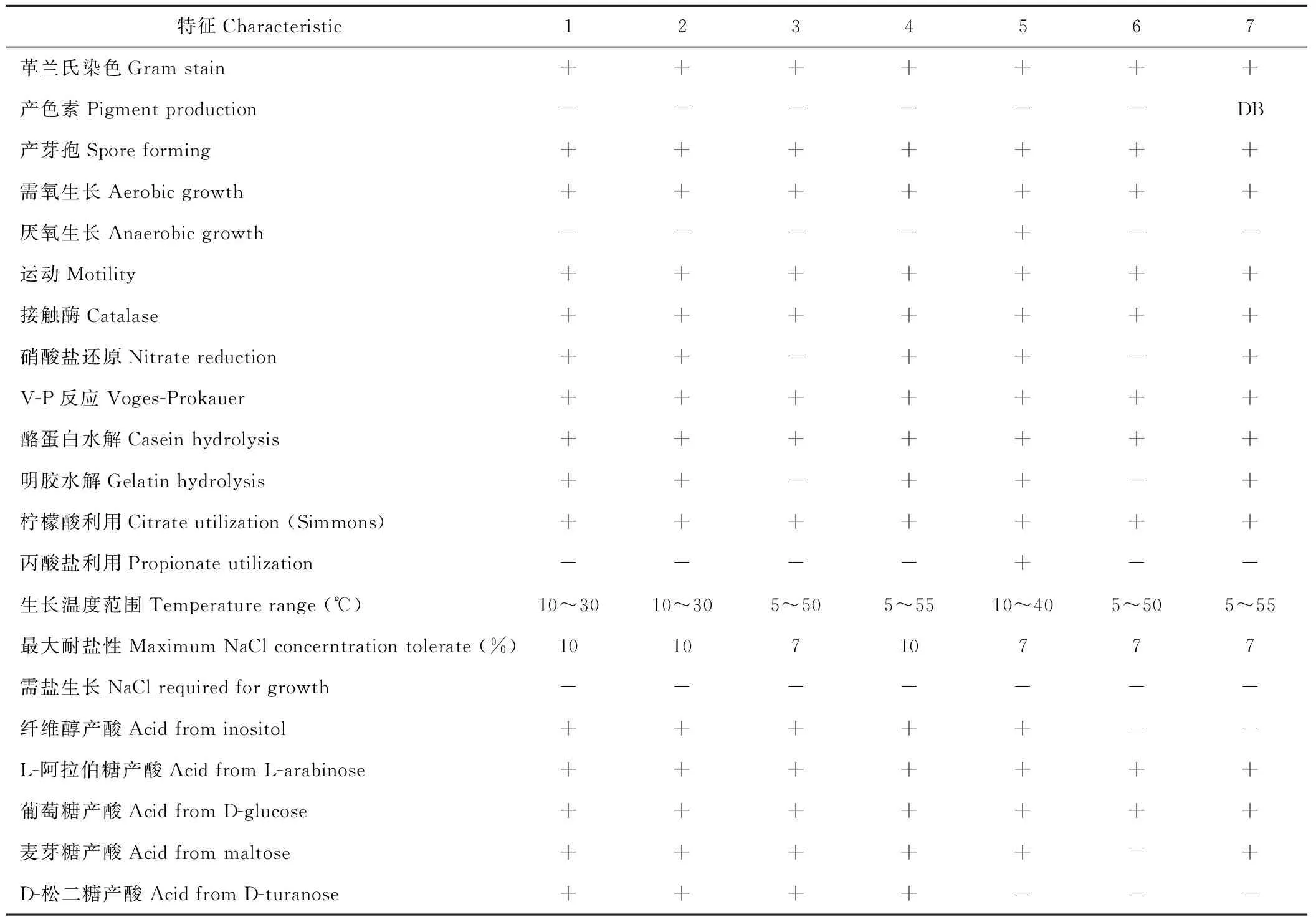
表2 甘农三号紫花苜蓿种带细菌分离物的表型特征Table 2 Phenotypic characteristics of bacterial strains isolated from seeds of lucerne cultivar Gannong No.3
1:BacillussubtilisACCC 10243;2:ZSR9;3:ZSR10;4:ZSR11;5:ZSR12;6:ZSR14;7:ZSR15; +:阳性Positive reaction;-:阴性Negative reaction;DB:暗褐色Dark brown.
2.3.216S rDNA鉴定 8株可培养紫花苜蓿种带细菌成功提取其基因组DNA并扩增出16S rDNA序列。经16S rDNA序列相似性分析和构建系统发育分析(图2),表明甘农三号紫花苜蓿种带细菌分属3个属,它们分别为芽孢杆菌属(Bacillus)、土地芽孢杆菌属(Terribacillus)和肠杆菌属(Enterobacter)。8株细菌分离物在NCBI的BLASTN与其16S rDNA序列同源性高达99%~100%。ZSR9和ZSR11与枯草芽孢杆菌(B.subtilis)、莫海威芽孢杆菌(B.mojavensis)、特基拉芽孢杆菌(B.tequilensis)和太阳海岸芽孢杆菌(B.axarquiensis)聚为一类;ZSR10与沙福芽孢杆菌(B.safensis)聚为一类;ZSR12与地衣芽孢杆菌(B.licheniformis)聚为一类;ZSR13与肠杆菌属(Enterobactersp.)聚为一类;ZSR14与短小芽孢杆菌(B.pumilus)聚为一类;ZSR15与深褐芽孢杆菌(B.atrophaeus)聚为一类;ZSR16与土地芽孢杆菌属(Terribacillussp.)聚为一类;表明在系统发育上其亲缘关系较近。

图2 甘农三号紫花苜蓿种带细菌的16S rDNA系统发育树Fig.2 16S rDNA sequence phylogenetic tree of seed-borne bacteria isolated from lucerne of Gannong No.3 括号内为 GenBank 登录号Numbers in parentheses represent the sequences’ accession number in GenBank;分支点上的数字为自展值百分比The number at each branch point is the percentage supported by bootstrap.
3 讨论与结论
本试验首次证实甘农三号紫花苜蓿的种带细菌具有多样性,从甘农三号紫花苜蓿种子中分离、纯化出8株细菌(ZSR9~16),通过对这8株菌的菌体形态描述、生理生化特征和16S rDNA鉴定,它们分别属于3个属的8种菌。其中芽孢杆菌属(Bacillus)的有6株:枯草芽孢杆菌(B.subtilis) ZSR9、沙福芽孢杆菌(B.safensis) ZSR10、莫海威芽孢杆菌(B.mojavensis) ZSR11、地衣芽孢杆菌(B.licheniformis) ZSR12、短小芽孢杆菌(B.pumilus) ZSR14和深褐芽孢杆菌(B.atrophaeus) ZSR15;以及属于肠杆菌属(Enterobacter)的ZSR13和属于土地芽孢杆菌属(Terribacillus)的ZSR16。芽孢杆菌属(Bacillussp.)广泛地存在于自然界,在土壤、水、空气、极端环境中和紫花苜蓿种子均存在[18,28]。福芽孢杆菌、莫海威芽孢杆菌和地衣芽孢杆菌首次于紫花苜蓿种子中分离得到。肠杆菌属(Enterobactersp.)广泛存在于自然界中,在人和动物的粪便、水、泥土、紫花苜蓿种子等植物中均可检出[18,32]。土地芽孢杆菌属(Terribacillussp.)首次于农田土壤中分离得到[33],又陆续从动物、西沙野生诺尼和烟草(Nicotianatabacum)等植物检测出[34-36]。其中土地芽孢杆菌属是首次分离自紫花苜蓿种子丰富了该属细菌的生境分布。
本试验分离得到6种芽孢杆菌(ZSR9~12和ZSR14~15),它们具有功能多样性,均能产IAA、溶磷、固氮和分解纤维素,枯草芽孢杆菌ZSR9的所有功能的能力最强,该结果与已有研究结果一致[14,37-39]。已有研究表明,芽孢杆菌与自然界物质转化、土壤肥力、环境卫生均密切相关,许多能水解淀粉,分解蛋白质、果胶、藻酸盐等,工业上用于提取淀粉酶、蛋白酶、果胶酶等[18];它们有的还可以产生抗菌素,可以抑制病原菌的发生扩展[40-42],本试验未对此类功能进行进一步研究,有待深入研究。生理生化指标测定显示,这6种菌具有较强的耐盐性和较宽的生长温度范围,最高能耐受10% NaCl和5~55 ℃,表明分离自甘农三号紫花苜蓿的6株芽孢杆菌具有耐瘠薄、耐寒、耐高温等属性。芽孢杆菌属里的大部分细菌都具有较高的耐盐性和较宽的生长温度范围,本研究结果与其一致[28]。菌株肠杆菌属ZSR13具有较弱的产IAA能力;菌株土地芽孢杆菌ZSR16具有功能多样性,具有较强的产IAA、溶磷、固氮和分解纤维素的能力;表明这两菌株是对甘农三号紫花苜蓿有利的。这些菌种的得到将为下一步将其作为生防菌种资源的开发利用奠定基础。
甘农三号紫花苜蓿与种带细菌是互惠互利的共生体,种带细菌可以帮助寄主适应瘠薄、寒冷等逆境,从而更健康的生长和繁殖;而紫花苜蓿给它提供稳定的寄生场所及生长繁殖所需的营养。因此,有益微生物的种类和数量的多少,是评价与其共生寄主的品质重要指标之一。本研究仅利用传统培养方法进行种带细菌的培养,不能充分展示甘农三号紫花苜蓿微生物的多样性。文献[43]报道用分子非培养手段从未感染Clavibactermichiganensissubsp.insidiosus的苜蓿种样中检测到其他32种种带细菌。因此,有必要探索模拟更接近种带细菌其营养需求及真实的生存环境,分离培养更丰富的有益细菌资源,为进一步的开发利用提供理论基础。当然,许多研究已证实通过传统的分离方法鉴定的微生物只占环境微生物总数的0.1%~10%,且一部分植物内生细菌由于人工环境不适宜而不能进行继代培养[4,44]。因此,也有必要利用非培养方法对其组织内非可培养其他种带细菌进行更详细的研究,从而更真实地了解其细菌多样性及其功能。
References:
[1] Abdallaha R A B, Mokni-Tlilib S, Nefzid A,etal. Biocontrol ofFusariumwilt and growth promotion of tomato plants using endophytic bacteria isolated fromNicotianaglaucaorgans. Biological Control, 2016, 97: 80-88.
[2] Suhandono S, Kusumawardhani M K, Aditiawati P. Isolation and molecular identification of endophytic bacteria from rambutan fruits (NepheliumlappaceumL.) cultivar Binjai. HAYATI Journal of Biosciences, 2016, 23: 39-44.
[3] Wang Y, Yang C D, Yao Y L,etal. The diversity and potential function of endophytic bacteria isolated fromKobreasiacapillifoliaat alpine grasslands on the Tibetan Plateau, China. Journal of Integrative Agriculture, 2016, 15(9): 2153-2162.
[4] Yang C D, Wang Y Q, Chen X R,etal. Diversity of endophytic bacteria isolated fromKobresiaduringwinter dormancy. Acta Prataculturae Sinica, 2016, 25(8): 136-144.
杨成德, 王玉琴, 陈秀蓉, 等. 2种嵩草属牧草休眠期内生细菌多样性研究. 草业学报, 2016, 25(8): 136-144.
[5] Li Z D, Chen X R, Li P,etal. Identification ofPolygonumviviparumendophytic bacteria Z5 and determination of the capacity to secrete IAA and antagonistic capacity towards pathogenic fungi. Acta Prataculturae Sinica, 2010, 19(2): 61-68.
李振东, 陈秀蓉, 李鹏, 等. 珠芽蓼内生菌Z5产IAA和抑菌能力测定及其鉴定. 草业学报, 2010, 19(2): 61-68.
[6] Gao X X, Man B Y, Chen X R,etal. Identification and determination of biological characteristics ofKobresiacapillifoliaendophytic bacteria X4 in the East Qilian Mountain Alpine grasslands. Acta Prataculturae Sinica, 2013, 22(4): 137-146.
高晓星, 满百膺, 陈秀蓉, 等. 东祁连山线叶嵩草内生细菌X4的产吲哚乙酸、解磷、抗菌和耐盐特性研究及分子鉴定. 草业学报, 2013, 22(4): 137-146.
[7] Francis I M, Stes E, Zhang Y C,etal. Mining the genome ofRhodococcusfascians, a plant growth-promoting bacterium gone astray. New Biotechnology, 2016, 33(5): 706-717.
[8] Zhang Z F, Nan Z B. Isolation and identification of lucerne seed-borne growth promotingPaenibacilluspolymyxain Gansu Province, China. Acta Prataculturae Sinica, 2014, 23(5): 256-262.
张振粉, 南志标. 甘肃省紫花苜蓿种带促生多粘类芽孢杆菌的分离与鉴定. 草业学报, 2014, 23(5): 256-262.
[9] Li Y X, Guo P Y, Sun J G. Isolation, identification, phylogeny and growth promoting characteristics of endophytic diazotrophs from tuber and root crops. Scientia Agricultura Sinica, 2017, 50(1): 104-122.
李艳星, 郭平毅, 孙建光. 块根块茎类作物内生固氮菌分离鉴定、系统发育与促生特性. 中国农业科学, 2017, 50(1): 104-122.
[10] da Silveiraa A P D, Salaa V M R, Cardosob E J B N,etal. Nitrogen metabolism and growth of wheat plant under diazotrophic endophytic bacteria inoculation. Applied Soil Ecology, 2016, 107: 313-319.
[11] Zhang F F, Song X Q, Ding Q,etal. Activity analysis of growth-promoting endophytic bacteria isolated from the roots ofPhalaenopsispulcherrima. Journal of Tropical Biology, 2015, 6(3): 295-292.
张芳芳, 宋希强, 丁琼, 等. 五唇兰根部内生细菌的筛选及其促生活性. 热带生物学报, 2015, 6(3): 295-292.
[12] Zhang Y, Liu H J, Chen Z,etal. Genetic diversity of phosphorous dissolving ginger endophytic bacteria and their Al-P and Fe-P dissolving ability. Southwest China Journal of Agricultural Sciences, 2015, 28(2): 591-596.
张雨, 刘汉军, 陈章, 等. 生姜内生溶磷细菌遗传多样性及溶解Al-P和Fe-P能力研究. 西南农业学报, 2015, 28(2): 591-596.
[13] Li Z D, Chen X R, Yang C D,etal. Isolation and identification of cellulose-decomposing microorganisms inKobresiacapillifolia. Pratacultural Science, 2014, 31(1): 48-55.
李振东, 陈秀蓉, 杨成德, 等. 线叶嵩草内生产纤维素酶细菌分离及初步鉴定. 草业科学, 2014, 31(1): 48-55.
[14] Zhang Z F. 16S rDNA Identification and Diversity Function Study of Endophytic Bacterias from 4 Forage Grasses. Lanzhou: Gansu Agricultural University, 2010.
张振粉. 四株牧草内生细菌的功能多样性研究及其16S rDNA鉴定. 兰州: 甘肃农业大学, 2010.
[15] Xua J Y, Han Y H, Chen Y S,etal. Arsenic transformation and plant growth promotion characteristics of As-resistant endophytic bacteria from As-hyperaccumulatorPterisvittata. Chemosphere, 2016, 114: 1233-1240.
[16] Shahzada R, Khanb A L, Bilala S,etal. Inoculation of abscisic acid-producing endophytic bacteria enhances salinity stress tolerance inOryzasativa. Environmental and Experimental Botany, 2017, 136: 68-77.
[17] Nan Z B. Alfalfa diseases and its integrated control system in China. Animal Science and Veterinary Medicine, 2001, 18(4): 1-4.
南志标. 我国的苜蓿病害及其综合防治体系. 动物科学与动物医学, 2001, 18(4): 1-4.
[18] Zhang Z F. Research of Lucerne (MedicagosativaL.) Seed-borne Bacterial Diversity and Bacterial Diseases. Lanzhou: Lanzhou University, 2013.
张振粉. 紫花苜蓿种带细菌多样性及细菌性病害研究. 兰州: 兰州大学, 2013.
[19] Rajjou L, Duval M, Gallardo K,etal. Seed germination and vigor. Annual Review of Plant Biology, 2012, 63: 507-533.
[20] Xu H H, Li N, Liu S J,etal. Research progress in seed germination and its control. Acta Agronomica Sinica, 2014, 40(7): 1141-1156.
徐恒恒, 黎妮, 刘树君, 等. 种子萌发及其调控的研究进展. 作物学报, 2014, 40(7): 1141-1156.
[21] Weitbrecht K, Müller K, Leubner-Metzger G. First off the mark: early seed germination. Journal of Experimental Botany, 2011, 62: 3289-3309.
[22] Ma H L, Wen S W. Seed production technology of luserne cultivar Gannong 3. Chinese Qinghai Journal of Animal and Veterinary Sciences, 2001, 31(5): 45.
马晖玲, 温尚文. 甘农三号紫花苜蓿种子生产技术. 青海畜牧兽医杂志, 2001, 31(5): 45.
[23] Fang Z D. The Study Method of Plant Disease. The Third Edition. Beijing: China Agriculture Press, 1998: 182-186.
方中达. 植病研究法. 第三版. 北京: 中国农业出版社, 1998: 182-186.
[24] Nan Z B. Fungicide seed treatments of sainfoin control seed-borne and root-invading fungi. New Zealand Journal of Agricultural Research, 1995, 38(3): 413-420.
[25] Xi L Q, Li D F, Wang J F,etal. Measurement of nitrogen fixation capability and excreted IAA capability of PGPB isolated from cotton rhizosphere in salina. Arid Zone Research, 2008, 25(5): 690-694.
席琳乔, 李德锋, 王静芳, 等. 棉花根际促生菌固氮和分泌生长激素能力的测定. 干旱区研究, 2008, 25(5): 690-694.
[26] Yang C D, Li Z D, Chen X R,etal. Identification, pathogen inhibiting and nitrogen fixation of endophytic bacterium Z19 ofPolygonumviviparum. Microbiology China, 2014, 41(2): 267-273.
杨成德, 李振东, 陈秀蓉, 等. 高寒草地珠芽蓼内生拮抗固氮菌Z19的鉴定及其固氮功能研究. 微生物学通报, 2014, 41(2): 267-273.
[27] Jin X, Chu Y Q, Jin X J. Separation and purification of the high-efficiency cellulose-decomposing bacterium in composting. China Biogas, 2011, 29(6): 7-11.
晋昕, 褚艳琴, 晋小军. 堆肥中高效纤维素分解菌的分离与纯化. 中国沼气, 2011, 29(6): 7-11.
[28] De Vos P, Garrity G M, Jones D,etal. Bergey’s Manual of Systematic Bacteriology. Second Edition, Volum 3. New York: Springer Print, 2009.
[29] Dong X Z, Cai M Y. Handbook of Common Bacterial System Identification. Beijing: Science Press, 2001.
东秀珠, 蔡妙英. 常见细菌系统鉴定手册. 北京: 科学出版社, 2001.
[30] Satomi M, La Duc M T, Venkateswaran K.Bacillussafensissp. nov., isolated from spacecraft and assembly-facility surfaces. International Journal of Systematic and Evolutionary Microbiology, 2006, 56: 1735-1740.
[31] Zhang G X, Mao Q, He Z Y,etal. Detection of nitrogenase activity and phosphorus dissolving ability of endophytic isolates fromOryzarufipogonin Lingshui. Chinese Journal of Applied & Environmental Biology, 2006, 12(4): 457-460.
张国霞, 茅庆, 何忠义, 等. 陵水普通野生稻(Oryzarufipogon)内生菌的固氮及溶磷特性. 应用与环境生物学报, 2006, 12(4): 457-460.
[32] Brenner D J, Krieg N R, Staley J T. Bergey’s Manual of Systematic Bacteriology. Second Edition, Volum 2 Part B. New York: Springer Publication, 2005.
[33] An S Y, Asahara M, Goto K,etal.Terribacillussaccharophilusgen. nov., sp. nov. andTerribacillushalophilussp. nov., spore-forming bacteria isolated from field soil in Japan. International Journal of Systematic and Evolutionary Microbiology, 2007, 57: 51-55.
[34] Xia X D, Liu X L, Wang Y,etal. Isolation and identification of spoilage organisms in whitefish. Food Science, 2015, 36(21): 175-179.
夏秀东, 刘小莉, 王英, 等. 白鱼腐败细菌的分离与鉴定. 食品科学, 2015, 36(21): 175-179.
[35] Chen Z B, Huang L, Xia Z Y,etal. Species diversity characteristics of endophytic bacteria in tobacco at different regions of Yunnan Province. Southwest China Journal of Agricultural Sciences, 2015, 28(2): 857-861.
陈泽斌, 黄丽, 夏振远, 等. 云南不同地区烟草内生细菌多样性特征. 西南农业学报, 2015, 28(2): 857-861.
[36] Bai F R, Liu Y, Cao Y H,etal. Isolation and identification of endophytes in wild Noni leaves from Paracel islands. Journal of Food Science and Technology, 2015, 33(1): 32-37.
白飞荣, 刘洋, 曹艳花, 等. 西沙野生诺尼叶片内生菌的分离与初步鉴定. 食品科学技术学报, 2015, 33(1): 32-37.
[37] Zhang L J, Li S N, Zhu B C. Screening, identification and degradation conditions of cellulose decomposing bacteriaBacilluspumilusT-7. Chinese Agricultural Science Bulletin, 2011, 27(7): 112-118.
张立静, 李术娜, 朱宝成. 高效纤维素降解菌短小芽孢杆菌(Bacilluspumilus) T-7的筛选、鉴定及降解能力的研究. 中国农学通报, 2011, 27(7): 112-118.
[38] Chang T, Yang C D, Xue L,etal. Effects of disease control and growth promotion ofPolygonumviviparumendophytic bacteriaBacillusmojavensison potato. Acta Prataculturae Sinica, 2015, 24(12): 83-91.
畅涛, 杨成德, 薛莉, 等. 珠芽蓼内生菌 ZA1 对马铃薯的防病促生研究. 草业学报, 2015, 24(12): 83-91.
[39] Yuan S L, Xing D M, Dou S H,etal. Isolation and identification of a fibrinolytic enzyme producing bacterium and its analysis of the fibrinolytic components. Microbiology China, 2014, 41(9): 1843-1849.
袁慎亮, 邢德明, 窦少华, 等. 一株产纤溶酶菌株的分离鉴定及其纤溶组分分析. 微生物学通报, 2014, 41(9): 1843-1849.
[40] Ji Z L, Tang L J, Zhang Q X,etal. Isolation, purification and characterization of antifungal protein fromBacilluslicheniformisW10 strain. Acta Phytopathologica Sinica, 2007, 37(3): 260-264.
纪兆林, 唐丽娟, 张清霞, 等. 地衣芽孢杆菌W10抗菌蛋白的分离纯化及其理化性质研究. 植物病理学报, 2007, 37(3): 260-264.
[41] Ran J J, Xu J H, He D,etal. Identification of antagonistic bacterium strainBacillusamyloliquefaciens7M1 againstFusariumgraminearumand characterization of the antibiotics from the target strain. Microbiology China, 2016, 43(11): 2437-2447.
冉军舰, 徐剑宏, 赫丹, 等. 小麦赤霉病原菌拮抗菌Bacillusamyloliquefaciens7M1产抗菌素的研究. 微生物学通报, 2016, 43(11): 2437-2447.
[42] Lian L L, Xie L Y, Lin Q Y,etal. Hybridization detection of three antibiotics related genes fromBacillusspp. Acta Laser Biology Sinica, 2008, 17(1): 81-85.
连玲丽, 谢荔岩, 林奇英, 等. 芽孢杆菌三种抗菌素基因的杂交检测. 激光生物学报, 2008, 17(1): 81-85.
[43] European Plant Protection Organization.Clavibactermichiganensisssp.insidiosus. European Plant Protection Organization Bulletin, 2010, 40: 353-364.
[44] Amann R I, Ludwig W, Schleifer K H. Phylogenetic identification and in situ detection of individual microbial cells without cultivation. Microbiological Reviews, 1995, 59(1): 143-169.
