干法灰化-碱熔-离子选择性电极法测定植物样品中氟
2018-01-19,,,,
, , , ,
(1. 中国地质调查局 武汉地质调查中心, 武汉 430205; 2. 中国地质科学院 地球物理地球化学勘查研究所, 廊坊 065000)
氟是生物体内重要的微量元素之一,也是环境化学和生命科学研究中的常见元素。在生态地球化学中,氟为必测定元素,含量很低,但具有高度的生物活性,在动植物体内无生物降解作用[1-2]。氟化物污染空气后,能够在植物中富集,对植物的生长和发育造成严重的危害,即使低水平的污染也能通过生物富集和食物链作用对人体造成一定的危害,不利于身体健康[3]。同时人体缺氟或氟过量也会对健康造成不良的影响[4]。因此,分析植物样品中氟含量的变化对研究生态地球化学以及人体和动植物的健康特征具有重要的意义。
植物样品中氟元素的含量非常低,而离子选择性电极法是测定低含量氟的常用方法,具有仪器设备简单、抗干扰能力强、成本低、选择性强以及灵敏度高等优点,可以快速测定大批量的含氟样品[5-7]。
测定样品中氟的预处理方法主要有酸蒸馏法[8]、氟试剂比色法[9]、高温热水解法[10]、碱熔法[11-14]等。酸蒸馏法具有测定空白值低的优点,但操作很复杂;氟试剂比色法的灵敏度较低;高温热水解法具有能使待测元素与基体组分分离等优点,但需要特殊的前处理装置,因而较难得到推广;碱熔法具有操作简便、样品分解完全、样品处理快速以及灵敏度高的优点,适合于批量含氟样品的测定。
植物样品具有体积蓬松、有机物含量高等特殊性,为避免有机物对待测元素的干扰,在测定前必须充分去除有机物。目前植物样品去除有机物的方法主要有干法灰化和湿法消解两种[15]。湿法消解具有消耗大量的试剂、污染环境、空白值偏高的缺点[16];干法灰化通过高温灼烧分解试样中的有机物,减少试剂污染,空白值低,可以有效富集待测非挥发元素。本工作采用干法灰化-碱熔-离子选择性电极法测定植物样品中氟的含量。
1 试验部分
1.1 仪器与试剂
PXSJ-216F型离子计,配PF-1-01型氟离子指示电极及217-01型参比电极;CJJ-781型磁力搅拌器;F 6000型马弗炉。
氟标准储备溶液:100.0 mg·L-1,称取预先在120 ℃干燥过2 h以上的氟化钠0.221 0 g,溶于600 mL左右的水中,再稀释至1 L,摇匀,移至塑料瓶中保存。
氟标准溶液:10.0 mg·L-1,移取100.0 mg·L-1氟标准储备溶液10 mL,稀释至100 mL,摇匀,移至塑料瓶中保存。
所用试剂均为分析纯,试验用水为去离子水。
1.2 试验方法
1.2.1 样品预处理
称取植物试样1.500 0 g于50 mL镍坩埚中(同时做空白样),加入100 g·L-1乙酸镁溶液10 mL。将坩埚放在电热板上蒸干并炭化,转入到马弗炉中进行灰化,缓慢升高马弗炉灰化温度,于300 ℃恒温0.5 h,400 ℃恒温0.5 h,550 ℃恒温2.0 h。灰化后取出坩埚并冷却至室温,加入颗粒状氢氧化钠4 g均匀覆盖在灰化后的试样上面,放入750 ℃的马弗炉中恒温20 min进行碱熔,取出试样并冷却至50 ℃左右。用坩埚钳将坩埚夹入到250 mL烧杯中,向坩埚底部加入无水乙醇1 mL,同时加入沸水约30 mL进行浸提,在沸水浸提过程中,如果有样品未完全溶于沸水中,可将烧杯放入电热板上加热溶解。将浸提液定容至50 mL玻璃比色管中,摇匀,静置过夜。移取上清液10 mL置于25 mL玻璃比色管中,滴入3 g·L-1甲基橙指示剂1~2滴,加入硫酸(1+3)溶液调节酸度至溶液由黄色刚变为紫红色。再向溶液中加入0.94 mol·L-1柠檬酸钠溶液10 mL,用水稀释至25 mL,摇匀,此时该溶液的pH为5.5左右。将溶液全部移入50 mL干燥的烧杯中,放入搅拌子,于25 ℃恒温室内平衡0.5 h以上,待测。
1.2.2 氟的测定
在分析待测溶液前,先将离子计中的氟离子选择性电极和饱和甘汞电极插入到饱和氯化钾溶液中浸泡40 min以上,使电极活化、平衡,再于电位测量仪上读取温度为25 ℃时的平衡电位(平衡电位指搅拌状态下,电极电位每分钟的变化不超过0.2 mV时的电位)。根据能斯特方程中的平衡电位与溶液浓度的对数成反比的特性,采用标准曲线法测量待测溶液中的氟离子浓度,再根据称样量转换成试样中的氟含量。
2 结果与讨论
2.1 预处理条件的选择
2.1.1 固氟试剂和固氟条件
由于植物样品体积蓬松、质量轻、糖分及有机物高,在炭化和灰化过程中样品的灰分容易挥发,从而导致了氟的损失,因此必须选择固氟试剂来保证氟含量的准确测定。在灼烧过程中,样品中结合状态的氟化物结构被破坏,无机镁盐能与氟进行络合从而将氟固定。试验选择乙酸镁作为固氟试剂。
试验以柑橘叶标准物质(GBW 10020)为样品,按试验方法考察了乙酸镁的质量浓度依次为10,40,70,100,150,200 g·L-1时对氟测定的影响,其结果见图1。

图1 乙酸镁的质量浓度对氟测定值的影响Fig. 1 Effect of mass concentration of magnesium acetate on determination values of F
由图1可知:乙酸镁的质量浓度低于100 g·L-1时,随乙酸镁的质量浓度的增大,氟的测定值明显增大,说明随乙酸镁质量浓度的增大,固氟的效果也在提高;乙酸镁的质量浓度高于100 g·L-1时,氟的测定值缓慢降低。加入乙酸镁的量首先要保证能完全浸没植物样品,量太少则未能浸没试样,氟固定不完全;量太多则镁离子可能会干扰氟的测定。试验选择加入100 g·L-1乙酸镁溶液10 mL。
2.1.2 灰化温度
植物样品的灰化是一个去除有机物的过程,有机物的存在会使氟浸提不完全,造成测定结果严重偏低。试验以柑橘叶标准物质(GBW 10020)为样品,考察了灰化温度对氟测定的影响。结果表明:当灰化温度低于500 ℃时,氟的测定值随灰化温度的升高而增大,测定值比认定值偏低,灰化后的样品中有黑色颗粒物存在,说明样品灰化不完全;当灰化温度高于500 ℃时,测定值基本恒定,与认定值吻合,样品呈白色灰分状,已完全灰化,在650 ℃时氟元素无挥发损失。但考虑到镍坩埚在高温下的使用寿命以及不同植物样品灰化温度过高时氟可能会有损失。试验选择灰化温度为550 ℃。
2.1.3 灰化时间
样品从进马弗炉开始缓慢升温1 h到灰化温度,灰化效果好。试验在灰化之前首先在电热板上蒸干、炭化,这是一个预灰化的过程,电热板温度最高为280 ℃。因此,马弗炉的温度从300 ℃(恒温0.5 h)开始升温,升至400 ℃恒温0.5 h,再升高至灰化温度550 ℃。
试验以柑橘叶标准物质(GBW 10020)为样品,按试验方法考察了灰化时间依次为0.5,1.0,1.5,2.0,3.0 h时对氟测定的影响。结果表明:当灰化时间小于2.0 h时,测定结果明显偏低,样品中有黑色颗粒物存在,灰化不充分;灰化时间为2~3 h时,测定结果趋于恒定,且接近认定值,灰化效果好。但考虑到时间过长,镍坩埚在高温下使用寿命会降低,样品的分析效率也会降低。试验选择灰化时间为2.0 h。
2.2 样品溶液基体的影响
标准曲线法适用于标准溶液和样品溶液具有大致相同的基体,能尽可能地消除基体对结果的影响。试验采用空白碱溶液的上清液作为介质,分取不等量的10.0 mg·L-1氟标准溶液加入到介质中配制成氟标准溶液系列,使标准溶液和样品溶液的基体一致,消除了基体效应。
2.3 标准曲线和检出限
按试验方法制备6个空白样,分别移取空白样的碱熔上清液10 mL于6个25 mL玻璃比色管中,依次加入10.0 mg·L-1氟标准溶液0,0.10,0.20,0.40,0.80,1.0 mL配制成标准溶液系列,以氟离子质量浓度的自然对数为横坐标,对应的平衡电位为纵坐标绘制标准曲线。结果表明:氟离子的质量浓度在0.10~1.0 mg·L-1内,其自然对数与平衡电位呈线性关系,线性回归方程为E=-18.33 lnρ+393.4,相关系数为0.999 4。
同时做12份空白样品,计算其标准偏差(σ),以3倍标准偏差对应的质量浓度作为该方法的检出限,同时考虑稀释因子以及称样量的影响,方法的检出限(3σ)为0.42 μg·g-1。
2.4 方法的精密度
以国家一级地球化学生物成分分析标准物质GBW 10015(菠菜)、GBW 10020(柑橘叶)、GBW 10023(紫菜)作为样品,按试验方法进行12份平行测定。结果表明:测定值的相对标准偏差(RSD)依次为6.1%,3.4%,4.4%,均小于7%。
2.5 方法的准确度
按试验方法对8种国家一级地球化学生物成分分析标准物质进行测定,结果见表1。
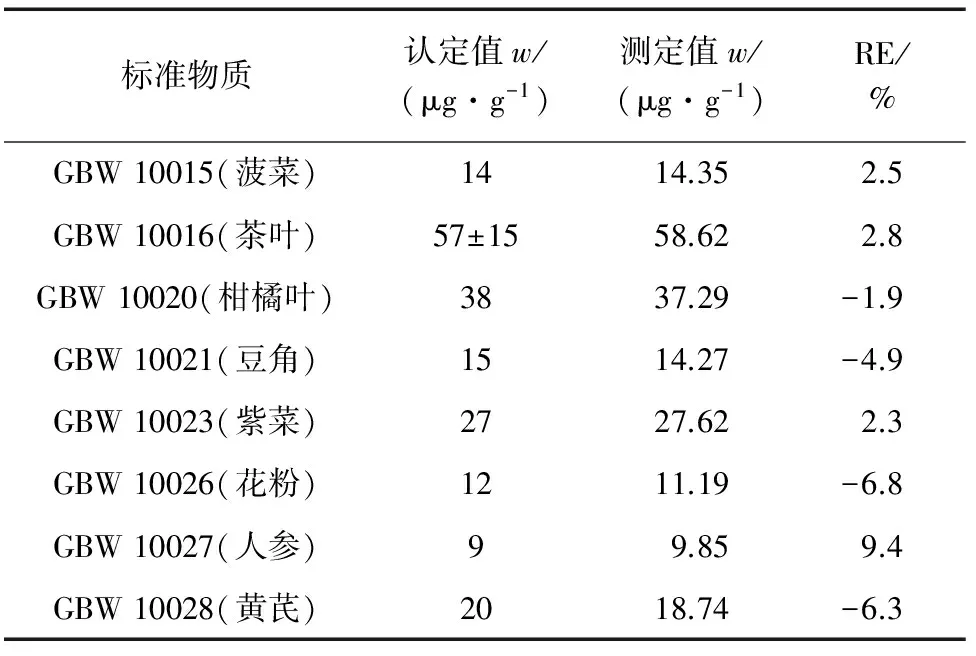
表1 标准物质分析结果Tab. 1 Analytical results of standard material
由表1可知:测定值与认定值基本吻合,相对误差(RE)均小于10%。
2.6 样品分析
按试验方法对某地区的8种不同类别的植物样品(鲜果、干果实、叶片、茎、根)进行了测定,并用干法灰化-碱熔-离子色谱法进行对比试验,其分析结果见表2。
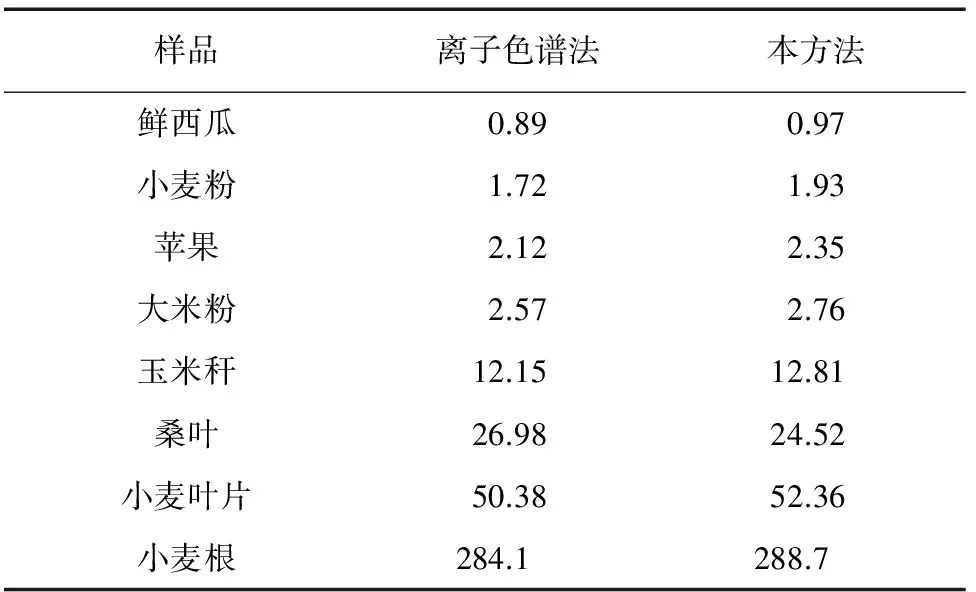
表2 样品分析结果Tab. 2 Analytical results of the samples μg·g-1
由表2可知:氟含量从鲜果到根呈低、中、高阶梯状分布,测定范围广泛。本方法与离子色谱法的分析结果一致,但本方法的分析成本比离子色谱法低,适合大批量植物样品的分析。
本工作针对植物样品的特殊性,改进了样品的预处理条件,消除了样品基体的影响,建立了一种快速、准确测定植物样品中氟的离子选择性电极法。方法的检出限较低、精密度和准确度较好,在环境化学和生态地球化学领域中具有重要的意义。
[1] 徐霞,应兴华,段彬伍.植物样品中痕量氟的离子色谱法分析[J].分析测试学报, 2008,27(1):57-59.
[2] 赵怀颖,孙德忠,吕庆斌.燃烧水解-离子选择电极法测定植物样品中氟含量的方法改进[J].岩矿测试, 2010,29(1):39-42.
[3] 赵文芳.氟离子电极法测定植物叶片中氟化物含量[J].甘肃环境研究与监测, 2002,15(1):25-26.
[4] 葛可佑.中国营养科学全书[M].北京:人民卫生出版社, 2004.
[5] 李宗澧,刘静.离子选择电极快速测定植物中氟[J].分析化学, 1992,20(2):244-246.
[6] 叶家瑜,江宝林.区域地球化学勘查样品分析方法[M].北京:地质出版社, 2004.
[7] 李清彩,赵庆令,张洪民,等.离子选择性电极电位法测定钼矿石和钨矿石中氟[J].理化检验-化学分册, 2011,47(8):932-934.
[8] 王家仪,张兴德.蒸馏法测定氟的几点改进意见[J].新疆有色金属, 1983(1):77-80.
[9] 高素虹,蔡梦华,洪祥奇.灰化蒸馏-氟试剂比色法与离子色谱法测定茶叶中氟含量的比较[J].预防医学论坛, 2010,16(6):549-550.
[10] 冯福建,刘晓平,虞江萍,等.环境样品中氟的测定[J].卫生研究, 2004,33(3):288-291.
[11] 熊文明,张志军.碱熔-离子色谱法同时测定玻璃中的氟和硫[J].岩矿测试, 2011,30(6):768-771.
[12] 肖芳,倪文山,毛香菊,等.混合碱熔融-离子选择性电极法测定矿石中氟[J].冶金分析, 2015,35(9):77-82.
[13] 邓海文,吴代赦,陈成广,等.碱熔-氟离子选择性电极法测定土壤氟含量[J].地球与环境, 2007,35(7):284-288.
[14] 李忆晨.以碱熔为基础的1∶20万化探样品中钨、钼、氟连测操作[J].内蒙古石油化工, 2015(16):65-66.
[15] 乔爱香,曹磊,江冶,等.干法灰化和微波消解-电感耦合等离子体发射光谱法测定植物样品中22个主次量元素[J].岩矿测试, 2010,29(1):29-33.
[16] 王晓凤,刘鸿皋,王树松.光谱分析中空白与检出限的讨论[J].光谱实验室, 1998,15(2):76-78.
