超高效液相色谱-串联质谱法测定蜂蜜中甲硝唑
2018-01-19,,,,*
, , , , *
(1. 贵州省疾病预防控制中心, 贵阳 550004; 2. 贵州师范学院 化学与生命科学学院, 贵阳 550018)
甲硝唑(MNZ)是人工合成的硝基咪唑类药物,广泛用于预防和治疗组织滴虫病、球虫病等疾病[1]。近年来,甲硝唑被许多蜂农用来预防和控制蜜蜂孢子虫病,因疗效明显,价格低廉,被蜂农广泛使用,这造成了甲硝唑药物在蜂蜜中残留[2]。甲硝唑对细菌有诱变作用,对人体具有神经毒性和潜在致癌性[3]。为防止甲硝唑残留对人体健康产生危害,欧盟、加拿大、美国等禁止甲硝唑用于食源性动物养殖。我国农业部和国家药品监督管理局2002年颁布的227号公告规定甲硝唑及其盐、酯及制剂不准以促进动物生长为目的在所有食品动物饲养过程中使用。为了解蜂蜜中甲硝唑的残留现状,建立准确、快速地测定蜂蜜中甲硝唑含量的方法十分必要。
目前,甲硝唑的测定方法主要有高效液相色谱法[4]、液相色谱-质谱法或液相色谱-串联质谱法[5-9]、气相色谱法[10]、气相色谱-质谱法[11]等。气相色谱法和高效液相色谱法只能依靠保留时间定性,蜂蜜基质干扰严重,且甲硝唑残留量低,检出限达不到要求;气相色谱-质谱法测定时甲硝唑需衍生化,受衍生效率的影响;虽然液相色谱-串联质谱法具有灵敏度高、检出限低等特点,但是蜂蜜中甲硝唑的残留量接近高效液相色谱-串联质谱法(HPLC-MS/MS)的检出限,还需要提高样品的前处理技术进行富集净化。本工作以固相萃取柱富集净化,采用超高效液相色谱-串联质谱法(UHPLC-MS/MS)测定蜂蜜中甲硝唑的含量。
1 试验部分
1.1 仪器与试剂
Thermo Ultimate 3000型超高效液相色谱仪;TSQ Quantum ultra型三重四极杆质谱仪,配电喷雾离子源;3-18K型台式高速离心机;TTL-DC Ⅱ型氮吹仪;Aquaplus型超纯水机;IKA MS3型涡旋混匀器;KQ-700DV型数控超声波清洗器;MCS固相萃取柱(500 mg/6 mL)。
甲硝唑标准储备溶液:1.000 g·L-1,称取甲硝唑标准品(纯度大于99.5%) 10 mg于10 mL容量瓶中,用甲醇稀释至刻度,-18 ℃冰箱保存。
D4-甲硝唑(内标)储备溶液:0.100 g·L-1,取D4-甲硝唑1 mg于10 mL容量瓶中,用甲醇稀释至刻度,-18 ℃冰箱保存。
磷酸氢二钾溶液:0.5 mol·L-1,称取三水合磷酸氢二钾57.00 g,用水配制成500 mL溶液。
甲酸、甲醇和乙腈为色谱纯,氨水、盐酸为优级纯,乙酸乙酯、磷酸氢二钾为分析纯,试验用水为超纯水。
1.2 仪器工作条件
1) 色谱条件 Hypersil Gold-C18色谱柱(150 mm×2.1 mm,1.9 μm),柱温为30 ℃;进样体积为10 μL;流量为0.3 mL·min-1。流动相:A为0.1%(体积分数,下同)甲酸溶液,B为乙腈。梯度洗脱程序:0~0.5 min时,A为95%;0.5~5.5 min时,A由95%降至10%,保持1.5 min;7.0~7.1 min时,A由10%升至95%。
2) 质谱条件 电喷雾正离子源(ESI+),喷雾电压3 kV;毛细管温度350 ℃,蒸发温度270 ℃;鞘气压力270 kPa,辅助气压力104 kPa;多反应监测(MRM)模式。其余质谱参数见表1,其中“*”为定量离子。
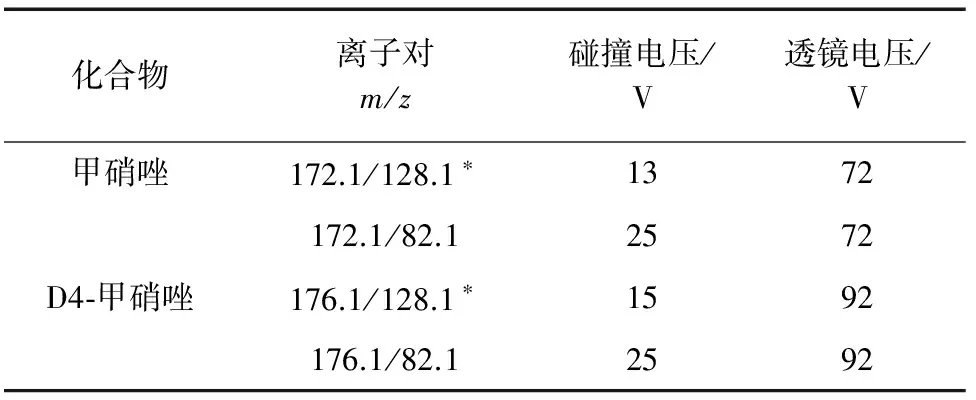
表1 质谱参数Tab. 1 MS parameters
1.3 试验方法
1) 样品提取 称取试样5.00 g于50 mL聚丙烯刻度离心管中,分别加入40 μg·L-1D4-甲硝唑溶液200 μL和0.5 mol·L-1磷酸氢二钾溶液10 mL,涡旋溶解,再加入乙酸乙酯10 mL,涡旋提取2 min,以10 000 r·min-1转速离心3 min。移取上层乙酸乙酯5 mL于10 mL试管中,水浴50 ℃氮吹干,加入甲醇-40 mmol·L-1盐酸(5+95)溶液2.0 mL,超声溶解1 min,溶解液待净化。
2) 样品净化 依次用甲醇5 mL、40 mmol·L-1盐酸溶液5 mL活化MCS固相萃取柱,将上述溶解液转移至MCS固相萃取柱内。待溶解液过柱后,依次用水5 mL、甲醇5 mL淋洗杂质,真空抽干后用氨化甲醇(5+95)溶液5 mL洗脱。收集洗脱液于50 ℃下氮吹至干,加入0.1%甲酸-乙腈(90+10)溶液1.0 mL溶解残留物,涡旋混匀10 s,过0.22 μm滤膜,按仪器工作条件进行测定。
2 结果与讨论
2.1 色谱行为
甲硝唑标准溶液和样品的MRM图见图1。
2.2 仪器工作条件的选择
甲硝唑呈弱碱性,使用ESI+模式进行测定。试验对目标化合物进行全扫描,找出准分子离子峰,通过改变试验条件(毛细管温度、蒸发温度等),使母离子以最大效率通过一级质谱进入二级质谱,并且以此准分子离子峰为母离子进行轰击,进行二级质谱扫描,找出两个信号较强的碎片离子构成监测离子对。选择不同的碰撞电压和滞留时间优化特征离子,选择的碰撞电压和离子对见表1。
在流动相中加低含量的甲酸可得到更加丰富的离子碎片信息,改善甲硝唑峰形,提高测定的灵敏度。试验选择0.1%甲酸溶液和乙腈作为流动相,进行二元梯度洗脱。

(a) 甲硝唑标准溶液 (b) 样品 图1 甲硝唑标准溶液和样品的MRM图Fig. 1 MRM chromatograms of metronidazole standard solution and the sample
2.3 样品提取条件的选择
考察了二氯甲烷、乙酸乙酯和乙腈为提取剂时对测定的影响。结果表明:二氯甲烷毒性大,不利于试验人员的健康;文献[1]中报道乙酸乙酯和乙腈对甲硝唑的提取效率相当,乙腈作为提取剂时,需加入氯化钠促使分层,且沸点较高,浓缩耗时较长。试验选择乙酸乙酯作为提取剂。
蜂蜜基质的物理性状差别较大,直接使用有机溶剂提取时很难完全混匀,所以需用水或0.5 mol·L-1磷酸氢二钾溶液(pH约为8.8)稀释溶解蜂蜜后再用有机溶剂提取。甲硝唑是弱碱性化合物,酸性条件下呈质子化状态,不易进入有机相,在弱碱性条件下呈游离分子状态。试验考察了用水和0.5 mol·L-1磷酸氢二钾溶液稀释溶解蜂蜜对甲硝唑回收率的影响。结果表明:使用水、0.5 mol·L-1磷酸氢二钾溶液稀释溶解蜂蜜时甲硝唑的回收率依次为93.0%,82.0%。试验选择0.5 mol·L-1磷酸氢二钾溶液稀释溶解蜂蜜后用乙酸乙酯提取蜂蜜中甲硝唑。
2.4 基质效应的影响
基质和干扰组分的存在影响待测物的离子化效率,从而影响定量结果的准确性,常表现为基质增强或基质抑制效应。试验分别采用空白蜂蜜按照试验方法提取与净化后的定容液和初始流动相作为标准溶液的稀释溶剂,通过测定标准溶液的峰面积的比值考察基质效应的强弱。结果表明:两者的峰面积比值为0.757,这表明蜂蜜基质对甲硝唑的测定具有一定的抑制效应,可采用内标法或基质匹配的标准曲线定量,从而有效地降低样品的基质效应。试验选择同位素内标法定量。
2.5 标准曲线与测定下限
用0.1%甲酸-乙腈(90+10)溶液将1.000 g·L-1甲硝唑标准储备溶液稀释成0.5,1.0,2.0,4.0,8.0,16.0,32.0,64.0 μg·L-1标准溶液系列,其中D4-甲硝唑内标的质量浓度为4.0 μg·L-1。在仪器工作条件下对上述标准溶液系列进行测定,以甲硝唑的质量浓度为横坐标,对应的甲硝唑峰面积与内标峰面积的比值为纵坐标绘制标准曲线。结果表明:甲硝唑的线性范围为0.5~64.0 μg·L-1,线性回归方程为y=0.431x-0.005,相关系数为0.999 8。
以10倍信噪比计算方法的测定下限(10S/N)为0.15 μg·kg-1。
2.6 方法的精密度和回收试验
在空白蜂蜜样品中进行加标回收试验,平行测定6次,其结果见表2。
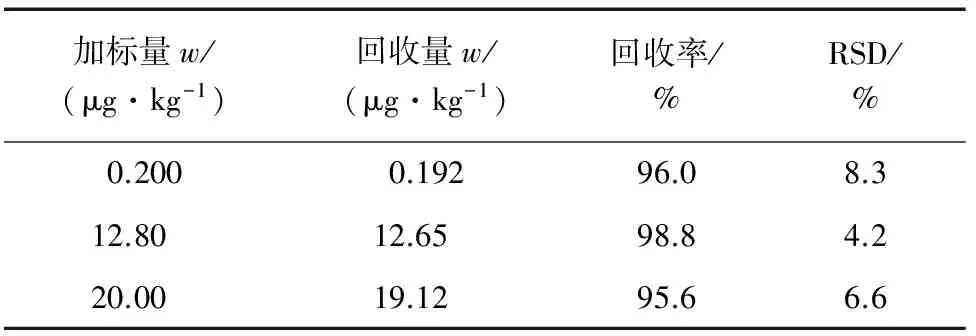
表2 精密度和回收试验结果(n=6)Tab. 2 Results of tests for precision and recovery(n=6)
由表2可知:加标回收率为95.6%~98.8%,相对标准偏差(RSD)为4.2%~8.3%。
2.7 样品分析
按试验方法对在某超市随机购买的30批次蜂蜜样品进行测定。结果表明:26批次蜂蜜样品中未检出甲硝唑,4批次蜂蜜样品中检出甲硝唑,检出率为13.3%,甲硝唑的质量分数为0.4~6.5 μg·kg-1。这说明蜂农在养蜂过程中滥用甲硝唑药物预防和控制蜜蜂疾病等现象仍有发生。
本工作采用超高效液相色谱-串联质谱法测定蜂蜜中甲硝唑,有效地减少了基质对甲硝唑测定的干扰,该方法专属性强、测定下限低、快速、灵敏、准确。
[1] 张鸿伟,简慧敏,林黎明,等.液相色谱-四极杆/离子阱质谱快速测定蜂蜜中痕量硝基咪唑类药物及其代谢物残留[J].分析测试学报, 2012,31(7):763-770.
[2] 张璐,孔祥虹,王菡,等.在线净化-超高效液相色谱同位素稀释串联质谱法检测蜂蜜中硝基咪唑类及其代谢物的残留[J].分析化学, 2014,42(12):1735-1742.
[3] 殷居易,谢东华,刘永明,等.蜂产品中9种硝基咪唑类药物原药及代谢物残留量的HPLC-APCI(+)MS/MS分析[J].分析测试学报, 2009,28(8):935-939.
[4] 高小龙,王大菊,汪纪仓,等.蜂产品中硝基咪唑类药物残留高效液相色谱法研究[J].湖北大学学报(自然科学版), 2008,30(1):71-75.
[5] 丁涛,徐锦忠,刘飞,等.高效液相色谱-串联质谱联用测定蜂王浆中的三种硝基咪唑类残留[J].色谱, 2006,24(4):331-334.
[6] 郭少飞,王鹏,荆涛,等.高效液相色谱-串联质谱法同时测定蜂蜜中甲硝唑、二甲硝咪唑和洛硝哒唑残留[J].华中科技大学学报(医学版), 2008,37(6):830-833.
[7] 左志辉,高立勤,唐素芳.固相萃取-液相色谱串联质谱法同时定量检测蜂蜜中28种抗生素类药物残留的研究[J].药物分析杂志, 2009,29(7):1196-1201.
[8] 倪晓丹,卢平,何旭伦,等.食品中甲硝唑残留的碳纳米管固相萃取-高效液相色谱法测定[J].分析测试学报, 2010,29(8):807-811.
[9] 刘永明,曹彦忠,李金,等.液相色谱-串联质谱法快速测定蜂蜜中3种硝基咪唑类药物残留[J].色谱, 2010,28(6):596-600.
[10] 刘波,黄为红,王金中.气相色谱-电子捕获检测器同时测定硝基咪唑类药物[J].分析科学学报, 2008,24(5):586-588.
[11] 何东,李秀英,冼燕萍,等.气相色谱-质谱法测定祛痘化妆品中4种硝基咪唑类化合物[J].分析测试学报, 2015,34(8):911-916.
