气相色谱-质谱法测定蔬菜和水果中螺虫乙酯的残留量
2018-01-19,,,,
, , , ,
(1. 黄岛出入境检验检疫局, 青岛 266555; 2. 山东省农业科学院 植物保护研究所, 济南 250100)
螺虫乙酯是新季酮酸衍生物类杀虫剂,杀虫谱广,持效期长。它的作用机理主要是通过干扰昆虫的脂肪生物合成而促使幼虫死亡,降低成虫的繁殖能力。螺虫乙酯是迄今唯一具有在木质部和韧皮部双向内吸传导性能的现代杀虫剂。该化合物可以在整个植物体内向上、向下移动,抵达叶面和树皮,从而防治生菜和白菜等蔬菜内叶上隐藏的害虫及果蔬皮上的害虫。这种独特的内吸性可以保护新生芽、叶和根部,防止害虫的卵和幼虫生长。双向内吸传导性能意味着害虫没有安全可以隐藏的地方,防治作用更加彻底[1]。因此,该农药具有很好的应用前景,已在69个国家和地区提交登记,可用于棉花、大豆、柑橘、热带果树、坚果、葡萄、啤酒花和土豆等多种作物上,防治各种刺吸式口器害虫,如蚜虫、蓟马、木虱、粉虱、粉蚧和介壳虫等[1-2]。
随着螺虫乙酯的登记、推广和使用,作为我国蔬菜、水果主要出口市场的美国、欧盟、韩国、日本、加拿大等国家对其制定了最大允许残留限量标准(MRL),食品法典也对螺虫乙酯的MRL进行了规定,规定的MRL为0.02~9.0 mg·kg-1[3-4]。现在,国内外对蔬菜和水果中螺虫乙酯残留量的检测方法研究较多[5-11],主要采用乙腈提取,QuEChERS基质固相分散萃取净化或固相萃取(SPE)净化,液相色谱-串联质谱法(LC-MS/MS)或液相色谱法(LC)进行检测。使用LC-MS/MS检测农药残留具有快速、简便、灵敏度高等优点,但也存在配置少,与其他检测项目共用一台仪器需不断平衡液相系统的缺陷;单独使用LC进行检测时,存在不能准确定性的缺点。气相色谱-质谱仪是各检测机构配备最多的对农药残留进行检测的仪器。气相色谱-质谱仪(电子轰击离子源)为通用性检测仪器,可实现几百种农药的多残留分析,并同时定性和定量,目前国内没有任何有关气相色谱-质谱法(电子轰击离子源)检测果蔬中螺虫乙酯残留量的报道。
本工作参照QuEChERS前处理技术的分散固相萃取技术,采用混合吸附剂净化,建立了气相色谱-质谱法(GC-MS)测定蔬菜和水果中螺虫乙酯残留量的分析方法,为更好应对国外技术壁垒提供了有力的技术支持。
1 试验部分
1.1 仪器与试剂
Agilent 7890B-5977A型气相色谱-质谱仪(配电子轰击离子源);3K 15型离心机;ULTRA-TURRAX T-18 basic型均质器;NV24A-II型氮吹加热浓缩仪;MilliQ型超纯水器;Vortex 3000型旋涡混合器。
QuEChERS分散固相萃取管1[15 mL离心管中装150 mg乙二胺-N-丙基硅烷(PSA)、900 mg无水硫酸镁];QuEChERS分散固相萃取管2[15 mL离心管中装150 mg十八烷基硅烷(C18)、900 mg无水硫酸镁];QuEChERS分散固相萃取管3[15 mL离心管中装150 mg PSA、45 mg石墨炭黑(Carb)粉末、855 mg无水硫酸镁];QuEChERS分散固相萃取管4(15 mL离心管中装150 mg PSA、150 mg C18和900 mg无水硫酸镁)。
螺虫乙酯标准储备溶液:1.000 g·L-1,称取螺虫乙酯标准物质(相对分子质量为373.46,纯度不小于98.0%)适量,用乙腈配制而成。
乙腈为色谱纯;氯化钠、无水硫酸镁(用前均在450 ℃烘5 h,200 ℃时取出冷却备用)为分析纯。
1.2 仪器工作条件
1) 色谱条件 HP-5MS毛细管色谱柱(30 m×0.25 mm,0.25 μm);进样口温度为250 ℃;不分流进样,进样量为1 μL;载气为氦气(纯度不小于99.999%),恒流模式,流量1.0 mL·min-1。程序升温:初始温度为60 ℃,保持2 min;以20 ℃·min-1速率升温至200 ℃;然后以2 ℃·min-1速率升温至220 ℃;再以20 ℃·min-1速率升温至280 ℃,保持10 min。
2) 质谱条件 电子轰击离子源(EI),电子能量为70 eV;离子源温度为230 ℃,四极杆温度为150 ℃,色谱-质谱接口温度为280 ℃;选择离子监测(SIM)模式,定性离子m/z286.2,270.2,314.2,定量离子m/z373.2。
1.3 试验方法
取蔬菜或水果样品可食用部分,粉碎并混匀,称取试样10.00 g置于50 mL离心管中,加入乙腈20 mL,均质提取1 min,加入无水硫酸镁4 g、氯化钠1 g,立即涡旋混匀后,以7 000 r·min-1转速离心5 min。移取上层有机相6.0 mL转移至装有300 mg C18、150 mg PSA和900 mg无水硫酸镁粉末的离心管中,加入后立即涡旋混匀2 min,以7 000 r·min-1转速离心5 min,取上清液4 mL于氮吹管中,于40 ℃氮气吹干,加入丙酮-正己烷(1+1)混合溶剂900 μL溶解残渣,涡旋混匀后,按仪器工作条件进行测定。
2 结果与讨论
2.1 色谱行为
按仪器工作条件对黄瓜、苹果和洋葱的混合空白样品和加标后的上述混合空白样品(加标量20 μg·kg-1)进行分析,SIM色谱图见图1。
由图1可知,样品基质不干扰螺虫乙酯的测定。
2.2 提取剂的选择
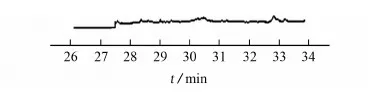
(a) 混合空白样品

(b) 加标后的混合空白样品图1 混合空白样品中加标前后的SIM色谱图Fig. 1 SIM chromatograms of mixed blank samples without and with standard solution
QuEChERS方法现已被国内外研究者和检测工作者广泛应用于蔬菜和水果中多种农药残留的检测,为解决碱性农药(如吡蚜酮)在酸性基质(如柑橘)中不稳定,碱敏感农药(抑菌灵、百菌清)在非酸性基质(如生菜)中降解的问题,很多学者采用加入乙酸和乙酸钠或柠檬酸盐形成缓冲体系来改善大部分农药的回收率。在试验中加入乙酸等酸性溶液对样品中残留农药进行提取,经PSA净化后,去杂效果稍差,这可能是因为酸性溶液对PSA的净化效果产生影响。螺虫乙酯属于常规农药,对酸和碱都不敏感,为使PSA达到最佳的净化效果,试验选择乙腈作为提取剂。
2.3 基质分散固相萃取剂及其用量的选择
常用的基质分散净化剂有PSA、C18和Carb。PSA常用来去除各种有机酸、部分色素以及蛋白质、糖类;C18是一种非极性吸附剂,可以吸附相对分子质量较高的非极性干扰物质,对样品中的蛋白、脂质物质、部分维生素、色素和甾醇等杂质有一定的吸附作用;Carb主要是用来去除类甾体、叶绿素等色素[9]。各种净化剂在去除杂质的同时也可能对目标化合物产生吸附。
为最大程度地保证试验材料的均匀性,选择使用已经过质量控制的市售QuEChERS分散固相萃取管进行试验,共试验了4种QuEChERS分散固相萃取管。填装的基质分散固相萃取剂分别为:① 150 mg PSA;② 150 mg C18;③150 mg PSA 、45 mg Carb;④ 150 mg PSA、150 mg C18。
将黄瓜、苹果和洋葱的混合空白样品提取液配制的20 μg·L-1螺虫乙酯标准溶液6 mL分别经装有上述4种基质分散固相萃取剂的市售QuEChERS分散固相萃取管进行涡旋净化。净化浓缩后测定的回收率分别为106%,104%,97.5%,99.4%,可见,PSA、C18和Carb对螺虫乙酯均不产生吸附。
上述混合空白样品提取液经4种基质分散固相萃取剂净化后的总离子流图见图2。
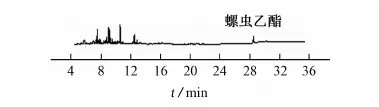
(a) PSA
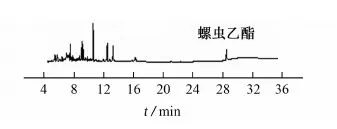
(b) C18
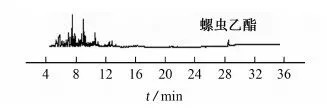
(c) PSA和Carb
(d) PSA和C18图2 混合空白样品提取液经4种基质分散固相萃取剂净化后的总离子流图Fig. 2 TIC chromatograms of mixed blank sample extract purged by 4 matrix dispersion solid phase extractant
由图2可知:混合使用PSA和C18进行净化时净化效果最好。试验选用PSA和C18作为基质分散固相萃取剂。
采用散装基质分散固相萃取剂单独称量的方法进行基质分散固相萃取净化试验,发现每毫升提取液中PSA添加量超过25 mg时,回收率会出现一定程度的降低;每毫升提取液中C18添加量只要不超过50 mg,C18不会对螺虫乙酯产生吸附。试验选择在每毫升提取液中加入25 mg PSA和50 mg C18进行基质分散固相萃取。
2.4 定性离子和定量离子的选择
使用选择离子监测方式进行扫描,通过选择离子丰度相对较高、相对分子质量较大的离子作为定量或定性离子,同时避让保留时间相近的化合物之间的共有离子,并摒除测试样品基质干扰离子。试验确定了螺虫乙酯的定性离子m/z286.2,270.2,314.2,定量离子m/z373.2。
2.5 基质效应的消除
使用GC-MS(EI)测定农药时一般会存在一定的基质增强效应,试验对使用GC-MS(EI)测定螺虫乙酯时的基质效应进行了考察。使用苹果、葡萄、黄瓜和洋葱空白样品溶液配制50 μg·L-1基质标准溶液,使用纯溶剂配制50 μg·L-1标准溶液。将苹果、葡萄、黄瓜和洋葱基质标准溶液获得的响应值除以纯溶剂标准溶液获得的响应值表示基质效应,基质效应分别为147%,153%,156%,205%。由上述结果可以看出:使用GC-MS(EI)测定螺虫乙酯时存在较强的基质效应,不同样品的基质效应不尽相同,对于洋葱等基质干扰较强的样品,基质效应增强能达到100%以上。另外,试验还发现,气相色谱仪的状态对基质效应的影响也较强,衬管的洁净程度、柱子进样数量等因素均能明显影响标准的响应值。为保证试验结果的准确性和可靠性,试验选择以空白样品提取净化液配制基质标准溶液,使标准溶液和样品溶液具有同样的背景条件,从而消除样品的基质效应。
2.6 标准曲线和检出限
移取1.000 g·L-1螺虫乙酯标准储备溶液适量,用丙酮-正己烷(1+1)混合溶剂配制成10 mg·L-1标准溶液,再用丙酮-正己烷(1+1)混合溶剂将10 mg·L-1标准溶液稀释成0.1,0.2,0.5,1,2,5 mg·L-1的标准溶液。取空白样品按试验方法进行测定,得样品提取净化残渣,在此残渣中加入丙酮-正己烷(1+1)混合溶剂900 μL和上述标准溶液系列100 μL,涡旋混匀,配成10,20,50,100,200,500 μg·L-1基质标准溶液系列。
按仪器工作条件对上述基质标准溶液系列进行测定,以峰面积为纵坐标,与其对应的质量浓度为横坐标绘制标准曲线。结果表明:螺虫乙酯的线性范围为10~500 μg·L-1,线性回归方程为y=42.86x-61.80,相关系数为0.999 7。
以3倍信噪比计算方法的检出限(3S/N)为0.75 μg·kg-1,以10倍信噪比计算方法的测定下限(10S/N)为2.51 μg·kg-1。
2.7 方法的精密度和回收试验
按试验方法对空白苹果、葡萄、黄瓜、洋葱、圆白菜、韭菜样品进行加标回收试验[2.00 mg·kg-1(加标水平)的样品待测液测定前,用定容溶剂将净化定容液稀释至残留量在线性范围之内],平行测定6次,结果见表1。
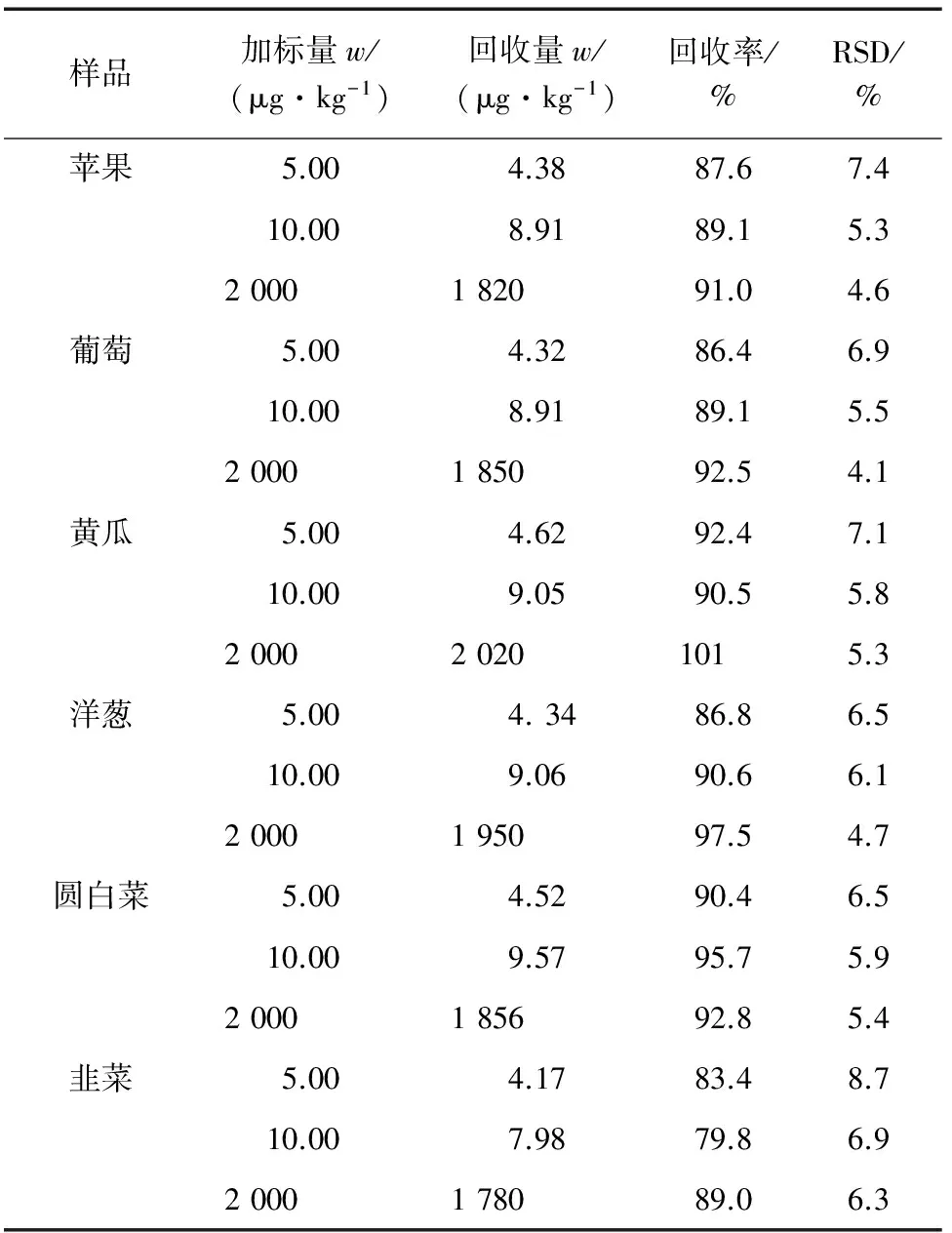
表1 精密度和回收试验结果(n=6)Tab. 1 Results of tests for precision and recovery(n=6)
由表1可知:加标回收率为79.8%~101%,相对标准偏差为4.1%~8.7%。
2.8 样品分析
按试验方法对市售菠菜、甘蓝、草莓、苹果、黄瓜、小葱、圆白菜、韭菜等25批农贸市场销售的蔬菜和水果样品进行测定,均未检出螺虫乙酯。
本工作采用气相色谱-质谱法测定蔬菜和水果中螺虫乙酯的残留量,结果准确可靠,应用于实际蔬菜和水果样品中螺虫乙酯残留量的测定,结果满意。
[1] 刘长令.世界农药大全-杀虫剂卷[M].北京:化学工业出版社, 2012.
[2] 杨吉春,吴峤,孙旭峰,等.杀虫、杀螨剂开发的新进展[J].农药, 2012,51(10):704-705.
[3] 宋稳成,单炜力,简秋,等.国际食品法典农药残留限量标准最新动态及发展趋势[J].农药科学与管理, 2013,34(1):31-39.
[4] 郑庆伟.加拿大拟修订稀禾定、2甲4氯和螺虫乙酯的最大残留限量[J].农药市场信息, 2013(28):42-42.
[5] MOHAPATRA S, DEEPA M, JAGADISH G K. An efficient analytical method for analysis of spirotetramat and its metabolite spirotetramat-enol by HPLC[J]. Bull Environ Contam Toxicol, 2012,88:124-128.
[6] ZHU Y L, LIU X G, XU J, et al. Simultaneous determination of spirotetramat and its four metabolitesin fruits and vegetables using a modified quick, easy, cheap, effective, rugged, and safe method and liquid chromatography/tandem mass spectrometry[J]. Journal of Chromatography A, 2013,1299:71-77.
[7] HAN Y T, XU J, DONG F S, et al. The fate of spirotetramat and its metabolite spirotetramat-enol in apple samples during apple cider processing[J]. Food Control, 2013,34(2):283-290.
[8] 严会会,胡斌,刘惠民,等.高效液相色谱串联质谱法分析烟草中15种农药残留[J].烟草化学, 2011(7):43-47.
[9] 田宏哲,杜芳,苑馨方,等.高效液相色谱法测定蔬菜中螺虫乙酯的残留[J].农药, 2015,54(4):289-291.
[10] 吴育佳,杨仁斌,聂红英.螺虫乙酯在黄瓜及其土壤中残留量检测方法及残留规律研究[J].中国农学通报, 2015,31(35):110-115.
[11] 李菊颖,吴文铸,孔德洋,等.超高效液相色谱-质谱法测定柑橘和土壤中螺虫乙酯及4种代谢产物[J].农药, 2016,55(1):45-47.
