超声辅助深共熔溶剂提取两种烟草多酚的方法研究
2018-01-19尚宪超谭家能杜咏梅刘新民张忠锋
尚宪超,谭家能,杜咏梅,刘新民,张忠锋
(1.中国农业科学院烟草研究所,青岛 266101;2.中国农业科学院研究生院,北京 100081)
绿色化学是指在制造和应用化学产品时应有效利用(最好可再生)原料,消除废物和避免使用有毒和危险的试剂和溶剂[1]。自从绿色化学概念被提出以来,新型绿色溶剂的开发一直占据着至关重要的位置。作为绿色溶剂必须符合以下条件:原料易得、没有毒性、成本低且可生物降解。在过去20年,“绿色溶剂”离子液体因具有蒸汽压低、不可燃、溶解性和导电性优良、电化学稳定窗口宽等独特的物理化学性质,在分离技术、生物催化、有机合成和电化学等领域倍受关注[2]。然而,离子液体存在合成过程复杂、提纯困难、成本较高等缺点,从而限制了其大规模工业化应用和发展。此外,最新有关离子液体毒理研究表明,吡啶和咪唑类离子液体并非完全“绿色”,其毒性与传统有机溶剂相当,咪唑类离子液体毒性甚至大于传统有机溶剂[3-4]。因此,寻找合成简单、经济且更为绿色的替代新型绿色溶剂意义重大。
深共熔现象又称低温共熔,是指将两种或两种以上固体物质加到一起,使其混合物的熔点发生下降的现象。ABBOTT等[5]研究发现,季铵盐可以和酰胺类化合物形成低温共熔体系,并称之为深共熔溶剂(Deep Eutectic Solvents,DES)。这种溶剂无毒性,可生物降解,且合成过程中原子利用率达100%,是一种新型的绿色溶剂。深共熔溶剂是由两到三种成本低、无毒的物质通过氢键作用构成,其具有离子液体的优良物理化学性质,并具备生物可降解性、合成路线简单等离子不具备特点。因此,深共熔溶剂一经发现就迅速进入人们的视线,并在电化学、化学合成、纳米材料制备、提取分离等领域中得到广泛的应用[6]。
烟草作为一种重要经济作物,含有相当丰富的有机化合物。烟叶中目前被鉴定的化学物质约有2549种,多酚是其中一类重要物质[7-9]。目前烟草中发现多酚类化合物包括单宁类(绿原酸及其衍生物、咖啡酸等),香豆素类(莨菪亭),黄酮类(芸香苷等)和简单酚类衍生物等,其中绿原酸、芸香苷是烟草中最主要的酚类化合物。多酚类化合物是烟草中重要指标化合物,一般优质的烟叶含有较多的绿原酸和芸香苷。另外,多酚类化合物还是一类重要生物活性物质,绿原酸、芸香苷具有抗氧化和降低自由基活性的功能,并在食品抗氧化剂,抗心血管病、癌症、人体衰老药物中有着广泛应用[10-11]。
目前,烟草多酚分析方法中使用的仍是传统的有机溶剂法,即有机溶剂浸提、分析检测[12-14]。这种提取技术无法避免使用大量有机溶剂,而使用有机溶剂不符合当前化学领域中提倡的可再生、环境兼容和可持续发展的新理念。因此本研究致力于发展一种绿色溶剂高效、快速检测烟草多酚的方法。首先比较了深共熔溶剂种类及含水量对提取结果的影响。然后通过正交试验方法优化重要的参数(温度、时间和料液比)。最后,还研究了从DES溶剂中回收活性化合物的方法。
1 材料与方法
1.1 仪器与试剂
仪器:Waters UPLC H-CLASS超高压液相色谱仪;万分之一电子天平;IKA磁力搅拌器;KQ-500GVDV型双拼恒温数控超声波发生器。
试剂:氯化胆碱、葡萄糖、乳酸、乙二酸、尿素、苹果酸、丙三醇、甜菜碱、脯氨酸为化学纯,购买于阿拉丁试剂公司;乙二醇、丙二酸、1,4-丁二醇为化学纯,购买于国药集团化学试剂公司;绿原酸、芸香苷为分析纯,购买于上海源叶生物科技有限公司;Waters Oasis HLB固相萃取柱,购买于Waters公司;甲醇为色谱纯,购买于德国MERCK公司。
1.2 材料的预处理
将新鲜烟叶(品种为红花大金元,由云南省大理市试验站提供)于60℃烘干,制成40目粉末,4℃冰箱中贮存,作为绿原酸、芸香苷提取的原料。
1.3 色谱条件
分析条件:流动相A为甲醇,流动相B为0.5%醋酸水溶液。梯度洗脱程序:0~5 min,18%A,82%B;5~6 min,18%~40%A,82%~60%B;6~9 min,40%~90%A,60%~10%B;9~11 min,90%~100%A,10%~0%B;11~14 min,100%~60%A,0%~40%B;14~15 min,60%~18%A,40%~82%B。BEH C18色谱柱(50 mm×2.1 mm,1.7 μm);流速 0.3 mL/min;进样量 3 μL;柱温 35 ℃;检测波长340 nm。
标准曲线:称取绿原酸纯品111.8 mg、芸香苷13.3 mg,用50%甲醇水溶液溶解并定容至100 mL容量瓶中。将上述溶液转移到200 mL容量瓶中,并用甲醇定容。分别吸取上述溶液1.0、2.0、4.0、8.0、12.0、16.0 mL于100 mL容量瓶中,用50%的甲醇溶液定容,配置成系列标准溶液。利用UPLC法,以峰面积对质量浓度做标准曲线。在此质量浓度范围内,绿原酸的线性回归方程为Y=16099X-41253(R2=0.999,n=6),标准曲线的线性范围为5.59~89.44 μg/mL;芸香苷的线性回归方程为Y=13115X+958.9(R2=0.999,n=6),标准曲线的线性范围为0.67~10.64 μg/mL。
绿原酸、芸香苷质量分数的测定方法:绿原酸、芸香苷的测定采用YC/T202—2006烟草及烟草制品多酚类化合物绿原酸、莨菪亭和芸香苷的测定。标准品及样品中目标化合物的色谱分离图如图1所示,化学结构[9,11]如图2所示。

图1 绿原酸(A)及芸香苷(B)标准溶液(1)和烟草样品(2)色谱分离图Fig.1 UPLC chromatograms of the standards(1)and target compounds(2):Chlorogenic acid(A),rutin(B)
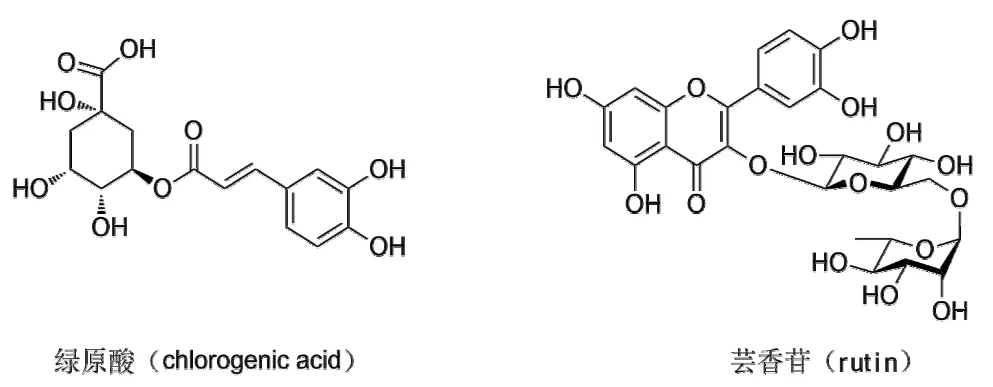
图2 绿原酸及芸香苷化学式Fig.2 The structures of target phenolic compounds
1.4 试验方法
1.4.1 深共熔溶剂制备 深共熔溶剂由氯化胆碱(甜菜碱或脯氨酸)与不同氢键供体(葡萄糖、乳酸、乙二酸、苹果酸、乙二醇、丙二酸、1,4-丁二醇、尿素)加热搅拌生成。分别称取氯化胆碱7.0 g(50 mol)、葡萄糖9.0 g(50 mol)放置于100 mL圆底烧瓶中,80℃下磁力搅拌4~6 h,得到无色透明液体,之后冷却至室温,制得新型低共熔溶剂。然后分别称取不同质量乳酸、乙二酸、苹果酸、乙二醇、丙二酸、1,4-丁二醇、尿素,依照上述制备方法,分别与氯化胆碱合成不同类型深共熔溶剂[15]。
1.4.2 提取方法 准确称取10 mg烟末置于提取器中,加入1 mL深共熔溶剂,混匀,一定条件下超声萃取,然后用50%甲醇将提取液定容至10 mL,滤膜过滤,取1 mL滤液用色谱仪器分析。每个样品均重复检测2次。优化条件包括:深共熔溶剂种类、含水量(0~50%)、料液比(1∶25~1∶200)、温度(30~60℃)及时间(10~50 min)。
1.4.3 DES提取液中多酚的回收 活化好的固相萃取柱(Waters Oasis HLB)装入2 mL的DES提取液并洗脱。首先用去离子水清洗直至DES全部洗脱。然后用甲醇(50 mL)洗脱,收集组分用旋转蒸发仪旋干。样品用10 mL 50%甲醇溶解,用于液相色谱分析。
2 结果
2.1 深共熔溶剂种类对绿原酸、芸香苷提取量的影响
深共熔溶剂的组成对其理化性质(极性、粘度和溶解性)有很大的影响,而这些理化性质直接影响目标化合物的提取效率[16-18]。为了选择一个适合烟草多酚提取的深共熔溶剂,本研究共合成11种深共熔溶剂,其组成及摩尔比如表1所示。11种深共熔溶剂按氢键供体分成4类:氯化胆碱-丙三醇、氯化胆碱-1,4-丁二醇、氯化胆碱-尿素-丙三醇、甜菜碱-丙三醇、脯氨酸-丙三醇,氢键供体为多元醇;氯化胆碱-尿素,氢键供体为酰胺类;氯化胆碱-葡萄糖,氢键供体为糖类;氯化胆碱-乳酸、氯化胆碱-丙二酸、氯化胆碱-乙二酸、氯化胆碱-苹果酸,氢键供体为羧酸类。

表1 深共熔溶剂组成Table 1 Composition of the DESs
超声辅助提取条件下,温度设定40℃、提取时间为30 min,水/深共熔溶剂体积比为4/6(V/V),并以传统有机溶剂甲醇-水为比对。结果如图3所示,氢键供体为羧酸类时(DES-4、DES-6、DES-7),深共熔溶剂对绿原酸提取效率明显优于氢键供体为多元醇、糖类、酰胺类深共熔溶剂。其中,DES-4、DES-6提取效率与甲醇-水相当,最优为氯化胆碱-苹果酸(DES-7)。而芸香苷结果表明,氯化胆碱-葡萄糖(DES-1)、氯化胆碱-丙三醇(DES-3)、氯化胆碱-1,4-丁二醇(DES-4)、氯化胆碱-苹果酸(DES-7),这4种深共熔溶剂提取效率更高。选取氯化胆碱/苹果酸作为提取溶剂,40%(V/V)的水为辅助溶剂,提取温度为40℃,提取时间为30 min条件下,绿原酸、芸香苷提取量分别为(16.12±0.62)、(8.53±0.52) mg/g。
2.2 深共熔溶剂含水量对绿原酸、芸香苷提取量的影响
文献报道,DES溶剂应用于橄榄油中酚类化合物分离过程中,含水量影响显著,合适的水含量可以提高提取效率[19]。在相同的超声辅助提取条件下,温度设定50℃、提取时间为20 min,如图4a,加入一定体积水后,目标化合物的提取率增加1.1~1.4倍。40%(V/V)含水量的深共熔溶剂对绿原酸及芸香苷的提取率最高。
2.3 提取温度、时间、料液比

图3 深共熔溶剂种类对绿原酸及芸香苷提取量的影响Fig.3 The effect of DES on the extraction of two target phenolic acids from tobacco

图4 不同含水量(a)、温度(b)、时间(c)和料液比(d)对两种多酚提取量影响.Fig.4 Concentrations of the two phenolic compounds a at different water content in DES,b at different temperatures c for different
如图4b,在其他条件不变情况下,温度30~50℃范围内,绿原酸及芸香苷提取量随温度升高略微增加,在50℃时达到最大值。随着温度继续升高,2种多酚提取量无明显变化;如图4c,时间5~20 min范围内,绿原酸及芸香苷提取量随时间的延长而升高,到20 min时接近最大值。再随着时间延长,2种多酚提取量无明显变化;如图4d,料液比1∶25~1∶100范围内,绿原酸及芸香苷提取量随料液比的增大而升高,到1∶100时接近最大值。
2.4 正交试验
根据单因素试验的结果,选取影响烟草多酚提取效果的温度(A)、提取时间(B)、料液比(C)作为3个考察因素,选取3个水平,采用L9(33)正交表设计正交试验(表2),对结果进行极差分析,以确定最佳的提取条件。

表2 深共熔溶剂提取烟草多酚正交试验因素水平表Table 2 Factors and levels for L9(33)orthogonal array design
绿原酸正交试验结果见表3。由表3的极差(R)分析结果可以看出,RB>RA>RC,3个因素对烟草绿原酸的提取率影响大小依次为萃取时间(B)>萃取温度(A)>料液比(C)。3因素中,萃取时间与萃取温度的影响较为显著,其中,萃取时间的提取作用最为显著。在实验设计范围内,优化得到深共熔溶剂提取烟草绿原酸的最佳条件为A2B3C2,即萃取温度50℃、萃取时间30 min、料液比1∶100。芸香苷正交试验结果见表4。由表4的极差分析结果可以看出,RB>RC>RA,3个因素对芸香苷的提取率影响大小依次为:萃取时间(B)>料液比(C)>萃取温度(A)。3因素中,萃取时间与料液比的影响较为显著,其中,萃取时间的提取作用最为显著。在实验设计范围内,优化得到深共熔溶剂提取烟草绿原酸的最佳条件为A2B3C2,即萃取温度50℃、萃取时间30 min、料液比1∶100。
2.5 活性化合物回收
固相萃取柱(Waters Oasis HLB)对酚酸有良好的吸附和解吸能力,被用于从DES提取液中回收两种酚类化合物。在洗脱过程中,由于DES溶剂的强极性和水溶性,DES溶剂首先被水洗脱。而进一步用醇类溶剂洗脱可回收酚类化合物。结果显示,绿原酸、芸香苷的回收率分别为91.67%和99.81%,综合提取率为99.86%。证明了酚类化合物可以从DES提取物中有效地回收。水相洗脱液旋蒸除去溶剂后,除部分烟草水溶物(烟草糖类、生物碱、有机酸及无机离子)外,大部分为深共熔溶剂,如何有效回收深共熔溶剂需今后进一步研究。

表3 深共熔溶剂提取绿原酸正交试验设计及结果Table 3 L9(33)orthogonal array design and results for chlorogenic acid
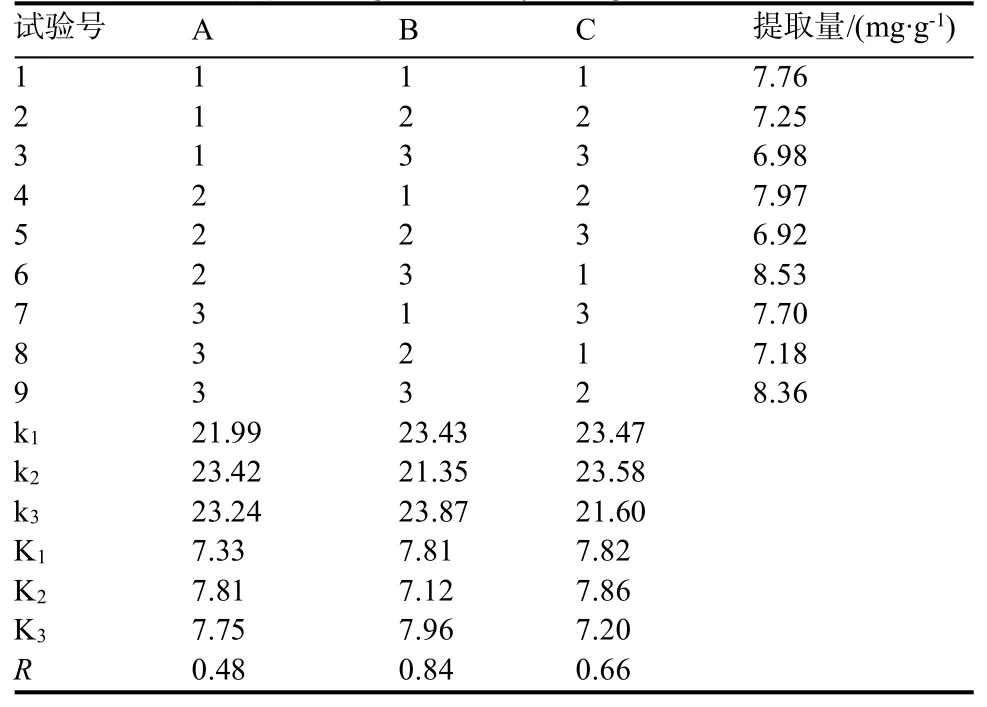
表4 深共熔溶剂提取芸香苷正交试验设计及结果Table 4 L9(33)orthogonal array design and results for rutin
3 讨论
对比不同深共熔溶剂对两种多酚化合物提取量的影响可以看出,氯化胆碱/苹果酸组成的DES对两种多酚化合物的提取效果最优,故本实验选择DES氯化胆碱-苹果酸作为最佳提取溶剂。由于绿原酸和芸香苷与DES氯化胆碱-苹果酸均存在较强的氢键相互作用,两种烟草多酚能够快速分散到DES中,因此采用DES氯化胆碱-苹果酸进行综合提取。艾心灵等[13]用95%乙醇进行综合提取,提取率仅为93.65%,提取率较低,提取温度较高(80℃),提取时间较长(90 min)。而本方法采用氯化胆碱-苹果酸组成的DES对烟草中绿原酸、芸香苷进行综合提取,具有较短的提取时间(30 min)、较低的提取温度(50℃)以及较高的提取率(99.86%)。由于DES绿色无毒,本提取方法有望实现烟草中活性成分的规模化制备。研究中发现,本方法所用DES粘度差异较大,DES粘度影响多酚化合物提取效果的规律,需今后进一步探究。
4 结论
新型绿色溶剂——深共熔溶剂被首次应用于烟草多酚类化合物提取。结果表明,深共熔溶剂是一种理想的有机酸的提取溶剂,能有效提高酚酸类物质的溶解性。经过条件优化后,深共熔溶剂氯化胆碱-苹果酸具有较高的提取效率。最佳条件为:DES中水含量为40%,料液比为1∶100,提取温度50℃,提取时间30 min。该条件下,绿原酸、芸香苷提取量达到最优,分别为(16.95±0.69)、(8.53±0.52) mg/g。
[1]ANASTAS P T,KIRCHHOFF M M.Origins,current status,and future challenges of green chemistry[J].Accounts of Chemical Research,2002,35(9):686-694.
[2]PETKOVIC M,SEDDON K R,REBELOA L P N,et al.Ionic liquids:a pathway to environmental acceptability[J].Chemical Society Reviews,2011,40(3):1383-1403.
[3]VENTURA S P M,MARQUES C S,ROSATELLA A A,et al.Toxicity assessment of various ionic liquid families towards Vibrio fischeri marine bacteria[J].Ecotoxicology&Environmental Safety,2012,76(2):162-168.
[4]赵永升,赵继红,张香平,等.离子液体毒性及降解性研究进展[J].化工新型材料,2012,40(10):9-11.
[5]ABBOTT A P,CAPPER G,DAVIES D L.Novel solvent properties of choline chloride/urea mixtures[J].Chemical Communications,2003,9(1):70-71.
[6]ZHANG Q,DE OLIVEIRA V K,ROYER S,et al.Deep eutectic solvents: syntheses, properties and applications[J].Chemical Society Reviews,2012,41(21):7108-7146.
[7]肖协忠.烟草化学[M].北京:中国农业科技出版社,1997.
[8]尉芹,马希汉.绿原酸及其提取分离方法评述[J].中成药,2001,23(2):135-138.
[9]上海医药工业研究院中药分析室,上海中药制药厂.金银花有效成分的初步研究[J].医药工业,1975(7):24-27.
[10]国家医药管理局中草药情报中心站.植物药有效成分手册[M].北京:人民卫生出版社,1986.
[11]武征,赵维中,汪琳,等.芸香苷对实验性急性胰腺炎肺损伤的保护作用及机制[J].中国药理学通报,2006,22(9):1121-1125.
[12]张海波.废次烟叶中茄尼醇和绿原酸的提取分离研究[D].无锡:江南大学,2005.
[13]艾心灵,王洪新,朱松.烟草中绿原酸、烟碱和茄尼醇的超声波辅助提取[J].烟草科技,2007(4):45-48.
[14]朱松,娄在祥,陈尚卫,等.超声辅助酶法提取废次烟叶中绿原酸、烟碱工艺研究[J].食品工业科技,2012,33(5):181-183.
[15]DAIA Y T,SPRONSENB VAN J,WITKAMPB G J,et al.Natural deep eutectic solvents as new potential media for green Technology[J].Analytica Chimica Acta,2013,766(5):61-68.
[16]OLIVEIRA F S,PEREIRO A B.Deep eutectic solvents as extraction media for azeotropicmixtures[J].Green Chemistry,2013,15(5):1326-1341.
[17]CHOI Y H,SPRONSEN J,DAI Y,et al.Are natural deep eutectic solvents the missing link in understanding cellular metabolism and physiology?[J]Plant Physiology,2001,156(4):1701-1705.
[18]BI W T,TIAN M L,ROW K H.Evaluation of alcohol-based deep eutectic solvent in extraction and determination of flavonoids with response surface methodology optimization[J].Journal of Chromatography A,2013,1285(2):22-30.
[19]REN S H,XIAO Y,WANG Y,et al.Effect of water on the separation of phenol from model oil with choline chloride via forming deep eutectic solvent[J].Fuel Processing Technology,2015,137(9):104-10.
