烟草叶片在二氯喹啉酸胁迫下的蛋白组学分析
2018-01-19张泰劼田兴山
张 纯,冯 莉,张泰劼,田兴山
(广东省农业科学院植物保护研究所,广东省植物保护新技术重点实验室,广州 510640)
烟草(Nicotiana tabacum)是我国重要的经济作物,在湖南、广西、广东等南方烟区,烟草种植主要实行“水稻-烟草”轮作或隔年轮作模式,该模式能充分均衡土壤养分,提高施肥效益,消除土壤有毒物质,减少病虫害,提高烟叶质量。
二氯喹啉酸(3,7-二氯-8-喹啉羧酸,Quinclorac)属生长素类除草剂,在我国水稻种植区广泛使用,是防治稻田稗属杂草(Echinochloa spp.)的特效除草剂,具有药效好、价格低廉、对稗草特效等优点,深受广大农户欢迎,但该药同时也是残留期较长的除草剂,在土壤和水中不易降解[1-2]。在稻-烟轮作区,长期或盲目使用后,土壤中残留的二氯喹啉酸会对烟草产生明显药害,烟草通常畸形生长,表现为新叶叶缘下卷,叶片皱缩,狭窄细长,严重影响烟叶的产量和质量[3-4],给烟农带来严重的经济损失。残留药害具有很大的危害性和隐蔽性,通常观察到药害症状时,作物已经出苗甚至到了种植后期,造成的损失难以挽回[2]。为了减轻二氯喹啉酸残留对后茬作物的影响,有许多研究致力于二氯喹啉酸导致作物尤其是烟草叶片畸形的解毒剂筛选工作。研究表明,一种从农药厂土壤中分离的细菌(Burkholderia cepaciaWZ1)可以有效降解土壤中的二氯喹啉酸[5]。TiO2作用的光催化反应可以有效降解水中的二氯喹啉酸[6]。此外,硝普钠、CaCl2、芸苔素内酯等药剂对二氯喹啉酸致畸的烟叶有一定的解毒效果,淡紫拟青霉菌剂和碳酸钾对低残留二氯喹啉酸引起的烟草畸形有很好的缓解作用,但解毒时间较长,短期效果不明显[7]。
二氯喹啉酸作用机理之一是模拟过量生长素的作用,激活植物体内9-顺式环氧类胡萝素双氧合酶(NCED)基因催化合成ABA,促进活性氧的产生,促进气孔关闭和抑制细胞生长和分裂[8-10],其除草对象主要为单子叶植物,相关作用机理研究主要围绕靶标植物稗草展开[11],而残留药害对烟草生长影响的研究较少。本研究首次利用iTRAQ技术分析二氯喹啉酸导致烟草畸形生长后的烟草叶片蛋白表达变化,筛选出差异基因,并分析了其中具有显著表达差异的蛋白ABA2[参与脱落酸(ABA)合成]和NCED(ABA合成的关键催化酶)的基因受二氯喹啉酸诱导的表达模式,初步探究了烟草抵抗二氯喹啉酸胁迫的作用机制。
1 材料与方法
1.1 试验材料
烟草种子由广东省农业科学院植物保护研究所杂草研究室保存,温室播种,育苗,于3~4片真叶期移栽。用于蛋白组学研究的材料于烟草五叶一心期用0.67 mg/mL浓度的二氯喹啉酸(50%二氯喹啉酸可湿性粉剂)处理7 d后取材。用于荧光定量PCR验证试验的烟草材料于二氯喹啉酸处理后0、6、12、24、48、72 h及7 d取材。
1.2 试验方法
1.2.1 样品总蛋白提取和浓度检测 采用三氯乙酸(Trichloroaceti Acid,TCA)/丙酮法提取烟草叶片蛋白质[12],取烟叶组织液氮研磨,加入TCA/丙酮抽提,–20℃静置30 min,5000×g,4℃离心30 min,弃上清,加入适量–20℃预冷丙酮洗2次,干燥后,加入蛋白抽提液和Tri-饱和酚振荡30 min,5000×g,30 min,4℃离心,弃上清,重复1次。加入5倍体积0.1 mol/L乙酸铵/甲醇,–20℃过夜,次日5000×g,4℃离心30 min,弃上清;加2倍体积的甲醇洗2次,加丙酮洗2次,离心,4℃干燥。尿素裂解液(8 mol/L尿素,2 mol/L硫脲,0.2 mol/L TEAB)溶解蛋白样品粉,用Bradford法[13]进行蛋白质定量。
1.2.2 蛋白样品酶解与标记 准备含量100 μg的蛋白样品溶液稀释到总体积20 μL。加入0.2 mol/L TCEP使蛋白还原,56℃反应1 h。加入375 mmol/L新鲜配制IAA使烷基化,避光反应1 h。样品液中加入5倍体积丙酮,–20℃沉淀过夜。加入0.2 mol/L三乙基碳酸氢铵(Triethylammonium bicarbonate)复溶蛋白样品。按胰蛋白酶和样品1∶50的比例,加入胰蛋白酶,37℃反应过夜,pH试纸测定样品溶液的pH(7~9)。
取出酶解后样品加入55 μL无水乙腈振荡溶解5 min,微离心。取50 μL标记试剂加入到蛋白样品酶切后溶液中,室温反应1 h。加入8 μL 5%羟胺(Hydroxylamine),15 min,终止标记反应。每组标记的样品各取1 μg混合,干燥。经C18柱SPE去除盐离子后,肽段样品用流动相A[200 mM甲酸胺(pH 10)]复溶,离心吸取上清液。在Thermo RSLC 3000上,收集通过waters的Xterra Ms C18柱(3.5µm,2.1 mm×150 mm)的第12~60分钟的样品馏分(液相流速为0.2 mL/min),准备96孔板,一次标记,用于收集分离得到的组份1~48。将48个组份合并成12部分。样品溶液干燥。
1.2.3 基于orbitrap fusion的LC-ESI-MSMS分析用含2%CAN、0.5%甲酸的水溶液,溶解蛋白肽段干粉,离心取上清液。对每个组份进行独立的质谱检测,基本条件如下:高效液相色谱仪,Thermo Scientific RSLC Nano 3000;富集柱,Thermo PepMap u-precolumn(5µm,300µm×5 mm);分析柱,PepMap C18 反相纳升柱(3 μm,75 μm×150 mm,Dionex);主要有机相梯度135 min 4%~90%ACN in 0.1%FA;流速300 nL/min;上样量1µg;质谱仪Thermo Orbitrap Fusion;喷雾电压1.9 kV;离子传输管温度275℃;扫描模式正离子;碰撞能量40%HCD;分辨率设置,一级(m/z 200),二级(m/z 200);母离子扫描范围 m/z 350~1550;子离子扫描范围,自动。
1.2.4 蛋白质的鉴定和定量 所获得的肽段数据经转换软件Proteome Discoverer1.4转换成mgf格式后,通过Mascot 2.5.1程序进行蛋白质检索。选择UniProt中的茄科数据库进行肽段匹配和蛋白质定性鉴定分析,搜库参数设定为(1)酶解:Trypsin;(2)最大漏切位点数:1;(3)固定修饰:Carbamidomethyl(C), TMT6plex(N-term),TMT6plex(K);(4)建好的数据库命名为Uniprot_Solanaceae。试验组样本和对照组样本相比,差异倍数大于1.5倍的蛋白,结果经双尾t检验,p<0.05的蛋白视为显著差异表达蛋白。
1.2.5 差异蛋白的验证 五叶一心期烟草经二氯喹啉酸处理后6、12、24、48、72 h和7 d取材,取幼嫩叶片利用Trizol-reagent提取总RNA,每1.5 μg RNA样品用2个单位的DNase I处理以除去基因组DNA,再利用Reverse Transcriptase MMLV(TaKaRa BIO Inc.,Otsu,Japan)试剂盒将RNA反转录成cDNA。利用Real-time PCR技术在基因水平上检测差异蛋白对二氯喹啉酸的响应。SYBR Premix Dimer Eraser TM试剂盒(TaKaRa BIO Inc.,Otsu,Japan)进行Real-time PCR反应,PCR反应体系:10 μL Premix Dimer Eraser TM(2x),上下游引物各0.4 μL(10 μmol/L),模板 2 μL,总体积 20 μL。利用BioRAD荧光定量PCR仪器进行PCR扩增,反应条件:95℃ 10 s;95℃ 5 s,60℃ 34 s,40个循环。基因相对表达量利用2-ΔCt方法计算。基因扩增引物如表1所示。
2 结果
2.1 iTRAQ试剂标记烟草叶片组织的蛋白质表达
二氯喹啉酸对烟草叶片尤其是嫩叶片的生长有明显的抑制作用,二氯喹啉酸处理后新长出来的叶片均表现为畸形(图1),烟草叶片长度和宽度与正常烟草叶片相比存在显著差异(表2)。利用iTRAQ和生物信息学技术,分析二氯喹啉酸和清水处理后的烟草叶片蛋白表达情况,结果显示,从二氯喹啉酸处理后的烟草畸形叶片中共鉴定到3255个蛋白,正常烟草叶片鉴定到3308个蛋白。通过比较二氯喹啉酸处理后的畸形烟叶和正常烟叶中蛋白相对表达丰度,共鉴定出65个差异蛋白,上调蛋白23个,其中10个蛋白功能未知,下调蛋白42个,其中7个蛋白功能未知,差异蛋白分子量介于5~102 kDa之间(表3)。与正常烟叶相比,畸形烟叶中参与光合作用、碳固定、氮代谢等代谢途径的蛋白酶下调表达,而与免疫反应相关的谷胱甘肽代谢途径蛋白表达量增加(表3)。
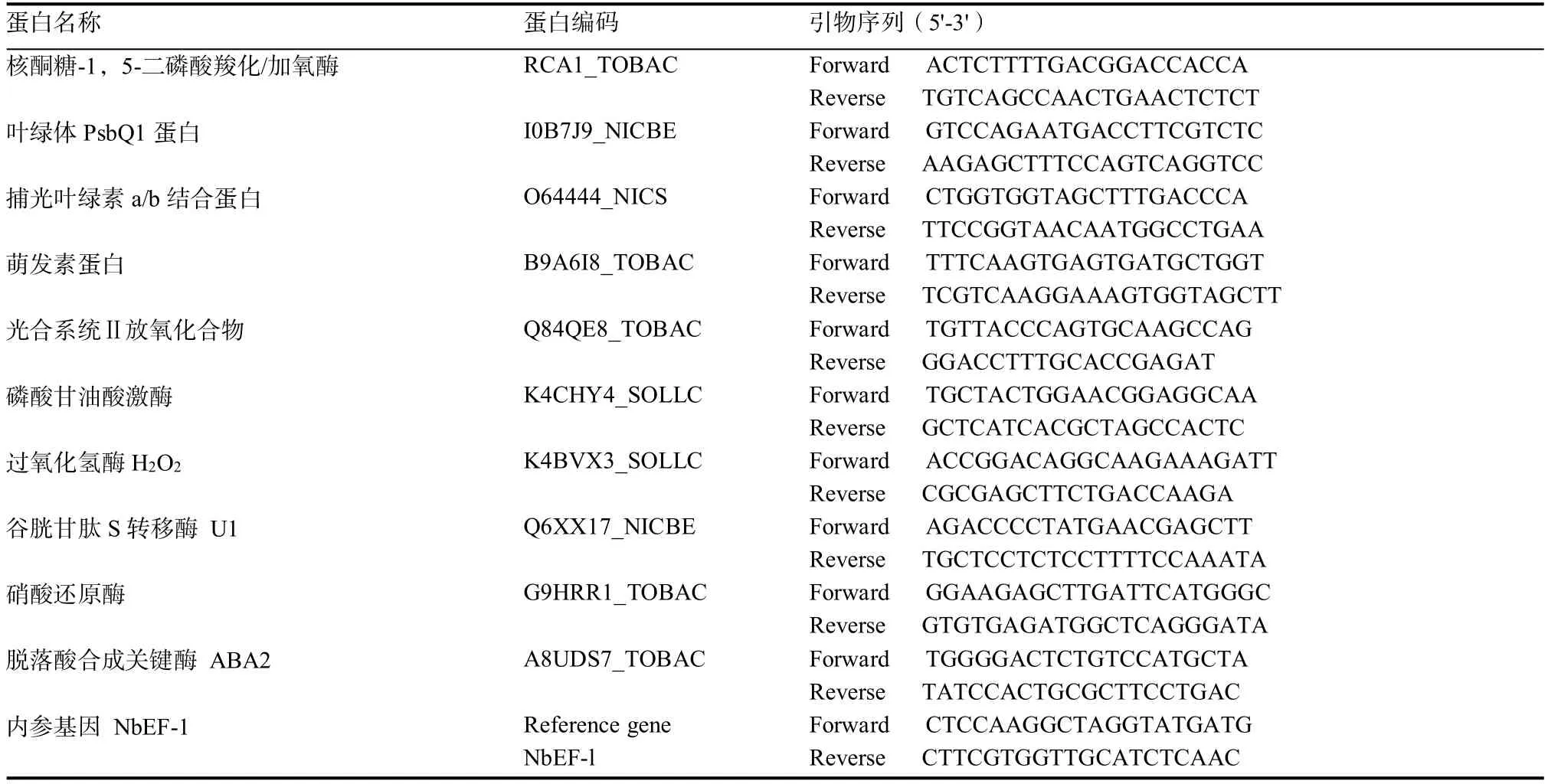
表1 试验所用到的引物Table 1 Primers used in the study

图1 烟草表型特征(N:清水处理后的正常烟草叶片;M:二氯喹啉酸处理后20 d烟草叶片特征)Fig.1 Phenotypes of tabacco leaves 20 d after treatment with H2O and quinclorac.(N and M indicate Normal and Malformed leaves which resulted by H2O and quinclorac residues respectively.)
对差异蛋白进行GO聚类分析显示,在生物过程方面,差异蛋白主要参与光合作用、细胞代谢及免疫反应过程等。细胞组分聚类分析显示,差异蛋白主要为细胞膜蛋白、大分子复合物以及细胞器蛋白,行使结合、催化和转运等分子功能(图2)。此外,差异蛋白共参与27种KEGG代谢途径,其中有9条KEGG代谢途径是显著的,包括代谢途径(26%)、碳代谢(15%)、光合作用中的碳固定(13%),二羧酸代谢(12%)、氮代谢(5.75%)和谷胱甘肽代谢途径等(图3)。
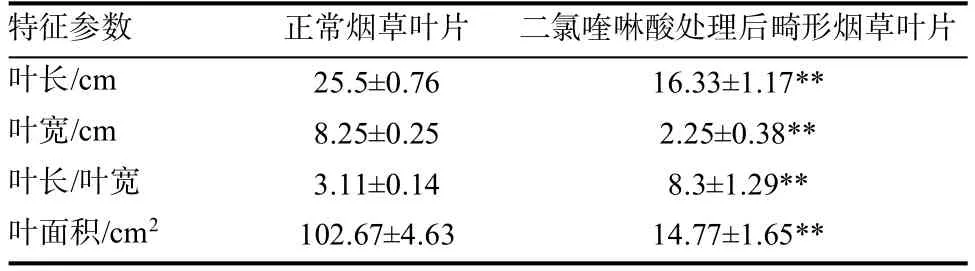
表2 二氯喹啉酸处理后烟草叶片形态参数变化Table 2 The change of leaf morphological parameters of cefazolin acid treatment after quinclorac.
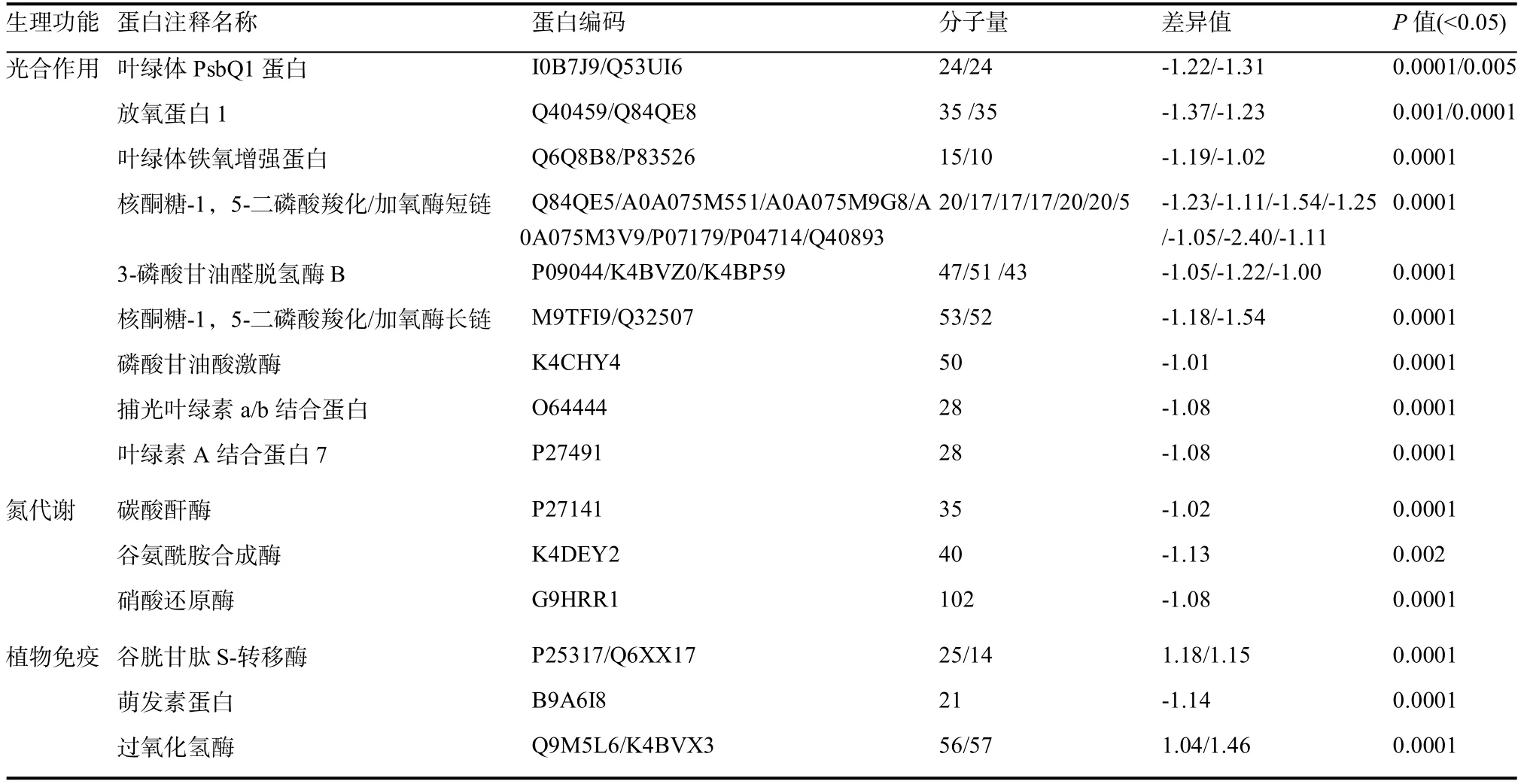
表3 二氯喹啉酸处理后烟草叶片差异表达蛋白Table 3 The main differentially accumulated protein species between normal and malformed tobacco leaves.

图2 畸形烟草叶片较正常烟草叶片差异表达蛋白聚类分析(Biological process,生物过程;Molecular function,分子功能;Cell component,细胞组分)Fig.2 Gene Ontology(GO)analysis of the differential expression protein in normal and malformed tobacco leaves.GO analysis was performed at level 2 for the three main categories.

图3 KEGG通路分析Fig.3 Analysis of KEGG Pathways
2.2 二氯喹啉酸诱导差异蛋白基因的表达
为了验证蛋白数据的可靠性,挑选了11个差异蛋白基因,采用荧光定量PCR方法分析其在二氯喹啉酸处理7 d后的烟草叶片中表达变化,包括2个上调基因(谷胱甘肽s-转移酶和过氧化氢酶)和9个下调基因(核酮糖-1,5-二磷酸羧化加氧酶(Rubisco)、叶绿体PsbQ1蛋白、甘油醛-3-磷酸脱氢酶B、叶绿素a/b结合蛋白、萌发素蛋白、磷酸甘油酸激酶、硝酸还原酶、ABA2)。结果显示,所有挑选的基因表达变化趋势与蛋白组学结果一致,表达上调的2个基因上调倍数为17.5和1.8,表达下调的基因表达差异倍数在0.02~0.76之间,符合大于1.2(上调)或者小于0.8(下调)蛋白差异筛选标准(表4)。
二氯喹啉酸作为生长素类除草剂,其作用机理之一是模拟过量生长素的作用,激活植物体内9-顺式环氧类胡萝素双氧合酶(NCED)基因催化ABA的合成,ABA促进衰老,促进活性氧的产生,促进气孔关闭和抑制细胞生长和分裂[8-10]。本研究的蛋白组学实验结果显示,二氯喹啉酸处理后的畸形烟草叶片中脱落酸ABA合成途径中ABA2蛋白比正常叶片中含量低,因此进一步检测了ABA2基因及ABA合成关键酶基因NCED在二氯喹啉酸处理后0~72 h的表达情况,结果显示在二氯喹啉酸处理后12 h,NCED的表达量开始上调表达,到24 h达到表达高峰,而ABA2则在处理后24 h上调,48 h才达到表达高峰。处理后72 h,NCED和ABA2的表达量都降到较低水平(图4)。
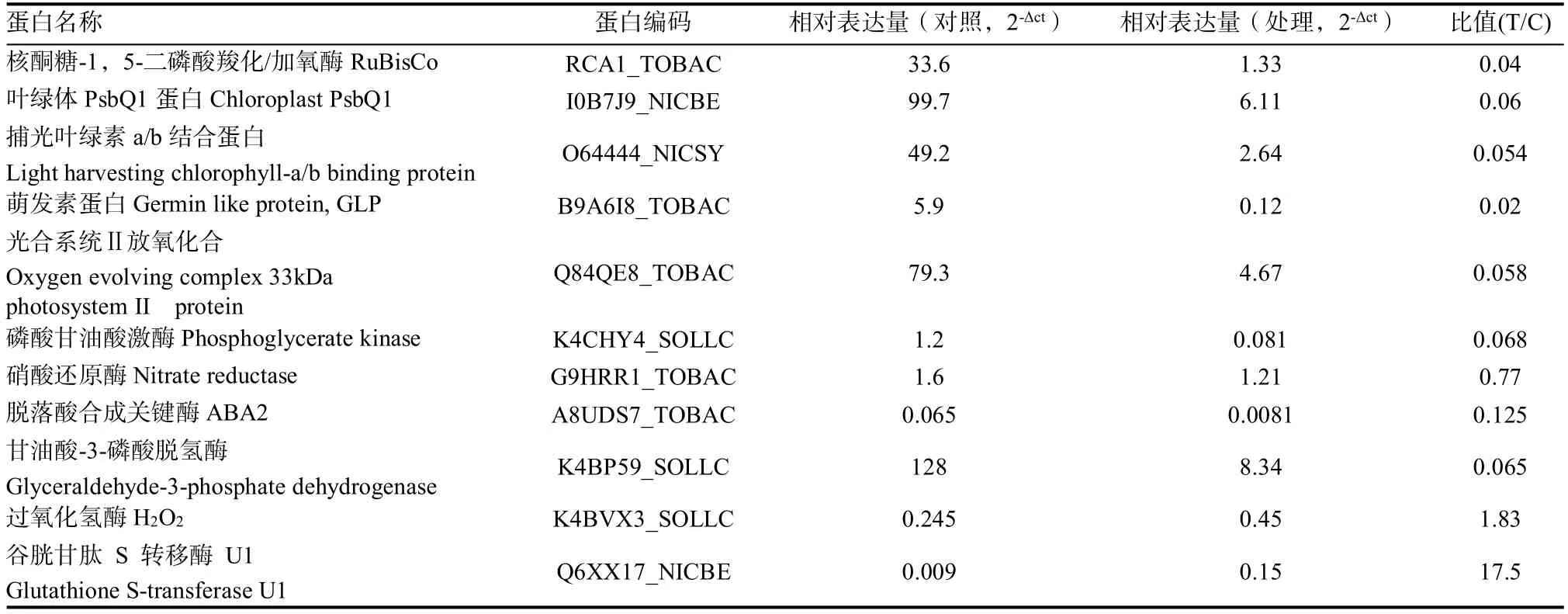
表4 荧光定量PCR(qRT-PCR)分析验证部分差异蛋白表达Table 4 qRT-PCR analysis of some of the gene expression which encode the differentially accumulated proteins
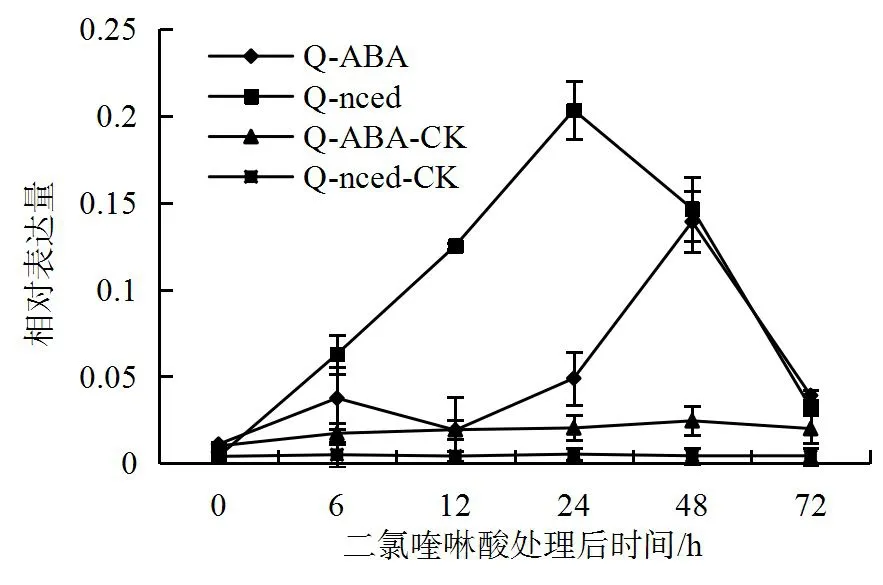
图4 二氯喹啉酸诱导烟草NCED和ABA2基因表达Fig.4 Expressions of mRNA of NCED and ABA2 gene in tobacco leaf treated with quinclorac
3 讨论
二氯喹啉酸的除草对象主要为单子叶植物稗草,相关作用机理已有较多研究[11],而残留药害对作物生长的影响研究较少。在我国稻-烟轮作区,二氯喹啉酸残留药害问题严重,市场上尚缺乏有效针对二氯喹啉酸药害的解毒剂或抗逆烟草品种。本研究运用iTRAQ蛋白组学技术比较了二氯喹啉酸处理后的烟草叶片与正常烟草叶片之间的蛋白质差异,筛选出65个差异蛋白,主要参与光合作用、防御免疫等生物学过程,在细胞质、细胞器和细胞膜上,主要行使结合、催化等分子功能。本文就光合作用、免疫反应系统、ABA合成通路中差异倍数较大的蛋白进行分析。
3.1 光合作用相关差异蛋白表达分析
生长素类除草剂能显著影响光合作用中的各种生理反应,如气孔的关闭、碳固定的减弱等[8]。有研究表明,二氯喹啉酸显著影响稗草光合系统各相关蛋白表达,破坏植株光合作用[11]。本研究发现,二氯喹啉酸药害导致烟草叶片畸形,从畸形叶片中鉴定出的65种差异蛋白中有24种参与了光合作用,其中核酮糖-1,5-二磷酸羧化加氧酶(RuBisco)、叶绿体PsbQ1蛋白、捕光叶绿素a/b蛋白和33 kDa光系统Ⅱ中放氧复合物表达差异显著。Rubisco蛋白约占植物可溶蛋白的50%,是光合作用中的关键酶,调节光合和光呼吸,鲜有其他分子功能报道[14]。PsbQ1蛋白是组成光系统II的重要外周蛋白之一,对维持光系统II的放氧活力起重要作用。最近的研究表明PsbQ蛋白在维持PSⅡ的结构完整性、增强PSⅡ对环境适应性方面发挥重要作用[15],并参与一些抗逆胁迫应答反应[16]。捕光叶绿素a/b结合蛋白主要行使光能的吸收和传递功能[17],对植物适应各种环境胁迫的过程中起着重要作用。33 kDa光系统Ⅱ中放氧复合物对PSII的放氧活力维持起重要的作用,同时保护锰簇不被还原剂等化学物质进攻[18]。甘油醛-3-磷酸脱氢酶(GAPDH)是细胞内的一个组成型表达的蛋白质,是碳固定代谢途径中的关键酶,其β亚基是维持盐胁迫下光合作用和植物生长发育过程的重要因子[19]。综合来看,这些差异蛋白虽是光合作用系统中关键酶,同时还具有响应外界胁迫等功能,因此,在二氯喹啉酸残留药害影响下,光合作用系统中这些蛋白的表达变化显著。
3.2 免疫反应相关差异蛋白表达分析
烟草对环境胁迫较为敏感,为了适应各种环境因子的变化,在外界环境因子改变时,烟草会在形态上和生理生化代谢方面进行一系列调整,而蛋白质直接参与并调控植物对环境胁迫的适应性反应。蛋白组学分析结果显示二氯喹啉酸处理烟草后,鉴定出植物萌发素、过氧化氢酶和谷胱甘肽S-转移酶等响应外界胁迫的蛋白。植物类萌发素蛋白(GLPs)是其中一类重要的胁迫响应蛋白,具有多种生物学功能,在植物的生长发育阶段、生物和非生物逆境胁迫应答中起重要的作用[20-21],在本研究中,二氯喹啉酸处理后,GLPs表达量下降,推测该酶可能并不参与烟草对二氯喹啉酸的胁迫响应。谷胱甘肽S-转移酶(GSTs)是一类催化还原型谷胱甘肽(GSH)与各种亲电化合物的亲核加成反应酶,在生物和非生物胁迫中具有重要作用,许多参与植物抗逆/抗病响应的GST被分离鉴定,包括水稻的 OsGST2显著响应稻瘟病菌(Magnaporthe grisea)的诱导[22],小麦对白粉病(Erysiphe graminis)的抗性[23],番茄对盐胁迫的响应等[24],本研究发现两个烟草GSTs蛋白表达显著上调,推测这两个GSTs蛋白在烟草抵抗二氯喹啉酸的胁迫中起重要作用。
3.3 脱落酸、过氧化氢酶对二氯喹啉酸的响应
脱落酸(ABA)是一种能引起芽休眠、叶子脱落等生理作用的植物激素。在逆境条件下,植物体内的ABA通过促进气孔关闭,降低叶片伸展率等方式增强植物的抗逆性[25]。生长类除草剂作用机理之一是模拟过量生长素的作用,激活植物体内9-顺式环氧类胡萝素双氧合酶(NCED)基因,催化ABA的合成[26]。过氧化氢(H2O2)和ABA都能够诱导气孔关闭,并且ABA诱导气孔的关闭依赖于H2O2的生成[27]。本研究蛋白组学结果显示,二氯喹啉酸处理后烟草中H2O2的含量显著上升,但ABA合成通路中的ABA2基因表达量下降。检测ABA2及ABA合成催化酶NCED基因在二氯喹啉酸处理后0~72 h的表达水平,结果显示处理12 h后NCED的表达量开始上调,24 h达到表达高峰,48 h后开始下降,而ABA2基因表达高峰比NCED晚12 h,72 h后下降至较低水平,因此在二氯喹啉酸处理7 d后的烟草畸形叶片中未检测到ABA2蛋白上调。二氯喹啉酸处理前期诱导烟草ABA2和NCED基因表达上调,ABA和H2O2的大量合成会导致烟草叶片气孔关闭和叶片伸展率降低,这可能是烟草叶片光合作用相关蛋白表达量显著下调,同时导致烟草叶片畸形生长的主要原因。
4 结论
通过分析比较二氯喹啉酸处理后烟草叶片和正常烟草叶片之间蛋白组表达差异,初步明确了二氯喹啉酸能导致烟草光合作用系统、ABA合成通路、碳代谢等途径部分蛋白非正常表达,从而对烟草生长发育造成严重影响。根据脱落酸ABA合成通路中的ABA2及NCED基因受二氯喹啉酸诱导表达模式,推测烟草植株内存在一种应激反应机制,抵抗二氯喹啉酸胁迫,研究结果可为二氯喹啉酸药害机理研究及补救方法的制定提供理论依据。
[1]BOND J A,WALKER T W.Effect of postflood quinclorac applications on commercial rice cultivars[J].Weed Technology,2012,26(2):183-188.
[2]陈国奇,田兴山,冯莉.南方二氯喹啉酸残留药害早期诊断和预警亟待研究[J].杂草科学,2014,32(1):96-100.
[3]钟秋瓒,万树青,黎茶根,等.江西烟叶畸形生长的原因及治理研究[J].江西农业学报,2014,26(6):65-68.
[4]王静.土壤残留二氯喹啉酸引起烟草畸形生长的研究[D].广州:华南农业大学,2004.
[5]LÜ Z M,MIN H,WU S W,et al.Phylogenetic and degradation characterization ofBukholeria cepaciaWZ1 degrading herbicide quinclorac[J]. Journal of Environmental Science&Health.part.b Pesticides Food Contaminants& AgriculturalWastes,2003,38(6):771-782.
[6]PAREJA L,PÉREZ-PARADA A,AGÜERA A,et al.Photolytic and photocatalytic degradation of quinclorac in ultrapure and paddy field water:identification of transformation products and pathways[J].Chemosphere.2012,87(8):838-844.
[7]邱慧,申昌优,钟秋瓒,等.稻田残留二氯喹啉酸致后茬烟草畸形的解毒剂筛选[J].浙江农业科学,2016,57(1):119-123.
[8]GROSSMANN K,KWIATKOWSKI J.The mechanism of quinclorac selectivity in grasses[J]. Pesticide Biochemistry and Physiology,2000,66(2):83-91.
[9]GROSSMANN K,SCHELTRUP F.Selective induction of 1-aminocyclopropane-1-carboxylic acid (ACC)synthase activity is involved in the selectivity of the auxin herbicide quinclorac between barnyard grass and rice[J].Pesticide Biochemistry and Physiology,1997,58(2):145-153.
[10]HANSEN H,GROSSMANN K.Auxin-induced ethylene triggers abscisic acid biosynthesis and growth inhibition[J].Plant Physiology,2000,124(3):1437-1448.
[11]YANG X,ZHANG Z C,GU T,et al.Quantitative proteomics reveals ecological fitness cost of multi-herbicide resistantbarnyardgrass (Echinochloa crus-galliL.)[J].Journal of Proteomics,2017,150:160-169.
[12]ISAACSON T,DAMASCENO C M B,SARAVANAN R S,et al.Sample extraction techniques for enhanced proteomic analysis of plant tissues[J].Nature Protocols,2006,1(2):769-774.
[13]BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1-2):248-254.
[14]BRACHER A,WHITNEY S M,HARTL F U,et al.Biogenesis and Metabolic Maintenance of Rubisco[J].Annual Review of Plant Biology,2017,68(1):29-60.
[15]KAKIUCHI S,UNO C,IDO K,et al.The PsbQ protein stabilizes the functional binding of the PsbP protein to photosystemⅡ in higherplants[J].Biochimicaet Biophysica Acta,2012,1817(8):1346-1351.
[16]孙新华,贾攀,张继超,等.四翅滨藜盐胁迫应答基因AcPsbQ1的克隆及其在酵母中的功能分析[J].遗传,2015,37(1):84-90.
[17]MINAGAWA J,TAKAHASHI Y.Structure,function and assembly of photosystemⅡ and its light-harvesting proteins[J].Photosynth Res,2004,82(3):241-263.
[18]韩广业,李淑芹,唐崇钦,等.光合放氧复合物结构及其放氧机理的研究[J].化学进展,2004,16(2):184-195.
[19]CHANG L,GUO A,JIN X,et al.The beta subunit of glyceraldehyde 3-phosphate dehydrogenase is an important factor for maintaining photosynthesis and plant development under salt stress-Based on an integrative analysis of the structural,physiological and proteomic changes in chloroplasts inThellungiella halophila[J].Plant Science,2015,236:223-238.
[20]CHRISTENSEN A B,THORDAL-CHRISTENSEN H,ZIMMERMANN G et al.The germinlike protein GLP4 exhibits superoxide dismutase activity and is an important component of quantitative resistance in wheat and barley[J].Moleculor Plant Microbe Interact,2004,17(1):109-117.
[21]DUNWELL J M,GIBBINGS J G,MAHMOOD T,et al.Germin and germin-likeproteins:evolution,structure,and function[J].CritRev Plant Sci,2008,27(5):342-375.
[22]AGRAWALGK,JWANS,RAKWALR.A pathogen-induced novel rice(Oryza sativaL.)gene encodes a putative protein homologous to type II glutathione S-transferases[J].Plant Science,2002,163(6):1153-1160.
[23]吴金华,张西平,胡言光,等.小麦抗白粉病相关基因GST克隆与表达[J].西北植物学报,2013,33(1):34-38.
[24]CSISZÁR J,HORVÁTH E,VÁRY Z,et al.Glutathione transferase supergene family in tomato: Salt stress-regulated expression of representative genes from distinct GST classes in plants primed with salicylic acid[J].Plant Physiology and Biochemistry,2014,78:15-26.
[25]MORILLON R,CHRISPEELS M J.The role of ABA and the transpiration stream in the regulation of the osmotic water permeability of leaf cells[J].Proc Natl Acad Sci USA,2001,98(24):14138-14143.
[26]GROSSMANN K.Auxin herbicides:current status of mechanism and mode of action[J].Pest management science,2010,66(2):113-120.
[27]BRIGH T J,DESIKAN R,HANCOCK J T,et al.ABA-induced NO generation and stomatal closure inArabidopsisare dependent on H2O2synthesis[J].The Plant Journal,2006,45(1):113-122.
