牛至草醇提物的抗氧化与抗炎、止咳祛痰作用研究*
2018-01-18早克然司马义麦合苏木艾克木阿不都热依木玉苏甫
早克然·司马义,麦合苏木·艾克木△,于 洋,阿不都热依木·玉苏甫
1.新疆医科大学维吾尔医学院 (乌鲁木齐 830011),2.新疆维吾尔自治区中医民族医药管理局(乌鲁木齐 830001)
牛至草是一种维吾尔医常用药材,以牛至草(Origanum valgare)的干燥地上部分入药,维吾尔语名为“买尔赞柱西”,药性属二级干热,具有消散寒气、开通湿阻、成熟及清除异常体液、利尿通经、增强营养吸收、促进机体自然随和、止咳化痰、平喘利肺、消肿止痛等功效,用于粘稠异常体液性咳喘、感冒、头痛、脉络闭阻性胸闷气短、形体消瘦、心烦身疲、食欲不振、尿少肢肿[1-3]。它也是新疆特色药用植物之一,分布于天山、阿勒泰山区、准噶尔西部等区[4],资源丰富。文献报道[5-6],牛至草含有挥发油、多酚、黄酮、萜类等化合物,国内外相关药理活性研究主要集中于其挥发油类成分。在维吾尔医及民间常以牛至草醇提物或水煎液用于治疗咳喘、感冒、支气管炎等疾病的治疗,疗效显著。因此,本实验对牛至草醇提物的体外抗氧化能力进行了评价,同时对其总多酚、总黄酮含量进行了测定,并对其抗炎、止咳、祛痰作用进行了研究,以期为牛至草的临床应用和进一步研究提供参考。
材料与方法
1 材 料
1.1 仪器:OSB-2100恒温水浴锅(上海爱郎仪器有限公司),DZKW-S-4型电热恒温水浴锅、DZF-6090型真空干燥箱(上海一恒科学仪器有限公司),KQ320ODE数控超声波清洗器(昆明市超声仪器有限公司),AK-800A 400g摇摆式中药粉碎机(温岭市奥力中药机械有限公司),VV-240型紫外可见光光度计(上海凌光技术有限公司),艾柯纯水仪(成都市康宁实验专用纯水设备厂),KDC-2044型低速冷冻离心机(安徽中科中佳科学仪器有限公司)。402A型雾化器(江苏鱼跃医疗设备股份有限公司)。
1.2 药品与试剂:抗败血酸(上海蓝季生物,批号:160625),DPPH·(日本),磷酸盐缓冲液(中国,天津),Tris-Hcl缓冲液(中国,北京Solarbio),芦丁对照品(上海源叶生物科技有限公司,批号:Y01M7S10307),没食子对照品(中国食品药品鉴定研究院,批号:110831-201204),福林酚(源叶生物,批号:S28F8J)。急支糖浆(太极集团重庆涪陵制药厂有限公司,批号:14101248 0551),苯酚红(成都市科龙化工试剂厂,批号:20160510),生理盐水(国药集团新疆制药有限公司,批号:1608008)。其余试剂均为分析纯。
1.3 实验动物:昆明种小鼠18~22g,均为清洁级、雌雄兼用,由新疆医科大学实验动物中心提供[生产许可证:SYXK(新)2011-0001]。
1.4 药材:牛至草药材购自新疆维吾尔自治区维吾尔医医院,经该医院质检部鉴定为是唇形科植物牛至草(Origanum valgare)的干燥地上部分。
2 方 法
2.1 NZEt的制备:取牛至草药材,切碎,粉碎,过筛。称取3kg牛至草粉末,采用回流法以95%乙醇为提取溶剂提取两次,料液比为1∶15,每次1.5h,滤过,合并滤液,浓缩至约1000 ml,抽滤。真空干燥,得NZEt,备用。
2.2 NZEt的体外抗氧化活性
2.2.1 对DPPH·自由基清除能力的测定[6-7]:用纯水溶解NZEt,配置成不同浓度梯度的溶液,依次为0.2 mg/ml、0.5 mg/ml、1.0 mg/ml、2.0 mg/ml,置于冰箱保存备用。DPPH·配置成0.1 mg/ml的DPPH甲醇溶液。取各浓度样品2 ml到西林瓶中,加2 ml DPPH甲醇溶液,避光反应30 min ,在517 nm处测定清除后OD值为(A1);取各浓度样品2 ml到西林瓶中,各加2 ml甲醇,测得样品OD值为(A2);以水为空白对照,以上水代替样品溶液,取2 ml水到西林瓶中,加DPPH甲醇溶液2 ml,混合后测量未清除OD值为(A3);预实验显示,VC浓度为2.0 mg/ml时,清除率与各浓度牛至草醇提物的清除率最接近,故以此浓度VC作为阳性对照[11],做3次平行。清除率(%)=[1-(A1-A2)/A3]×100%。
2.2.2 还原能力的测定[8]:用甲醇溶解NZEt,配制成不同浓度的溶解(0.1mg/ml、0.2 mg/ml、0.5 mg/ml、1.0 mg/ml、2.0 mg/ml)2 ml于10 ml试管中,依次加入磷酸盐缓冲液(pH=6.8)分别2ml,1%铁氰化钾溶液2 ml,混合后50℃水浴20 min,再加入10%三氯乙酸溶液2 ml,混合后3000 r/min离心10 min,取上清液2 ml于西林瓶中,加入纯水2 ml和0.1%三氯化铁0.4 ml,常温反应5 min,于700 nm处测定OD值。预实验显示,0.1 mg/ml VC的吸光度值与各浓度牛至草醇提物的吸光度值比较最为符合,故以此浓度VC作为阳性对照,做3次平行。
2.2.3 对·OH的清除能力的测定[9-10]:用蒸馏水溶解NZEt配制成不同浓度梯度的溶液(0.1mg/ml、0.2 mg/ml、0.5 mg/ml、1.0 mg/ml、2.0 mg/ml)。在具塞试管中加入4.5ml pH=7.4磷酸盐缓冲液和1.5ml 1.5mmol/L的邻二氮菲溶液,充分混匀,加入1ml 1.5mmol/L FeSO4溶液,立即混匀,加入1ml待测液,充分混匀,再加入1ml 0.02% 双氧水;另做损伤管,其中加入1ml 0.02% 双氧水与蒸馏水,未损伤管不加双氧水直接加入2ml蒸馏水(未损伤管和损伤管均用磷酸盐缓冲液调零)于37℃保温60min,510nm处测定A值。预实验显示,0.1 mg/ml VC清除羟基自由基的效果与NZEt最高浓度时的清除率最接近,故以此浓度VC为阳性对照,每组设计3次平行,重复3次。清除率(%)=[(A样-A损)/(A未-A损)]×100%。
2.3 NZEt总黄酮和总多酚含量测定
2.3.1 NZEt总黄酮含量的测定[11]:以芦丁作标准曲线,精密称取芦丁对照品10 mg,置50 ml容量瓶中,加80%乙醇溶解至刻度,摇匀即得对照品溶液。分别精密吸取1.0ml、2.0 ml、3.0 ml、4.0 ml和5.0 ml置于10 ml比色管中,各加80%乙醇至5 ml,加5%NaNO2溶液0.5 ml,摇匀放置6min,再加10%Al(NO3)溶液0.5 ml,摇匀放置6min,加入4%NaOH溶液4 ml,摇匀放置15min,在510nm处测吸光度值。以芦丁浓度为横坐标,以吸光度值为纵坐标,然后绘制标准曲线。
精密吸取样品溶液1.0 ml于10 ml比色管中,各加80%乙醇至5 ml,加5%NaNO2溶液0.5 ml,摇匀放置6 min,再加10%Al(NO3)溶液0.5 ml,摇匀放置6min,加入4%NaOH溶液4 ml,摇匀放置15min,在510nm处测吸光度值。根据测得的吸光度值,按回归方程计算样品黄酮含量。
2.3.2 NZEt总酚含量的测定[12]:以没食子酸作标准曲线,精密称取0.070g的干燥没食子酸标准品,用蒸馏水溶解,定容于100 ml容量瓶中,摇匀,取5 ml放置50 ml棕色容量瓶,用蒸馏水稀释至刻度,摇匀即得没食子酸对照品溶液。分别精密吸取对照品溶液1.0、1.5、2.0、2.5、3.0、3.5、4.0分别置25 ml棕色容量瓶中,加10 ml蒸馏水,再依次加入FoLin试剂1 ml,7.5%Na2CO3溶液8 ml,蒸馏水稀释至刻度,充分摇匀混合后,放置1h,以相应的试剂为空白调零,在760nm处测吸光度。以没食子酸浓度为横坐标,以吸光度值为纵坐标,绘制标准曲线。
精密吸取样品溶液1.0 ml于25 ml棕色容量瓶中,同样的加10 ml蒸馏水,再依次加入FoLin试剂1 ml,7.5%Na2CO3溶液8 ml,蒸馏水稀释至刻度,充分摇匀混合后,放置1 h,以相应的试剂为空白调零,在760nm处测定吸光度。根据测得的吸光度值,按回归方程计算样品总酚含量。
2.4 NZEt抗炎、止咳、祛痰作用研究
2.4.1 给药剂量的确定:根据成年人每日摄食牛至草人体推荐量为约9g(生药),再按动物与人体的每公斤体质量剂量折算系数表,确定小鼠每日用量,即牛至草醇提取物实验动物小鼠给药剂量确定为高剂量为5.4 g/kg、中剂量为2.7 g/kg、低剂量为剂量1.35 g/kg。
2.4.2 对二甲苯致小鼠耳肿胀的影响(抗炎实验):参照文献[13],取小鼠50只,随机分为5组,即空白对照组(0.9%生理盐水)、阳性对照组(急支糖浆5.0 ml/kg)、NZEt高、中、低剂量组(5.4 g/kg、2.7 g/kg、1.35 g/kg);适应性饲养3d后,灌胃给药1次/d,连续7 d。末次给药30 min后,于小鼠右耳两侧均匀涂抹二甲苯30μl致炎,左耳不涂作为对照。致炎1 h后颈椎脱臼处死小鼠,沿耳廓基线剪下两耳,使用直径为8 mm的打孔器摘取双耳对称耳片,精密称取。耳片质量以左右耳片重量差为肿胀度,并计算肿胀抑制率。以此判断牛至草醇提取物对二甲苯致小鼠耳肿胀的影响。肿胀抑制率(%)=(空白对照组平均肿胀度-给药组平均肿胀度)/空白对照组平均肿胀度×100%。
2.4.3 对浓氨水致小鼠咳嗽反应的影响(止咳作用) :取小鼠50只,随机分为5组,即空白对照组(生理盐水)、阳性对照组(急支糖浆5.0 ml/kg)、NZEt高、中、低剂量组(5.4 g/kg、2.7 g/kg、1.35 g/kg);适应性饲养3d后,灌胃给药1次/d,连续7d。给药体积均为0.02 ml/g,末次给药1h,将小鼠逐一放入2.5L密闭干燥容器内,恒压喷入25%浓氨水气雾,喷雾5s引咳,观察并记录其咳嗽潜伏期及2min内咳嗽次数。
2.4.4 对小鼠气管段酚红排泌量的影响(祛痰作用) ,取小鼠50只,随机分为5组,即空白对照组(0.9%生理盐水)、阳性对照组(急支糖浆5.0 ml/kg)、NZEt高、中、低剂量组(5.4、2.7、1.35 g/kg);适应性饲养3d后,灌胃给药1次/d,连续7d。体积0.02 ml/g末次给药后30min,每只小鼠腹腔注射5%酚红生理盐水溶液0.2ml/20g体重,30min后处死小鼠,仰卧固定,颈部拉直,剥离周围结缔组织暴露气管,解剖分离出自甲状软骨下至气管分叉处的一段气管,将各气管段放入预先盛有2 ml 5% NaHCO3溶液的试管中,超声波清洗15min,使气管酚红完全释放,1000r/min 15min离心,取上清液,于分光光度计560nm处测定OD值,与酚红标准曲线比较,折算成酚红含量。
2.5 统计学方法:使用SPSS 17.0统计学软件对数据进行统计学处理,实验数据以均数±标准差表示。采用单因素方差分析,以P<0.05位差异具有统计学意义。体外抗氧化实验数据以均数和标准差表示,由Excel生成图标。
结 果
1 NZEt的体外抗氧化活性
1.1 对DPPH·自由基的清除作用:见图1。随着NZEt浓度的升高,其清除能力就越高,呈上升趋势,各浓度组间比较,差异有统计学意义(P<0.05)。其浓度为2mg/ml时清除率高达61.37%,接近于相同浓度的阳性对照药VC清除率62.0%。
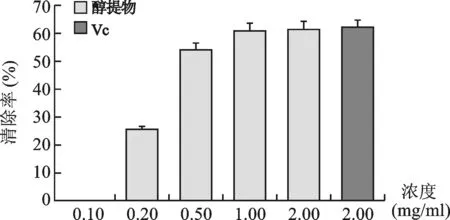
图1 NZEt的DPPH·自由基清除能力测定
1.2 还原能力:见图2。随着NZEt浓度的升高,其吸光度也一同升高,说明NZEt还原能力也逐渐增强,但其最高浓度时的吸光度(1.82)仍低于最低浓度时的阳性对照药VC(2.93),说明其还原能力小于阳性对照VC。
1.3 对·OH自由基的清除作用:见图3。NZEt清除羟基自由基能力同样随着醇提物浓度的升高呈增高趋势,其中浓度为2.0mg/ml的清除效果较高,清除率为41.3%,仍低于浓度为0.1mg/ml的VC清除率(53.4%)。
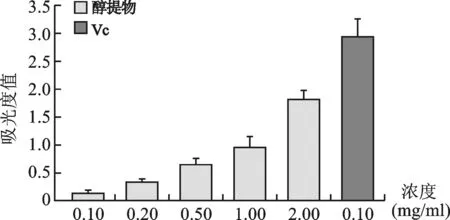
图2 NZEt的还原能力测定
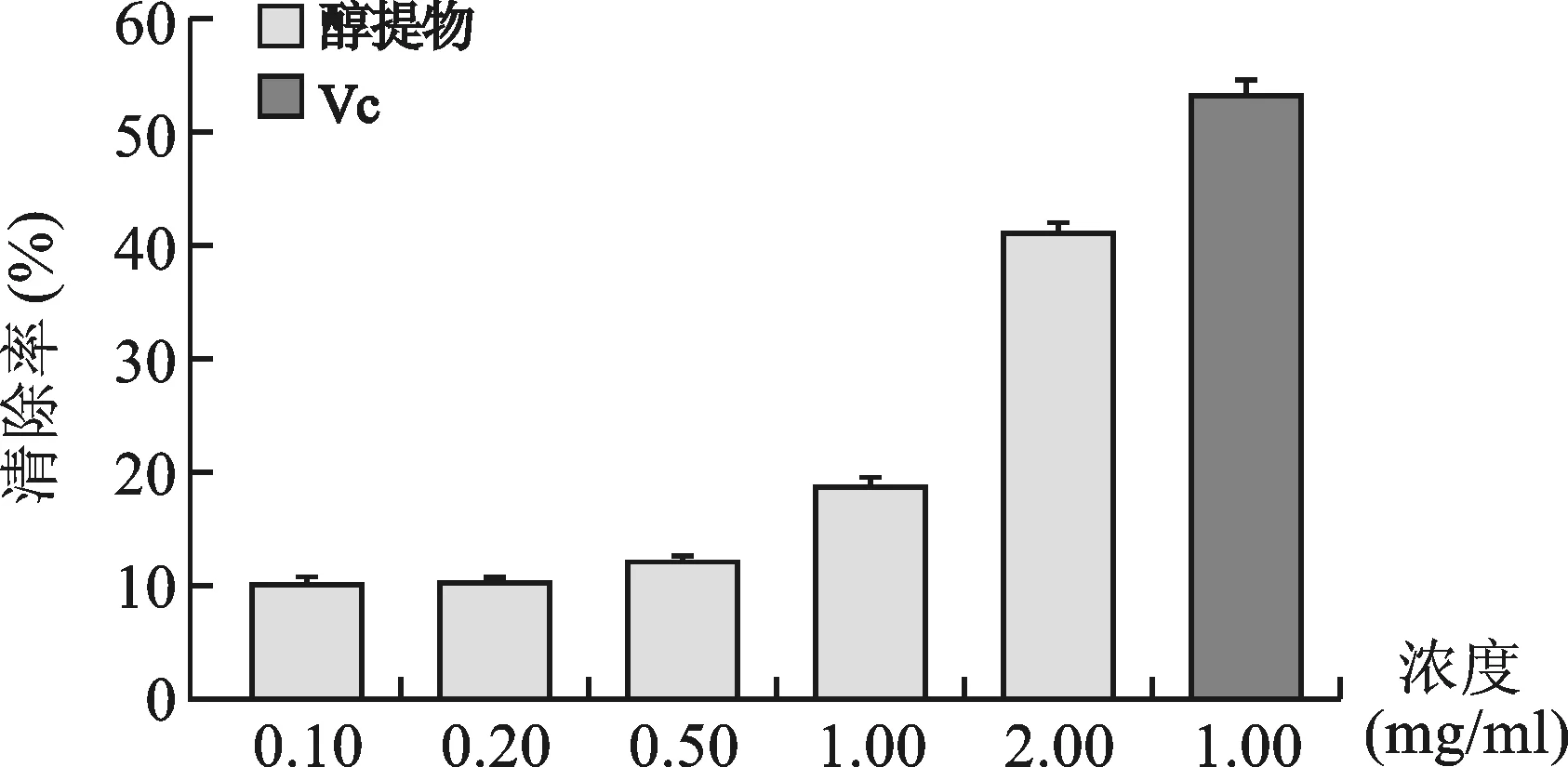
图3 NZEt的羟基自由基清除能力测定
2 NZEt 总多酚、总黄酮含量 根据2.3.1的方法,以芦丁浓度为横坐标,以吸光度值为纵坐标,绘制标准曲线。得回归方程A=0.2519C-0.0009,r2=0.9999,芦丁吸光度(A)和浓度(C)在20μg/ml~100μg/ml范围内线性良好。根据2.3.2的方法,以没食子酸浓度为横坐标,以吸光度值为纵坐标,绘制标准曲线。得回归方程A=0.0627C+0.0376,r2=0.999,没食子酸吸光度(A)和浓度(C)在2.8gμg/ml~11.2μg/ml范围内线性良好。按上述回归方程,计算NZEt总多酚和总黄酮含量。结果表明,其总多酚含量高达32.64mg没食子酸/g,总黄酮含量为46.92mg芦丁/g。
3 NZEt的抗炎、止咳、化痰作用 结果可见,与空白对照组比较,阳性对照组及NZEt三个剂量组肿胀度、咳嗽潜伏期、咳嗽次数及酚红含量的差异均有统计学意义(P<0.05);与阳性对照组比较,高、中、低剂量组肿胀度差异无统计学意义(P>0.05)。高剂量组咳嗽潜伏期差异有统计学意义(P<0.05),而中、低剂量组无统计学意义(P>0.05),高剂量组咳嗽次数差异有统计学意义(P<0.05),而中、低剂量组无显著性差异(P>0.05)。高、中剂量组酚红含量增多,差异具有显著性(P<0.05),而低剂量酚红含量低于阳性对照组。各剂量组间比较,酚红含量的差异具有显著性。说明牛NZEt具有较显著的抗炎、止咳、祛痰作用,具体见表1。
表1 牛至草醇提物抗炎、止咳、祛痰作用(
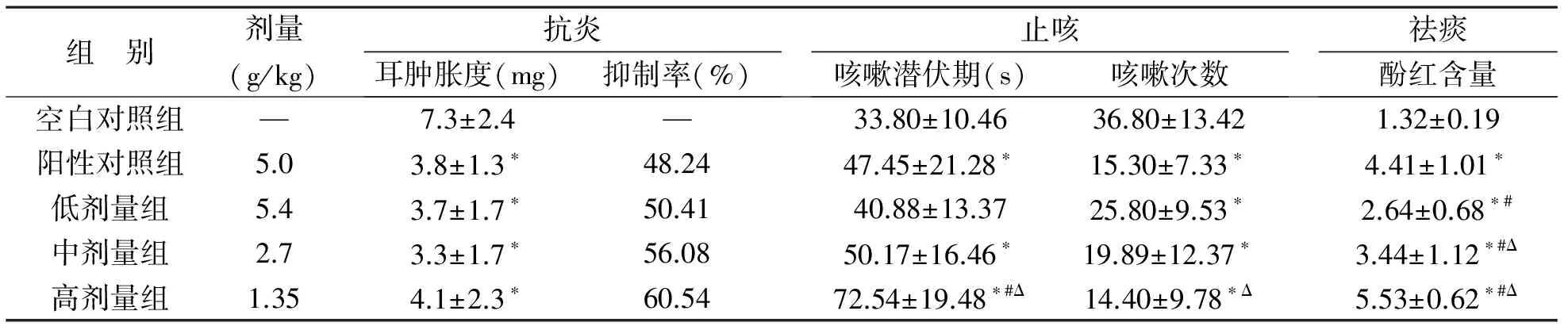
表1 牛至草醇提物抗炎、止咳、祛痰作用(
组 别剂量(g/kg) 抗炎耳肿胀度(mg)抑制率(%) 止咳咳嗽潜伏期(s)咳嗽次数 祛痰酚红含量空白对照组— 7.3±2.4— 33.80±10.4636.80±13.42 1.32±0.19阳性对照组5.0 3.8±1.3∗48.24 47.45±21.28∗15.30±7.33∗ 4.41±1.01∗低剂量组5.4 3.7±1.7∗50.41 40.88±13.3725.80±9.53∗ 2.64±0.68∗#中剂量组2.7 3.3±1.7∗56.08 50.17±16.46∗19.89±12.37∗ 3.44±1.12∗#Δ高剂量组1.35 4.1±2.3∗60.54 72.54±19.48∗#Δ14.40±9.78∗Δ 5.53±0.62∗#Δ
注:以空白对照相比,*P<0.05;与阳性对照比,#P<0.05;与各剂量组间比较,ΔP<0.05
讨 论
牛至草为维吾尔医习用药材,在维吾尔医临床和民间以其醇提物或水煎液用于治疗咳喘、感冒、支气管炎等异常黏液质性疾病治疗,疗效显著。它也是一种天然芳香植物之一,因其挥发油具有显著的杀菌和抑菌作用,多应用于饲料添加剂和食品防腐剂,国内外相关药理活性研究主要集中于其挥发油类成分。其挥发油的含量仅占药材的很少一部份,这样的使用状况既浪费了药材资源,也不能使药效得到全面发挥。因此,本研究将牛至草95%乙醇提取物为研究对象,采用DPPH· 、羟基自由基清除能力、还原能力及检测方法考察其的抗氧化作用,并对其总黄酮、总多酚含量进行测定;通过二甲苯致小鼠耳廓肿胀试验、氨水致咳试验及气管酚红排泌试验,探讨其抗炎、止咳、祛痰作用,旨在为牛至草的临床应用和进一步研究提供参考。
当机体内氧化平衡紊乱时,产生的DPPH·、·OH等无法及时清除,造成其蓄积,过量的自由基将会导致细胞凋亡或坏死。体内蓄积的自由基与诸多疾病的发生和发展密切相关。本研究体外抗氧化实验结果表明,NZEt具有一定的抗氧化活性,其清除DPPH·、·OH及铁离子还原能力均随着浓度的升高而增强趋势,其中NZEt最高浓度(2mg/ml)时清除DPPH·能力接近于相同浓度的VC,而其清除·OH能力、还原能力均小于相同浓度的VC。
黄酮、多酚是植物的二次代谢产物,也是许多植物的活性成分或药效物质基础。NZEt中总黄酮和多酚含量分别高达46.92mg/g、32.64mg/g,可能是其发挥抗氧化作用的物质基础,但其具体抗氧化有效成分及作用机理等有待进一步研究。
慢性支气管炎等临床呼吸系统常见病及多发病,主要表现在咳、痰、喘症状,对其治疗应达到抗炎、镇
咳、祛痰等目的。本研究 NZEt 的抗炎、止咳、祛痰作用实验结果表明,与空白对照组比较,NZEt 三个剂量组肿胀度、咳嗽次数及酚红含量的差异均有统计学意义(P<0.05),NZEt高剂量组的抗炎、止咳、祛痰作用优于阳性对照组,说明NZEt具有较显著的抗炎、止咳、祛痰作用。NZEt 的抗炎、止咳、祛痰作用,不仅为其临床应用及治疗物质基础提供了理论依据。至于其有效成分以及药理作用的确定有待今后进一步研究。
[1] 中华人民共和国卫生部药典委员会.中华人民共和国卫生部药品标准:维吾尔药分册[M].乌鲁木齐:新疆科技卫生出版社,1999.
[2] 国家中医药管理局.《中华本草》编委会.中华本草:维吾尔药卷[M].上海:上海科学技术出版社,2005.
[3] 刘勇民,沙吾提·伊克木.维吾尔药志(上册)[M].乌鲁木齐:新疆科技卫生出版社,1999.
[4] Prathyusha P,Subramanian MS,Nisha MC,etal. Pharmacognostical and phytochemical studies on Origanum vulgare L.(Laminaceae)[J]. Ancient Science of Life,2009,29(2):17.
[5] 李俊杰,李荣涛. 牛至的研究现状[J]. 光谱实验室,2013,30(1):171-175.
[6] Kim J S. Preliminary evaluation for comparative antioxidant activity in the water and ethanol extracts of dried citrus fruit,peel using chemical and biochemical assays[J]. Food & Nutrition Sciences,2013,04(2):177-188.
[7] 杨再波,谌连桃,吴应红,等. 密蒙花花蕾不同提取部位的抗氧化活性研究[J]. 中国药房,2016,27(1):32-34.
[8] Lhami G. Antioxidant and antiradical activities of l -carnitine[J]. Life Sciences,2006,78(8):803.
[9] Li X L,Zhou A G,Han Y. Anti-oxidation and anti-microorganism activities of purification polysaccharide from Lygodium japonicum,in vitro [J]. Carbohydrate Polymers,2006,66(1):34-42.
[10] 秦亚东,汪荣斌,周娟娟,等. 白芍醇提物及不同极性部位的体外抗氧化作用研究[J]. 中国药房,2015(28):3920-3923.
[11] 李启彭,李成杨,祁 岑,等. 昭通葡萄中黄酮提取工艺及含量测定[J]. 浙江农业科学,2017,58(1):126-128.
[12] 何巧丽,李柯翱,季志红,等. 甜叶菊中总多酚及总多糖含量测定[J]. 西部中医药,2016,29(5):34-36.
[13] 金兆磊,赵 超,陈华国,等. 吉祥草药材抗炎、止咳作用及谱效关系[J]. 食品与生物技术学报,2013,32(5):556-559.
