乳腺浸润性导管癌TOP2A基因状态与HER2及临床病理特征的关系
2018-01-18赵丽辉易冰孟凤娇
赵丽辉,易冰,孟凤娇
(中山市人民医院1.分子诊断中心,2.病理科,广东 中山528403)
乳腺癌发病率以每年5%的速度增长,且呈年轻化、低龄化[1-3]。目前乳腺癌的治疗除手术外,还包括激素治疗、化疗和靶向治疗;蒽环类药物在化疗方案中具有重要作用,但有效率仅为25% ~30%[4-5]。DNA拓扑异构酶Ⅱα(topoisomeraseⅡalpha,TOP2A)是常见的化疗疗效预测因子,其扩增或缺失与蒽环类药物的反应性之间具有相关性[6-7]。研究发现[8],蒽环类药物作用于TOP2a蛋白,产生细胞毒作用,诱导细胞凋亡,但同时具有严重的毒副作用。人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)是乳腺癌发生发展的驱动基因,也是临床预后重要的指标之一,其与TOP2A在乳腺癌中的表达具有一定相关性[9]。有分析指出,TOP2A基因扩增时不伴HER2基因扩增极为罕见。研究表明,当不存在HER2/neu型基因时,很大一部分乳腺癌患者会出现TOP2A基因扩增或过表达[10-11]。因此,本文拟通过荧光原位杂交法(FISH)检测371例乳腺浸润性导管癌患者TOP2A基因,分析其基因状态与HER2基因、HER2蛋白表达及临床病理特征之间的相关性。
1 对象和方法
1.1 研究对象
筛选收集2015年7月至2017年5月于中山市人民医院乳腺外科就诊的乳腺浸润性导管癌患者371例。其中,男3例,女368例;年龄25~86岁,≥50岁191例,<50岁180例;乳腺手术切除116例,B超引导下乳腺肿块穿刺活检255例;左乳190例,右乳181例。
所有患者手术及穿刺前均未行放疗、化疗或分子靶向治疗。手术及穿刺标本均按常规行10%中性甲醛固定、脱水、石蜡包埋、切片及HE染色,由病理科医师阅片确诊为浸润性导管癌。本研究所涉及的相关病理检测均获得患者的知情同意。
1.2 试剂与仪器
FISH检测GLP TOP2A/GSP 17探针试剂盒购自广州安必平生物技术有限公司;ThermoBrite S500-24荧光原位杂交仪(美国Abbott公司);BX51荧光显微镜,JENOPTIK摄像头及FISH分析软件(日本Olympus公司)。双色银染原位杂交法(DISH)检测试剂包括Inform HER-2/CEP17 DNA双探针、Ultra-View SISH DNP检测试剂盒、UltraViewRed ISH DIG检测试剂盒以及辅助试剂均为瑞士罗氏Ventana公司产品;免疫组织化学(IHC)检测试剂购自福州迈新生物技术有限公司;BenchMark XT全自动免疫组化染色仪(瑞士罗氏Ventana公司)。
1.3 方法
1.3.1 FISH检测TOP2A基因状态 3~4μm连续石蜡切片,贴至涂胶片上,65℃恒温箱烤片过夜;二甲苯脱蜡2次,每次15 min;无水乙醇脱蜡10 min;梯度乙醇(100%、95%、80%、70%)脱水各 3 min至去离子水;100℃煮片25 min;晾干后胃蛋白酶37℃恒温消化3~10 min;2×SSC缓冲液洗片2次,每次5 min;梯度乙醇(70%、80%、95%、100%)脱水各3 min,自然晾干;滴加TOP2A杂交液,封片,在杂交仪上变性杂交10~18 h,2×SSC与0.1%NP-40洗液洗去多余杂交液;滴加DAPI复染剂于荧光显微镜下观察计数。检测前需通过HE染色切片定位肿瘤浸润区域。
1.3.2 DISH检测HER2基因状态 3~4μm石蜡切片,65℃恒温箱烤片1~2 h,置于BenchMark XT全自动免疫组化染色机,放入DISH检测试剂进行检测,具体按操作试剂盒说明书进行。结束后取片,用含清洁剂的清水冲洗,梯度乙醇脱水,二甲苯透明,中性树脂封片。以肿瘤周边的间质成纤维细胞、内皮细胞、淋巴细胞以及其他非肿瘤细胞作为自身内对照。
1.3.3 IHC检测 HER2蛋白表达 2~3μm石蜡切片,65℃恒温箱烤片1~2 h,将切片置于Bench-Mark XT全自动免疫组化染色机,放入DAB试剂盒、苏木素、返蓝液,一抗为 HER2/NEU(4B5)单克隆抗体,具体操作步骤严格按罗氏诊断优化程序执行。结束后取片,用含清洁剂的清水冲洗,梯度乙醇脱水,二甲苯透明,中性树脂封片。阴性对照为同一切片中正常导管上皮,阳性对照选取HER2(2+)并经FISH检测证实的乳腺癌病例。
1.3.4 结果判读 FISH结果判读的具体方法参照文献[12-13];DISH检测结果判读参照2013年ASCO/CAPHER2指南[13];IHC:参照乳腺癌 HER2检测指南(2014版),均以浸润癌细胞为观察目标,无着色或≤10%癌细胞微弱膜着色为(0);≥10%癌细胞微弱膜着色为(1+);10%癌细胞不完整和(或)中等强度膜着色,或≤10%癌细胞强而完整的膜着色为(2+);>10%癌细胞强而完整的膜着色为(3+)。
1.4 统计学方法
采用SPSS 11.0软件进行统计学分析,各变量之间的关系采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 TOP2A基因状态与HER2的相关性
由表1可见,371例患者中TOP2A基因扩增64例,缺失 12例,总异常率为 20.49%(76/371),无扩增或缺失295例;HER2基因扩增122例(32.88%,122/371),高于TOP2A基因扩增;TOP2A基因与HER2基因共扩增53例;12例TOP2A基因缺失中有9例HER2基因扩增,295例TOP2A基因无扩增或缺失中有60例HER2基因扩增。统计分析显示,TOP2A基因状态与HER2基因明显相关(P<0.05)。TOP2A基因扩增率随HER2蛋白表达增强而增高(P<0.05),TOP2A基因状态与HER2蛋白表达明显相关(P<0.05)。乳腺浸润性导管癌基因TOP2A和HER2基因状态及 HER2蛋白表达见图1。
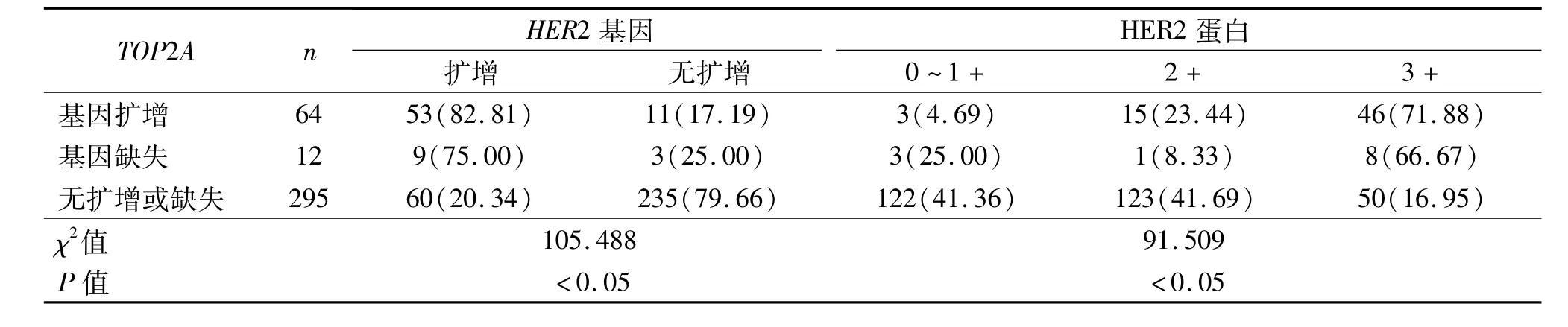
表1 TOP2A基因与HER2基因及HER2蛋白表达的关系 例(%)
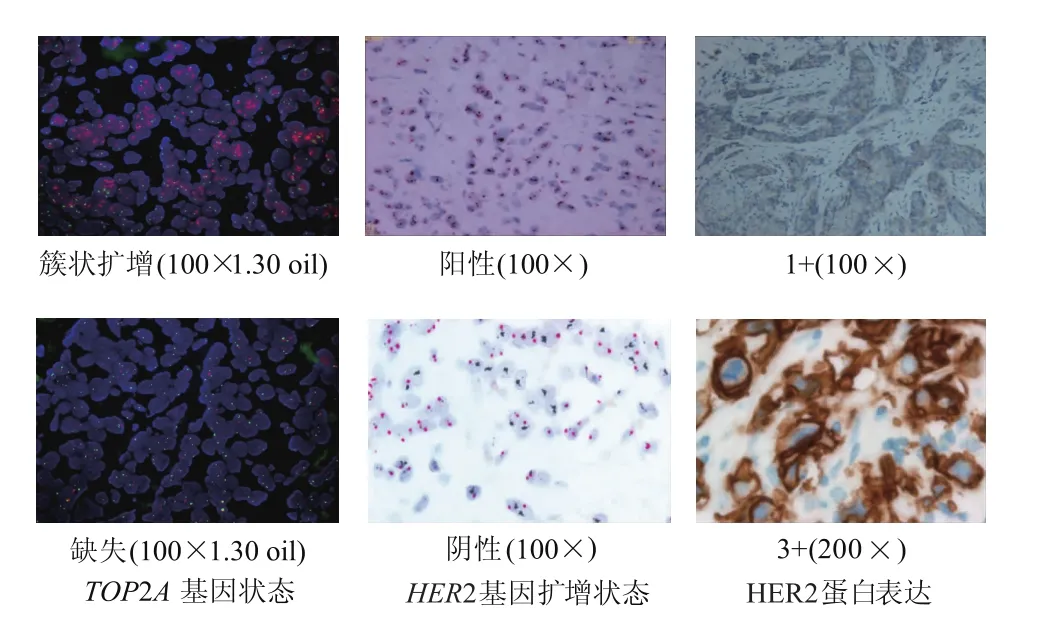
图1 乳腺浸润性导管癌基因状态及蛋白表达
2.2 TOP2A基因异常与临床病理特征的关系
由表2可见,TOP2A基因状态与年龄、部位及有无淋巴结转移均无相关性(P>0.05);男性异常率高于女性,但差异无统计学意义(P>0.05);Ⅰ级异常率最低(3.03%),Ⅲ级异常率最高(30.91%),TOP2A基因状态与病理组织学分级相关(P<0.05);TOP2A基因异常中伴有高级别导管原位癌的病例高于伴中、低级别导管原位癌的病例,但差异无统计学意义(P>0.05);肿瘤直径为 2~5 cm时TOP2A基因扩增和缺失率较高,肿瘤直径与TOP2A基因状态相关(P<0.05)。
3 讨论
TOP2A基因是核基质成分之一,在核内发挥作用[14]。TOP2A作为调节核酸空间结构动态变化、控制核酸生理功能的关键酶,在多种细胞中均有表达,且在增殖细胞中呈周期性特异表达。TOP2A在肿瘤细胞的不同周期表达各异,一般表现为在DNA复制后期及有丝分裂期表达增加,有丝分裂期结束后表达有所下降,提示肿瘤增殖受TOP2A表达影响[15]。TOP2A基因参与乳腺癌细胞的复制,存在TOP2A基因异常的患者预后差,无复发生存期缩短,尤其是TOP2A基因缺失的患者预后更差。基因扩增提示肿瘤有复发的可能,或者远期的疗效下降。因此,正确检测和评定乳腺癌中TOP2A状态至关重要。
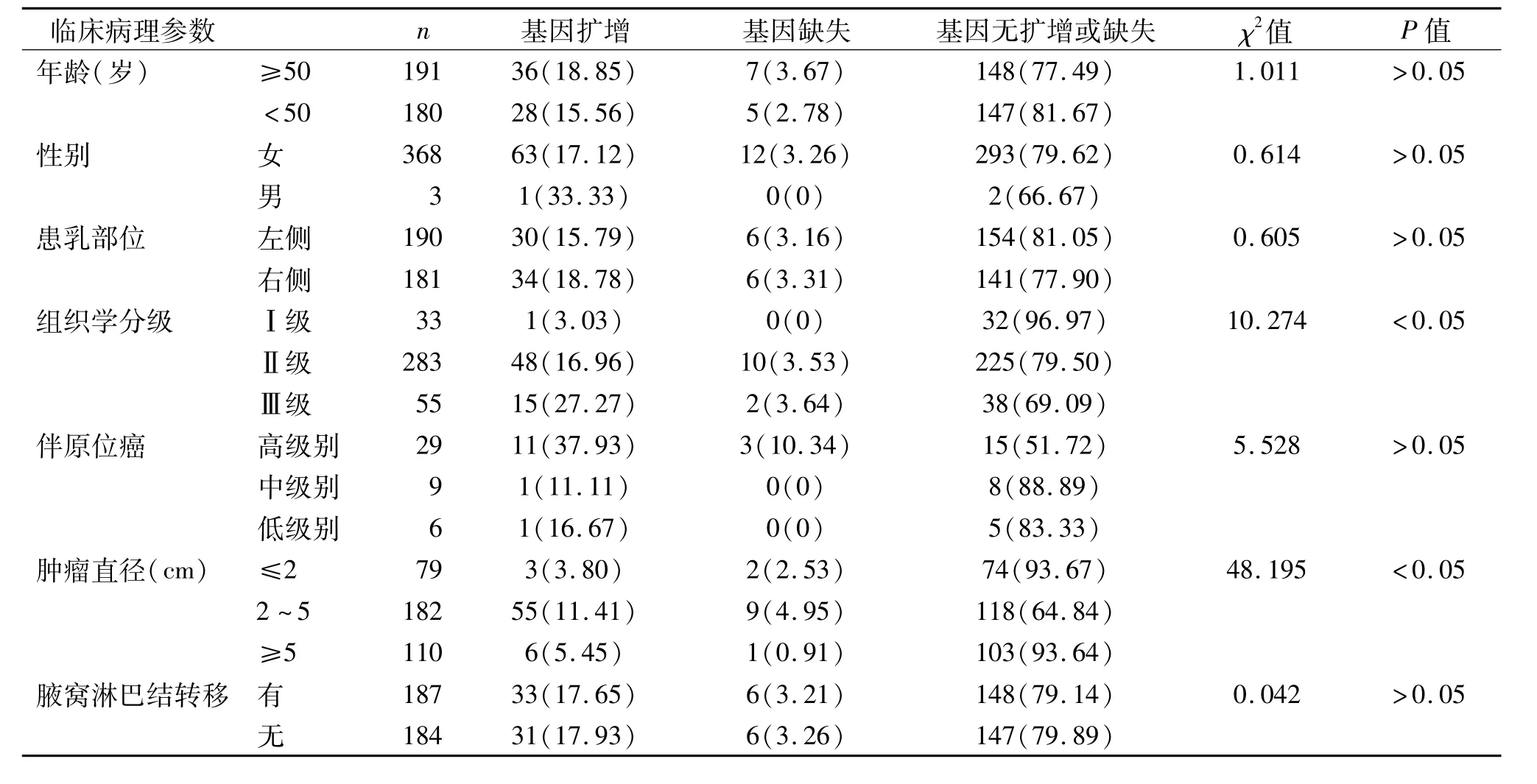
表2 TOP2A基因与临床病理特征的关系 例(%)
TOP2A变异有两种表现形式,分别是TOP2A基因拷贝数(判断扩增与否)和TOP2AmRNA表达。国外有文献报道,乳腺癌TOP2A基因扩增率为23.9%,基因缺失率为2.8%[16];国内文献报道TOP2A基因扩增率为12.6%~19.0%,未见有缺失报道[17-19]。本研究显示,371例乳腺浸润性导管癌患者TOP2A基因异常率为20.49%,其中扩增率为17.25%(64/371),与文献报道基本相符。TOP2A基因和HER2原癌基因均定位于染色体17q11.2-22,且二者相近。有研究表明[9],HER2与 TOP2A在乳腺癌中的表达存在一定相关性且共同影响乳腺癌发生发展。明洁等[18]研究显示,TOP2A扩增及表达可能依赖于 HER2扩增及表达;TOP2A与HER2呈共表达[20],HER2蛋白过表达与基因扩增存在一定的相关性。本研究结果显示,HER2基因扩增(122例)高于 TOP2A基因扩增(64例),TOP2A与HER2基因共扩增53例,达82.81%,二者呈明显相关,说明HER2基因表达可影响TOP2A基因表达。122例HER2基因扩增中有60例TOP2A基因无扩增或缺失,249例HER2无扩增中有10例TOP2A基因扩增,76例TOP2A基因扩增和缺失中有13例HER2基因并无扩增,这说明TOP2A与HER2基因虽具有相关性,但仍有各自独立的因素存在。本研究中TOP2A基因扩增随HER2蛋白表达增强而增高,TOP2A基因缺失在HER2蛋白表达为3+时最高,说明HER2蛋白过表达不但与HER2基因扩增相关,与TOP2A基因异常也存在一定的相关性。此外我们发现,TOP2A基因改变与患者年龄、性别和部位及淋巴结转移均无相关性,男性乳腺癌异常率虽然高于女性,但无统计学意义,可能是由于样本例数较少,还有待于积累病例数进一步明确。浸润性导管癌组织学分级越高,肿瘤细胞分化程度越差,TOP2A基因异常率就越高,而且肿瘤直径为2~5 cm时TOP2A基因扩增和缺失率较高。此外,76例TOP2A基因异常的浸润性导管癌中有16例伴有不同分化程度的原位癌,以高级别原位癌为主,这可能是肿瘤在从原位癌发展为浸润癌的过程中细胞增殖比较活跃导致异常率增高的原因。
TOP2A是蒽环类抗生素的靶酶,TOP2A基因扩增或缺失可影响蒽环类药物的反应及药效[21-22],而HER2状态对预测蒽环类药物的化疗效果尚无定论。有研究报道[19],TOP2A可能比HER2对蒽环类药物更有预测作用。因此,临床在使用蒽环类药物治疗时,应分别进行TOP2A及HER2基因检测,尤其是对HER2蛋白高表达、肿瘤组织分级高的患者。
乳腺浸润性导管癌TOP2A基因、HER2基因及蛋白的表达存在复杂性,但已成为乳腺癌治疗和预后评估的重要指标,TOP2A基因检测可能是乳腺浸润性导管癌蒽环类药物使用的重要依据。
[1]Siegel R,Naishadham D,Jemal A.Cancer statistics,2013[J].CA Cancer JClin,2013,63(1):11-30.
[2]Weiss JR,Moysich KB,Swede H.Epidemiology of male breast cancer[J].Cancer Epidemiol Biomarkers Prev,2005,14(1):20-26.
[3]Deb S,Jene N,Kconfab Investigators,et al.Genotypic and phenotypic analysis of familial male breast cancer shows under representation of the HER2 and basal subtypes in BRCA-associated carcinomas[J].BMC Cancer,2012,12:510.
[4]O′Malley FP,Chia S,Tu D,et al.TopoisomeraseⅡalpha and responsiveness of breast cancer to adjuvant chemotherapy[J].JNatl Cancer Inst,2009,101(9):644-650.
[5]Tubbs R,Barlow WE,Budd GT,etal.Outcome of patients with early-stage breast cancer treated with doxorubicin-based adjuvant chemotherapy as a function of HER2 and TOP2A status[J].JClin Oncol,2009,27(24):3881-3886.
[6]Simon G,Sharma A,Li X,etal.Feasibility and efficacy of molecular analysis-directed individualized therapy in advanced non-small-cell lung cancer[J].JClin Oncol,2007,25(19):2741-2746.
[7]Slamon DJ,Press MF.Alterations in the TOP2A and HER2 genes:association with adjuvant anthracycline sensitivity in human breast cancers[J].JNatl Cancer Inst,2009,101(9):615-618.
[8]华骁帆.早期非特殊性浸润性乳腺癌TOP2a蛋白表达与分级、分期及分子分型相关性分析[D].苏州:苏州大学,2016.
[9]Siddiqa A,Long LM,Li L,etal.Expression of HER-2 in MCF-7 breast cancer cells modulates anti-apoptotic proteins Survivin and Bcl-2 via the extracellular signalrelated kinase(ERK)and phosphoinositide-3 kinase(PI3K)signalling pathways[J].BMC Cancer,2008,8:129.
[10]许洁,陈洁,张科平,等.非特殊性浸润性乳腺癌TOP2A基因状态与分级、HER-2和Ki-67的相关性[J].临床与实验病理学杂志,2015,31(5):576-578.
[11]蒋奕,叶洪涛,姬逸男,等.乳腺组织 TOP2A和HER2/neu扩增与临床病理因素相关性研究[J].中华肿瘤防治杂志,2017,24(1):30-33.
[12]Wolff AC,Hammon ME,Schwartz JN,et al.American Society of ClinicalOncology/College of American Pathologists guideline for human epidermal growth factor receptor 2 testing in breast cancer[J].Arch Pathol Lab Med,2007,131(1):18-43.
[13]Wolff AC,Hammond ME,Hicks DG,et al.Recommendations for human epidermal growth factor receptor 2 testing in breast cancer:American Society of Clinical Oncology/College of American Pathologists clinical practice guideline update[J].J Clin Oncol,2013,31(31):3997-4013.
[14]Brase JC,Schmidt M,Fischbach T,et al.ERBB2 and TOP2A in breast cancer:a comprehensive analysis of gene amplification,RNA levels,and protein expression and their influence on prognosis and prediction[J].Clin Cancer Res,2010,16(8):2391-2401.
[15]Romero A,Caldés T,Díaz-Rubio E,etal.Topoisomerase 2 alpha:a real predictor of anthracycline efficacy?[J].Clin Transl Oncol,2012,14(3):163-168.
[16]Badawy OM,Loay I.FISH analysis of TOP2A and HER-2 aberrations in female breast carcinoma on archived material:egyptian NCIexperience[J].Appl Immunohistochem Mol Morphol,2017.[Epub ahead of print]
[17]刘春萍,逯翀,田源,等.乳腺癌Her-2与TOP2A基因表达对新辅助化疗效果的预测价值[J].中国普通外科杂志,2010,19(11):1200-1203.
[18]明洁,逯翀,田元,等.乳腺癌HER2与TOP2A的表达及其相关性[J].解剖学报,2010,41(3):391-394.
[19]张成娟,董凤梅,徐本玲,等.Ki-67、Her-2及Top2A在乳腺癌中的扩增表达与蒽环类药物疗效关系的研究[J].肿瘤基础与临床,2017,30(1):11-14.
[20]汤小江,周瑜辉,张伟,等.TOP2A基因表达与乳腺癌HER-2通路的相关性[J].西安交通大学学报(医学版),2015,36(4):519-522,557.
[21]Barinoff J,Traut A,Bauerschlag D,etal.Chemotherapy for 70-year-old women with breast cancer in Germany:a survey by the German breast group[J].Geburtshilfe Frauenheilkd,2013,73(5):433-439.
[22]Gogia A,Raina V,Deo SV,et al.Taxane and anthracycline based neoadjuvant chemotherapy for locally advanced breast cancer:institutional experience[J].Asian Pac JCancer Prev,2014,15(5):1989-1992.
