肺腺癌转移相关转录本1在乳腺癌患者血浆中的表达及临床意义
2018-01-18杨卉许文林苏兆亮陈琦
杨卉,许文林,苏兆亮,陈琦
(1.江苏大学第四附属医院乳腺科,江苏镇江212001;2.江苏大学医学院,江苏镇江212013)
乳腺癌是女性最为常见的一种恶性肿瘤,发病率和死亡率呈不断上升的趋势[1-2],早期诊断和治疗可有效降低死亡率。目前,乳腺癌的疾病筛查和对重点人群的监控主要基于血清学检测,如CA153、CA125以及癌胚抗原,这些肿瘤标志物的诊断敏感度和特异性都较低,限制了其在临床诊疗过程中对原发性乳腺癌早期诊断的应用价值[3]。国内有学者[4]研究发现,在乳腺癌筛查过程中,如果单独使用某一个肿瘤标志物,敏感度不超过10%,而即使联合多种标志物来筛查,敏感度最多达20%左右。因此,寻求乳腺癌血清学筛查的新型标志物成为研究的重点[5]。
近来研究发现,患者血浆miRNAs作为乳腺癌诊断标志物显示出比传统标志物更高的临床应用价值[6-8]。Huang等[9]用 RNA深度测序技术检测发现外泌体中存在一些长链非编码(long chain noncoding,lnc)RNA,直接证实了外周血中存在 lncRNA。大多数学者认为乳腺癌患者血液中循环核酸是由癌细胞凋亡或坏死而释放的[10-11]。肺腺癌转移相关转录本1(metastasis-associated lung adenocarcinoma transcript 1,MALAT-1)是长度约为8 700 nt,定位于人类染色体11q13.1的 lncRNA。MALAT-1在多种肿瘤细胞中呈高表达,如乳腺癌细胞,其高表达与细胞高增殖扩散能力相关[12-15]。近来研究发现,乳腺癌患者血浆中MALAT-1表达水平明显高于乳腺良性疾病者[16]。但是,外周血中过表达的MALAT-1与乳腺癌基因分型的关系及其较传统标志物CA153、CA125对乳腺癌的诊断价值尚不清楚。因此,本研究拟通过实时荧光定量PCR(qRTPCR)方法检测MALAT-1在乳腺癌组织和血浆中的表达,分析血浆MALAT-1与各临床病理特征的相关性以及对乳腺癌的诊断价值。
1 材料与方法
1.1 标本收集
选取2016年1月至2017年8月在镇江市第四人民医院及镇江市第一人民医院乳腺外科行乳腺癌切除术患者60例;年龄为41~82岁,中位年龄50岁。所有患者术前均未接受过手术、放疗及化疗。共收集到60例配对的乳腺癌组织及癌旁组织(距肿瘤>5 cm,经病理检查证实为正常乳腺组织且不伴杂质),离体30 min内保存于液氮罐中。选取同期在镇江市第四人民医院行乳腺肿块切除术,术后病检确诊为乳腺纤维瘤的女性患者60例,年龄29~67岁,中位年龄49岁。患者均签署知情同意书,所有试验均获得医院伦理委员会批准。
1.2 主要试剂与仪器
1.2.1 主要试剂 组织 RNA提取试剂 RNAiso Plus及血浆 RNA提取试剂 RNAiso Blood,Prime-ScriptTMRTⅡ反转录试剂盒,SYBR®Premix ExTaqⅡ扩增试剂盒(大连宝生物TaKaRa公司);lncRNA MALAT-1引物由广州锐博生物科技公司合成;血浆CA153和癌胚抗原检测试剂盒(瑞士Roche公司)。
1.2.2 主要仪器 C1000TM荧光定量PCR仪器、凝胶成像系统ChemiDoc TMXRS+凝胶成像仪(美国Bio-Rad公司);微量分光光度仪(北京美林恒通仪器有限公司);Cobas e601化学发光免疫分析仪(瑞士Roche公司)。
1.3 实验方法
1.3.1 血样采集及处理 所有患者于术前1 d采集空腹全血5 mL,于EDTA-K2抗凝管,2 000 r/min离心20 min,取血浆,于-80℃保存。
1.3.2 组织和血浆 RNA提取及反转录 采用RNAiso试剂提取组织与血浆中的RNA。行纯度和完整性检测,剔除不合格标本。采用试剂盒(Prime-ScriptTMRTⅡ)行反转录反应,以提取的总RNA为模板,反应总体积为20μL。加入相应试剂后于PCR仪内进行cDNA合成。产物于-80℃保存。
1.3.3 qRT-PCR检测 MALAT-1的表达 MALAT-1引物序列及退火温度见表1,GAPDH作为内参[11-13]。应用PCR扩增仪检测每个扩增循环后SYBR®GreenⅠ荧光信号水平。20μL反应体系,反应条件:95℃预变性10min;95℃变性5 s,60℃退火30 s,72℃延伸30 s,共40个循环。运用熔解曲线检测扩增产物纯度。采用相对定量2-ΔΔCt法计算表达量。
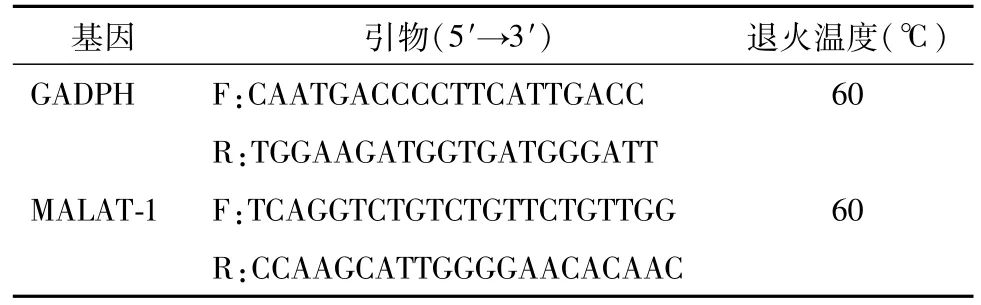
表1 引物序列和退火温度
1.3.4 血浆CA125和CA153含量检测 采用Cobas e601电化学发光免疫分析仪检测血浆中CA125及CA153含量。CA125参考范围为0~35 U/mL,CA153参考范围为0~30 U/mL。
1.4 统计分析
采用SPSS 22.0统计软件对数据进行统计分析,采用 MedCalc 11.4.2.0绘制ROC曲线。非正态分布的定量资料以中位数±四分位数间距(M±QR)表示;两组独立样本间比较采用Mann-WhineyU检验,两组配对样本间采用Wilcoxon符号秩和检验。采用Spearman秩相关系数检验两个随机变量之间的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 MALAT-1在乳腺癌组织和血浆中的表达
由图1可见,乳腺癌组织MALAT-1表达水平明显高于癌旁组织,差异有统计学意义(Z=-6.737,P<0.01)。乳腺癌患者血浆中MALAT-1表达水平明显高于纤维瘤患者,差异有统计学意义(Z=-9.449,P<0.01)。
2.2 血浆与乳腺癌组织中MALAT-1表达的相关性
Spearman秩相关分析显示,乳腺癌患者血浆中MALAT-1表达水平与癌组织的表达水平呈一定的正相关(rs=0.501,P<0.01)。见图2。
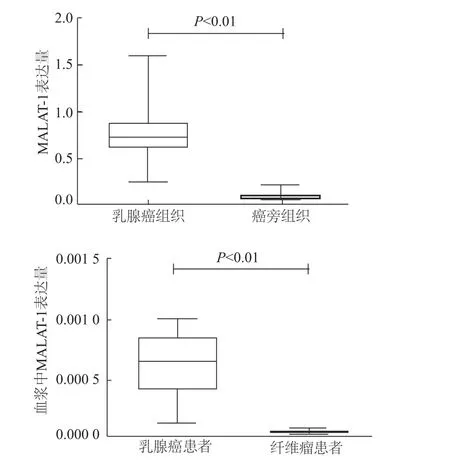
图1 qRT-PCR检测组织和血浆中MALAT-1的表达
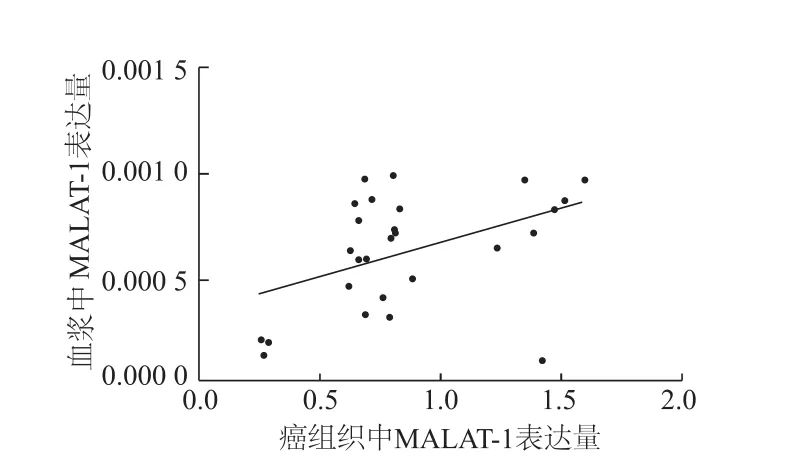
图2 乳腺癌组织和血浆中MALAT-1表达的相关性
2.3 乳腺癌患者血浆中MALAT-1表达与临床病理参数相关性
对乳腺癌患者的病理资料进行统计分析,结果显示患者血浆MALAT-1表达水平与淋巴结转移及基因分型相关,差异有统计学意义(P均<0.01);与患者年龄、TNM分期、病理类型、雌激素受体、孕激素受体、cerbB-2、p53及 Ki67无相关性(P>0.05)。见表 2、图3。
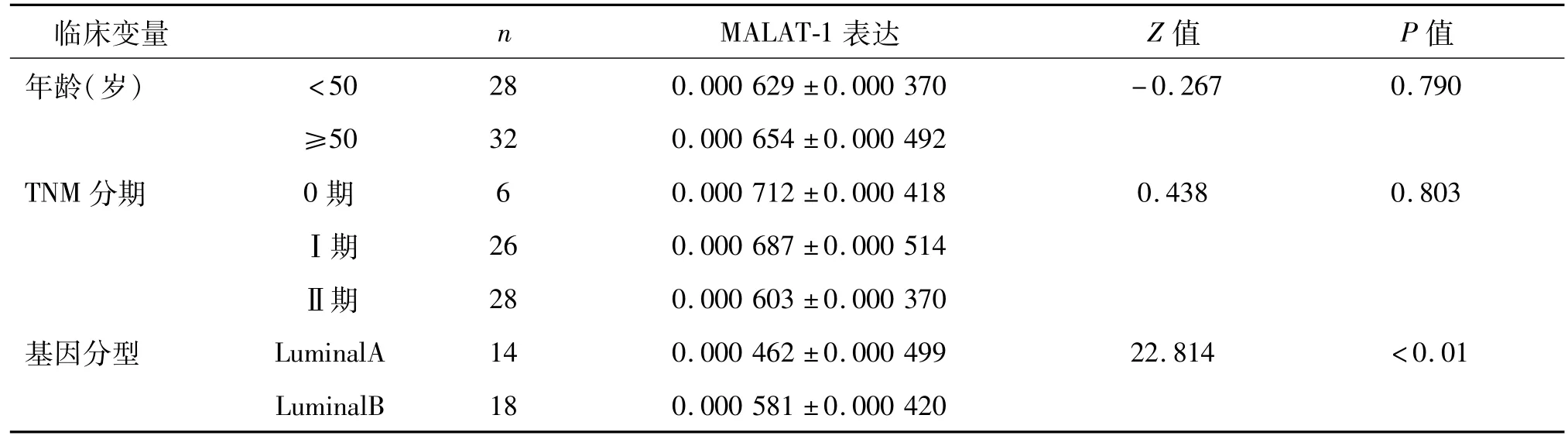
表2 乳腺癌患者血浆中MALAT-1表达与临床病理参数的相关性 M±QR
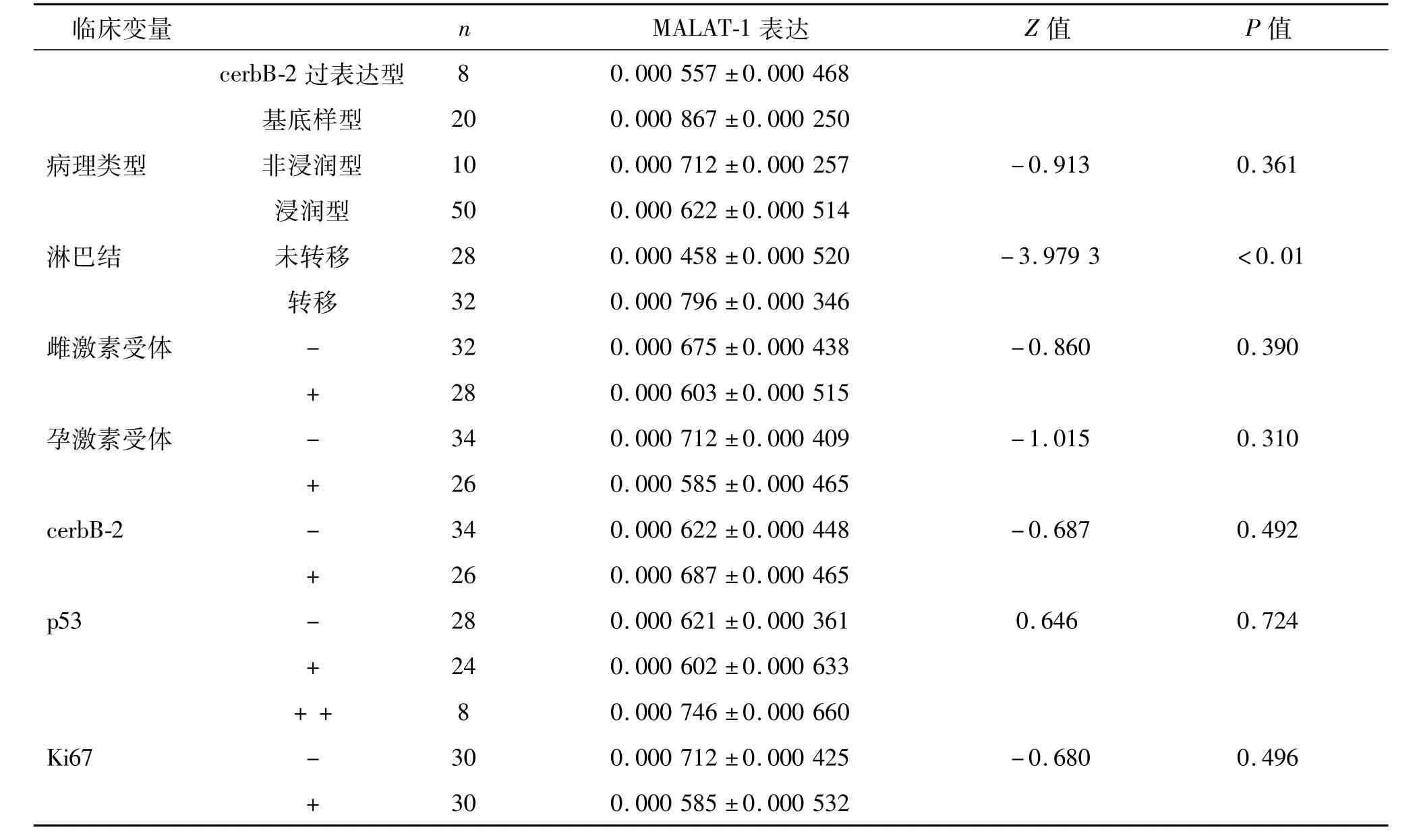
续表2
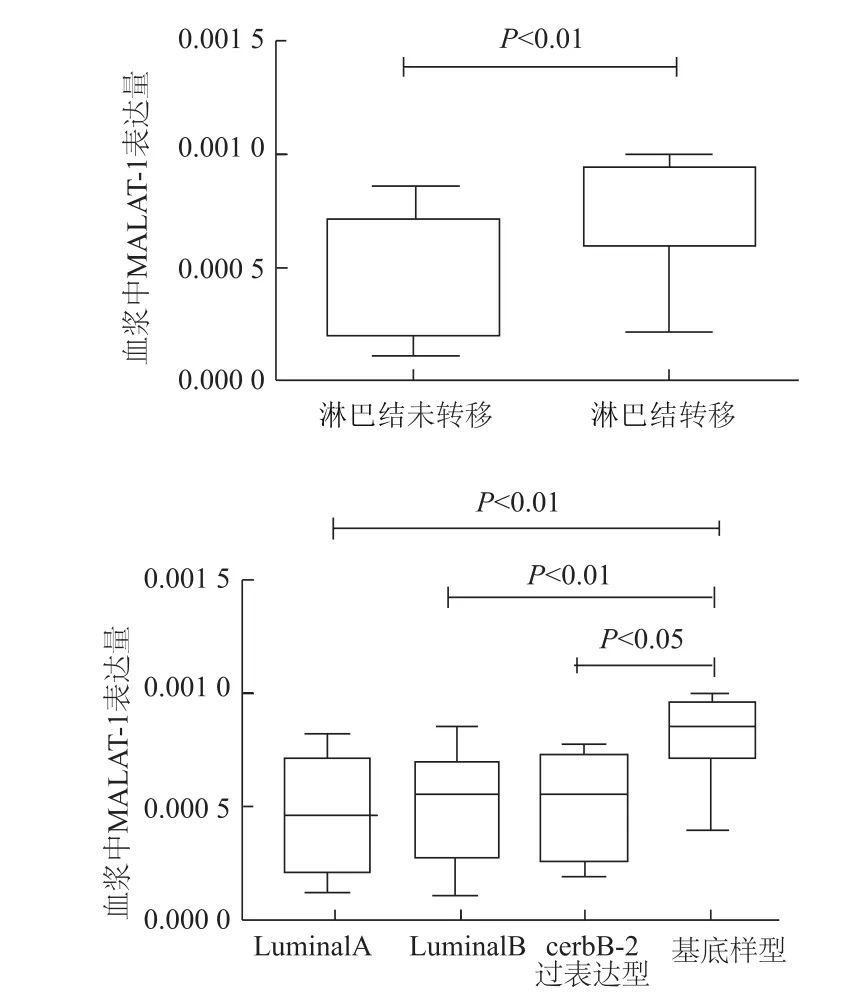
图3 MALAT-1在不同乳腺癌患者血浆中的表达
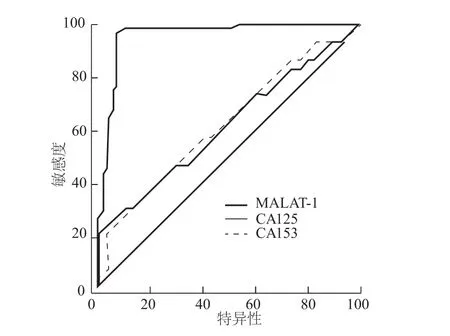
图4 血浆中MALAT-1、CA125和CA153诊断乳腺癌的ROC曲线
2.4 血浆中MALAT-1对乳腺癌的诊断价值
由图4可见,乳腺癌患者血浆中MALAT-1过表达曲线下面积(AUC=0.961)明显大于 CA125(AUC=0.618,P=0.022)和 CA153(AUC=0.623,P=0.016)。MALAT-1诊断敏感度和特异性高于CA125和CA153;联合应用3项指标检测的诊断敏感度高于各指标单独检测。见表3。
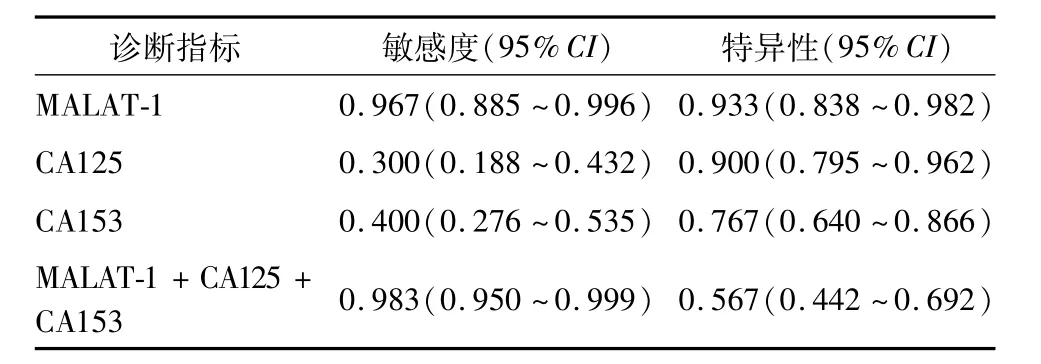
表3 各项指标单独检测和联合检测的敏感度和特异性
3 讨论
MALAT-1具有调节细胞周期的功能,可通过提高B-Myb的表达使细胞从G1期向S期、G2期向M期转变,从而促进肿瘤细胞增殖[12,17]。研究证明[18-19],可根据外周血细胞中 MALAT-1表达的差异区分非小细胞肺癌患者和健康者,表明其可作为非小细胞肺癌的诊断和预后指标。MALAT-1与乳腺癌细胞的增殖、凋亡、侵袭和转移有关。Zhao等[20]发现高浓度 17β-雌二醇(E2)可使下游靶点MALAT-1表达水平下降,从而减弱MALAT-1对乳腺癌细胞增殖及侵袭转移的影响。此外,有学者发现乳腺癌患者血浆MALAT-1水平较良性结节者明显升高,其高表达可作为乳腺癌诊断的生物学标志物[13]。本研究结果进一步证实乳腺癌患者癌组织中MALAT-1表达较癌旁组织明显增高,其血浆中MALAT-1水平较乳腺纤维瘤患者明显增高。为更加明确血浆MALAT-1对乳腺癌的诊断价值,对乳腺癌患者血浆中高表达的MALAT-1及乳腺癌传统标志物CA125和CA153绘制ROC曲线,发现MALAT-1诊断敏感度和特异性高于CA125和CA153,联合3项指标检测的诊断敏感度高于各指标单独检测。此外,乳腺癌患者血浆MALAT-1水平与组织MALAT-1水平具有一定相关性,这些均表明血浆MALAT-1可能为乳腺癌诊断的潜在标志物。
本研究结果表明,血浆MALAT-1表达水平与基底样型乳腺癌以及淋巴结转移相关。近几年采用基因表达和免疫组化的方法将乳腺癌分为LuminalA、LuminalB、cerbB-2过表达型和基底样型四大类。其中,基底样型乳腺癌又称三阴性乳腺癌,指雌激素受体、孕激素受体和cerbB-2表达均为阴性的乳腺癌,约占所有乳腺癌患者15%,其生物学特点表现为侵袭性强,易出现淋巴结转移,因缺乏内分泌及抗cerbB-2治疗的靶点,此类乳腺癌患者预后较差[21-23]。后续我们将进一步研究MALAT-1对三阴性乳腺癌细胞增殖、迁移和侵袭的影响。
综上所述,血浆MALAT-1有望成为乳腺癌诊断的潜在分子标志物。后续将随访60例乳腺癌患者的预后来探索MALAT-1在乳腺癌中的临床实用价值。
[1]Hong CS,Graham NA,Gu W,et al.MCT1 modulates cancer cell pyruvate exportand growth of tumors that coexpress MCT1 and MCT4[J].Cell Rep,2016,14(7):1590-1601.
[2]Ferlay J,Soerjomataram I,Dikshit R,etal.Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012[J].Int JCancer,2015,136(5):E359-E386.
[3]Duffy MJ,Evoy D,McDermott EW.CA 15-3:uses and limitation as a biomarker for breast cancer[J].Clin Chim Acta,2010,411(23/24):1869-1874.
[4]叶蓓,柳光宇,陆劲松,等.常用的乳腺癌血清肿瘤标志物在早期诊断中的应用价值不高[J].中国癌症杂志,2009,19(10):807-808.
[5]郭德阳,陈雷,余正.循环肿瘤细胞的检测及其在乳腺癌中的应用研究进展[J].中华临床医师杂志(电子版),2015,9(21):3992-3996.
[6]Shaker O,Maher M,Nassar Y,et al.Role ofmicroRNAs-29b-2,-155,-197 and-205 as diagnostic biomarkers in serum of breast cancer females[J].Gene,2015,560(1):77-82.
[7]Müller V,Gade S,Steinbach B,et al.Changes in serum levels ofmiR-21,miR-210,and miR-373 in HER2-positive breast cancer patients undergoing neoadjuvant therapy:a translational research project within the Geparquinto trial[J].Breast Cancer Res Treat,2014,147(1):61-68.
[8]BertoliG,Cava C,Castiglioni I.MicroRNAs:new biomarkers for diagnosis,prognosis,therapy prediction and therapeutic tools for breast cancer[J].Theranostics,2015,5(10):1122-1143.
[9]Huang X,Yuan T,Tschannen M,et al.Characterization of human plasma-derived exosomal RNAs by deep sequencing[J].BMC Genomics,2013,14:319.
[10]Schwarzenbach H,Hoon DS,Pantel K.Cell-free nucleic acids as biomarkers in cancer patients[J].Nat Rev Cancer,2011,11(6):426-437.
[11]Van der Vaart M,Pretorius PJ.Circulating DNA.Its origin and fluctuation[J].Ann N Y Acad Sci,2008,1137:18-26.
[12]Tripathi V,Shen Z,Chakraborty A,et al.Long noncoding RNA MALAT1 controls cell cycle progression by regulating the expression ofoncogenic transcription factor B-MYB[J].PLoSGenet,2013,9(3):e1003368.
[13]Zheng HT,Shi DB,Wang YW,et al.High expression of lncRNA MALAT1 suggests a biomarker of poor prognosis in colorectal cancer[J].Int J Clin Exp Pathol,2014,7(6):3174-3181.
[14]Gutschner T,Hämmerle M,Eissmann M,et al.The noncoding RNA MALAT1 is a critical regulator of the metastasis phenotype of lung cancer cells[J].Cancer Res,2013,73(3):1180-1189.
[15]Han Y,Liu Y,Nie L,et al.Inducing cell proliferation inhibition,apoptosis,andmotility reduction by silencing long noncoding ribonucleic acid metastasis-associated lung adenocarcinoma transcript1 in urothelial carcinoma of the bladder[J].Urology,2013,81(1):209.e 1-7.
[16]刘艳华,孙三元,鹿存涛.长链非编码RNA在乳腺癌组织与外周血中的表达[J].中华临床医师杂志(电子版),2016,10(12):1710-1713.
[17]Gutschner T,Hämmerle M,Diederichs S.MALAT1—a paradigm for long noncoding RNA function in cancer[J].JMol Med(Berl),2013,91(7):791-801.
[18]Weber DG,Johnen G,Casjens S,et al.Evaluation of long noncoding RNA MALAT1 as a candidate bloodbased biomarker for the diagnosis of non-small cell lung cancer[J].BMC Res Notes,2013,6:518.
[19]Ji P,Diederichs S,WangW,et al.MALAT-1,a novel noncoding RNA,and thymosinβ4 predictmetastasis and survival in early-stage non-small cell lung cancer[J].Oncogene,2003,22(39):8031-8041.
[20]Zhao Z,Chen C,Liu Y,et al.17β-Estradiol treatment inhibits breast cell proliferation,migration and invasion by decreasing MALAT-1 RNA level[J].Biochem Biophys Res Commun,2014,445(2):388-393.
[21]Beg S,Siraj AK,Prabhakaran S.Loss of PTEN expression is associated with aggressive behavior and poor prognosis in Middle Eastern triple-negative breast cancer[J].Breast Cancer Res Treat,2015,151(3):541-553.
[22]Williams N,Harris L.Triple-negative breast cancer in the post-genomic era[J].Oncology(Williston Park),2013,27(9):859-860,864.
[23]Spanheimer PM,Lorenzen AW,De Andrade JP,et al.Receptor tyrosine kinase expression predicts response to sunitinib in breast cancer[J].Ann Surg Oncol,2015,22(13):4287-4294.
