人源多能干细胞体外定向诱导分化为肝细胞
2018-01-18杜盼余江南徐希明
杜盼,余江南,徐希明
(江苏大学药学院,江苏镇江212013)
原位肝移植是目前唯一能有效治疗肝脏严重疾病的方法[1-2]。然而,由于器官短缺,近年来因为肝脏疾病而死亡的人数不断增加[3];此外,世界范围内的肝脏疾病发病率也在不断上升。肝细胞移植的临床试验已取得了极大进展[4],但作为替代肝脏移植的肝细胞移植仍然需要解决肝细胞来源问题[5]。目前,很多研究都致力于寻找一种能够稳定产生功能性肝细胞的可行方法[6-9],其中,可能会成为肝细胞不竭来源的细胞就是人源诱导多能干细胞(human induced pluripotent stem cells,hiPSCs)。hiPSCs具有自我更新和多向分化能力[10-13],与人源胚胎干细胞(hESCs)相比,hiPSCs涉及的伦理问题较少,且完全不受来源限制。因此,hiPSCs来源的肝细胞(hiPSC-HEPs)在药物筛选、细胞治疗以及体外疾病模型等方面的研究中具有重要意义[14]。本实验以hiPSCs为源细胞,对其进行肝细胞定向诱导分化,并筛选优化出最佳诱导分化培养基,采用最佳诱导方案对其进行培养,使其分化为肝细胞,有望为肝细胞移植提供一种可行的细胞来源,从而更好地解决肝细胞短缺的问题。
1 材料与方法
1.1 主要材料
hiPSCs(本课题组构建,来源于人脐带间充质干细胞)[15];β-ME(美国 Amresco公司);hESCs-HEPs(由本实验室以hESCs诱导后形成的肝细胞,hESCs细胞购自上海干细胞库);肝细胞培养基HBM、HCM(美国 Lonza公司);曲古柳菌素 A(trichostatin A,TSA)购自百灵威科技有限公司;人源甲胎蛋白、白蛋白ELISA试剂盒(美国Abcam公司);KnockoutTMDMEM培养基、FBS、KnockOutTM血清替代物(Knock-OutTMserum replacement,KSR)、非必需氨基酸(nonessential amino acid,NEAA)、谷氨酰胺替代物(glutamax,GM,美国 Gibco公司);牛血清白蛋白(BSA)、重组抑瘤素 M(oncostatin-M,OSM)、DMSO、胰蛋白酶(美国Sigma公司);b-成纤维细胞生长因子 (b-FGF)、a-FGF、FGF-4、人 表 皮 生 长 因 子(hEGF)、骨形态发生蛋白 4(bone morphogenetic protein 4,BMP4)、肝细胞生长因子(HGF)均为美国PeproTech公司产品;性别决定Y框转录因子17(sex determining region Y—box 17,SOX17)的抗体(美国Abcam公司);蛋白标准参照物(美国Invitrogen公司);PVDF膜(瑞士 Roche公司);Immobilon ECL发光液(美国Millipore公司);人源丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)以及乳酸脱氢酶(LDH)酶联免疫试剂盒购自山东烟台生物科技研究所;抗体 GAPDH、细胞色素 P450(CYP450)、葡萄糖醛酸转移酶(UGT)与谷胱甘肽硫转移酶(GST)均为美国Santa Cruz公司产品。
1.2 干细胞培养及最优诱导培养基的选择
1.2.1 细胞培养 先以 KnockoutTMDMEM培养基为基础,加入 24%KSR,1×GM,1×NEAA,0.1 mmol/Lβ-ME,100 U/mL青霉素/链霉素(P/S)和4.8 ng/mL bFGF,配制成 hESCs培养基。然后将hiPSCs置于hESCs培养基,于37℃,5%CO2培养箱中培养,用Ⅳ型胶原酶消化传代。
1.2.2 筛选最佳诱导方案 按照表1中的培养步骤和诱导培养基组成,分别考察4种肝细胞诱导分化培养基(Ⅰ号、Ⅱ号、Ⅲ号和Ⅳ号)诱导细胞分化的能力,筛选出hiPSCs的最佳诱导培养基组成。具体操作:将“1.3.1”中培养的克隆球接种到24孔板,放入培养箱中培养,待贴壁后弃掉原有培养基,分别换成上述4种诱导培养基,观察细胞形态变化。分别收集诱导培养第0,3,7,11,15,19,23,27,32天的细胞上清液,利用酶联免疫试剂盒检测不同时间点上清液中甲胎蛋白、白蛋白含量,从而筛选出最佳诱导培养基(样本量=3,重复3次)。最优诱导方案为Ⅱ号方案,其诱导流程见图1。
1.3 二维条件下肝细胞的诱导分化
1.3.1 形态观察 采用最佳诱导方案对hiPSCs进行诱导分化,分别在诱导前、诱导第3天、第7天、第11天、第15天、第19天、第21天以及第23天,于倒置显微镜下观察细胞形态。

表1 4种不同肝细胞分化培养基的组成
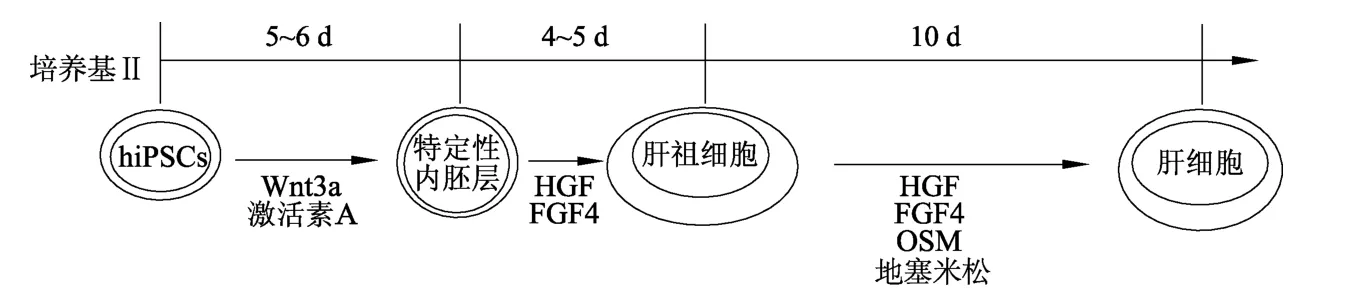
图1 最优诱导方案的诱导流程
1.3.2 免疫荧光法检测肝脏特征蛋白的表达 取24孔板中体外诱导分化培养21 d左右类肝脏细胞,吸弃上清液,用PBS缓冲液洗1遍后,每孔加入1 mL 4%低聚甲醛,4℃固定过夜。PBS洗3遍,5 min/次;加入含 0.3%Triton X-100和 5%BSA的溶液,于37℃封闭30 min;PBS洗3次,5 min/次;加入一抗(均为1∶250):鼠抗白蛋白抗体,兔抗甲胎蛋白抗体,兔抗CK8抗体,兔抗CK18抗体,鼠抗SOX17抗体,500μL/孔,4℃过夜;PBS洗3次,5 min/次;加入对应的荧光二抗,室温避光反应2 h;PBS洗 3次,5 min/次;加入 0.2μmol/L Hoechst33258,染细胞核,37℃15 min;PBS洗3次,5 min/次;加入甘油,并在倒置荧光显微镜下观察结果。
1.3.3 蛋白质印迹法检测细胞肝脏特征蛋白的表达 用RIPA细胞裂解液提取蛋白,于样品中加入适量上样缓冲液,100℃煮沸10 min;将凝胶放于垂直电泳槽中,加入适量1×SDS-PAGE工作液;在不同的孔道中对蛋白标准参照和样品进行上样;80 V恒压,电泳20 min后调电压至 110 V,1~1.5 h;将电泳完成的凝胶转移至PVDF膜上,4℃,350mA恒流,2 h;将转膜结束后的PVDF膜放入3%BSA中,室温封闭1 h;一抗(均为1∶250):兔抗GAPDH抗体,兔抗SOX17抗体,兔抗CK18抗体,兔抗白蛋白抗体,兔抗甲胎蛋白抗体,4℃过夜或室温2 h;回收一抗后,用1×TBS/T清洗PVDF膜,15min/次,洗3次;加入HRP标记的二抗鼠抗兔IgG抗体(1∶5 000),室温静置2 h;用1×TBS/T清洗 PVDF膜,15 min/次,洗3次后用ECL化学发光仪检测蛋白条带。以hiPSCs作为空白对照,hESCs-HEPs作为阳性对照。
1.3.4 二维条件下肝细胞药物代谢酶的表达 诱导结束后,提取细胞蛋白,利用蛋白质印迹法检测Ⅰ相代谢酶CYP450、Ⅱ相代谢酶UGT与GST的表达,同时比较诱导前、诱导后及与hESCs-HEPs的表达差异,以GAPDH作为内参。
1.3.5 酶联免疫法检测肝细胞功能 在诱导分化前、诱导后第3、7、11、15、19、23、27和第 32天,收集上清液,1 500 r/min,离心 5 min,采用 AST、ALT与LDH试剂盒测定上清液中相应酶的质量浓度,并以hESCs-HEPs作为对照进行比较。n=3,重复3次。
1.4 三维条件下肝细胞诱导分化
1.4.1 形态观察 在三维条件下,采用Ⅱ号诱导培养基诱导 hiPSCs分化,倒置显微镜下观察细胞形态。
三维条件诱导细胞21 d,采用4%多聚甲醛将三维支架固定,进行石蜡包埋切片,标本脱蜡,二甲苯透明,HE染色。光学显微镜下观察诱导后的细胞形态及结构特征。
1.4.2 三维条件下肝细胞功能检测 在三维条件下诱导的第 3、7、11、15、19、23、27和 32天,收集上清液,用试剂盒测定上清液中ALT、AST与LDH的质量浓度,并与二维条件下的浓度比较。n=3,重复3次。
2 结果
2.1 最优诱导方案选择
酶联免疫法检测结果显示,在4种培养基诱导下,甲胎蛋白分泌量在第11天均达到最高,随时间延长,甲胎蛋白含量逐渐降低,直至第32天时分泌量基本“消失”(图2)。白蛋白在诱导分化1周后含量没有明显变化,直至诱导分化2周后才显著增多(P<0.05),随时间延长,白蛋白表达量也逐渐增加。诱导分化3周后,白蛋白表达量趋于稳定,继续培养,含量呈现下降趋势(图3)。
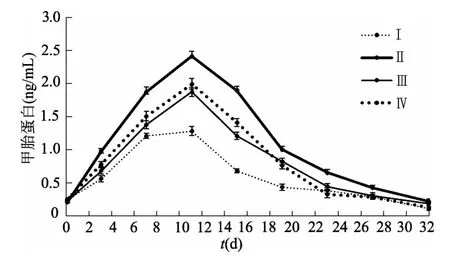
图2 4种培养基诱导细胞后的各时点上清液甲胎蛋白含量(n=3)
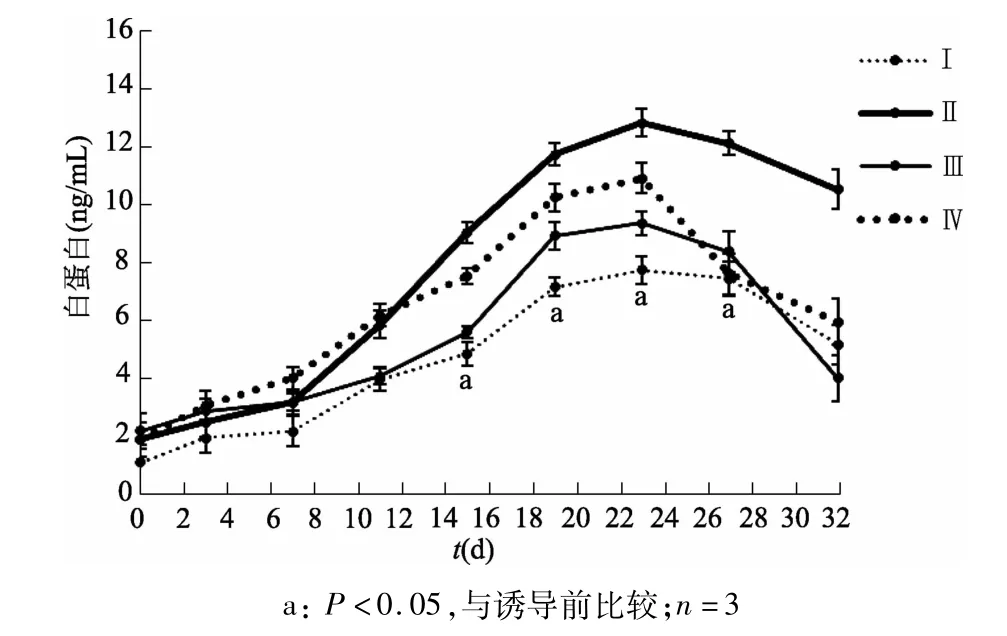
图3 4种培养基诱导细胞后的各时点上清液白蛋白含量
在4种培养基诱导下,白蛋白和甲胎蛋白的表达趋势基本一致,但同一时刻,两类蛋白的含量仍然存在差异。Ⅰ号培养基中细胞产生的甲胎蛋白和白蛋白浓度明显低于Ⅱ、Ⅲ和Ⅳ号。Ⅱ、Ⅲ和Ⅳ号都是采用多因子、多阶段诱导分化模式。Ⅲ号和Ⅳ号诱导分化效果没有明显区别,而Ⅱ号诱导分化效果明显优于Ⅲ和Ⅳ号。Ⅲ号方案诱导分化过程中所使用的因子较多,成本较高,而Ⅳ号方案步骤烦琐。考虑成本、操作简便性以及诱导效果,后续诱导分化均使用Ⅱ号培养基。
2.2 二维条件下肝细胞诱导分化
2.2.1 形态观察 诱导前培养液中的hiPSCs呈克隆团;诱导分化第3天,克隆团周围诱导分化出少许细胞;随着时间延长,克隆团周围细胞数量逐渐增加,且形态逐渐发生变化;诱导分化至10 d左右,逐渐形成肝前体细胞。细胞进一步分化为多边形或者椭圆形。诱导分化第23天,细胞形态基本一致,为多边形或者类圆形,且细胞核较明显,部分细胞呈典型的双核甚至多核的肝脏细胞形态。上述结果说明在Ⅱ号培养基中,hiPSCs被成功诱导分化为肝细胞样细胞。见图4。
2.2.2 肝脏特征蛋白的表达 免疫荧光法检测结果显示,诱导分化成的细胞能够高表达SOX17,早期肝脏标志蛋白甲胎蛋白和白蛋白以及成熟肝细胞标志蛋白CK8与CK18均表达阳性。上述结果表明hiPSCs被成功诱导分化为肝细胞。见图5。
蛋白质印迹结果也显示,hiPSCs很少表达甚至不表达肝脏特征蛋白,而hiPSCs-HEPs中的肝脏特征蛋白(甲胎蛋白、白蛋白、CK8、CK18、SOX17)表达量均明显增加,与hESCs-HEPs中的肝脏特征蛋白表达水平相似。见图6。
2.2.3 肝细胞药物代谢酶的表达 蛋白质印迹检测结果显示,诱导前的hiPSCs很少表达甚至不表达CYP450、UGT和 GST,而 hiPSCs-HEPs与 hESCs-HEPs中CYP450、UGT与GST的表达均较明显。见图7。
2.2.4 肝细胞功能 hiPSCs诱导分化过程中AST、ALT与LDH含量的变化趋势与hESCs基本一致,间接反映了hiPSCs-HEPs具有正常肝细胞功能。见图8、图9、图10。
2.3 三维条件下肝细胞诱导分化
2.3.1 形态观察 诱导分化第3天,克隆团周围出现少量单个细胞,克隆团慢慢松散;第7天时,克隆团周围单个细胞慢慢增多;第11天时,克隆团已经松散成一片,单个细胞越来越多,且呈明显的肝细胞样细胞形态;随后,克隆团慢慢分化为单个肝细胞样 细胞,不再呈现克隆团形态。见图11。
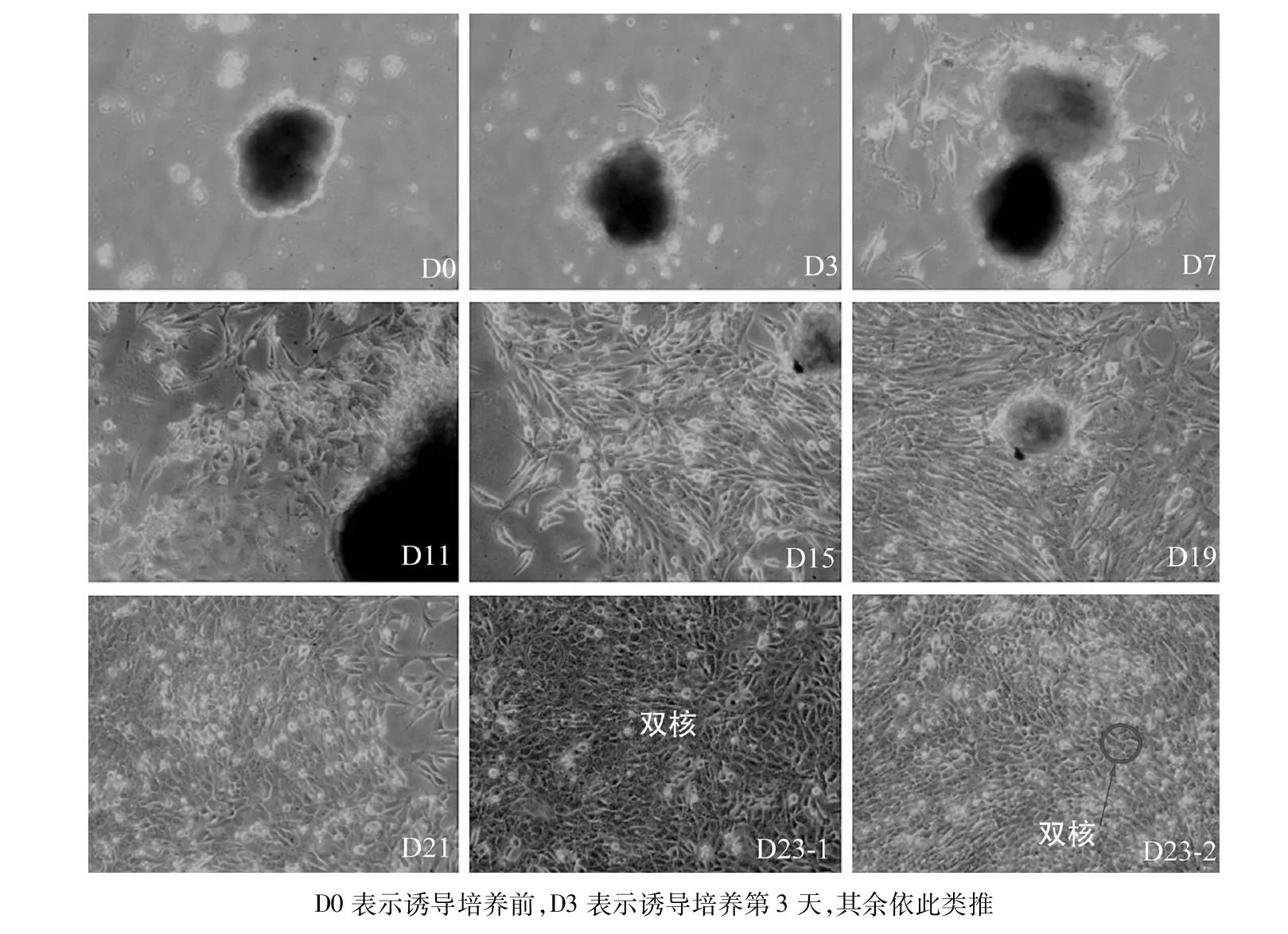
图4 hiPSCs向肝细胞诱导过程各时段细胞形态(倒置显微镜×100)
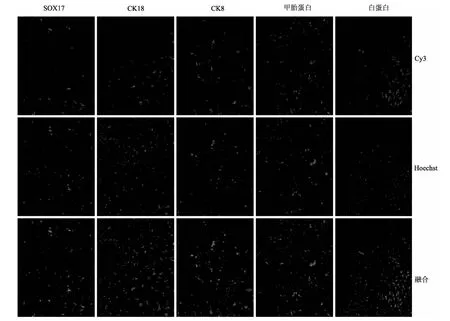
图5 人源多能干细胞来源的肝细胞中肝脏特征蛋白的表达(免疫荧光染色×100)
HE染色结果显示,诱导结束后,细胞形态出现明显的双核甚至多核现象,这是肝细胞最典型的特征,说明在三维培养体系下,hiPSCs被成功诱导分化为肝细胞样细胞。见图12。
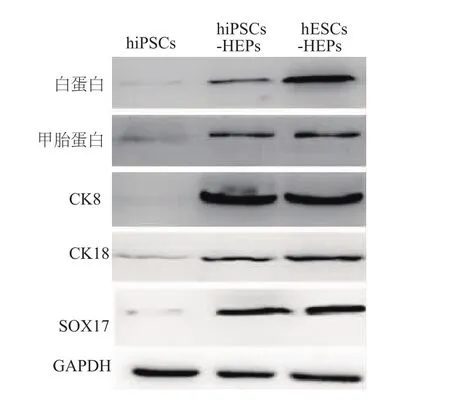
图6 人源多能干细胞来源的肝细胞中特征蛋白的表达
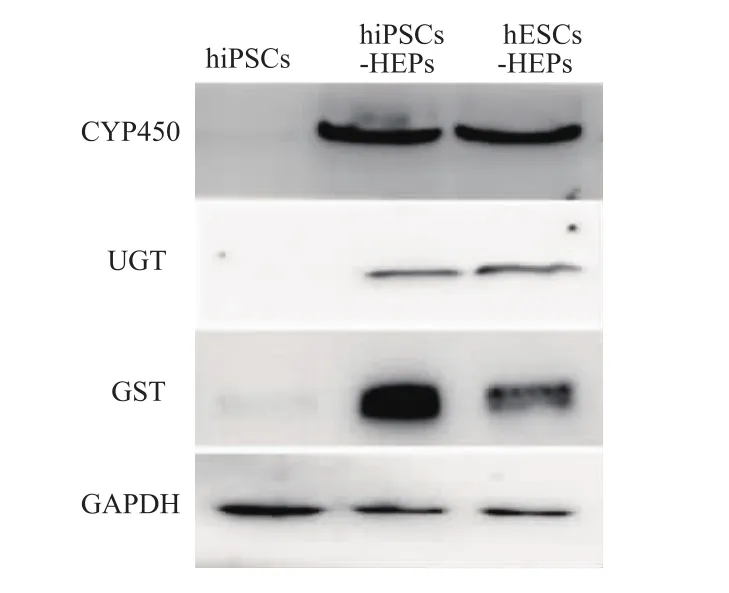
图7 二维条件下诱导形成的肝细胞药物代谢酶CYP450、UGT、GST的表达
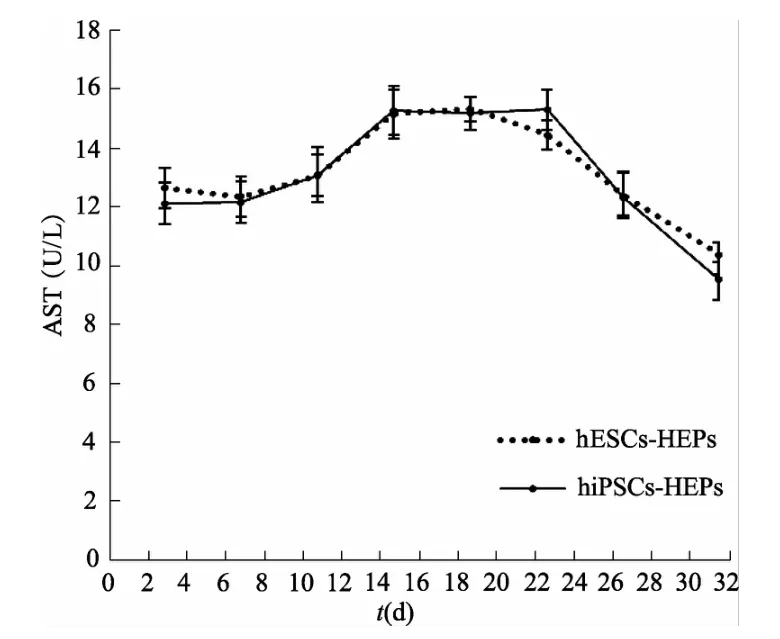
图8 二维条件下两类肝细胞上清液中AST含量(n=3)
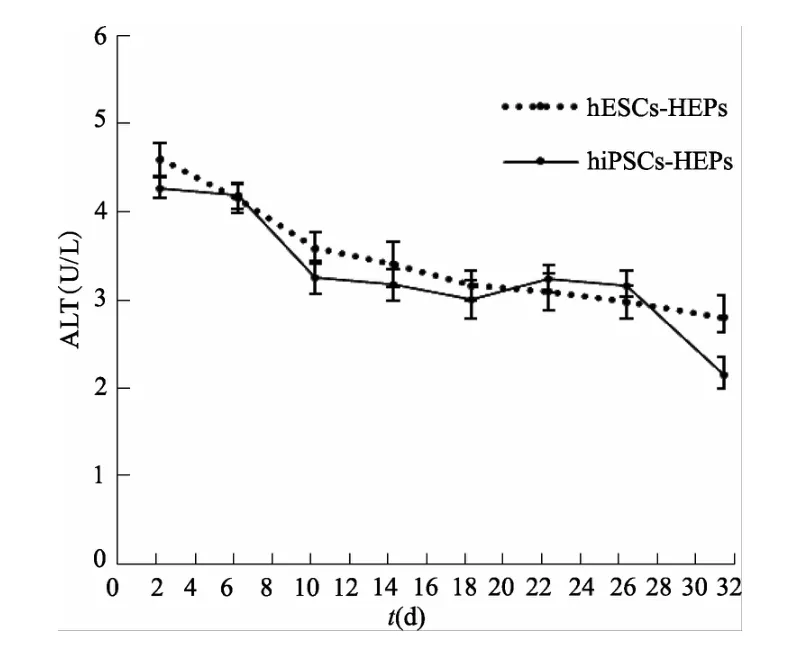
图9 二维条件下两类肝细胞上清液中ALT含量(n=3)
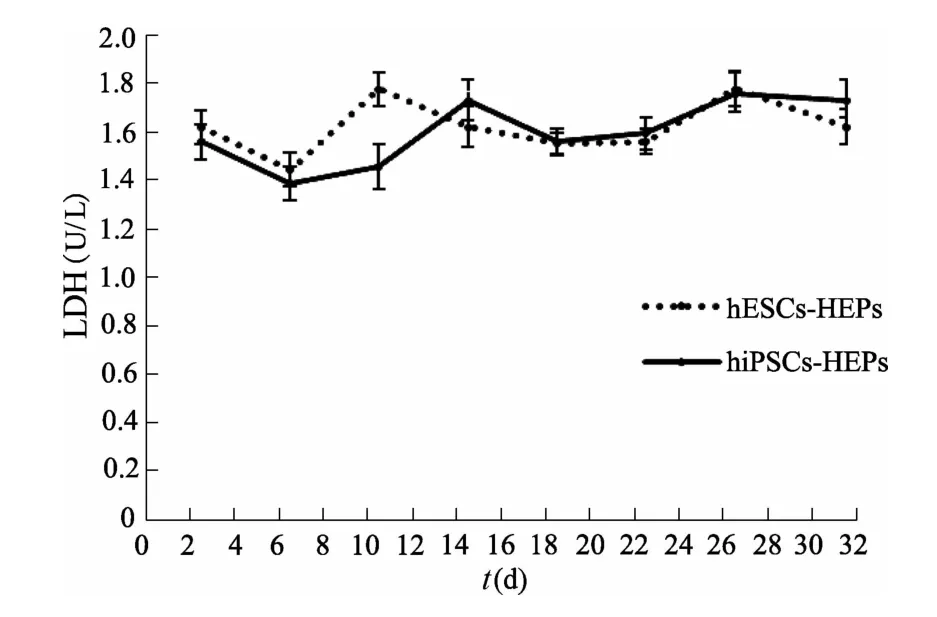
图10 二维条件下两类肝细胞上清液中LDH含量(n=3)
2.3.2 肝细胞功能检测 酶联免疫法检测结果显示,hiPSCs-HEPs在三维培养条件下的 ALT、AST、LDH变化趋势与二维条件下基本一致,说明在三维培养条件下诱导形成的肝细胞具有正常的肝细胞功能。见图13、图14、图15。
3 讨论
目前,针对肝癌等终末期肝病最有效的治疗手段仍然为肝移植。然而,由于供体的严重短缺,该治疗手段无法普及;因此,可以用人工肝支持系统暂时替代肝脏相关功能,从而帮助患者度过危险期以待肝细胞再生。理论上,由于安全性好、功能相同、同源等特点,成人肝脏细胞被认为是生物人工肝理想的细胞来源[4]。然而,由于受到来源及伦理学影响,建立肝细胞库十分困难。迄今为止,应用最多的细胞为猪肝细胞,然而,排斥反应与免疫原问题,使其推广与应用受到限制。
由于具有转化为不同细胞的能力,近年来干细胞始终是细胞替代疗法的研究热点,生物人工肝的肝细胞来源也有望从干细胞获得,包括hESCs、iPSCs和间充质干细胞。ESCs的应用受到伦理学问题困扰。骨髓间充质干细胞获取有限,且不易建立细胞系,无法满足生物人工肝所需要的细胞数量要求。与ESCs类似,iPSCs能够自我更新、增殖与分化,与此同时,还能规避ESCs面临的伦理及法律问题,且不存在目前常用的细胞异种问题,有望成为治疗肝癌终末期肝病新的细胞来源,具有广阔的临床应用前景[16-17]。
本实验通过联合使用激活素A、HGF、Wnt3a和OSM等细胞因子对重编程生成的hiPSCs进行多阶段诱导分化,明显提高了hiPSCs的肝细胞定向诱导分化效率。在二维条件下,对诱导分化培养基进行筛选和优化,经酶联免疫实验发现Ⅱ号培养基诱导效果较好,能将hiPSCs诱导为具有肝细胞形态的肝细胞样细胞,免疫荧光和蛋白质印迹实验结果显示,诱导后的肝细胞样细胞能够阳性表达肝细胞特征蛋白,且表达水平与hESCs-HEPs类似,而诱导前的hiPSCs很少表达甚至不表达肝细胞特征蛋白;酶联免疫实验结果显示,二维条件下诱导形成的细胞具有正常肝功能。
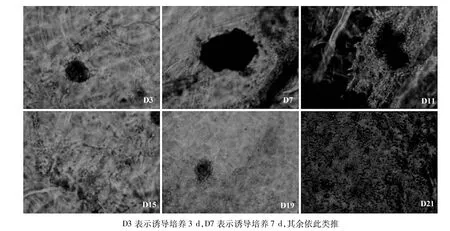
图11 三维培养条件下细胞形态(倒置显微镜×100)
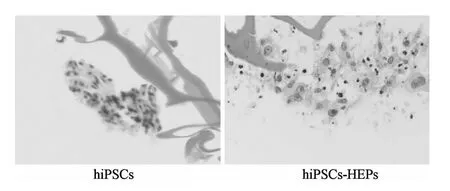
图12 三维培养条件下诱导形成的肝细胞(HE染色×200)
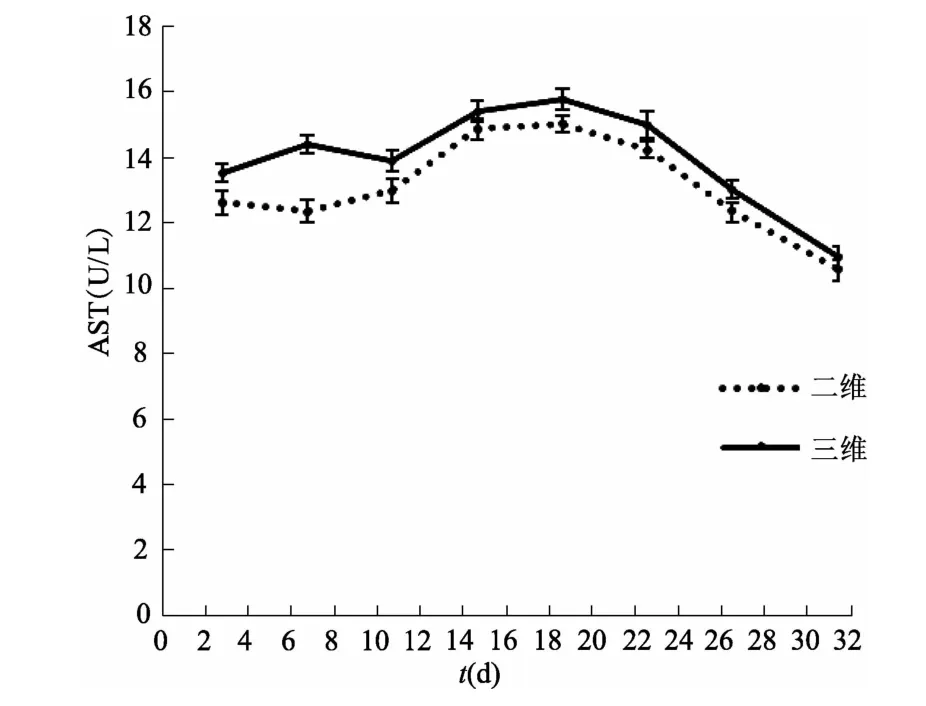
图13 二维与三维培养条件下细胞上清液中AST含量比较(n=3)
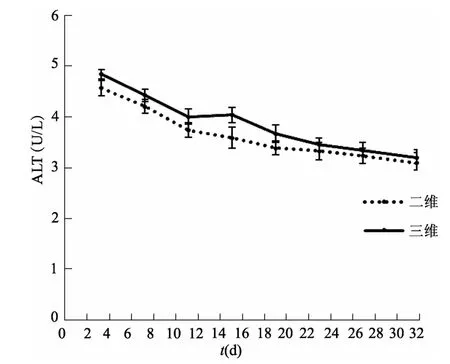
图14 二维与三维培养条件下上清液中ALT含量比较(n=3)
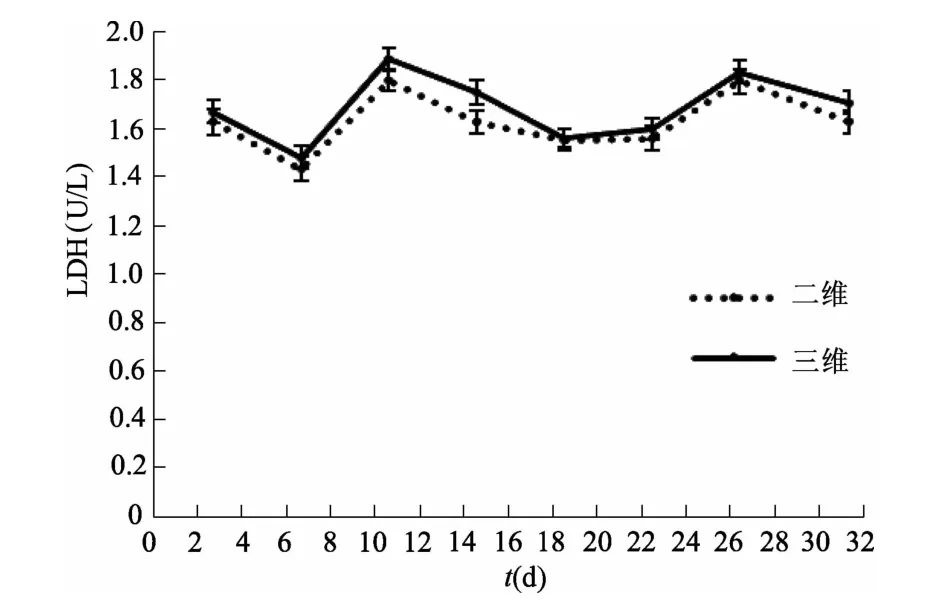
图15 二维与三维培养条件下LDH含量比较(n=3)
与二维培养相比,三维体系能更好地模拟体内组织器官天然的微环境。在体内胚胎发育过程中,不仅存在细胞与细胞之间的相互作用,还存在细胞与细胞外基质之间的作用。这些细胞外基质对细胞生长、分化以及组织形态的保持具有多重功能。本研究在三维条件下对hiPSCs进行肝细胞诱导,HE染色结果显示细胞呈现典型的肝细胞双核现象,初步判断肝细胞形成。对二维及三维培养体系中诱导形成的肝细胞功能进行比较,结果表明,在三维培养体系中诱导形成的细胞具有肝细胞典型的双核或多核特征,且具有正常肝细胞功能。三维条件下AST、ALT以及LDH含量高于二维条件下,其原因可能是三维体系中细胞密度较大,但浓度均在正常范围内,表明三维培养条件下形成的肝细胞功能并未受到损伤。
上述结果表明,本实验中的肝细胞定向诱导方案能够提供数量充足的人源肝细胞,从而为肝细胞移植提供了实验基础。但是,各细胞因子在肝细胞诱导分化过程中的分子机制以及如何解决细胞分选等问题,仍亟待进一步研究。
[1]Mattar RH,Azevedo RA,Speridiao PG,et al.Nutritional status and intestinal iron absorption in children with chronic hepatic diseasewith and without cholestasis[J].JPediat-brazil,2017,81(4):317-324.
[2]Wong RJ,Aguilar M,Cheung R,et al.Nonalcoholic steatohepatitis is the second leading etiology of liver disease among adults awaiting liver transplantation in the United States[J].Gastroenterology,2015,148(3):547-555.
[3]Nicolas CT,Hickey RD,Chen HS,et al.Concise review: liver regenerative medicine: from hepatocyte transplantation to bioartificial livers and bioengineered grafts[J].Stem Cells,2017,35(1):42-50.
[4]Dreyzin A,Barnato AE,Soltys K A,et al.Parent perspectives on decisions to participate in a phase Ihepatocyte transplant trial[J].Pediatr Transplant,2014,18(1):112-119.
[5]Puppi J,Strom SC,Hughes RD,et al.Improving the techniques for human hepatocyte transplantation:report from a consensus meeting in London[J].Cell Transplant,2012,21(1):1-10.
[6]Hanley J,Dhar DK,Mazzacuva F,et al.Vps33b is crucial for structural and functional hepatocyte polarity[J].JHepatol,2017,66(5):1001-1011.
[7]Huang J,Guo X,Li W,et al.Activation of Wnt/βcatenin signalling via GSK3 inhibitors direct differentiation of human adipose stem cells into functional hepatocytes[J].Sci Rep,2017,7:40716.
[8]Sakiyamav R,Blau BJ,Miki T.Clinical translation of bioartificial liver support systemswith human pluripotent stem cell-derived hepatic cells[J].World JGastroenterol,2017,23(11):1974-1979.
[9]Esmaeli S,Allameh A,Adelipour M,etal.The impact of oxidative DNA changes and ATM expression on morphological and functional activities on hepatocytes obtained from mesenchymal stem cells[J].Biologicals,2017,47:52-58.
[10]Cayo MA,Cai J,DeLaForest A,et al.JD induced pluripotent stem cell-derived hepatocytes faithfully recapitulate the pathophysiology of familial hypercholesterolemia[J].Hepatology,2012,56(6):2163-2171.
[11]Takayama K,Morisaki Y,Kuno S,et al.Prediction of interindividual differences in hepatic functions and drug sensitivity by using human iPS-derived hepatocytes[J].Proc Natl Acad Sci U S A,2014,111(47):16772-16777.
[12]Carpentier A,Jake Liang T.Transplantation of iPS-derived hepatocytes into amouse liver:a newmurinemodel of hepatitis C virus infection[J].Med Sci(Paris),2015,31(3):256-259.
[13]Araki T,Iwazaki N,Ishiguro N,et al.Requirements for human iPS cell-derived hepatocytes as an alternative to primary human hepatocytes for assessing absorption,distribution,metabolism,excretion and toxicity of pharmaceuticals[J].Fundam Toxicol Sci,2016,3(3):89-99.
[14]Takayama K,Mizuguchi H.Generation of human pluripotent stem cell-derived hepatocyte-like cells for drug toxicity screening[J].Drug Metab Pharmacokinet,2017,32(1):12-20.
[15]Cao X,Deng WW,Qu R,et al.Non-viral co-delivery of the four Yamanaka factors for generation of human induced pluripotent stem cells via calcium phosphate nanocomposite particles[J].Adv Funct Mater,2013,23(43):5403-5411.
[16]Kim JH,Jang YJ,An SY,et al.Enhanced metabolizing activity of human ES cell-derived hepatocytes using a 3D culture system with repeated exposures to xenobiotics[J].Toxicol Sci,2015,147(1):190-206.
[17]Imai K,Tanoue A,Nakamura K,et al.An attempt to in vitro embryotoxicity testusingmouse ES cells and human hepatocytes[J].Aatex,2013,18(1):33-38.
