去乙酰化酶3在人颈动脉粥样硬化斑块中的表达及其临床意义
2018-01-18薛晓帆李新辉张海东曲爱娟周立春
薛晓帆, 齐 丹, 李新辉, 刘 冉, 张海东, 曲爱娟, 周立春
脑卒中作为死亡率及致残率最高的疾病严重影响患者的预后及生活质量[1,2],动脉粥样硬化(atherosclerosis,AS),尤其是颈动脉粥样硬化(carotid atherosclerosis,CAS)是引发缺血性脑卒中发病的重要病理基础,CAS造成的缺血性脑卒中占全部脑卒中的19%~35%[3]。随着CAS的进展,不稳定斑块的破裂形成血栓,栓塞脱落后引发脑卒中是缺血性脑卒中的重要发病机制,“氧化应激学说”作为AS斑块稳定性下降的可能发病机制之一被人们广泛关注,但具体信号通路及分子机制目前仍不清楚。沉默信息调节因子2相关酶类3(silent mating type information regulation2 homolog-3,SIRT3)是一种依赖于烟酰胺腺嘌呤二核苷酸(nicotinamide-adenine dinucleotide,NAD)的Ⅲ类去乙酰化酶[4]。SIRT3主要位于线粒体,广泛分布于肾脏、脑、心脏及肝脏等富含线粒体的组织器官中,可对组蛋白和非组蛋白去乙酰化在调控细胞代谢、细胞周期、细胞凋亡及细胞寿命方面起着重要的作用[5,6]。SIRT3通过去乙酰化相关蛋白调节生物活性,在抵抗氧化应激反应、改善血管内皮细胞功能等多种心血管疾病中,都起到了保护性作用,但在粥样硬化斑块组织中的表达及与之相关临床意义之间的研究甚少[7,8]。因此,了解SIRT3在AS斑块形成及稳定性中的作用,及可能调控的信号通路具有学术价值,对早期发现、早期干预从而减少缺血性心脑血管疾病的发生,有着至关重要的意义。本文采用免疫组化、免疫印迹法及免疫荧光共定位法检测6例人颈动脉组织中SIRT3的表达情况,并探讨其与AS斑块形成及发展之间可能存在的关系。
1 材料与方法
1.1 组织标本 收集2017年4月~2017年9月在首都医科大学附属北京朝阳医院尸检中心行尸体解剖检查且个人资料完整的6例患者,其中男5例,女1例,年龄分布39~85岁,取其双侧完整颈动脉(颈总动脉+颈动脉窦部+颈内动脉+颈外动脉)长度约8~10 cm,所取左侧完整组织分段进行石蜡切片完成H&E染色、Masson’s trichrome染色,冰冻切片完成油红O染色、免疫组化染色及免疫荧光共定位染色;所取右侧组织放入液氮冷冻后置于-80 ℃冰箱保存用于免疫印迹法检测SIRT3表达含量。所取标本及相关流程已得到首都医科大学附属北京朝阳医院伦理委员会批准。
1.2 H&E染色、Masson’s trichrome染色及油红O染色 所取6例左侧颈动脉组织浸泡于4%多聚甲醛中固定,一部分常规石蜡包埋,制作颈动脉石蜡切片(4 μm)10张,常规苏木精-伊红染色(H&E染色),中性树胶封片2张;另一部分用于冰冻切片(7 μm),Masson’s trichrome染色:(1)冰冻切片复温30 min后蒸馏水洗3遍;(2)4%多聚甲醛固定10 min后蒸馏水洗2~3遍;(3)湿盒内10%重络酸钾+10%三氯乙酸染色40 min后蒸馏水洗2~3遍;(4)用0.09 g丽春红+0.01 g酸品红+100 μl冰醋酸+9.9 ml蒸馏水配制的红色染料染色5 min;(5)1%磷钼酸浸泡5 min后,1%冰醋酸冲洗1~2遍,镜下观察上色情况;(6)用0.24 g苯胺蓝+200 μl冰醋酸+9.8 ml蒸馏水配制的蓝色染料染色30~40 s,后用1%磷钼酸及1%冰醋酸各冲洗一遍,镜下观察上色情况;(7)无水乙醇中浸泡5 s后中性树胶封片保存,染色2张,油红O染色:(1)冰冻切片复温30 min后蒸馏水洗3遍;(2)4%多聚甲醛固定10 min后蒸馏水洗2~3遍;(3)60%异丙醇滴染同步化10 min;(4)甩掉并擦干净异丙醇溶液,以0.25油红粉末+50 ml异丙醇配制的0.5%油红染料用蒸馏水稀释成浓度为60%的油红染料染色30 min;(5)异丙醇冲洗后用蒸馏水洗3遍,镜下观察染色情况;(6)甘油明胶封片,2张,镜下观察6例人颈部血管组织病理学特点,按照动脉粥样硬化斑块病理学分期标准进行分期[9](Ⅰ期脂纹脂斑期;Ⅱ期纤维斑块期;Ⅲ期粥样斑块期;Ⅳ期复合病变期)。
1.3 免疫组化 采用免疫组化Max Vision二步法:第1天:(1)冰冻切片复温30 min后蒸馏水洗3遍;(2)4%多聚甲醛固定10 min后蒸馏水洗2~3遍;(3)湿盒内以内源性过氧化物酶阻断剂覆盖组织20 min后蒸馏水洗3遍;(4)羊血清封闭非特异性抗原湿盒内30 min;(5)甩掉浮液后加入以1∶100配制SIRT3抗体(兔多克隆Anti-SIRT3抗体-C-terminal,abcam公司,货号ab137689)4 ℃冰箱过夜12 h。第2天:(1)室温复温30 min,蒸馏水洗3遍;(2)山羊抗兔/小鼠IgG/HRP聚合物(CST公司,货号7074)室温孵育30 min后蒸馏水洗3遍;(3)配制DAB显色剂(上海基因科技有限公司,货号GK600505/50次,GK600510/100次,GK600511/1000次)染色7~10 s,镜下观察组织显淡黄色后置于蒸馏水中浸泡;(4)苏木素染色10~15 s;(5)盐酸分化液洗片2~3 s;(6)流水冲洗反蓝5 min;(7)镜下观察染色情况后走免疫组化下行通路,中性树胶封片。以PBS缓冲液代替一抗作阴性对照,已证实的SIRT3染色阳性的切片作为阳性对照组,同时选取正常血管组织作为正常对照组。SIRT3染色阳性表达位于胞质内,呈清晰棕黄色颗粒。每张切片随机观察5个高倍镜视野,判断标准以显色细胞数面积占斑块总面积的比值进行评估。
1.4 免疫荧光共定位 免疫荧光共定位染色法:第1天:(1)冰冻切片复温30 min后蒸馏水洗3遍;(2)4%多聚甲醛固定10 min后蒸馏水洗2~3遍;(3)湿盒内以内源性过氧化物酶阻断剂覆盖组织20 min后蒸馏水洗3遍;(4)羊血清封闭非特异性抗原湿盒内30 min;(5)分别以小鼠单克隆CD31(PharMingen公司,货号553300)、α-SMA(abcam公司,货号ab7817)及MAC-2(SantaCruz公司,货号sc-32790)3种抗体标记组织中内皮细胞、平滑肌细胞及巨噬细胞,分别加入SIRT3抗体及PBS,以1∶1∶100分别配制3种一抗混合液,滴染各组片子4 ℃冰箱过夜12 h;第2天:(1)室温复温30 min,蒸馏水洗3遍;(2)以1∶1∶100比例配制山羊抗小鼠IgG/TRITC(中杉金桥公司,货号ZF-0313)红光二抗及山羊抗小鼠IgG/FITC(中杉金桥公司,货号ZF-0312)绿光二抗混合液,加至片子后湿盒保存1 h后蒸馏水洗5遍;(3)DAPI封片,4 ℃保存;(4)荧光显微镜暗室拍照。观察各类细胞内SIRT3染色差异,以PBS缓冲液代替一抗作阴性对照,Ⅰ期及Ⅳ期人颈动脉粥样硬化斑块组织染色阳性的切片作为阳性对照组,同时选取正常血管组织作为正常对照组。
1.5 免疫印迹法 Western blot检测,取保存于-80 ℃冰箱的组织样本:(1)用高效RIPA裂解液(Solarbio公司,货号R0010)提取总蛋白;(2)采用BCA法检测蛋白浓度后加入上样缓冲液;(3)100摄氏度煮沸5~10 min变性;(4)12%的分离胶进行SDS-PAGE电泳,每孔上样总蛋白约30 μg左右,后进行转膜;(5)5%脱脂奶粉室温封闭1 h;(6)TBST洗膜后加入SIRT3及β-ACTIN抗体,用5%BSA稀释,稀释比例均为1∶1000,4摄氏度摇床过夜;(7)TBST洗膜后二抗室温孵育1 h,运用ECL试剂盒发光、显影、定影、冲洗晾干、拍照并成像分析,运用Quantity One软件分析蛋白条带的灰度值,将SIRT3/β-ACTIN的比值作为蛋白表达的相对量。
1.6 统计学分析 采用Prism 6 软件进行统计学分析,对Western blot检测的蛋白相对表达量运用t检验,免疫组化测定结果进行χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 H&E染色、Masson’s trichrome染色、油红O染色进行人颈动脉粥样硬化斑块组织的分期及临床病理特征的分析结果 6例患者病理切片均按照动脉粥样硬化病理分期分为2例正常血管,2例Ⅰ期脂紋脂斑期,2例Ⅳ期复合病变期。
2.2 免疫印迹法结果提示SIRT3在人颈动脉Ⅳ期粥样硬化斑块血管组织中显著表达 目的条带SIRT3分子量为29 kD,β-ACTIN分子量为43 kD。SIRT3在Ⅳ期斑块组织中的蛋白表达量明显高于Ⅰ期斑块及正常血管组织(见图1)。
2.3 免疫组化检测SIRT3在人Ⅳ期颈动脉粥样硬化斑块中显著表达 SIRT3表达阳性在免疫组化染色中呈棕黄色颗粒,主要位于细胞质染色。结果显示2例正常血管组织中未见阳性细胞表达,2例I期斑块组织中偶见阳性细胞,2例Ⅳ期斑块组织中SIRT3阳性细胞表达率为40%(24/60)(见图2)。
2.4 SIRT3在人Ⅳ期颈动脉粥样硬化斑块中的内皮细胞、平滑肌细胞及巨噬细胞内均表达 SIRT3由TRITC荧光二抗标记为红色,主要位于细胞质染色。内皮细胞、平滑肌细胞及巨噬细胞分别由CD31、α-SMA及MAC-2一抗标记,由FITC荧光二抗标记为绿色,细胞核由DAPI标记为蓝色,Merge后共定位染色为橙黄色。结果显示2例正常血管组织中未见SIRT3表达,2例Ⅰ期斑块组织中偶见少量SIRT3表达,2例Ⅳ期斑块组织中内皮细胞、平滑肌细胞及巨噬细胞内均可见大量SIRT3表达。

图1 正常颈动脉组织、Ⅰ期斑块组织及Ⅳ期斑块组织中SIRT3表达
3 讨 论
动脉粥样硬化(AS)是引发缺血性脑卒中发生的重要病理基础,在AS的发生发展过程中,线粒体氧化应激损伤作为斑块稳定性下降的可能机制被人们广泛关注。多重危险因素(高脂血症、高血压、糖尿病、高同型半胱氨酸血症、吸烟、肥胖等)引起血管内皮细胞损伤和功能失调,从而产生大量ROS,促进过氧化物酶产生,同时激活内皮细胞源性炎性因子如TNF-α及多种白细胞介素等表达[10,11]。ROS介导的氧化应激反应和炎性因子介导的炎性反应同时可诱导低密度脂蛋白胆固醇(LDL-C)的氧化修饰,形成修饰的低密度脂蛋白(ox-LDL),引起平滑肌细胞的增殖与凋亡。细胞因子和ox-LDL能激活NF-κB信号通路,被激活的NF-κB迁移至细胞核,诱导多种细胞间基质表达,其中包括内皮细胞粘附因子(VCAM)、金属蛋白酶(MMPs)等,促使AS斑块形成并降解细胞外基质,削弱纤维帽,使斑块稳定性下降,引发血栓、斑块破裂、斑块内出血、动脉瘤等多种继发性改变[12,13]。如何维持内皮细胞稳定及线粒体功能,避免功能失调作为AS斑块形成的启动靶点成为AS斑块研究的主要方向。
目前研究证实Sirt3能对线粒体内多种乙酰化蛋白脱乙酰基,增加ROS清除酶活性和稳定线粒体功能,抑制线粒体内ROS的蓄积,改善可由ROS增多并激活NF-κB通路,减轻氧化应激诱发的细胞损伤过程[14]。Someya等研究证实[15]。线粒体内Srit3过表达,使乙酰化的IDH2脱乙酰基,提高NADPH的水平,抑制ROS的产出,延迟老年性听力丧失疾病的发生。仍有研究证实S3过表达后,使超氧化物歧化酶-2(SOD-2)两个关键的赖氨酸残基去乙酰化,从而减少ROS的产生,阻碍Bax蛋白移位到线粒体,减少氧化应激诱导的细胞凋亡[16]。Sundaresan等[17]研究发现,SIRT3对乙酰化的转录因子Foxo3a脱乙酰基后,使其进入细胞核,并提高依赖Foxo3a的抗氧化基因转录产物锰超氧化物歧化酶(Mn-SOD)及过氧化氢酶(CAT)的mRNA表达水平,抑制细胞内ROS的蓄积,阻断了ROS诱导激活的通路上游靶点Ras基因,并抑制下游信号通路MAPK/ERK1/2和PI3K/Akt,减轻氧化应激反应。
本实验结果初步证实了与正常人颈部血管组织相比,SIRT3在人CASIV期斑块组织中是显著表达的,这可能与AS斑块形成及发展过程中线粒体氧化应激损伤相关。且在斑块发展过程中,SIRT3的表达也存在差异,Ⅳ期斑块组织中SIRT3表达量明显高于Ⅰ期粥样硬化组织,免疫印迹法检测Ⅰ期斑块未见SIRT3表达可能与表达量过少相关。且免疫荧光共定位染色结果提示SIRT3广泛表达于Ⅳ期斑块中的内皮细胞、平滑肌细胞及巨噬细胞内。既往研究证实,SIRT3可以通过去乙酰化线粒体相关蛋白,减轻ROS的累积,维持血管内皮细胞的稳定性[18]。且一般情况下低氧可以诱导SIRT3表达增加,SIRT3在内皮细胞抗氧化信号通路中活性增强,起到维持内皮细胞线粒体功能的作用[19]。由此推测,SIRT3可能参与了CAS斑块形成过程,并起到了稳定斑块的保护性作用,但具体的信号通路及作用机制目前尚不明确,仍需进一步大样本重复试验,本课题组将进一步应用动物及细胞实验验证上述结果,且确定SIRT3通过去乙酰化何种蛋白来发挥作用,来证实其在AS斑块稳定性中的角色。
综上所述,SIRT3可能与AS斑块的发生、发展相关,其在Ⅳ期斑块中的高表达可能在斑块稳定性中起到了一定作用,但目前研究SIRT3与AS斑块形成及稳定性之间的相关研究较少,如能确定SIRT3蛋白在斑块稳定性中的保护性机制,可能成为潜在的检测指标及基因治疗的一个作用靶点,为缺血性心脑血管疾病的预防有着重要的临床意义。
[1]Yu Di,Yang Lei,Feng Yu,et al.MicroRNAs expression and function in cerebral ischemia reperfusion injury[J].Neurosci,2014,53:242-250.
[2]Liu K,Li Z,Wu T,et al.Role of rho kinase in microvascular damage following cerebral ischemia reperfusion in rats[J].Sci,2011,12:1222-1231.
[3]Mead GE,Murray H,Farrell A,et al.Pilot study of carotid surgery for acute stroke[J].Br J Surg,1997,84:990-992.
[4]Yujiro Kida,Michael S.Goligorsky.Sirtuins,cell senescence,and vascular aging[J].Can J Cardiol,2016,32(5):634-641.
[5]Houtkooper RH,Pirinen E,Auwerx J.Sirtuins as regulators of metabolism and healthspan.Nature reviews[J].Molecular Cell Biology,2012,13:225-238.
[6]Feldman JL.Activation of the protein deacetylase SIRT6 by long-chain fatty acids and widespread deacylation by mammalian sirtuins[J].J Biol Chem,2013,288:31350-31356.
[7]Dikalova AE,Bikineyeva AT,Budzyn K,et al.Therapeutic targeting of mitochondrial superoxide in hypertension[J].Circ Res,2010,107:106-116.
[8]Dikalov SI,Nazarewicz RR,Bikineyeva A,et al.Nox2-induced production of mitochondrial superoxide in angiotensin Ⅱ-mediated endothelial oxidative stress and hypertension[J].Antioxid Redox Signal,2014,20:281-294.
[9]Komatsu S,Ohara T,Takahashi S,et al.Early detection of vulnerable atherosclerotic palque for risk reduction of acute aortic rupture and thromboemboli and atheroemboli using non-obstructive angioscopy[J].Circ J,2015,79(4):742-750.
[10]Kawashima S,Yokoyama M.Dysfunction of endothelial nitric oxide synthase and atherosclerosis[J].Arterioscler Thromb Vasc Biol,2004,24:998-1005.
[11]Chuang Yuan,Christopher WK,Lawrence WC,et al.Cumulative effects of hypertension,dyslipidemia,and chronic kidney disease on carotid atherosclerosis in chinese patients with type 2 diabetes mellitus[J].BMC Cardiovasc Disord,2014,doi:10.1155/2014/179686.
[12]Gareus R,Kotsaki E,Xanthoulea S,et al.Endothelial cell-specific NF-κB inhibition protects mice from atherosclerosis[J].Cell Metab,2008,8(5):372-383.
[13]Zhang XT,Wang Y,Hu WJ,et al.Interleukin-1/Toll-like receptor-induced nuclear factor kappa B signaling participates in intima hyperplasia after carotid artery balloon injury in goto-kakizaki rats:A potential target therapy pathway[J].PloS One,2014,9(8):e103794.
[14]Aaron CH,Chen Praveen R,Huang Ying Ying,et al.Low-level laser therapy activates NF-κB via generation of reactive oxygen species in mouse embryonic fibroblasts[J].PloS One,2011,6(7):doi:10.1371/journal.pone.0022453.
[15]Shinichi Someya,Wei Yu,William C,et al.Prolla.sirt3 mediates reduction of oxidative damage and prevention of age-related hearing loss under caloric restriction[J].Cell,2010,143(5):802-812.
[16]Sundaresan NR,Samant SA,Pillai VB,et al.SIRT3 is a stressresponsive deacetylase in cardiomyocytes that protects cells from stress-mediated cell death by deacetylation of Ku70[J].Mol Cell Biol,2008,28(20):6384-6401.
[17]Sundaresan NR,Gupta MP,Kim G,et al.Sirt3 blocks the cardiac hypertrophic response by augmenting Foxo3a-dependent antioxidant defense mechanisms in mice[J].J Clin Invest,2009,119(9):2758-2771.
[18]Liu H,Chen T,Li N,et al.Role of SIRT3 in Angiotensin II-induced human umbilical vein endothelial cells dysfunction[J].BMC Cardiovasc Disord,2015,30:15-81.
[19]Tseng AH,Wu LH,Shieh SS,et al.SIRT3 interactions with FOXO3 acetylation,phosphorylation and ubiquitinylation mediate endothelial cell responses to hypoxia[J].The Biochemical Journal,2014,464:157-168.
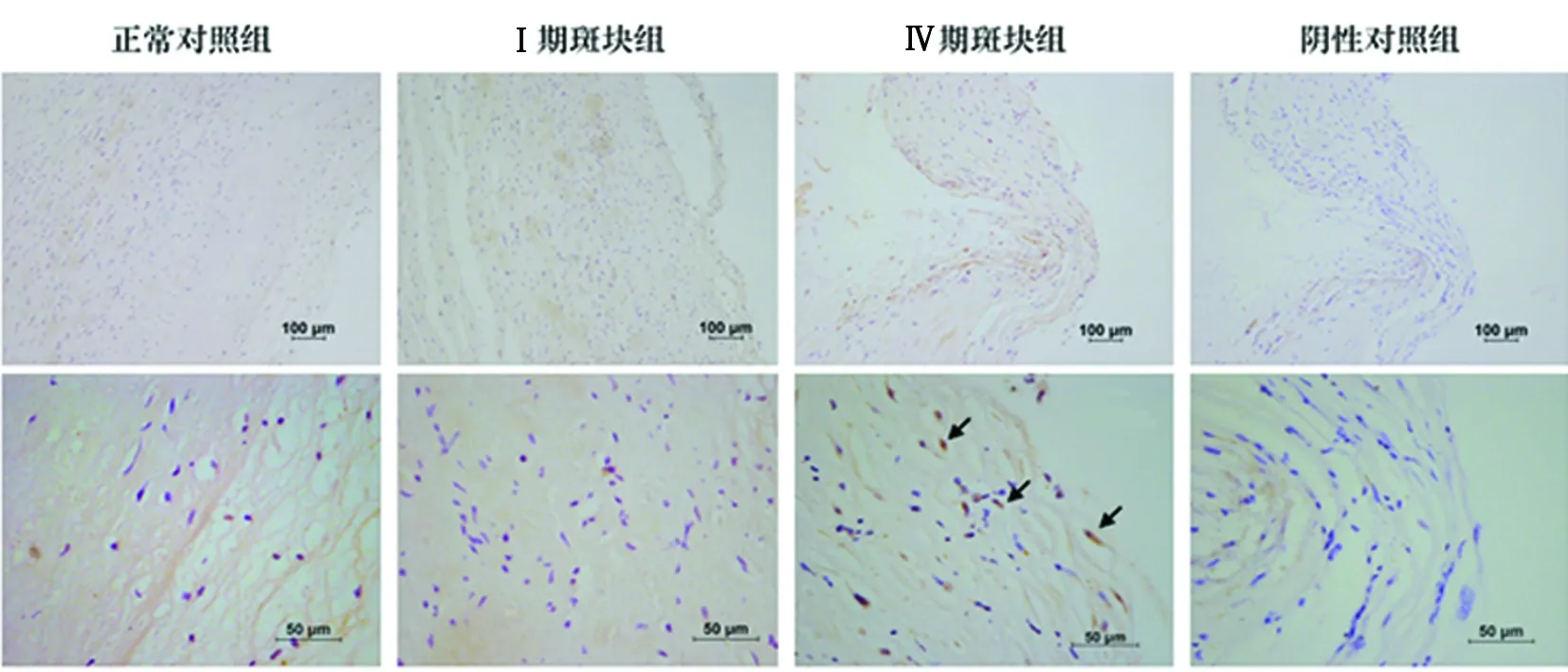
图2 正常颈动脉组织、Ⅰ期斑块组织及Ⅳ期斑块组织中SIRT3免疫组化染色结果
